二元气液相平衡数据的测定(数据处理)

五、实验数据记录与处理:
项目温度
(0C)
液相x 气相y
饱和蒸汽压
P s*100000
数据1 正己烷
74.4
68.8899 76.127 1.206289 正庚烷31.1101 23.873 0.472527
数据2 正己烷
76.4
72.2217 77.8291 1.280930 正庚烷27.7783 22.1709 0.505914
数据3 正己烷
79.1
56.6229 66.8828 1.383679 正庚烷43.3771 33.1172 0.553946
数据4 正己烷
82.5
50.4742 45.1909 1.530921 正庚烷
49.5285
8
54.8091 0.619527
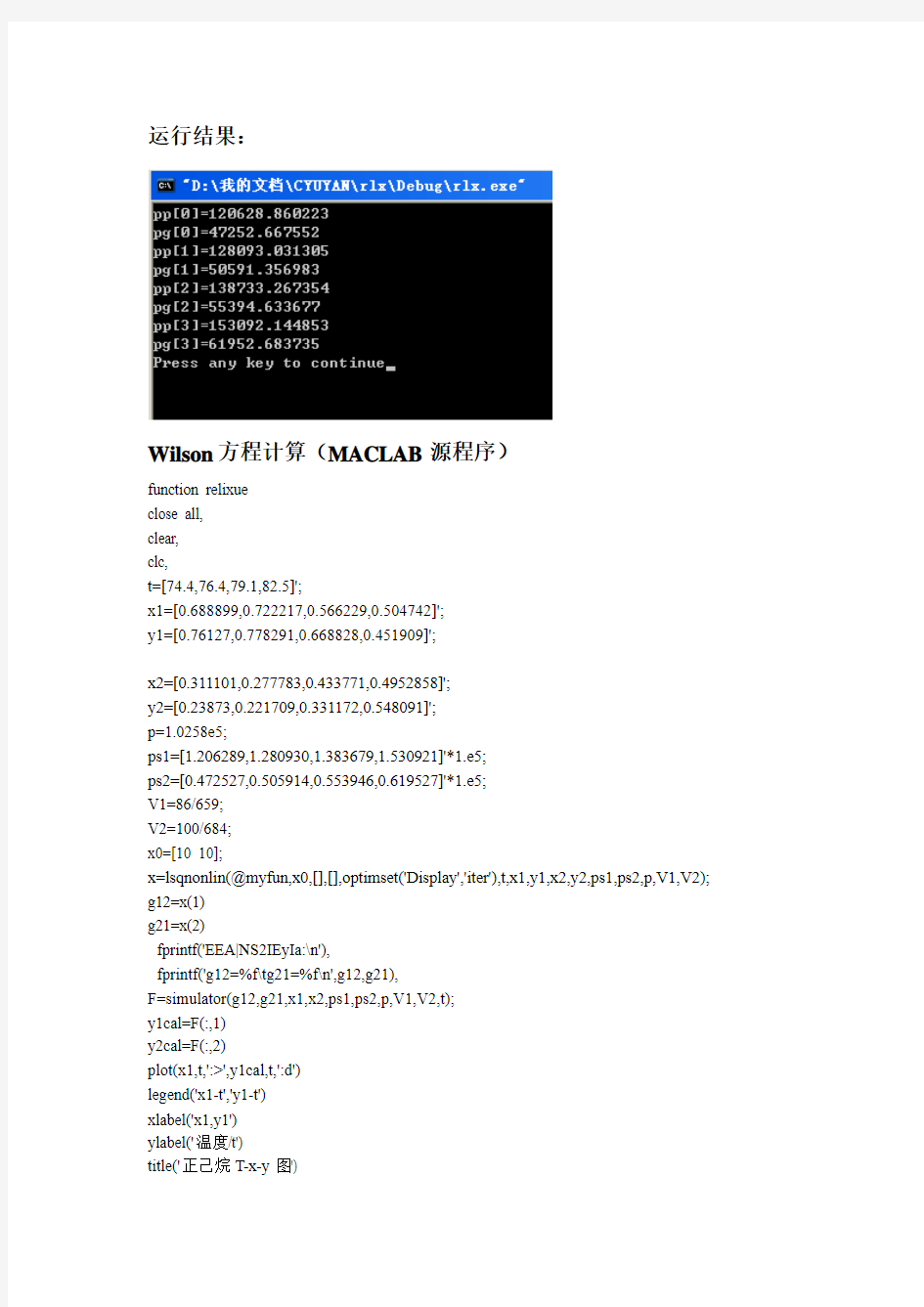
饱和蒸汽压的计算(c语言源程序)
#include
#include
void main()
{ int i;
double pp[4],pg[4];
double p=1.0158e5,t[4]={74.4,76.4,79.1,82.5};
double A1=9.2164,B1=2697.55,C1=-48.78;
//正己烷安托因方程系数
double A2=9.2535,B2=2911.32,C2=-56.51;
//正庚烷安托因方程系数
for(i=0;i<4;i++)
{
pp[i]=100000*exp(A1-B1/(t[i]+273.15+C1));
// 正己烷饱和蒸汽压单位化为帕
pg[i]=100000*exp(A2-B2/(t[i]+273.15+C2));
//正庚烷饱和蒸汽压
printf("pp[%d]=%lf\n",i,pp[i]);
printf("pg[%d]=%lf\n",i,pg[i]);
}
}
运行结果:
Wilson方程计算(MACLAB源程序)
function relixue
close all,
clear,
clc,
t=[74.4,76.4,79.1,82.5]';
x1=[0.688899,0.722217,0.566229,0.504742]';
y1=[0.76127,0.778291,0.668828,0.451909]';
x2=[0.311101,0.277783,0.433771,0.4952858]';
y2=[0.23873,0.221709,0.331172,0.548091]';
p=1.0258e5;
ps1=[1.206289,1.280930,1.383679,1.530921]'*1.e5;
ps2=[0.472527,0.505914,0.553946,0.619527]'*1.e5;
V1=86/659;
V2=100/684;
x0=[10 10];
x=lsqnonlin(@myfun,x0,[],[],optimset('Display','iter'),t,x1,y1,x2,y2,ps1,ps2,p,V1,V2); g12=x(1)
g21=x(2)
fprintf('EEA|NS2IEyIa:\n'),
fprintf('g12=%f\tg21=%f\n',g12,g21),
F=simulator(g12,g21,x1,x2,ps1,ps2,p,V1,V2,t);
y1cal=F(:,1)
y2cal=F(:,2)
plot(x1,t,':>',y1cal,t,':d')
legend('x1-t','y1-t')
xlabel('x1,y1')
ylabel('温度/t')
title('正己烷T-x-y图')
figure
plot(x2,t,':>',y2cal,t,':d')
legend('x2-t','y2-t')
xlabel('x2,y2')
ylabel('温度/t')
title('正庚烷T-x-y图')
figure
x1=[1,0.688899,0.722217,0.566229,0.504742,0]';
y1=[1,0.76127,0.778291,0.668828,0.451909,0]';
y1cal=[ 1 y1cal' 0];
plot(x1,y1,':>',x1,y1cal,':s')
xlabel('x1')
ylabel('y1')
title('正己烷x-y图')
legend('测量值','计算值')
x2=[0,0.311101,0.277783,0.433771,0.4952858,1]';
y2=[0,0.23873,0.221709,0.331172,0.548091,1]';
y2cal=[ 0 y2cal' 1];
figure
plot(x2,y2,':>',x2,y2cal,':s')
xlabel('x2')
ylabel('y2')
title('正庚烷x-y图')
legend('测量值','计算值')
function F=myfun(x,t,x1,y1,x2,y2,ps1,ps2,p,V1,V2)
g12=x(1); g21=x(2);
g21=x(2);
A12=V2/V1*exp(-g12/8.314./(t+273.5));
A21=V1/V2*exp(-g21/8.314./(t+273.15));
gangma1=exp(-log(x1+A12.*x2)-x2.*(A12./(x1+A12.*x2)-A21./(x2+A21.*x1))); gangma2=exp(-log(x2+A21.*x1)-x1.*(A21./(x2+A21.*x1)-A12./(x1+A12.*x2))); y1cal=gangma1.*x1.*ps1/p;
y2cal=gangma2.*x2.*ps2/p;
F=[y1-y1cal;y2-y2cal];
function F=simulator(g12,g21,x1,x2,ps1,ps2,p,V1,V2,t)
A12=V2/V1*exp(-g12/8.314./(t+273.5))
A21=V1/V2*exp(-g21/8.314./(t+273.15))
gangma1=exp(-log(x1+A12.*x2)-x2.*(A12./(x1+A12.*x2)-A21./(x2+A21.*x1))) gangma2=exp(-log(x2+A21.*x1)-x1.*(A21./(x2+A21.*x1)-A12./(x1+A12.*x2))) y1cal=gangma1.*x1.*ps1/p;
y2cal=gangma2.*x2.*ps2/p;
F=[y1cal,y2cal]
运行结果:
Norm of First-order
Iteration Func-count f(x) step optimality CG-iterations
0 3 0.1122 6.37e-005
1 6 0.110667 10 6.26e-005 1
2 9 0.107667 20 6.05e-005 1
3 12 0.101932 40 5.62e-005 1
4 1
5 0.0914919 80 4.79e-005 1
5 18 0.0745998 160 3.19e-005 1
6 21 0.055209 320 1.98e-005 1
7 24 0.0383033 640 7.13e-006 1
8 27 0.0351408 453.591 5.51e-007 1 Optimization terminated: first-order optimality less than OPTIONS.TolFun,
and no negative/zero curvature detected in trust region model.
g12 = -137.5221 g21 = 1.4686e+003
EEA|NS2IEyIa:
g12=-137.522127 g21=1468.583178
A12 =
1.1748
1.1745
1.1741
1.1736
A21 =
0.5370
0.5385
0.5406
0.5432
gangma1 =
0.8570
0.8745
0.7950
0.7649
gangma2 =
1.8378
1.8796
1.6581
1.5702
F =
0.6943 0.2634
0.7886 0.2575
0.6072 0.3884
0.5762 0.4697 y1cal =
0.6943
0.7886
0.6072
0.5762
y2cal =
0.2634
0.2575
0.3884
0.4697
气液平衡的计算Word版
《化工热力学》过程论文 题目:气液平衡的计算方法系别:化学材料与工程系班级:13级化工卓越班 姓名: 学号:1303022014 教师: 日期:2016-1-12
气液平衡的计算方法 摘要本文综合分析了多组分相平衡理论特点,主要介绍了利用Peng Robinson ( PR) 立方型状态方程进行氧、氮、氩系统气液平衡计算的方法(泡点、露点和闪蒸计算),对该计算方法的准确性进行分析和验证。 关键词立方型状态方程;气液平衡计算;泡点;露点;闪蒸
目录 1 前言 .................................................................................................................... - 3 - 2 状态方程的选择 ................................................................................................ - 4 - 3 混合规则 ............................................................................................................ - 5 - 4 气液平衡的计算 ................................................................................................ - 6 - 4.1 泡点计算[3] ............................................................................................. - 6 - 4.2 露点计算[3] ............................................................................................. - 7 - 4.3 等温闪蒸的计算 ..................................................................................... - 8 - 5 结论 .................................................................................................................... - 8 - 6 参考文献 ............................................................................................................ - 9 -
旋光法测溶液浓度
用旋光法测定糖溶液的浓度 一、简介 许多物质如石英晶体、氯酸钠、糖溶液、松节油等都有旋光性。利用旋光性测定糖溶液浓度的仪器称为旋光糖量计。除了在制糖工业中广泛应用外,在制药工业、药品检测及商品检测部门中也常用来测定一些药物和商品(如可卡因、尼古丁、樟脑等)的浓度。本实验主要是学习理解偏振光的产生和检测方法;观察旋光现象,了解旋光物质的旋光性质;测定糖溶液的旋光率和浓度的关系;熟悉旋光仪的原理和使用方法并学习自己组装旋光仪。 二、实验原理 线偏振光通过某些物质的溶液后,偏振光的振动面将旋转一定的角度,这种现象称为旋光现象,旋转的角度称为该物质的旋光度。通常用旋光仪来测量物质的旋光度。溶液的旋光度与溶液中所含旋光物质的旋光能力、溶液的性质、溶液浓度、样品管长度、温度及光的波长等有关。当其它条件均固定时,旋光度θ与溶液浓度C 呈线性关系,即 C βθ= (1) 上式中,比例常数β与物质旋光能力、溶剂性质、样品管长度、温度及光的波长等有关,C 为溶液的浓度。 物质的旋光能力用比旋光度即旋光率来度量,旋光率用下式表示: []C l t ?=θαλ (2) 上式中,[]t λα右上角的t 表示实验时温度(单位:o C), λ是指旋光仪采用的单色光源的波长(单位:nm),θ为测得的旋光度( o ),l 为样品管的长度(单位:dm ),C 为溶液浓度(单位:g/100mL )。
由(2)式可知:①偏振光的振动面是随着光在旋光物质中向前进行而逐渐旋转的,因而振动面转过角度θ透过的长度l成正比;②振动面转过的角度θ不仅与透过的长度l成正比,而且还与溶液浓度C成正比。 如果已知待测物质浓度C和液柱长度l,只要测出旋光度θ就可以计算出旋光率。如果已知液柱长度l为固定值,可依次改变溶液的浓度C,就可测得相应旋光度θ。并作旋光度θ与浓度的关系直线,从直线斜率、长度l及溶液浓度C,可计算出该物质的旋光率;同样,也可以测量旋光性溶液的旋光度θ,确定溶液的浓度C。 旋光性物质还有右旋和左旋之分。当面对光射来方向观察,如果振动面按顺时针方向旋转,则称右旋物质;如果振动面向逆时针方向旋转,称左旋物质。表1给出了一些药物在温度t=20o C,偏振光波长为钠 λ589.3nm(相当于太阳光中的D线)时的旋光率。 光≈ 表1某些药物的旋光率(单位:(o)·g-1·cm3·dm-1) 三、实验仪器及装置 实验仪器主要有偏振光旋光实验仪和半荫旋光仪(糖量计)两种类型。本实验中采用偏振光旋光实验仪。 偏振光旋光实验仪的结构如图2所示。它由光具座、带刻度转盘的偏振片2个、样品试管、样品试管调节架、光功率计等组成。
实验设计与数据处理
《实验设计与数据处理》大作业 班级:环境17研 姓名: 学号: 1、 用Excel (或Origin )做出下表数据带数据点的折线散点图 余浊(N T U ) 加量药(mL) 总氮T N (m g /L ) 加量药(mL ) 图1 加药量与剩余浊度变化关系图 图2 加药量与总氮TN 变化关系图 总磷T P (m g /L ) 加量药(mL) C O D C r (m g /L ) 加量药(mL) 图3 加药量与总磷TN 变化关系图 图4 加药量与COD Cr 变化关系图 去除率(%) 加药量(mL)
图5 加药量与各指标去除率变化关系图
2、对离心泵性能进行测试的实验中,得到流量Q v 、压头H 和效率η的数据如表所示,绘制离心泵特性曲线。将扬程曲线和效率曲线均拟合成多项式(要求作双Y 轴图)。 η H (m ) Q v (m 3 /h) 图6 离心泵特性曲线 扬程曲线方程为:H=效率曲线方程为:η=+、列出一元线性回归方程,求出相关系数,并绘制出工作曲线图。 (1) 表1 相关系数的计算 Y 吸光度(A ) X X-3B 浓度(mg/L ) i x x - i y y - l xy l xx l yy R 10 -30 2800 20 -20 30 -10 40 ()() i i x x y y l R --= = ∑
50 10 60 20 70 30 平均值 40 吸光度 X-3B浓度(mg/L) 图7 水中染料活性艳红(X-3B )工作曲线 一元线性回归方程为:y=+ 相关系数为:R 2= (2) 代入数据可知: 样品一:x=样品二:x=、试找出某伴生金属c 与含量距离x 之间的关系(要求有分析过程、计算表格以及回归图形)。 表2 某伴生金属c 与含量距离x 之间的关系分析计算表 序号 x c lgx 1/x 1/c 1 2 2 3 3 4 4 5 5 7 6 8 7 10 1
气液平衡
汽液平衡数据的测定 汽液平衡数据是最常用的化工基础数据。许多化工过程如精馏的设计、操作及过程控制等都离不开汽液平衡数据。有热力学研究方面,新的热力学模型的开发,各种热力学模型的比较筛选等也离不开大量精确的汽液平衡实测数据。现在,各类化工杂志每年都有大量的汽液平衡数据及汽液平衡测定研究的文章发表。所以汽液平衡数据的测定及研究深受化工界人士的重视 一、实验目的: 通过测定常压下乙醇—水二元系统汽液平衡数据的实验,使同学们了解、掌握汽液平衡数据测定的方法和技能,熟悉有关仪器的使用方法,将课本上学到的热力学理论知识与实际运用有机地联系在一起。从而既加深对理论知识的理解和掌握,又提高了动手的能力。 二、汽液平衡测定和种类: 由于汽液平衡体系的复杂性及汽液平衡测定技术的不断发展,汽液平衡测定也形成了特点各异的不同种类。 按压力分,有常减压汽液平衡和高压所液平衡测定。高压汽液平衡测定的技术相对比较复杂,难度较大。常减压汽液平衡测定则相对较易。 按形态分,有静态法和动态法。静态法技术相对要简单一些,而动态法测定的技术要复杂一些但测定较快较准。 在动态法里又有单循环法和双循环法。双循环法就是让汽相和液相都循环,而单循环只让其中一相(一般是汽相)循环。在一般情况下,常减压汽液平衡都采用双循环,而在高压所液平衡中,只让汽相强制循环。循环的好处是易于平衡、易于取样分析。 根据对温度及压力的控制情况,有等温法与等压法之分。一般,静态法采用等温测定,动态法的高压汽液平等多采用等温法。 总之汽液平衡系统特点各异,而测定的方法亦丰富多彩。 本实验采用的是常压下(等压)双循环法测定乙醇—水的汽液平衡数据。 三、实验原理: 以循环法测定汽液平衡数据的平衡釜有多种形式,但基本原理是一样的。如图书馆所示,当体系达到平衡时,A 和B 两容器中组成不随时间布景为化,这时从A 和B 两容器中取样分析可以得到一组汽液平衡实验数据。 根据下平衡原理,当所液两相达到相平衡时,汽液两相温度压力相等,同时任一组分在各相中的逸度相等,即: v L i i f f =)) 这里 v v i i i f y P =Φ)) 0 L i i i i f r x f =)) 对低压汽液平衡,其汽相可以视为理想气体混合物,即1v i Φ=) ,忽略压力对液体 逸度的影响,即0 i i f P =),从而得出低压下汽液平衡关系式: i i i i Py r x P = 式中 P ——体系压力(总压) i P ——纯组分i 在平衡温度下的饱合蒸汽压。
旋光度测定法 中国药品检验标准操作规范2010年版
旋光度测定法 1 简述 许多有机化合物具有光学活性,即平面偏振光通过其液体或溶液时,能引起旋光现象,使偏振光的平面向左或向右发生旋转,偏转的度数称为旋光度。这种特性是由于物质分子中含有不对称元素(通常为不对称碳原子)所致。光学异构体数为2n,n为分子中不对称碳原子数。使偏振光向右旋转者(顺时针方向,朝光源观测)称为右旋物质,常以“+”号表示;使偏振光向左旋转者则称为左旋物质,常以“—”号表示。影响物质旋光度的因素很多,除化合物的特性外,还与测定波长、使用的溶剂偏振光通过的供试液浓度与液层的厚度以及测定时的温度有关。当偏振光透过长1dm、每1ml中含有旋光性物质1g的溶液,在一定波长与温度下测定的旋光度称为该物质的比旋度,以 [α]λt表示。t为测定时的温度,λ为测定波长。通常测定温度为20℃,使用钠光谱的D线(589.3nm)表示,表示为[α]D20。比旋度为物质的物理常数,可用以区别或检查某些物质的光学活性和纯杂程度。旋光度在一定条件下与浓度呈线性关系,故还可以用来测定含量。 2 仪器 2.1 旋光仪又称旋光计,是药品检验工作中较早使用的仪器。早期的圆盘式旋光仪由钠光灯光源、起偏镜、测定管、检偏镜、半影板调零装置和支架组成。起偏镜是一组可以产生平面偏振光的晶体,称为尼科尔棱镜,用一种天然晶体如方解石按一定方法切割再用树胶黏合而制成。现今则多采用在塑料膜上涂上某些具有光学活性的物质,使
其产生偏振光。早期旋光仪用人眼观测误差较大,读数精度为0.05°。20世纪80年代数显自动指示旋光仪和投影自动指示旋光仪相继问市。仪器的读数精度液提高到了0.01°和0.001°。《中国药典》2010年版规定使用读数精度达到0.01°的旋光仪。 2.2 仪器的性能测试根据中华人民共和国“旋光仪及旋光糖量计检定规程”JJG536-98目视旋光仪的准确度等级有二种:0.02与0.05,自动旋光仪准确度的等级有三种:0.01、0.02与0.05,检定项目有准确度、重复性和稳定性,还有对测定管盖玻片内应力与长度误差等的检查。《中国药典》2010年版附录规定准确度可用标准石英旋光管(+5°与﹣1°两支)进行校准,方法可参照JJG536-1998,在规定温度下,重复测定6次,两支标准石英旋光管的平均测定结果均不得超出示值±0.01°。测定管旋转不同角度与方向测定,结果均不得超出示值﹣0.04°。 《中国药典》1990年版之前曾收载用蔗糖作为基准物进行校准。取经105℃干燥2h的蔗糖(化学试剂一级),精密称定,加水溶解并定量稀释制成每1ml中含0.2g的溶液,依法测定,结果在20℃时的比旋度应为±66.60°。但用蔗糖校准时,蔗糖的纯度与水分必须符合要求,必须准确称量与稀释,否则易造成误差。而且蔗糖溶液容易生霉,不能长时间放置,目前已很少采用。国际统一糖分析委员会(ICUMSA)也推荐用标准石英旋光管进行校验。 3 测定方法 《中国药典》旋光度测定法主要用于某些药品性状项下比旋度的
气液相平衡分析(正式)
编订:__________________ 单位:__________________ 时间:__________________ 气液相平衡分析(正式) Deploy The Objectives, Requirements And Methods To Make The Personnel In The Organization Operate According To The Established Standards And Reach The Expected Level. Word格式 / 完整 / 可编辑
文件编号:KG-AO-6622-58 气液相平衡分析(正式) 使用备注:本文档可用在日常工作场景,通过对目的、要求、方式、方法、进度等进行具体、周密的部署,从而使得组织内人员按照既定标准、规范的要求进行操作,使日常工作或活动达到预期的水平。下载后就可自由编辑。 在吸收操作中,气体总量和溶液总量都随吸收的进行而改变,但惰性气体和吸收剂的量则始终保持不变,因此,常采用物质的量比表示相的组成,以简化吸收过程的计算。 物质的量比是指混合物中一组分物质的量与另一组分物质的量的比值,用X或y表示。 吸收液中吸收质A对吸收剂S的物质的量比(摩尔比)可以表示为 XA=nA/ns (11—1) 物质的量比与摩尔分数的换算关系为 XA=工A/(1一XA) (11—2) 式中XA——吸收液中组分A对组分S的物质的量比; nA,ns——组分A与S的物质的量,kmol;
XA——吸收液中组分A的摩尔分数。 混合气体中吸收质A对惰性组分月的物质的量比可以表示为 式中YA——混合气中组分A对组分B的物质的量比; nA,nR——组分A与B的物质的量,kmol yA——混合气中组分A的摩尔分数。 在一定温度和压力下,混合气体与液相接触时,溶质便从气相向液相转移,而溶于液相内的溶质又会从溶剂中逸出返回气相。随着溶质在液相中的浓度逐渐增加,溶质返回气相的量也逐渐增大,当单位时间内溶于液相中的溶质量与从液相返回气相的溶质量相等时,气相和液相的量及组成均不再改变,达到动态平衡。它是吸收过程的极限,它们之间的关系称为相平衡关系。 在一定温度下,当气相总压力不高时,稀溶液中溶质的平衡浓度和该气体的平衡分压的平衡关系可用
试验设计与数据处理
试验设计与数据处理方法总述及总结 王亚丽 (数学与信息科学学院 08统计1班 081120132) 摘要:实验设计与数据处理是一门非常有用的学科,是研究如何经济合理安排 试验可以解决社会中存在的生产问题等,对现实生产有很重要的指导意义。因此本文根据试验设计与数据处理进行了总述与总结,以期达到学习、理解、掌握的以及灵活运用的目的。 1 试验设计与数据处理基本知识总述 1.1试验设计与数据处理的基本思想 试验设计与数据处理是数理统计学中的一个重要分支。它是以概率论、数理统计及线性代数为理论基础,结合一定的专业知识和实践经验,研究如何经济、合理地安排实验方案以及系统、科学地分析处理试验结果的一项科学技术,从而解决了长期以来在试验领域中,传统的试验方法对于多因素试验往往只能被动地处理试验数据,而对试验方案的设计及试验过程的控制显得无能为力这一问题。 1.2试验设计与数据处理的作用 (1)有助于研究者掌握试验因素对试验考察指标影响的规律性,即各因素的水平改变时指标的变化情况。 (2)有助于分清试验因素对试验考察指标影响的大小顺序,找出主要因素。(3)有助于反映试验因素之间的相互影响情况,即因素间是否存在交互作用。(4)能正确估计和有效控制试验误差,提高试验的精度。 (5)能较为迅速地优选出最佳工艺条件(或称最优方案),并能预估或控制一定条件下的试验指标值及其波动范围。 (6)根据试验因素对试验考察指标影响规律的分析,可以深入揭示事物内在规律,明确进一步试验研究的方向。
1.3试验设计与数据处理应遵循的原则 (1)重复原则:重可复试验是减少和估计随机误差的的基本手段。 (2)随机化原则:随机化原则可有效排除非试验因素的干扰,从而可正确、无偏地估计试验误差,并可保证试验数据的独立性和随机性。 (3)局部控制原则:局部控制是指在试验时采取一定的技术措施方法减少非试验因素对试验结果的影响。用图形表示如下: 2试验设计与数据处理方法总述和总结 2.1方差分析 (1)概念:方差分析是用来检验两个或两个以上样本的平均值差异的显著程度。并由此判断样本究竟是否抽自具有同一均值的总体。 (2)优点:方差分析对于比较不同生产工艺或设备条件下产量、质量的差异,分析不同计划方案效果的好坏和比较不同地区、不同人员有关的数量指标差异是否显著时,是非常有用的。 (3)缺点:对所检验的假设会发生错判的情况,比如第一类错误或第二类错误的发生。 (4)基本原理:方差分析的基本思路是一方面确定因素的不同水平下均值之间的方差,把它作为对由所有试验数据所组成的全部总体的方差的第一个估计值;另一方面再考虑在同一水平下不同试验数据对于这一水平的均值的方差,由此计算出对由所有试验数据所组成的全部数据的总体方差的第 二个估计值。比较上述两个估计值,如果这两个方差的估计值比较接近就说明因素的不同水平下的均值间的差异并不大,就接受零假设;否则,说明因素的不同水平下的均值间的差异比较大。
二组分气液平衡实验数据处理~
7.实验数据记录和处理 1、乙醇和水的实验基础数据 (1)、物性 表1-1 乙醇和水的物性 名称摩尔质量沸点(℃)折光指数乙醇(1)46.0778.30 1.3595 水(2)18.02100.0 1.3325(注:1-乙醇,2-水,下同) (2)、Antoine常数 表1-2 Antoine常数 Antoine常数适用范围 A B C(℃) 乙醇8.11221593.864226.18420~93 水8.071311730.630233.4261~100 (3)、常压下饱和液体的摩尔体积 表1-3 常压下饱和液体的摩尔体积 温度乙醇水 8061.9718.52 9063.0118.65 10064.1218.78 (4)、乙醇—水二元交互能量参数 2、的计算
(1)、内插法平衡温度下乙醇和水的摩尔体积 根据表1-3数据,利用内插法求得平衡温度下的摩尔体积,列表如下。 表1-4平衡温度下乙醇和水的摩尔体积(常压下) 温度(℃)乙醇的摩尔体 () 水的摩尔体积 () 90.263.0318.65 85.662.5518.59 83.262.3018.56 82.362.2118.55 以1#数据为计算示例。(下同) (2)、Willson配偶参数的确定 根据表1-4计算Willson配偶参数,计算结果如列表所示。 表1-5 平衡温度下的Willson配偶参数 温度(℃) 90.20.21770.8506 85.60.21740.8259 83.20.21750.8161 82.30.21750.8125 (3)、Willson方程计算。 由表1-5和原始数据根据Willson方程计算,计算结果如下表所示。 表1-6 平衡温度下乙醇—水的 温度(℃)乙醇水 90.2 4.0882 1.0053
旋光度的测定
旋光度的测定方法和注意事项 中国卖仪器网整理:平面偏振光通过含有某些光学活性化合物的液体或溶液时,能引起旋光现象,使偏振光的平面向左或向右旋转。旋转的度数,称为旋光度。偏振光透过长1dm并1mL中含有旋光性物质1g的溶液,在一定波长与温度下测得的旋光度称为比旋度。 测定比旋度(或旋光度)可以区别或检查某些药品的纯杂程度,亦可用以测定含量。 除另有规定外,本药典系用钠光谱的D线(589.3nm)测定旋光度,测定管长度为1dm(如使用其他管长, 应进行换算),测定温度为20℃。 测定旋光度时,用读数至0.01°并经过检定的旋光度测定计。将测定管用供试液体或溶液(取固体供试品,按各药品项下的方法制成)冲洗数次,缓缓注入供试液体或溶液适量(注意勿使产生气泡),置于旋光计 (旋光测定仪)内检测读数,即得供试液的旋光度。 使偏振光向右旋转者(顺时针方向)为右旋,以“+”符号表示;使偏振光向左旋转者(反时针方向)为左 旋,以“-”符号表示。 用同法读取旋光度3次,取3次的平均数,照下列公式计算,即得供试品的比旋度。 a 对液体供试品[a](t,D)= --- ld 100a 对固体供试品[a](t,D)= ----- Lc 式中[α]为比旋度; D 为钠光谱的D线; t 为测定时的温度; l 为测定管长度,dm; α 为测得的旋光度; d 为液体的相对密度; c 为每100ml溶液中含有被测物质的重量,g(按干燥品或无水物计算)。 旋光计的检定,可用标准石英旋光管进行,读数误差应符合规定。 【注意事项】 (1)每次测定前应以溶剂作空白校正,测定后,再校正1次,以确定在测定时零点有无变动;如第2次 校正时发现零点有变动,则应重新测定旋光度。 (2)配制溶液及测定时,均应调节温度至20℃±0.5℃(或各品种项下规定的温度)。 (3)供试的液体或固体物质的溶液应不显浑浊或含有混悬的小粒。超净工作台如有上述情形时,应预先滤 过,并弃去初滤液。 (4)物质的比旋度与测定光源、测定波长、溶剂、浓度和温度等因素有关。因此,表示物质的比旋度时应 注明测定条件。
气液两相流 整理
第一章概论 相的概念:相是体系中具有相同化学组成和物理性质的一部分,与体系的其它均匀部分有界面隔开 两相流动的处理方法:双流体瞬态模拟方法和精确描述物理现象的稳态机理模型是多相管流研究的主要方法 目前研究存在的问题:1、多相流问题未得到解析解;2、油气水三相流的研究不够深入;3、水平井段变质量流动研究较少;4、缺乏向下流动的综合机理模型;5、缺乏专用研究仪器 气液两相流的分类:1、细分散体系:细小的液滴或气泡均匀分散在连续相中 2、粗分散体系:较大的气泡或液滴分散在连续相中 3、混合流动型:两相均非连续相 4、分层流动:两相均为连续相 气液两相流的基本特征: 1、体系中存在相界面:两相之间也存在力的作用,出现质量和能量的交换时伴随着机械能的损失 2、两相的分布情况多种多样:两相流动中两相介质的分布称为流型 3、两相流动中存在滑脱现象:相间速度的差异称为滑脱,滑脱将产生附加的能量损失 4、沿程流体体积流量有很大变化,质量流量不变 气液两相流研究方法: 1、经验方法:从气液两相流动的物理概念出发,或者使用因次分析法,或者根据流动的基本微分方程式,得到反映某一特定的两相流动过程的一些无因次参数,然后依据实验数据整理出描述这一流动过程的经验关系式。 优点:使用方便,在一定条件下能取得好的结果 缺点:使用有局限性,且很难从其中得出更深层次的关系 2、半经验方法:根据所研究的气液两相流动过程的特点,采用适当的假设和简化,再从两相流动的基本方程式出发,求得描述这一流动过程的函数关系式,最后用实验方法确定出函数关系式中的经验系数。 优点:有一定的理论基础,应用广泛 缺点:存在简化和假设,具有不准确性 3、理论分析方法:针对各种流动过程的特点,应用流体力学方法对其流动特性进行分析,进而建立起描述这一流动过程的解析关系式。 优点:以理论分析为基础,可以得到解析关系式 缺点:建立关系式困难,求解复杂 研究气液两相流应考虑的几个问题: 1、不能简单地用层流或紊流来描述气液两相流 2、水平或倾斜流动是轴不对称的 3、由于相界面的存在增加了研究的复杂性 4、总能量方程中应考虑与表面形成的能量问题 5、多相流动中各相的温度、组分的浓度都不是均匀的,相之间有传热和传质 6、各相流速不同,出现滑脱问题,是多相流研究的核心与重点 流动型态:相流动中两相介质的分布状况称为流型或两相流动结构 流型图:描述流型变化及其界限的图。把流型变换的实验数据加以总结归纳后,按照两个或多个主要的流动参数绘成曲线,便可以得到流型图。 影响流型的因素:1、各相介质的体积比例2、介质的流速3、各相的物理及化学性质(密度、粘度界面张力等)4、流道的几何形状5、壁面特性6、管道的安装方式 流型分类:1、根据两相介质分布的外形划分;垂直气液两相流:泡状流、弹状流、段塞流、环状流、雾状流。水平气液两相流:泡状流、团状流、层状流、波状流、冲击流、环状流、雾状流。 2、按流动的数学模型或流体的分散程度划分为:分散流、间歇流、分离流。 两种分类方法的比较:第一类划分方法较为直观;第二类划分方法便于进行数学处理 气液两相流的特性参数: 质量流量:单位时间内流过过流断面的流体质量,kg/s, 气相质量流量:单位时间内流过过流断面的气体质量,kg/s, l g G G G+ =
气液平衡的计算x (1)
合肥学院Hefei University 《化工热力学》过程论文 题目:汽液平衡的计算方法 系别:化学与材料工程系 专业:化学工程与工艺 学号: 1303021011 姓名:徐磊
教师: 高大明 2016 年1月 汽液平衡的计算方法 摘要: 在恒定的温度和压力下,汽液两相发生接触后,吸收质由汽相向液相转移,随液体中吸收质浓度的逐渐增高,吸收速率逐渐减小,解吸速率逐渐增大。经过相当长的时间接触后,吸收速率与解吸速率相等,即吸收质在气相中的分压及在液相中的浓度不再发生变化,此时汽,液两相达到平衡状态,简称相平衡。国内外学者已建立了多种T 、p 、x 推算y 的方法,它们都是在Gibbs-Duhem(G-D)方程的基础上建立起来的。 关键词:汽液平衡、G-D 方程 正文: 在计算时根据应用G-D 方程方式上的不同,可以归结为两大类:其一是直接法,它是将式(1-6.11)表示的逸度的G-D 方程同时应用于气液两相而得到联系T 、p 、x 和y 的共存方程,解此共存方程即可实现由T 、p 、x 推算y 的目的;另一种是间接法,它首先计算过量吉氏函数Q ,根据Q 与活度因子的关系(隐含了G-D 方程)计算液相活度因子,从而实现间接计算气相组成的目的。 1.Q 函数法(间接法) Q 函数法原理 汽液平衡时,按判据式)()(L V k k f f (k =1, …, K ),如气相采用逸度因子、液相采用第I 种活度因子分别计算气液相的非理想性,得
] /)(exp[* *,,**RT p p V x p py k L k m k k k k k k -=I γ?? 整理上式可得系统总压p , ∑∑==-==K k k k L k m k k k k K k k RT p p V x p py p 1 **,,**1 /]/)(ex p[?γ?I 得 ?? ??????????????? ????-???? ????-???????????? ????-???? ????+????????? ????-???? ????+-=∑∑∑∑-=-==-=11],[],[11],[],[2111],[],[* *,**exp ] /)(exp[K j K j x j j K k x k E m K j K j x j j K k x k E m K k K j K j x j j K k x k k k L k m k k k x p x x p RT V x T x x T RT H x Q x x Q Q RT p p V x p p ??. 如果暂时不考虑*k p 、*k ?、L k m V *,、k ?、E m H 和E m V ,则式中除了Q 以外,其它的 变量就是已输入的T 、p 、x 。而Q 函数正是T 、p 、x 的函数,式(2-2.3)实质上是一个Q 函数的偏微分方程,只要有足够数量的一系列T 、p 、x 的实验数据,原则上可以解得Q =Q (T , p , x )。但实践上却有很大困难,因为导数出现在exp 中,是一个超越型的偏微分方程,没有解析解,只能通过数值方法求解。 2.直接法 直接法原理 直接法是从逸度的Gibbs-Duhem 方程出发建立起来的T 、p 、x 推算y 的方法。对于一个含有K 个组分的系统,其液相逸度的Gibbs-Duhem 方程为, p RT V T RT H H x p f x m m K k k m k K k k k d d ln d )(2 )(1 o ,1 o )(L L L +-= ∑∑== 当处理一系列T 、p 、x 实验数据时, T 、p 和)(L k f 均可形式上表达为液相组成x 1、 x 2、…、x K -1的函数,上式变为
气液相平衡分析详细版
文件编号:GD/FS-2042 (解决方案范本系列) 气液相平衡分析详细版 A Specific Measure To Solve A Certain Problem, The Process Includes Determining The Problem Object And Influence Scope, Analyzing The Problem, Cost Planning, And Finally Implementing. 编辑:_________________ 单位:_________________ 日期:_________________
气液相平衡分析详细版 提示语:本解决方案文件适合使用于对某一问题,或行业提出的一个解决问题的具体措施,过程包含确定问题对象和影响范围,分析问题,提出解决问题的办法和建议,成本规划和可行性分析,最后执行。,文档所展示内容即为所得,可在下载完成后直接进行编辑。 在吸收操作中,气体总量和溶液总量都随吸收的进行而改变,但惰性气体和吸收剂的量则始终保持不变,因此,常采用物质的量比表示相的组成,以简化吸收过程的计算。 物质的量比是指混合物中一组分物质的量与另一组分物质的量的比值,用X或y表示。 吸收液中吸收质A对吸收剂S的物质的量比(摩尔比)可以表示为 XA=nA/ns (11—1) 物质的量比与摩尔分数的换算关系为 XA=工A/(1一XA) (11—2) 式中XA——吸收液中组分A对组分S的物质
的量比; nA,ns——组分A与S的物质的量,kmol; XA——吸收液中组分A的摩尔分数。 混合气体中吸收质A对惰性组分月的物质的量比可以表示为 式中YA——混合气中组分A对组分B的物质的量比; nA,nR——组分A与B的物质的量,kmol yA——混合气中组分A的摩尔分数。 在一定温度和压力下,混合气体与液相接触时,溶质便从气相向液相转移,而溶于液相内的溶质又会从溶剂中逸出返回气相。随着溶质在液相中的浓度逐渐增加,溶质返回气相的量也逐渐增大,当单位时间内溶于液相中的溶质量与从液相返回气相的溶质量相
试验设计与数据处理课程论文
课 程 论 文 课程名称试验设计与数据处理 专业2012级网络工程 学生姓名孙贵凡 学号201210420136 指导教师潘声旺职称副教授
成绩 科学研究与数据处理 学院信息科学与技术学院专业网络工程姓名孙贵凡学号:201210420136 摘要:《实验设计与数据处理》这门课程列举典型实例介绍了一些常用的实验设计及实验数据处理方法在科学研究和工业生产中的实际应用,重点介绍了多因素优化实验设计——正交设计、回归分析方法以对目标函数进行模型化处理。其适于工艺、工程类本科生使用,尤其适用于化学化工、矿物加工、医学和环境学等学科的本科生使用。其对行实验设计可提供很大的帮助,也可供广大分析化学工作者应用。关键字:优化实验设计; 标函数进行模型化处理; 正交设计; 回归分析方法 1 引言 实验是一切自然科学的基础,科学界中大多数公式定理是由试验反复验证而推导出来的。只有经得起试验验证的定理规律才具有普遍实用性。而科学的试验设计是利用自己已有的专业学科知识,以大量的实践经验为基础而得出的既能减少试验次数,又能缩短试验周期,从而迅速找到优化方案的一种科学计算方法,就必然涉及到数据处理,也只有对试验得出的数据做出科学合理的选择,才能使实验结果更具说服力。实验设计与数据处理在水处理中发挥着不可估量的作用,通过科学合理的实验设计过程加上严谨规范的数据处理方法,可以使水处理原理,内在规律性被很好的发现,从而更好的应用于生产实践。 2 材料与方法 2.1 供试材料 1. 论文所围绕的目标和假设 研究的目标就是实验的目的,我们设计了这个实验是想来做什么以及想得到什么样的结论。要正确的识别问题和陈述问题,这些需要专业知识和大量的阅读文献综述等方法来获得我们所要提出的问题。需要对某一个具体的问题,并且对这个具体的问题提出假设。如水处理中混凝剂的最佳投加量,混凝剂的最佳投加量有一个适宜的PH值范围。
气液平衡
第二节气液相平衡 上节中图8-2(b)所示的湿壁塔吸收是吸收过程最基本的操作方式,它与套管换热器中的传热颇相类似。若将吸收与传热两个过程作一比较,不难看出其间的异同:传热过程是冷、热两流体间的热量传递,传递的是热量,传递的推动力是两流体间的温度差,过程的极限是温度相等;吸收过程是气液两相间的物质传递,传递的是物质,但传递的推动力不是两相的浓度差,过程的极限也不是两相浓度相等。这是由于气液之间的相平衡不同于冷热流体之间的热平衡。 8-2-1 平衡溶解度 在一定温度下气液两相长期或充分接触后,两相趋于平衡。此时溶质组分在两相中的浓度服从某种确定的关系,即相平衡关系。此相平衡关系可以用不同的方式表示。 溶解度曲线气液两相处于平衡状态时,溶质在液相中的浓度称为溶解度,它与温度、溶质在气相中的分压有关。若在一定温度下,将平衡时溶质在气相中的分压p e与液相中的摩尔分率x相关联,即得溶解度曲线。图8-3为不同温度下氨在水中的溶解度曲线。从此图可以看出,温度升高,气体的溶解度降低。 液相中氨的摩尔分率x 图8-3 氨在水中的平衡溶解度图8-4 101.3kPa下SO2在水中的溶解度 溶解度及溶质在气相中的组成也可用其它单位表示。例如,气相以摩尔分率y表示,液相用摩尔浓度C表示(其单位为kmol溶质/m3溶液)。图8-4 为SO2在101.3kPa下的溶解度曲线,图中气、液两相中的溶质浓度分别以y、x(摩尔分率)表示。 在一定温度下,分压是直接决定溶解度的参数。当总压不太高时(一般约小于0.5MPa,视物系而异),总压的变化并不改变分压与溶解度之间的对应关系。但是,当保持气相中溶质的摩尔分率y为定值,总压不同意味着溶质的分压不同。因此,不同总压下y~x溶解度曲线的位置不同。 以分压表示的溶解度曲线直接反映了相平衡的本质,用以思考和分析问题直截了当;而以摩尔分率x与y表示的相平衡关系,则可方便地与物料衡算等其他关系式一起对整个吸收过程进行数学描述。 亨利定律吸收操作最常用于分离低浓度的气体混合物,因此时吸收操作较为经济。低浓度气体混合物吸收时液相的浓度通常也较低,即常在稀溶液范围内。稀溶液的溶解度曲线
旋光度的测定
一、实验目得 1、了解旋光仪测定旋光度得基本原理 2、掌握用旋光仪测定溶液或液体物质得旋光度得方法 3、测定布洛芬得旋光度 二、实验内容 1、布洛芬溶液得配定.采用乙醇为溶剂配定一定溶度得布洛芬溶液。 2、旋光仪零点得校正 3、布洛芬旋光度得测定 三、实验原理 只在一个平面上振动得光叫做平面偏振光,简称偏振光。物质能使偏振光得振动平面旋转得性质,称为旋光性或光学活性。具有旋光性得物质,叫做旋光性物质或光学活性物质。旋光性物质使偏振光得振动平面旋转得角度叫做旋光度。许多有机化合物,尤其就是来自生物体内得大部分天然产物,如氨基酸、生物碱与碳水化合物等,都具有旋光性。这就是由于它们得分子结构具有手征性所造成得.因此,旋光度得测定对于研究这些有机化合物得分子结构具有重要得作用,此外,旋光度得测定对于确定某些有机反应得反应机理也就是很有意义得。 测定溶液或液体得旋光度得仪器称为旋光仪。旋光仪得光学系统如图1所示. 由单色光源发出得光线经起偏器后变为线偏振光,在放入待测溶液前调节目镜得焦距使视场更清晰,再调节检偏器,使视场最暗。当放入待测溶液后由于旋光性,视场由暗变亮.旋转检偏器,使视场重新变暗,所转过得角度就就是旋转角,进而就可以代人公式(1)求出浓度。
图1中半波片为一长方形石英片,位于光路截面得中央,将光路得圆形截面直径分割为三部分,两侧为空气,通过物目镜组瞧到得视场就就是由此分割而成得三分视场。石英晶片得光轴方向与起偏器、检偏器得透振方向同位于垂直于仪器光轴得平面内(图2中CD方向)。实验时起偏器透振方向固定,旋转检偏器,使其透振方向在图2得平面内旋转,通过目镜可以观察到亮暗连续变化得三分视场.检偏器透振方向转过360°得过程中,将产生4个特殊得三分视场,以此为例说明三分视场得原理。 图2中P11就是起偏器得透振方向,P2就是检偏器透振方向,P11与半波片得光轴方向夹角为α,正常使用时通常为10°左右。实验过程中,P11保持固定,α亦固定,仅P2可以连续改变.线AB与线CD垂直,钠光灯发出得光线经过起偏器后变成线偏振光,光路中央得线偏振光经过半波片后,振动方向转过2α,为P12。当旋转检偏器使P2方向连续变化时,三分视场中间部分与两边部分将出现明暗得连续变化,其中两边得明暗变化情况相同.如下所述: 1)当P2与P12平行时,如图2(a),在视野中将观察到,中间部分较明亮,而两边较暗,视
旋光度测定法
旋光度测定法 平面偏振光通过含有某些光学活性化合物的液体或溶液,能引起旋光现象,使偏振光的平面向左或向右旋转。旋转的度数,称为旋光度。在一定波长与温度下,偏振光透过每lml含有lg旋光性物质的溶液且光路为长ldm时,测得的旋光度称为比旋度。比旋度(或旋光度)可以用于鉴别或检查光学活性药品的纯杂程度,亦可用于测定光学活性药品的含量。 在间上不能重叠,互为镜像关系的立体异构体称为对映体。手性物质的对映异构体之间,除了使平面偏振光发生偏转的程度相同而方向相反之外,在非手性环境中的理化性质相同。生物大分子如酶、生物受体等通常为手性物质,总是表现出对一种对映体的立体选择性,因此,对映体可在药理学与毒理学方面有差异来源于自然界的物质,例如氨基酸、蛋白质、生物碱、抗体、糖苷、糖等,大多以对映体的形式存在。外消旋体一般由等量的对映异构体构成,旋光度净值为零,其物理性质也可能与其对映体不同。 最常用的光源是采用钠灯在可见光区的D线(589.3nm),但也使用较短的波长,如光电偏振计使用滤光片得到汞灯波长约为578nm、546nm、436nm、405nm和365nm处的最大透射率的单色光,其具有更髙的灵敏度,可降低被测化合物的浓度。还有一些其他光源,如带有适当滤光器的氙灯或卤钨灯。 除另有规定外,本法系采用钠光谱的D线(589.3mn)测定旋光度,测定管长度为ldm(如使用其他管长,应进行换算),测定温度为20℃。用读数至0.01°并经过检定的旋光计。 旋光度测定一般应在溶液配制后30分钟内进行测定。测定旋光度时,将
测定管用供试液体或溶液(取固体供试品,按各品种项下的方法制成)冲洗数次,缓缓注人供试液体或溶液适量(注意勿使发生气泡),置于旋光计内检测读数,即得供试液的旋光度。使偏振光向右旋转者(顺时针方向)为右旋,以“+”符号表示;使偏振光向左旋转者(反时针方向)为左旋,以“一”符号表示。用同法读取旋光度3次,取3次的平均数,照下列公式计算,即得供试品的比旋度 对液体供试品 []ld t D α α= 对固体供试品 []lc 100t D αα= 式中 [α]为比旋度; D 为钠光谱的D 线; f 为测定时的温度,℃; l 为测定管长度,dm ; α为测得的旋光度; d 为液体的相对密度; c 为每100ml 溶液中含有被测物质的重量(按干燥品或无水物计算),g 。 旋光计的检定,可用标准石英旋光管进行,读数误差应符合规定。 【注意事项】 (1)每次测定前应以溶剂作空白校正,测定后,再校正1次,以确定在测定时零点有无变动;如第2次校正时发现旋光度差值超过±0.01时表明零点有变动,则应重新测定旋光度。
相平衡计算
2 相平衡计算 迄今已有很多专著介绍相平衡的计算方法,见文献[2-1~2~5] 。一些大型过程模拟软件,如Pro II 和Aspen 等,可以提供很完善的计算方法。本章简单介绍相平衡计算的基本原理, 至于具体的编程技巧等方面的细节可以参看上述专著。本章花比较多的篇幅介绍相平衡计算的无模型法及其在气液平衡数据测定中的应用,以及气液平衡实验数据的热力学一致性检验[2-6,7],这部分内容在其他专著中介绍得相对较少。 2.1 相平衡计算——有模型法为解决一个具体的相平衡问题,在有了切题的普遍热力学关系式,并确定了独立变量后,还应输入那些为表征系统所必需的性质。本节讨论的相平衡计算,主要采用模型来输入那些性质。 相平衡问题往往表现为:已知一个相的组成x( ),求另一相的组成x( );或已经总组成z,求分相后各相组成x( )和x( )。定义组分k 在和相中分配的相平衡常数K k(αβ)为: K k(αβ)x k(α)/ x k(β)(2-1.1) 相平衡问题的中心,就是要计算每一组分的相平衡常数。 对于计算相平衡的问题,最切题的普遍热力学关系式即相平衡判据。按式(1-5.15)和(1-6.13), k ( ) k ( ),f k( )f k( ),k 1,2, ,K (2-1.2) 在第一章中,已介绍了两种计算逸度的方法,即状态方程法和活 度因子法,具体应用于式(2-1.2) 时有三种选择: (1) 和相采用统一的状态方程。以式(1-6.21)代入式(2-1.2), px k( ) k( )px k( ) k( )(2-1.3) 这种选择可用于气液和液液平衡的计算,特别是高压气液平衡的计算 (2) 相(例如气相) 采用状态方程,相(例如液、固相)采用活度因子关联式。以式(1-6.21)和(1-7.18)代入式(2-1.2),对于不同类型的活度或活度因子,可分别写出: (2-1.5) K H( k)x(k ) k(,II) (2-1.6) K H(k)(m)(m k( )/m o) k(,III)(2-1.7) (αβ) k (β)/( α) kk (2-1.4)
