2020版高考化学二轮复习 第3部分 专题6 大题题空逐空突破(八) 最佳反应条件、原因解释集训
2020高考化学新课标地区专用版提分二轮复习讲义:专题六 化学反应速率 化学平衡Word版含答案

考点一 化学反应速率及影响因素 (一)化学反应速率的计算及速率常数 1.化学反应速率的计算
(1)根据图表中数据和定义计算:v(X)=X的浓度变化量mol·L-1时间的变化量s或min或h,即v(X)=|Δc|Δt=|Δn|V·Δt,计算时一定要注意容器或溶液的体积,不能忽视容器或溶液的体积V,盲目地把Δn当作Δc代入公式进行计算,同时还要注意单位及规范书写,还要根据要求注意有效数字的处理。 (2)根据化学方程式计算:对于反应“mA+nB===pC+qD”,有v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q。 2.速率常数 (1)假设基元反应(能够一步完成的反应)为aA(g)+bB(g)===cC(g)+dD(g),其速率可表示为v=kca(A)cb(B),式中的k称为反应速率常数或速率常数,它表示单位浓度下的化学反应速率,与浓度无关,但受温度、催化剂、固体表面性质等因素的影响,通常反应速率常数越大,反应进行得越快。不同反应有不同的速率常数。 (2)正、逆反应的速率常数与平衡常数的关系 对于基元反应aA(g)+bB(g)cC(g)+dD(g),v正=k正·ca(A)·cb(B),v逆=k逆·cc(C)·cd(D),平
衡常数K=ccC·cdDcaA·cbB=k正·v逆k逆·v正,反应达到平衡时v正=v逆,故K=k正k逆。 (二)正确理解化学反应速率的影响因素 1.内因——活化能 活化能是指为了能发生化学反应,普通分子(具有平均能量的分子)变成活化分子所需要吸收的最小能量,即活化分子比普通分子所多出的那部分能量。相同条件下,不同化学反应的速率不同,主要是内因——活化能大小不同所致,活化能小的化学反应速率快,活化能大的反应速率慢。 注意 反应热为正、逆反应活化能的差值。 2.外因 相同的化学反应,在不同条件下,化学反应速率不同,主要原因是外因——浓度、压强、温度、催化剂、光照、接触面积等因素不同所致。 (1)浓度(c):增大(减小)反应物浓度→单位体积内活化分子数目增加(减少),活化分子百分数不变→有效碰撞频率提高(降低)→化学反应速率加快(减慢)。 (2)压强(p):对于气相反应来说,增大(减小)压强→相当于减小(增大)容器容积→相当于增大(减小)反应物的浓度→化学反应速率加快(减慢)。 注意 “惰性气体”对反应速率的影响 ①恒容:充入“惰性气体”――→引起总压增大―→参与反应的物质浓度不变(活化分子浓度不变)―→反应速率不变。 ②恒压:充入“惰性气体”――→引起体积增大――→引起参与反应的物质浓度减小(活化分子浓度减小)――→引起反应速率减小。 (3)温度(T):升高(降低)温度→活化分子百分数增大(减小)→有效碰撞频率提高(降低)→化学反应速率加快(减慢)。 (4)催化剂 ①添加催化剂→降低反应的活化能→活化分子百分数增大→有效碰撞频率提高→化学反应速率加快。 ②添加催化剂→降低反应的活化能→降低反应所需的温度→减少能耗。 ③添加催化剂能改变反应的路径,如乙醇的氧化实验,该实验的总反应为2CH3CH2OH+O2―→2CH3CHO+2H2O,活化能为E总;使用铜丝作催化剂将一步反应改变为两步反应,第一步反应为2Cu+O2=====△2CuO,活化能为E1;第二步反应为CH3CH2OH+CuO――→△
2020年高考化学二轮专题复习6:化学反应速率与化学平衡(附解析)

2020年高考化学二轮专题复习6:化学反应速率与化学平衡(附解析)考纲指导1.了解化学反应速率的概念及反应速率的定量表示方法。
2.了解化学反应的可逆性及化学平衡的建立。
3.掌握化学平衡的特征,了解化学平衡常数的含义,能够利用化学平衡常数进行相关计算。
4.理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识其一般规律。
5.了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。
Ⅰ.客观题(1)考查化学反应速率、化学平衡常数的简单计算。
(2)外界条件对化学反应速率和化学平衡的影响,化学平衡状态的判断。
(3)以图像表格考查化学反应速率、化学平衡的综合应用。
Ⅱ.主观题常常与基本理论,工业生产相联系,通过图像或表格提供信息进行命题,主要考查化学反应速率的表示方法、外界条件对速率和平衡的影响规律、化学平衡常数的应用以及平衡转化率、起始或平衡浓度的计算等。
知识梳理一、化学反应速率及影响因素1.对化学反应速率计算公式的理解对于反应m A(g)+n B(g)===c C(g)+d D(g)(1)计算公式:v (B)=Δc (B)Δt =Δn (B)V Δt 。
(2)同一反应用不同的物质表示反应速率时,数值可能不同,但意义相同。
不同物质表示的反应速率,存在如下关系:v (A)∶v (B)∶v (C)∶v (D)=m ∶n ∶c ∶d 。
(3)注意事项①浓度变化只适用于气体和溶液中的溶质,不适用于固体和纯液体。
②化学反应速率是某段时间内的平均反应速率,而不是即时速率,且计算时取正值。
2.外界条件对化学反应速率的影响3.稀有气体对反应速率的影响(1)恒容:充入“惰性气体”――→引起总压增大―→物质浓度不变(活化分子浓度不变)―→反应速率不变。
(2)恒压:充入“惰性气体”――→引起体积增大――→引起物质浓度减小(活化分子浓度减小)――→引起反应速率减小。
二、平衡的判定与平衡移动原理1.化学平衡状态的判断标志(1)速率标志①同一物质在同一时间内生成速率与消耗速率相等。
高考化学大题逐空突破系列(全国通用)有关晶胞参数的计算 (附答案解析)
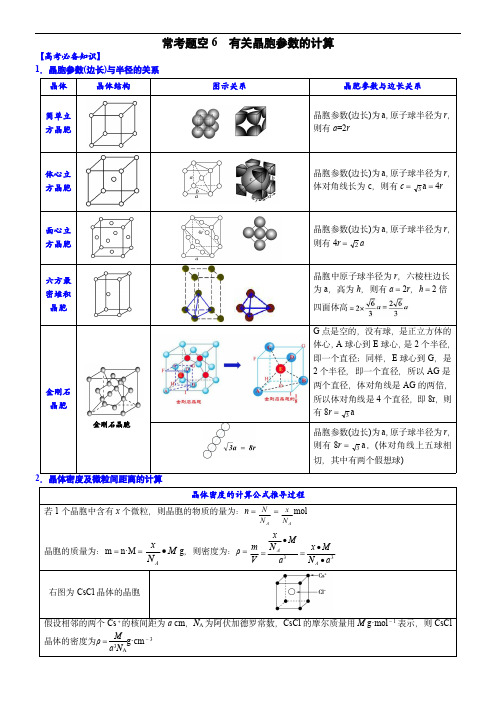
常考题空6有关晶胞参数的计算【高考必备知识】1.晶胞参数(边长)与半径的关系晶体晶体结构图示关系晶胞参数与边长关系简单立方晶胞晶胞参数(边长)为a ,原子球半径为r ,则有a =2r体心立方晶胞晶胞参数(边长)为a ,原子球半径为r ,体对角线长为c ,则有c =3a =4r面心立方晶胞晶胞参数(边长)为a ,原子球半径为r ,则有4r =2a六方最密堆积晶胞晶胞中原子球半径为r ,六棱柱边长为a ,高为h ,则有a =2r ,h =2倍四面体高金刚石晶胞金刚石晶胞G 点是空的,没有球,是正立方体的体心,A 球心到E 球心,是2个半径,即一个直径;同样,E 球心到G ,是2个半径,即一个直径,所以AG 是两个直径,体对角线是AG 的两倍,所以体对角线是4个直径,即8r ,则有8r =3a晶胞参数(边长)为a ,原子球半径为r ,则有8r =3a 。
(体对角线上五球相切,其中有两个假想球)2.晶体密度及微粒间距离的计算晶体密度的计算公式推导过程若1个晶胞中含有x 个微粒,则晶胞的物质的量为:n =AN N =AN x mol晶胞的质量为:m =n·M =M N x A g ,则密度为:ρ=33aN M x a MN xV m A A 右图为CsCl 晶体的晶胞假设相邻的两个Cs +的核间距为a cm ,N A 为阿伏加德罗常数,CsCl 的摩尔质量用M g·mol -1表示,则CsCl 晶体的密度为ρ=Ma 3N Ag·cm -33.金属晶体空间利用率的计算方法(1)空间利用率的定义及计算步骤①空间利用率(η):指构成晶体的原子、离子或分子总体积在整个晶体空间中所占有的体积百分比②%1003433a r V V 球数空间利用率晶胞球类型晶体结构示意图图示关系简单立方堆积原子的半径为r ,立方体的棱长为2r ,则V 球=43πr 3,V 晶胞=(2r )3=8r 3,空间利用率=V 球V 晶胞×100%=43πr 38r 3×100%=6 ≈52%体心立方晶胞原子的半径为r ,体对角线c 为4r ,面对角线b 为2a ,由(4r )2=a 2+b 2得a =43r 。
(浙江选考)2020版高考化学二轮复习专题六第3讲化学反应速率和化学平衡教案

第3讲 化学反应速率和化学平衡[考试说明]化学反应速率及影响因素[学生用书P46]1.对化学反应速率计算公式的剖析v (B)=Δc (B)Δt =Δn (B)V Δt(1)浓度变化只适用于气体和溶液中的溶质,不适用于固体和纯液体。
(2)化学反应速率是某段时间内的平均反应速率,而不是瞬时速率,且计算时取正值。
(3)同一反应用不同的物质表示反应速率时,数值可能不同,但意义相同。
同一化学反应中用不同物质表示的反应速率之比等于其化学计量数之比。
(4)对于可逆反应,反应进行的净速率是正、逆反应速率之差,当达到平衡时,净速率为零。
2.影响反应速率的因素 (1)内因反应物本身的性质是主要因素,如相同条件下Mg 、Al 与稀盐酸反应的速率大小关系为v (Mg)>v (Al)。
(2)外因(只改变一个条件,其他条件不变)3.分析有气体参与的化学反应的反应速率(1)恒温时,压缩体积――→引起压强增大―→气体反应物浓度增大――→引起反应速率增大。
(2)恒温恒容时①充入气体反应物――→引起气体反应物浓度增大(压强也增大)――→引起反应速率增大。
②充入“惰性”气体――→引起总压强增大―→气体反应物浓度未改变――→引起反应速率不变。
(3)恒温恒压时,充入“惰性”气体――→引起体积增大――→引起气体反应物浓度减小――→引起反应速率减小。
4.外界条件对可逆反应的正、逆反应速率的影响方向是一致的,但影响程度不一定相同。
(1)当增大反应物浓度时,v (正)瞬间增大,随后逐渐减小;v (逆)瞬间不变,随后逐渐增大;直至v (正)和v (逆)相等时达到平衡。
(2)增大压强,气体分子数减小方向的反应速率变化程度大。
(3)对于反应前后气体分子数不变的反应,改变压强可以同等程度地改变正、逆反应速率。
(4)升高温度,v (正)和v (逆)都增大,但吸热反应方向的反应速率增大的程度大。
(5)使用催化剂,能同等程度地改变正、逆反应速率。
(江苏专用)2020高考化学二轮复习教案:专题六化学反应速率化学平衡教案.doc

化学反应速率 化学平衡[考纲要求] 1.了解化学反应速率的概念和平均反应速率的表示方法。
2.理解温度、浓度、压强和催化剂等对化学反应速率影响的一般规律。
3.认识催化剂在生产、生活和科学研究领域中的重大作用。
4.认识化学反应的可逆性。
能用焓变和熵变说明常见简单化学反应的方向。
5.理解化学平衡和化学平衡常数的含义,能用化学平衡常数进行简单计算。
6.理解浓度、温度、催化剂等对化学平衡影响的一般规律。
7.认识化学反应速率和化学平衡的调控在生产、生活和科学研究领域中的重要作用。
考点一 化学反应速率及其影响因素(一)化学反应速率的计算及速率常数 1.化学反应速率的计算(1)根据图表中数据和定义计算:v (X)=X 的浓度变化量(mol·L -1)时间的变化量(s 或min 或h ),即v (X)=|Δc |Δt =|Δn |V ·Δt ,计算时一定要注意容器或溶液的体积,不能忽视容器或溶液的体积V ,盲目地把Δn 当作Δc 代入公式进行计算,同时还要注意单位及规范书写,还要根据要求注意有效数字的处理。
(2)根据化学方程式计算:对于反应“m A +n B===p C +q D”,有v (A)∶v (B)∶v (C)∶v (D)=m ∶n ∶p ∶q 。
2.速率常数(1)假设基元反应(能够一步完成的反应)为a A(g)+b B(g)===c C(g)+d D(g),其速率可表示为v =kc a (A)c b (B),式中的k 称为反应速率常数或速率常数,它表示单位浓度下的化学反应速率,与浓度无关,但受温度、催化剂、固体表面性质等因素的影响,通常反应速率常数越大,反应进行得越快。
不同反应有不同的速率常数。
(2)正、逆反应的速率常数与平衡常数的关系 对于基元反应a A(g)+b B(g)c C(g)+d D(g),v正=k正·c a (A)·c b(B),v逆=k逆·c c(C)·c d(D),平衡常数K =c c (C )·c d (D )c a (A )·c b (B )=k 正·v 逆k 逆·v 正,反应达到平衡时v 正=v 逆,故K =k 正k 逆。
2020高考化学新课标地区专用版提分大二轮复习讲义:专题六 化学反应速率 化学平衡 Word版含答案.doc

考点一 化学反应速率及影响因素(一)化学反应速率的计算及速率常数 1.化学反应速率的计算(1)根据图表中数据和定义计算:v (X)=X 的浓度变化量(mol·L -1)时间的变化量(s 或min 或h ),即v (X)=|Δc |Δt =|Δn |V ·Δt ,计算时一定要注意容器或溶液的体积,不能忽视容器或溶液的体积V ,盲目地把Δn 当作Δc 代入公式进行计算,同时还要注意单位及规范书写,还要根据要求注意有效数字的处理。
(2)根据化学方程式计算:对于反应“m A +n B===p C +q D ”,有v (A)∶v (B)∶v (C)∶v (D)=m ∶n ∶p ∶q 。
2.速率常数(1)假设基元反应(能够一步完成的反应)为a A(g)+b B(g)===c C(g)+d D(g),其速率可表示为v =kc a (A)c b (B),式中的k 称为反应速率常数或速率常数,它表示单位浓度下的化学反应速率,与浓度无关,但受温度、催化剂、固体表面性质等因素的影响,通常反应速率常数越大,反应进行得越快。
不同反应有不同的速率常数。
(2)正、逆反应的速率常数与平衡常数的关系 对于基元反应a A(g)+b B(g)c C(g)+d D(g),v 正=k 正·c a (A)·c b (B),v 逆=k 逆·c c (C)·c d (D),平衡常数K =c c (C )·c d (D )c a (A )·c b (B )=k 正·v 逆k 逆·v 正,反应达到平衡时v 正=v 逆,故K =k 正k 逆。
(二)正确理解化学反应速率的影响因素 1.内因——活化能活化能是指为了能发生化学反应,普通分子(具有平均能量的分子)变成活化分子所需要吸收的最小能量,即活化分子比普通分子所多出的那部分能量。
相同条件下,不同化学反应的速率不同,主要是内因——活化能大小不同所致,活化能小的化学反应速率快,活化能大的反应速率慢。
2020届高三化学二轮复习策略—— 综合实验 大题突破
突破一以物质制备为载体的综合实验题1.无机物制备题的常考方向2.有气体参与的制备实验的注意事项(1)操作顺序问题与气体有关的实验操作顺序:装置选择与连接→气密性检查→装入固体药品→加液体药品→按程序实验→拆卸仪器。
(2)加热操作的要求①使用可燃性气体(如H2、CO、CH4等),先用原料气赶走系统内的空气,再点燃酒精灯加热,以防止爆炸。
②制备一些易与空气中的成分发生反应的物质(如H2还原CuO的实验),反应结束时,应先熄灭酒精灯,继续通原料气至试管冷却。
(3)尾气处理的方法有毒气体常采用溶液(或固体)吸收或将之点燃的方法,不能直接排放。
(4)特殊实验装置①制备在空气中易吸水、潮解以及水解的物质(如Al2S3、AlCl3等),往往在装置的末端再接一个干燥装置,以防止空气中水蒸气的进入。
②用液体吸收气体,若气体溶解度较大,要加防倒吸装置。
③若制备物质易被空气中氧气氧化,应加排空气装置。
3.有机物制备实验综合题设问角度及过程分析涉及有机物制取的综合实验,重点考查物质分离中的蒸馏、分液操作,反应条件的控制,产率的计算等问题。
题组一 无机物的制备实验综合题1.水合肼(N 2H 4·H 2O)又名水合联氨,无色透明,是具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。
利用尿素法生产水合肼的原理为:CO(NH 2)2+2NaOH +NaClO===N 2H 4·H 2O +Na 2CO 3+NaCl 。
实验1:制备NaClO 溶液。
(已知:3NaClO=====△2NaCl +NaClO 3)(1)图甲装置Ⅰ中烧瓶内发生反应的化学方程式为____________________________________________________________________________________________________。
(2)用NaOH 固体配制溶质质量分数为30%的NaOH 溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
2020浙江高考化学二轮讲义:专题八第2讲 化学反应条件的控制 Word版含解析
姓名,年级:时间:第2讲化学反应条件的控制[考试说明]知识内容考试要求(1)硫代硫酸钠和强酸反应的原理及实验现象b(2)浓度、温度对硫代硫酸钠与酸反应速率的影响c(3)不同的催化剂对同一反应的催化效果c(4)变量控制在实验研究中的应用c(5)氯化钴溶液的变色原理b(6)浓度、温度变化对氯化钴溶液平衡体系的影响b(7)不同条件下(酸、碱性)乙酸乙酯水解的速率和程度b化学反应影响因素的探究[学生用书P83]1.实验探究程序提出问题→做出假设→设计实验程序→预测可能的结果→进行实验→获得实验数据→分析实验数据→得出结论。
2.化学反应探究类型(1)对反应条件的探究探究一个反应发生的条件,通常需要从反应发生所处的环境,如温度、压强、使用催化剂以及溶液的浓度大小等方面进行考虑。
(2)对反应途径的探究一个化学反应的发生,从反应物到最终生成物都有一个反应历程,即反应途径。
对反应途径的探究,就是通过分析反应可能进行的途径后,确定其最可能的一种情况。
(3)对实验原理的探究对实验原理的探究,就是根据实验现象或结果进行“追根溯源”,寻找产生这种实验现象或实验结果的原理,并使之与对应的原理相吻合。
(4)对化学理论的探究根据实验事实提出假设的理论依据,在此基础上构思原理并设计出实验方案,若得到的实验结果与假设相符,则理论正确。
(5)对反应现象的探究反应现象是反应原理的表现形式,探究反应现象,就是列举出产生这种现象反对应的各种原理、理论,要注意可能的解释是否合理、准确。
(6)对物质成分的探究根据提供的实验现象、实验数据及其他相关的实验内容,假设某物质可能的成分,再以这些成分的物理性质、化学性质及特征反应设计出实验方案,最后通过分析实验结果,得出结论。
(7)对反应结论的探究反应结论是实验的最终结果,反应结论可以是实验现象、数据或图表,还可以是一个化学方程式等.结论是唯一的,而对反应结论的探究方案却可以有多种,关键是要依据题给信息设计出合理、简便的实验方案.(8)对计算结果的探究计算结果是实验过程的定量体现。
2020年高考化学二轮复习专题二 大题题空逐空突破热重分析计算
3.为确定NVCO{化学式可表示为(NH4)a[(VO)b(CO3)c(OH)d]·10H2O}的组成,进行如 下实验: ①称取2.130 g样品与足量NaOH充分反应,生成NH3 0.224 L(已换算成标准状况下)。
固体样品的剩余质量 ②另取一定量样品在氮气氛围中加热,样品的固体残留率( 固体样品的起始质量 × 100%)随温度的变化如下图所示(分解过程中各元素的化合价不变)。
12
2.[2014·新课标全国卷Ⅱ,27(4)]PbO2在加热过程发生分解的失重曲线如下图所示,
样品起始质量-a点固体质量
已知失重曲线上的a点为样品失重4.0%(即
样品起始质量
×100%)的残
留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值。
答案 根据 PbO2==△===PbOx+2-2 xO2↑, 有2-2 x×32=239×4.0%, 解得 x=2-239×164.0%≈1.4,
123
(2)通过计算求出500 ℃时固体的成分及质量(写出计算过程)。
123
m剩余 答案 在 600 ℃时,m起始×100%=68.49%,m(剩余)=36.50 g×68.49%≈25 g,
从
300
℃至
600
℃时,失去的总质量为
32
g-25
g=7
g,失去物质的摩尔质量为0.275
g mol
123
2.为研究一水草酸钙(CaC2O4·H2O)的热分解性质,进行如下实验:准确称取36.50 g
固体样品的剩余质量
样品加热,样品的固体残留率(
×100%)随温度的变化如下图所示:
固体样品的起始质量
(1)300 ℃时残留固体的成分为_C__a_C_2_O_4_,900 ℃时残留固体的成分为__C_a_O__。
