2023年元素周期表与元素周期律知识点归纳精华版
元素周期表、元素周期律知识点总结

元素周期表、元素周期律知识点总结元素周期表、元素周期律知识点总结上学的时候,大家都背过不少知识点,肯定对知识点非常熟悉吧!知识点也可以通俗的理解为重要的内容。
哪些知识点能够真正帮助到我们呢?下面是店铺帮大家整理的关于元素周期表、元素周期律知识点总结,供大家参考借鉴,希望可以帮助到有需要的朋友。
元素周期表、元素周期律知识点总结篇1一、元素周期表★熟记等式:原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则①按照原子序数递增的顺序从左到右排列;②将电子层数相同的元素排成一个横行——周期;③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行——族2、如何精确表示元素在周期表中的位置周期序数=电子层数;主族序数=最外层电子数口诀:三短三长一不全;七主七副零八族熟记:三个短周期,第一和第七主族和零族的元素符号和名称3、元素金属性和非金属性判断依据①元素金属性强弱的判断依据单质跟水或酸起反应置换出氢的难易;元素最高价氧化物的水化物——氢氧化物的碱性强弱; 置换反应。
②元素非金属性强弱的判断依据单质与氢气生成气态氢化物的难易及气态氢化物的稳定性;最高价氧化物对应的水化物的酸性强弱; 置换反应。
4、核素:具有一定数目的质子和一定数目的中子的一种原子。
①质量数==质子数+中子数:a == z + n②同位素:质子数相同而中子数不同的'同一元素的不同原子,互称同位素。
(同一元素的各种同位素物理性质不同,化学性质相同)二、元素周期律1、影响原子半径大小的因素:①电子层数:电子层数越多,原子半径越大(最主要因素)②核电荷数:核电荷数增多,吸引力增大,使原子半径有减小的趋向(次要因素)③核外电子数:电子数增多,增加了相互排斥,使原子半径有增大的倾向2、元素的化合价与最外层电子数的关系:最高正价等于最外层电子数(氟氧元素无正价)负化合价数 = 8—最外层电子数(金属元素无负化合价)3、同主族、同周期元素的结构、性质递变规律同主族:从上到下,随电子层数的递增,原子半径增大,核对外层电子吸引能力减弱,失电子能力增强,还原性(金属性)逐渐增强,其离子的氧化性减弱。
(完整word版)元素周期律知识点总结(精华版),

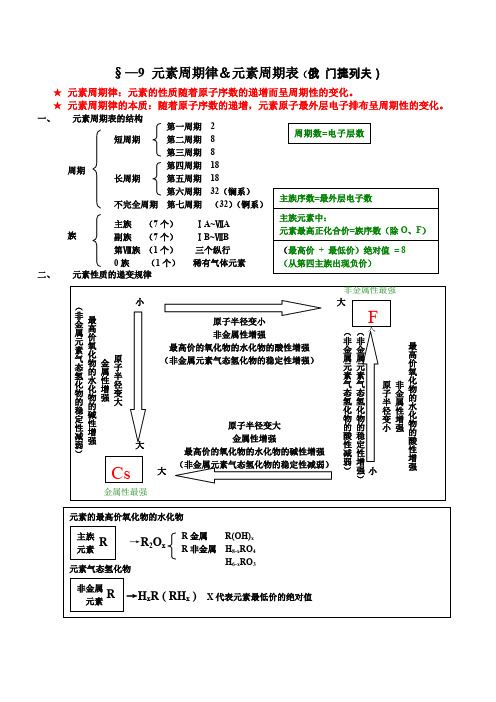
(圆满word 版)元素周期律知识点总结(精华版),1 / 1湖南省长郡中学远程管理学校资料§— 9 元素周期律&元素周期表(俄 门捷列夫)★ 元素周期律:元素的性质跟着原子序数的递加而呈周期性的变化。
★ 元素周期律的实质:跟着原子序数的递加,元素原子最外层电子排布呈周期性的变化。
一、元素周期表的构造第一周期 2周期数 =电子层数短周期第二周期 8第三周期 8周期第周围期 18长周期第五周期 18第六周期 32(镧系)主族序数 =最外层电子数不圆满周期 第七周期( 32)(锕系)主族( 7 个) Ⅰ A~ Ⅶ A 主族元素中:元素最高正化合价 =族序数(除 O 、 F )族副族( 7 个)Ⅰ B~Ⅶ B第Ⅷ族 ( 1 个)三个纵行 (最高价 + 最廉价)绝对值 = 80 族 ( 1 个)罕有气体元素(从第四主族出现负价)二、元生性质的递变规律非金属性最强(小大F非 最原子半径变小金高属非金属性加强( ( 大价元非 非氧 最高价的氧化物的水化物的酸性加强最素金 金 化高气 原 (非金属元素气态氢化物的坚固性加强)属 属物 金 价态 的 属 子元 元 氧氢 半素 素水 性化化 径气 气 原 非化 增物物 变态 态 子 金物 强的的 大氢 氢 半 属的水稳化 化 径 性碱化定物 物 变 增 性 原子半径变大物 性的 的 小 强增的减 金属性加强酸 稳 强酸弱大性 定最高价的氧化物的水化物的碱性加强性)减 性(非金属元素气态氢化物的坚固性减弱)弱 增增Cs强) 强大小)金属性最强元素的最高价氧化物的水化物主族R 金属 R(OH) x元素R→R 2O xR 非金属H 8-x RO 4 元素气态氢化物H 6-x RO3非金属→ H x R ( RH x ) X 代表元素最廉价的绝对值R元素怀化市长郡湖天中学、怀化市第一中学、怀化市第五中学。
元素周期律知识点总结精华版
★元素周期律:元素的性质随着原子序数的递增而呈周期性的变化。
★元素周期Leabharlann 的本质:随着原子序数的递增,元素原子最外层电子排布呈周期性的变化。
一、 元素周期表的结构
周期
族
二、元素性质的递变规律
2四主族出现负价族二元素性质的递变规律非金属性最强小大大大大小f金属性最强cs元素的最高价氧化物的水化物元素气态氢化物hxrrhxx代表元素最低价的绝对值5r非金属元素r主族元素r2oxr金属rohxr非金属h8xro4h6xro3原子半径变大金属性增强最高价氧化物的水化物的碱性增强非金属元素气态氢化物的稳定性减弱原子半径变大金属性增强最高价的氧化物的水化物的碱性增强非金属元素气态氢化物的稳定性减弱原子半径变小非金属性增强最高价的氧化物的水化物的酸性增强非金属元素气态氢化物的稳定性增强最高价氧化物的水化物的酸性增强非金属性增强原子半径变小非金属元素气态氢化物的稳定性增强非金属元素气态氢化物的酸性减弱怀化市长郡湖天中学怀化市第一中学怀化市第五中学
(完整版)元素周期律和元素周期表知识总结(可编辑修改word版)

元素周期律和元素周期表一、元素周期律及其应用1、元素周期律实质:元素性质随着原子序数的递增呈现周期性变化,其本质原因是元素的原子核外电子排布呈周期律变化。
2、元素周期表中主族元素性质的递变规律(1)最外层电子数:同一周期,从左至有依次增加;同一主族,不变。
(2)电子层数:同一周期,不变;同一主族,从左至有依次增加。
(3)原子半径:同一周期,从左至右,原子半径减小;同一主族,从上至小至有依次增大。
(4)失电子能力:同一周期,从左至右,逐渐增大;同一主族,从上至小至有依次减弱。
(5)得电子能力:同一周期,从左至右,逐渐减弱;同一主族,从上至小至有依次递增。
(6)主要化合价:同一周期,最该正价=族序数(O、F 外);同一主族,最该正价=族序数(O、F 外)(7)最高价氧化物对应水的酸碱性:同一周期,从左至右,酸性逐渐增强,碱性逐渐减弱;同一主族,从上至下,酸性逐渐减弱,碱性逐渐增强。
(8)气态氢化物:同一周期,从左至右,形成难度逐渐减弱,气态氢化物稳定逐渐增强;同一主族,从上至下,形成难度最近增大,气态氢化物稳定性逐渐减弱。
二、元素周期表的及其用1、周期:具有相同的电子层数的元素按原子序数递增的顺序排列而成的一个横行,叫做一个周期,族:在周期表中,将最外层电子数相同的元素按原子序数递增的顺序排成的纵行叫做一个族。
2、元素周期表结构(1)元素周期表中共有7 个周期,其分类如下:短周期(3 个):包括第一、二、三周期,分别含有2、8、8 种元素周期(7 个)长周期(3 个):包括第四、五、六周期,分别含有18、18、32 种元素不完全周期:第七周期,共26 种元素(1999 年又发现了114、116、118 号三种元素)(2)第六周期中的57 号元素镧(La)到71 号元素镥(Lu)共15 种元素,因其原子的电子层结构和性质十分相似,总称镧系元素。
第七周期中的89 号元素锕(Ac)到103 号元素铹(Lr) 共15 种元素,因其原子的电子层结构和性质十分相似,总称锕系元素。
元素周期表知识点总结

元素周期表知识点总结导语:化学元素周期表是根据原子序数从小至大排序的化学元素列表。
下面是小编收集整理的元素周期表知识点总结,希望对你有帮助!1、原子结构(1).所有元素的原子核都由质子和中子构成。
正例:612C、613C、614C三原子质子数相同都是6,中子数不同,分别为6、7、8。
反例1:只有氕(11H)原子中没有中子,中子数为0。
(2).所有原子的中子数都大于质子数。
正例1:613C、614C、13H等大多数原子的中子数大于质子数。
正例2:绝大多数元素的相对原子质量(近似等于质子数与中子数之和)都大于质子数的2倍。
反例1:氕(11H)没有中子,中子数小于质子数。
反例2:氘(11H)、氦(24He)、硼(510B)、碳(612C)、氮(714N)、氧(816O)、氖(1020Ne)、镁(1224Mg)、硅(1428Si)、硫(1632S)、钙(2040Ca)中子数等于质子数,中子数不大于质子数。
(3).具有相同质子数的微粒一定属于同一种元素。
正例:同一元素的不同微粒质子数相同:H+、H-、H等。
反例1:不同的中性分子可以质子数相同,如:Ne、HF、H2O、NH3、CH4。
反例2:不同的阳离子可以质子数相同,如:Na+、H3O+、NH4+。
反例3:不同的阴离子可以质子数相同,如:NH4+、OH-和F-、Cl和HS。
2、电子云(4).氢原子电子云图中,一个小黑点就表示有一个电子。
含义纠错:小黑点只表示电子在核外该处空间出现的机会。
3、元素周期律(5).元素周期律是指元素的性质随着相对原子质量的递增而呈周期性变化的规律。
概念纠错:元素周期律是指元素的性质随着原子序数的递增而呈周期性变化的规律。
(6).难失电子的元素一定得电子能力强。
反例1:稀有气体元素很少与其它元素反应,即便和氟气反应也生成共价化合物,不会失电子,得电子能力也不强。
反例2:IVA的非金属元素,既不容易失电子,也不容易得电子,主要形成共价化合物,也不会得失电子。
元素周期律知识点总结精华版

★元素周期律的本质:随着原子序数的递增,元素原子最外层电子排布呈周期性的变化。
一、 元素周期表的结构
周期
族
二、元素性质的递变规律
元素最高正化合价族序数除of最高价cs原子半径变小非金属性增强最高价的氧化物的水化物的酸性增强非金属元素气态氢化物的稳定性增强原子半径变大金属性增强最高价的氧化物的水化物的碱性增强非金属元素气态氢化物的稳定性减弱金属性最强非金属性最强元素的最高价氧化物的水化物元素气态氢化物主族元素金属roh8xro6xro非金属元素
-元素周期律_知识点总结
元素周期表与周期律知识总结知识结构图:一·周期表结构二·“位,构,性”的相互推导元素周期律三·原子结构四·碱金属五·卤素一.周期表结构1.元素周期表注意:A元素周期表的上界②金属与非金属的边界线B元素周期表中几个量的关系:(1)原子序数=核电荷数=质子数=核外电子数(2)周期序数=核外电子层数(3)主族序数=最外层电子数=元素的最高正价数(F无正价,O一般也无正价)(4)非金属元素:|最高正价数|+|负价数|=8C主族元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同(3)主族元素的最高正价和+最低负价的绝对值=82. 推断元素位置的规律判断元素在周期表中位置应牢记的规律:(1)元素周期数等于核外电子层数;(2)主族元素的序数等于最外层电子数;(3)确定族数应先确定是主族还是副族,其方法是采用原子序数逐步减去各周期的元素种数,即可由最后的差数来确定。
最后的差数就是族序数,差为8、9、10时为VIII族,差数大于10时,则再减去10,最后结果为族序数。
3推算元素的原子序数的简便方法同一主族相邻两元素原子序数差值(上周期的元素种类数)同一周期相邻两主族元素的原子序数差值4.每个周期元素的总数和每个周期过渡元素的总数二.“位、构、性”的相互推导失电子能力↓⇒金属性↑1.结构与性质 原子半径↑⇒F↓得电子能力↓⇒非金属性↓(1)原子核对最外层电子的引力核电核数↓ ⇒F↓半径↓ 半径↑ (主)同周期 F↓ 同主族 F↓ 质子数↑ 质子数↓(次)2.位置与结构(1) 周期数=电子数主族序数=3位置与性质①、核外电子排布②、原子半径性质递变 ③、主要化合价④、金属性与非金属性⑤、气态氢化物的稳定性⑥、最高价氧化物的水化物酸碱性电子层数 相同条件下,电子层越多,半径越大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
元素周期表与元素周期律知识点归纳 1、元素周期表共有 横行, 个周期。其中短周期为 、 、 。所含元素种类为 、 、 。长周期涉及 、 、 。所含元素种类为 、 、 。 第七周期为不完全周期,假如排满的话有 种元素。 2元素周期表有 个纵行 个族。涉及 个主族, 个副族,一个 族,一个第Ⅷ族(涉及 个纵行)按从左到右的顺序把16个族排列 。过度元素共涉及 个纵行(第 纵行到第 纵行)。涉及哪些族 。过渡元素全为 元素。又称为 。 3、写出七个主族和0族元素的名称和元素符号 ⅠA族 ⅡA族 ⅢA族 ⅣA族 ⅤA族 ⅥA族 ⅦA族 0族 4.同一周期第ⅡA族和第ⅢA族原子序数之间的关系 若元素位于第二、三周期,第ⅡA族的原子序数为a,则第ⅢA族的原子序数为 若元素位于第四、五周期,第ⅡA族的原子序数为a,则第ⅢA族的原子序数为 若元素位于第六周期,第ⅡA族的原子序数为a,则第ⅢA族的原子序数为 5、同一主族上下相邻两个周期原子序数之间的关系 若A在B的上一周期,设A的原子序数为a ⑴若A、B位于第ⅠA族或ⅡA族(过度元素的左边)则B的原子序数为 。 ⑵若A、B位于第ⅢA族——ⅦA族(过度元素的右边)则B的原子序数为 。 。 6、微粒半径大小判断的方法
。
。
。 7 与He原子电子层结构相同的简朴离子 。 与Ne原子电子层结构相同的简朴离子 。 与Ar原子电子层结构相同的简朴离子 。 阳离子与 周期稀有气体原子的电子层结构相同。阴离子与 周期稀有气体原子的电子层结构相同。 8、阴上阳下规律
9原子得电子能力强弱判断的方法 ⑴、原子得电子能力越强——单质的氧化性 ——元素的非金属性 ——阴离子的还原性 ——单质与氢气化和的能力 ——生成的气态氢化物越 ——最高价氧化物相应水化物的酸性 。 ⑵、此外可以通过单质间的置换反映判断得电子能力的强弱 如Cl2+Na2S=2NaCl+S得电子能力Cl S 10、原子失电子能力强弱判断的方法 ⑴、原子失电子能力越强——单质的还原性 ——元素的金属性 ——阳离子的氧化性 ——单质与水或酸反映置换出氢的能力 ——最高价氧化物相应水化物的碱性 。 ⑵、此外可以通过单质间的置换反映判断失电子能力的强弱 如Fe+CuSO4=FeSO4+Cu失电子能力Fe Cu 11、同一主族元素及其化合物性质的递变性: 同主族元素的原子,最外层电子数 ,决定同主族元素具有 的化学性质。从上到下原子的核电荷数依次 ,原子的电子层数依次 ,原了半径逐渐 ;原子失电子能力逐渐 ,元素的金属性逐渐 ,单质的还原性逐渐 ,相应阳粒子的氧化性逐渐 ,单质与水或酸反映置换出氢气的能力逐渐 ,最高价氧化物相应水化物的碱性逐渐 ;原子得电子能力逐渐 ,元素的非金属性逐渐 ,单质的氧化性逐渐 ,相应阴离子的还原逐渐 ,单质与氢气化合的能力逐渐 ,最高价氧化物相应水化物的酸性逐渐 。气态氢化物的稳定性逐渐 。 12、同一周期元素及其化合物性质的递变性: 在同一周期中,各元素原子的核外电子层数 ,但从左到右核电荷数依次 ,最外层电子数依次 ,原子半径逐渐 (稀有气体元素除外)。原子失电子能力逐渐 ,元素的金属性逐渐 ,单质的还原性逐渐 ,相应阳粒子的氧化性逐渐 ,单质与水或酸反映置换出氢气的能力逐渐 ,最高价氧化物相应水化物的碱性逐渐 。 原子得电子能力逐渐 ,元素的非金属性逐渐 ,单质的氧化性逐渐 ,相应阴离子的还原逐渐 ,单质与氢气化合的能力逐渐 ,最高价氧化物相应水化物的酸性逐渐 ,气态氢化物的稳定性逐渐 。
根据原子结构、元素周期表的知识及相关条件可推算原子序数,判断元素在周期表中的位置等。
1.位、构、性的关系 2.周期表中数字与性质的关系 (1)由原子序数拟定元素位置的规律:只要记住稀有气体元素的原子序数就可以拟定主族元素的位置。 He:2、Ne:10、Ar:18、Kr:36、Xe:54、Rn:86
①若比相应的稀有气体元素的原子序数多1或2,则应处在下一周期的ⅠA或ⅡA,如88号元素,88-86=2,则应在第7周期第ⅡA。 ②若比相应的稀有气体元素的原子序数少1~5时,则应在第ⅦA~ⅢA,如84号元素在第6周期第ⅣA。 ③若预测新元素,可与未发现的稀有气体元素118号相比按上面的方法推算。如116号元素应在第7周期ⅥA。 (2)同族的上下周期元素原子序数之间的关系 ①第ⅠA、ⅡA的元素上下周期元素原子序数的差值等于上一种元素所在周期所可以排列的元素种类数。因此第ⅠA、ⅡA族的元素的原子序数等于上一种元素的原子序数+上一周期所能排列的元素种类数。如:Cs的原子序数=37(上一种元素Rb的原子序数)+18(Rb所在的周期可以排列的元素种类数)=55。 ②第ⅢA~0族的元素上下周期元素原子序数的差值等于下一种元素所在周期所可以排列的元素种类数。因此第ⅢA~0族的元素的原子序数等于上一种元素的原子序数+下一周期所能排列的元素种类数。如:Se的原子序数=16(上一种元素S的原子序数)+18(Se所在的周期可以排列的元素种类数)=34。 (3)同周期的左右主族元素原子序数之间的关系 ①前三周期的所有元素中相邻元素的原子序数差值为1。 ②第4周期以后只有ⅡA和ⅢA族元素之间的差值不为1,第4、5周期的差值为11,第6、7周期为25。 (4)周期表中原子序数为奇数的元素所在的族也为奇数,最高化合价和最低负价也是奇数;原子序数为偶数时所在的族为偶数或0族,最高价和最低价为偶数或0。 3.周期表的应用 (1)由元素周期表中元素的相似性和递变性,结合一些区域特点,从中可以找出一些“元素之最” ①单质 非金属性最强的单质为F2,金属性最强的是Cs(Fr为放射性元素不考虑);密度最小的金属元素为Li,密度最小的气体为H2,熔点最高的单质为石墨,熔、沸点最低的单质为He。原子半径最小的元素为H,最大的为Cs(不考虑放射性元素)。 ②化合物 最稳定的气态氢化物为HF;酸性最强的含氧酸为HClO4;最强的碱为CsOH(不考虑放射性元素),含氢质量分数最大的气态氢化物为CH4。 (2)比较或推断一些物质的性质 ①比较同族元素的金属性、非金属性、最高价氧化物的水化物的酸碱性、氢化物的稳定性。如KOH的碱性大于NaOH,H2O的稳定性大于H2S。 ②比较同周期元素及其化合物的性质。如:HCl的稳定性大于H2S;NaOH的碱性大于Mg(OH)2。 ③比较不同周期、不同族元素性质时,要找到“参照物”。如:比较Mg(OH)2与KOH的碱性可以参照NaOH,判断出KOH的碱性大于Mg(OH)2。 6.推断题的解题方法 (1)预测元素的性质 常见题目是给出一种不常见的主族元素或尚未发现的主族元素,推测该元素及其单质或化合物所具有的性质。 (2)根据原子结构、元素周期表的知识及相关已知条件可推算原子序数、判断元素在周
4.简朴微粒半径的比较方法 期表中的位置,基本思绪为: (3)推断中常见的“突破口” Ⅰ.周期表中特殊位置的关系 ①族序数等于周期数的元素:H、Be、Al、Ge; ②族序数等于周期数2倍的元素:C、Si; ③族序数等于周期数3倍的元素:O ④周期数是族序数的2倍的元素是:Li、Ca; ⑤周期数是族序数的3倍的元素是:Na、Ba; ⑥最高正价与最低负价之和为0的短周期元素是:C、Si; ⑦最高正价是最低负价绝对值3倍的元素是:S; ⑧原子半径最小的元素为H,另一方面为F; ⑨短周期中离子半径最大的是P3-。 Ⅱ.常见元素及其化合物的特性 ①形成化合物种类最多的元素、单质是自然界硬度最大的物质、气态氢化物中氢的质量分数最高的元素:C;
6.推断题的解题方法 (1)预测元素的性质 常见题目是给出一种不常见的主族元素或尚未发现的主族元素,推测该元素及其单质或化合物所具有的性质。 (2)根据原子结构、元素周期表的知识及相关已知条件可推算原子序数、判断 ②空气中含量最多的元素、气态氢化物呈碱性的元素、化合价最多的元素:N; ③地壳中含量最多的元素、氢化物沸点最高的元素、氢化物在常温下呈液态的元素:O; ④单质在常温下呈液态的元素:非金属元素Br、金属元素Hg; ⑤最高价氧化物既能与强酸反映,又能与强碱反映的元素、最高价氧化物相应水化物既是酸又是碱的元素、地壳中含量最多的金属元素:Al; ⑥元素的气态氢化物和最高价氧化物相应水化物可以发生化合反映的元素是N,可以发生氧化还原反映的元素是S; ⑦单质在常温下能与水反映生成气体的元素是;Na、Li、F。
考点三化学键 演 题 悟 道 例6】下列说法中,对的的一组是( ) ①两种元素构成的共价化合物分子中的化学键都是极性键 ②两种非金属元素原子间形成的化学键都是极性键 ③具有极性键的化合物分子一定不含非极性键 ④只要是离子化合物,其熔点就比共价化合物的熔点高 ⑤离子化合物中也许具有共价键 ⑥共价化合物中一定不具有离子键 ⑦任何物质内一定有共价键 ⑧单质中一定有共价键 A.只有②④⑤⑥⑦ B.只有①②③⑤⑥ C.只有②⑤⑥ D.只有②③⑤⑥⑧ 【解析】①错,如H2O2中有非极性键;同理③错;④错,SiO2等共价化合物的熔点很高;⑦错,⑧错,Ar等物质不存在化学键。 【演练6】下列叙述中,对的的是( ) A.离子化合物一定含共价键
