短周期元素特点(严选优质)
1-18 短周期元素性质归纳

1-18 短周期元素性质归纳短周期元素性质详细归纳湖南省郴州市湘南中学:田万福 1号元素 H1、最外层电子数=电子层数主族序数=周期序数(Be,Al)2、原子半径最小,最轻的气体单质3、单质常做还原剂N+3H? 2NH(工业合成氨,放热反应) 322H+F=2HF(黑暗处就能反应) 22H+Cl=2HCl(光照爆炸,点燃苍白色火焰) 22CuO+H=Cu+HO(吸热反应) 224、制备实验室:Zn+HSO= ZnSO+H 24 42工业制法:C(s)+HO(g)= CO + H 225、同位素:质子数相同而中子数不同的核素 H D T (氕氘氚) 2号元素 He单质无化学键(稀有气体都无化学键,单原子分子)3号元素 Li1、最外层电子数是内层电子数的一半(P) 最外层电子数是最内层电子数的一半(Na)2、密度最小的金属,保存在石蜡油中,防止氧化3、与水反应生成碱和氢气,与O不能生成过氧化物 24号元素 Be1、最外层电子数,次外层电子数;最外层电子数,电子层数;2、氧化物为BeO;价态+,价;两性元素,其氧化物和氢氧化物为两性 5号元素 B最外层电子数比次外层多一个;氢化物BH;硼酸(HBO)可用于洗涤不小心溅在皮肤上的碱液 26336号元素 C1、最外层电子数是内层电子数的2倍最外层电子数是最内层电子数的2倍(Si)2、形成化合物种类最多(有机物)3、同素异形体:石墨,金刚石,C (氧气与臭氧,红磷与白磷,正交硫和单斜硫) 604、氧化物 AB AB型 2CO:有毒,可燃(淡蓝色火焰,S、H、CH、CHOH),还原性气体 2425CO:电子式温室效应,固态称为干冰,用于人工降雨(还有AgI) 2检验方法:使澄清石灰水变浑浊(注意与SO区别鉴定) 25、氢化物: 10电子体,正四面体结构6、连续氧化:C C(CH)——CO——CO——HCO 42237、NaCO与NaHCO鉴别 233当两者为固体时,加热的方法方程式当两者为溶液时,用CaCl溶液(为什么不能用Ca(OH)溶液) 227号元素 N1、空气中含量最多的元素,N是活泼的非金属,但N性质稳定,做保护气22、氧化物 AB AB型为主(还有NO,NO,NO,NO,NO)污染空气,形成光化学烟雾,酸雨 2223225NO:无色有毒气体,中毒原理与CO一样,遇氧气马上变为红棕色NO:红棕色气体(红棕色固体FeO,红棕色液体Br) 22322 NO(g)? NO (g) 放热反应 2 243、氢化物 10电子体,三角锥形,分子中有氢键,氮族中氢化物沸点最高,水溶液惟一呈碱性检验方法:使湿润的红色石蕊试纸变蓝色;遇HCl(g)产生大量白烟 4、连续氧化制HNO N(NH)NO——NO——HNO 3 23——2393,HNO因溶入NO而呈黄至棕黄色,开盖则逸出棕色浓雾,叫发烟硝酸。
高一短周期元素推断知识点

高一短周期元素推断知识点短周期元素,又称为主族元素,是指位于周期表第2A、3A、4A、5A和6A族的元素。
这些元素在化学特性上有一定的相似性,但又存在一些差异。
理解短周期元素的性质和推断其化学行为是化学学习的基础之一。
本文将从电子结构、原子半径、电负性、离子半径和电离能等几个方面,分析和探讨短周期元素的重要知识点。
一、电子结构短周期元素的电子结构决定了其化学行为。
以第2周期的氢(H)、氦(He)、锂(Li)、铍(Be)、硼(B)、碳(C)和氮(N)为例,分析它们的电子结构可得:- 氢元素(1s1)只有一个s轨道上的单电子;- 氦元素(1s2)具有一个s轨道上的双电子;- 锂元素(1s2 2s1)有一个s轨道上的双电子和一个s轨道上的单电子;- 铍元素(1s2 2s2)有两个s轨道上的双电子;- 硼元素(1s2 2s2 2p1)有两个s轨道上的双电子和一个p轨道上的单电子;- 碳元素(1s2 2s2 2p2)有两个s轨道上的双电子和两个p轨道上的单电子;- 氮元素(1s2 2s2 2p3)有两个s轨道上的双电子和三个p轨道上的单电子。
从上述分析可知,周期表中短周期元素的电子结构显著特点是外层电子只存在于s轨道和p轨道上。
这种电子结构决定了短周期元素的离子化倾向和化合价。
二、原子半径原子半径是同一周期不同元素原子的半径大小。
在短周期元素中,原子半径由上至下逐渐增大,即同一族元素的原子半径随着周期数的增加而增大。
这是因为随着主量子数的增加,电子云几率分布越来越远离原子核,电子层之间相互屏蔽作用增强,使得原子半径增大。
三、电负性电负性是反映原子吸引和获取电子的能力的指标。
在短周期元素中,电负性依次递增,即同一周期内的元素,从左至右电负性逐渐增大。
这是由于内层电子的屏蔽效应相对稳定,但原子核的电荷数增加,吸引外层电子的能力增强。
四、离子半径离子半径是离子的半径大小,离子半径与原子半径有一定的关系。
在短周期元素中,正离子半径小于原子半径,负离子半径大于原子半径。
高考短周期元素知识点

高考短周期元素知识点化学作为一门重要的自然科学,涉及众多的理论和知识点。
其中,元素是化学研究的基础,而短周期元素则是高中化学的重要内容之一。
掌握短周期元素的知识对于高考化学考试至关重要。
在本文中,我们将深入探讨高考短周期元素的知识点。
短周期元素是指位于化学周期表第三周期和第四周期的元素。
它们有着独特的性质和特点,需要我们详细了解和记忆。
首先,我们来介绍一下短周期元素的共同特点。
1. 原子半径逐渐减小:在短周期元素中,原子半径从左向右逐渐减小。
这是因为原子核中质子数的增加,使得电子云向核心收缩,从而导致原子半径减小。
2. 电负性逐渐增加:随着原子核电荷数的增加,元素的电负性也会相应增加。
因此,短周期元素的电负性是逐渐增强的。
3. 第一电离能逐渐增大:短周期元素的第一电离能通常随着周期增加而增大。
这是因为原子半径减小,核电荷增加,电子与核之间的引力增强,需要克服更大的能量才能将电子从原子中移除。
通过了解短周期元素的共同特点,我们可以更好地理解它们的性质和变化规律。
接下来,我们将依次讨论短周期元素的各个特点。
1. 化合价和氧化态:短周期元素的化合价和氧化态通常具有一定的规律。
以第三周期元素为例,从左至右的元素的普通氧化态分别为+1、+2、+3和+4。
这是因为较小的原子半径和较大的电负性使得这些元素更容易失去电子,形成带正电荷的离子。
2. 价电子层的填充规律:在短周期元素中,电子的填充规律也有着一定的规律。
以第三周期元素为例,它们的4s和3d层是相关的。
当4s层填满后,电子开始填充3d层。
这个规律在正负电离电位和键能等方面有重要影响。
3. 化学反应活性:短周期元素的化学反应活性也有规律可循。
比如,从左到右,第三周期元素的金属性逐渐减弱,非金属性逐渐增强。
这是因为原子半径减小和电负性增大,使得金属元素失去电子容易,而非金属元素更感觉到了这种需要。
以上是短周期元素的一些重要特点和规律。
了解这些知识点,有助于我们更好地理解和掌握高考化学中与短周期元素相关的题目。
元素周期表的基本结构与特点

元素周期表的基本结构与特点元素周期表是化学中一项重要的工具,用于组织和分类元素。
它以一种整洁、有序的方式呈现了所有已知元素的基本信息。
本文将介绍元素周期表的基本结构和特点。
1. 元素周期表的基本结构元素周期表按照一定规律将所有元素分类,并将其排列在一个方格状的表格中。
表格中的每个方格代表一个元素,按照从左到右和从上到下的顺序排列。
每个方格包含了元素的符号、原子序数、相对原子质量和元素名称等信息。
2. 周期与族元素周期表按照元素的物理和化学性质将元素分为周期和族。
周期是指元素在周期表中的水平行,共有7个周期。
第一周期只包含两个元素(氢和氦),而第七周期则是目前尚未被发现的超重元素。
族是指元素在周期表中的垂直列,共有18个族。
族数越小,元素的性质越相似。
3. 元素周期表的特点(1)周期性:元素周期表的主要特点是周期性,即元素的性质和周期号有关。
同一周期的元素具有相似的外层电子结构,因此它们的化学性质也相似。
例如,第一周期的元素都是气体,具有较低的沸点和熔点。
(2)原子序数增加规律:从左到右和从上到下,元素的原子序数逐渐增加。
原子序数是指元素原子核中的质子数量,也是元素的唯一标识。
原子序数的增加反映了元素化学性质的变化。
(3)周期表的分区:周期表根据元素的一些共同特征进行了分区。
主要分为主族元素、过渡金属、稀土金属和贵金属等。
这种分区方式有助于我们了解元素的特性和应用。
(4)元素周期表的扩展:随着科学技术的发展和新元素的发现,元素周期表不断扩展。
最初的周期表只包含了少数元素,而今天的周期表已经扩展到118个已知元素。
4. 元素周期表的应用元素周期表不仅仅是化学教学的基础工具,还具有广泛的应用价值。
它可以帮助科学家研究元素的性质和相互作用。
此外,周期表还在材料科学、药物研发、环境保护等领域发挥着重要作用。
通过对周期表的研究和应用,人们可以更好地理解元素和它们之间的关系,推动科学的发展。
总结:元素周期表作为化学领域的重要工具,具有整洁美观的排列结构和明确的信息呈现方式。
化学之元素周期表的性质
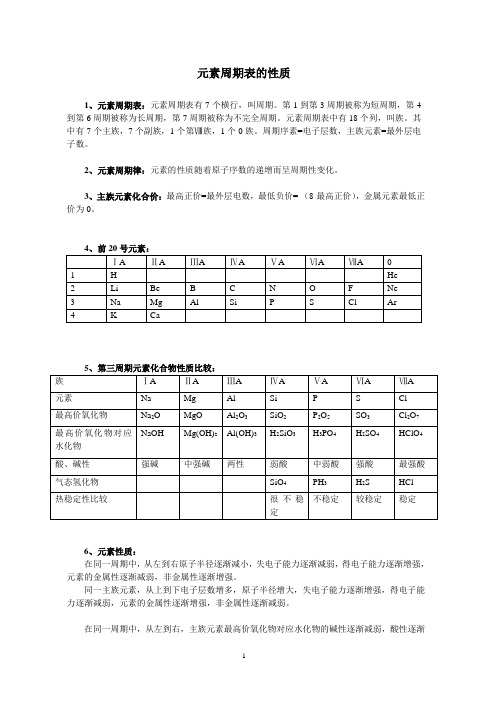
元素周期表的性质1、元素周期表:元素周期表有7个横行,叫周期。
第1到第3周期被称为短周期,第4到第6周期被称为长周期,第7周期被称为不完全周期。
元素周期表中有18个列,叫族。
其中有7个主族,7个副族,1个第Ⅷ族,1个0族。
周期序素=电子层数,主族元素=最外层电子数。
2、元素周期律:元素的性质随着原子序数的递增而呈周期性变化。
3、主族元素化合价:最高正价=最外层电数,最低负价=-(8-最高正价),金属元素最低正价为0。
4、前20号元素:ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 01 H He2 Li Be B C N O F Ne3 Na Mg Al Si P S Cl Ar4 K Ca5、第三周期元素化合物性质比较:族ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA元素Na Mg Al Si P S Cl最高价氧化物Na2O MgO Al2O3SiO2P2O5SO3Cl2O7NaOH Mg(OH)2Al(OH)3H2SiO3H3PO4H2SO4HClO4最高价氧化物对应水化物酸、碱性强碱中强碱两性弱酸中弱酸强酸最强酸气态氢化物SiO4PH3H2S HCl不稳定较稳定稳定热稳定性比较很不稳定6、元素性质:在同一周期中,从左到右原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强,元素的金属性逐渐减弱,非金属性逐渐增强。
同一主族元素,从上到下电子层数增多,原子半径增大,失电子能力逐渐增强,得电子能力逐渐减弱,元素的金属性逐渐增强,非金属性逐渐减弱。
在同一周期中,从左到右,主族元素最高价氧化物对应水化物的碱性逐渐减弱,酸性逐渐增强;它们气态氢化物的热稳定性逐渐增强。
在同一主族中,从上到下,元素最高价氧化物对应水化物的酸性逐渐减弱,碱性逐渐增强;它们的气态氢化物的热稳定性逐渐减弱。
原子半径金属性非金属性最高价氧化物对应水化物气态氢化物的稳定性酸性碱性同一横行减小减小增大减小增大增大同一列增大增大减小增大减小减小2011.11.12。
短周期元素特点(严选优质)

1—18号元素的结构性质特点(1)H ①原子半径最小;②最外层电子数=周期序数;③电子总数=电子层数;④第ⅠA族中唯一形成共价化合物的元素;⑤在化合物中该原子的数目虽有改变,但该元素原子质量分数改变不大;⑥原子序数最小;⑦原子核内没有中子;⑧成酸、碱必需的元素;⑨单质密度最小,最轻的气体;⑩与氧可生成两种液体:H2O、H2O2;单质是电解水产物之一;单质可由金属与酸反应得到。
(2)He:①最外层属饱和结构,但唯一个不是8电子;②电子总数是电子层数的二倍。
(3)Li:①最外层电子数是次外层的一半;②碱金属中不能形成过氧化物;③热核反应原料之一;④密度最小的轻金属;⑤保存于石蜡中。
(4)Be:①最外层电子数=次外层电子数;②最外层电子数=电子层数③价态为+2价(5)B ①最外层电子数比次外层多一个;②BF3属非极性分子(本章后边将学到);③氢化物为B2H6(了解就可以);④硼酸(H3BO3)可洗涤皮肤上的碱液;⑤硼砂(Na2B4O7、10H2O)是硼酸盐玻璃材料。
(6)C;①最外层电子数是次外层的二倍;②是形成化合物种类最多的元素;③有石墨、金刚石、足球碳(C60)等几种同素异形体,(第六章后边将学到);④氧化物有CO、CO2;⑤氢化物有多种最简单的是CH4;⑥最高价含氧酸是H2CO3。
(7)N:①最外层电子比次外层多3个;②单质在空气中含量最多;③除稀有气体外难与其它物质反应;④化肥三元素之一(N、P、K);⑤氢化物为NH3;⑥氧化物形式最多(6种:N2O、NO、N2O3、NO2、N2O5);⑦含氧酸有HNO3、HNO2;⑧气态氢化物水溶液唯一呈碱性。
(8)O: ①最外层电子数目是次外层的三倍;②地壳中含量最多;③占空气体积的21%;④能形成H2O2、H2O、Na2O2、Na2O等价态氯化物;⑤单质助燃(9)F;①最外层电子数比次外层多5个;②除H后前18号元素中原子半径最小;③无正价;④不能被任何物质氧化;⑤能与水反应置换水中的氧;⑥CaF2难溶、AgF溶于水;⑦无含氧酸;⑧HF为弱酸。
1-18 短周期元素性质归纳

1-18 短周期元素性质归纳短周期元素性质详细归纳湖南省郴州市湘南中学:田万福 1号元素 H1、最外层电子数=电子层数主族序数=周期序数(Be,Al)2、原子半径最小,最轻的气体单质3、单质常做还原剂N+3H? 2NH(工业合成氨,放热反应) 322H+F=2HF(黑暗处就能反应) 22H+Cl=2HCl(光照爆炸,点燃苍白色火焰) 22CuO+H=Cu+HO(吸热反应) 224、制备实验室:Zn+HSO= ZnSO+H 24 42工业制法:C(s)+HO(g)= CO + H 225、同位素:质子数相同而中子数不同的核素 H D T (氕氘氚) 2号元素 He单质无化学键(稀有气体都无化学键,单原子分子)3号元素 Li1、最外层电子数是内层电子数的一半(P) 最外层电子数是最内层电子数的一半(Na)2、密度最小的金属,保存在石蜡油中,防止氧化3、与水反应生成碱和氢气,与O不能生成过氧化物 24号元素 Be1、最外层电子数,次外层电子数;最外层电子数,电子层数;2、氧化物为BeO;价态+,价;两性元素,其氧化物和氢氧化物为两性 5号元素 B最外层电子数比次外层多一个;氢化物BH;硼酸(HBO)可用于洗涤不小心溅在皮肤上的碱液 26336号元素 C1、最外层电子数是内层电子数的2倍最外层电子数是最内层电子数的2倍(Si)2、形成化合物种类最多(有机物)3、同素异形体:石墨,金刚石,C (氧气与臭氧,红磷与白磷,正交硫和单斜硫) 604、氧化物 AB AB型 2CO:有毒,可燃(淡蓝色火焰,S、H、CH、CHOH),还原性气体 2425CO:电子式温室效应,固态称为干冰,用于人工降雨(还有AgI) 2检验方法:使澄清石灰水变浑浊(注意与SO区别鉴定) 25、氢化物: 10电子体,正四面体结构6、连续氧化:C C(CH)——CO——CO——HCO 42237、NaCO与NaHCO鉴别 233当两者为固体时,加热的方法方程式当两者为溶液时,用CaCl溶液(为什么不能用Ca(OH)溶液) 227号元素 N1、空气中含量最多的元素,N是活泼的非金属,但N性质稳定,做保护气22、氧化物 AB AB型为主(还有NO,NO,NO,NO,NO)污染空气,形成光化学烟雾,酸雨 2223225NO:无色有毒气体,中毒原理与CO一样,遇氧气马上变为红棕色NO:红棕色气体(红棕色固体FeO,红棕色液体Br) 22322 NO(g)? NO (g) 放热反应 2 243、氢化物 10电子体,三角锥形,分子中有氢键,氮族中氢化物沸点最高,水溶液惟一呈碱性检验方法:使湿润的红色石蕊试纸变蓝色;遇HCl(g)产生大量白烟 4、连续氧化制HNO N(NH)NO——NO——HNO 3 23——2393,HNO因溶入NO而呈黄至棕黄色,开盖则逸出棕色浓雾,叫发烟硝酸。
元素的周期表周期特点

元素的周期表周期特点周期表是化学的基本工具之一,用于组织和分类所有已知元素。
它以一种整齐的、有序的方式呈现了元素的周期性特征。
本文将探讨元素周期表的周期特点,探索元素性质的周期变化以及周期规律。
1. 周期表的结构周期表通常由横行称为“周期”和纵列称为“族”的元素组成。
周期表中有7个周期,从左到右,原子序数逐渐增加,元素的性质也随之变化。
同时,周期表的纵列是元素的族,具有相似的化学性质。
周期表的结构为我们提供了一种了解元素及其性质的框架。
2. 周期性规律2.1. 原子半径随着横向周期的增加,原子半径逐渐减小。
这是因为随着电子层数的增加,电子云的半径扩展,但正电荷的数量也增加,使得原子半径变小。
同一周期内,原子半径逐渐减小的趋势也存在,这是因为原子的核电荷逐渐增加,吸引力增强,电子靠近核心。
2.2. 电离能电离能是指从一个原子中移除一个电子所需的能量。
随着横向周期的增加,电离能逐渐增加。
这是因为半径变小,电子与核之间的相互作用增强,所以更多的能量需要从原子中移除电子。
同一周期内,电离能递增的趋势也存在,这是因为核电荷的增加,使电子更难从原子中移除。
2.3. 电负性电负性是一个元素吸引共享电子对的能力。
随着横向周期的增加,原子的电负性逐渐减小。
这是因为原子半径变小,核电荷增加,吸引力较强,减少了对电子对的吸引能力。
同一周期内,电负性逐渐增加的趋势也存在,因为核电荷的增加。
2.4. 原子半径与离子半径横向周期中,正离子半径小于原子半径,因为正离子失去了一个或多个电子,电子云收缩。
而负离子半径大于原子半径,因为负离子获得了一个或多个电子,电子云扩展。
同一周期内,离子的半径随着电荷的增加而减小。
所以,在元素周期表中,原子半径和离子半径呈现出明显的周期性变化。
3. 周期表的应用周期表提供了化学家们组织和理解元素性质的框架。
它不仅对元素的基本性质有很大的启发作用,还有助于预测元素的物理化学行为。
周期表的应用领域非常广泛,包括药物研发、材料科学、环境保护等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1—18号元素的结构性质特点
(1)H ①原子半径最小;②最外层电子数=周期序数;③电子总数=电子层数;④第ⅠA族中唯一形成共价化合物的元素;
⑤在化合物中该原子的数目虽有改变,但该元素原子质量分数改变不大;⑥原子序数最小;⑦原子核内没有中子;⑧成酸、碱必需的元素;⑨单质密度最小,最轻的气体;⑩与氧可生成两种液体:H2O、H2O2;单质是电解水产物之一;单质可由金属与酸反应得到。
(2)He:①最外层属饱和结构,但唯一个不是8电子;②电子总数是电子层数的二倍。
(3)Li:①最外层电子数是次外层的一半;②碱金属中不能形成过氧化物;③热核反应原料之一;④密度最小的轻金属;⑤保存于石蜡中。
(4)Be:①最外层电子数=次外层电子数;②最外层电子数=电子层数
③价态为+2价
(5)B ①最外层电子数比次外层多一个;②BF3属非极性分子(本章后边将学到);③氢化物为B2H6(了解就可以);④硼酸(H3BO3)可洗涤皮肤上的碱液;⑤硼砂(Na2B4O7、10H2O)是硼酸盐玻璃材料。
(6)C;①最外层电子数是次外层的二倍;②是形成化合物种类最多的元素;③有石墨、金刚石、足球碳(C60)等几种同素异形体,(第六章后边将学到);④氧化物有CO、CO2;⑤氢化物有多种最简单的是CH4;⑥最高价含氧酸是H2CO3。
(7)N:①最外层电子比次外层多3个;②单质在空气中含量最多;③除稀有气体外难与其它物质反应;④化肥三元素之一(N、P、K);⑤氢化物为NH3;⑥氧化物形式最多(6种:N2O、NO、N2O3、NO2、N2O5);⑦含氧酸有HNO3、HNO2;⑧气态氢化物水溶液唯一呈碱性。
(8)O: ①最外层电子数目是次外层的三倍;②地壳中含量最多;③占空气体积的21%;④能形成H2O2、H2O、Na2O2、Na2O等价态氯化物;⑤单质助燃
(9)F;①最外层电子数比次外层多5个;②除H后前18号元素中原子半径最小;③无正价;④不能被任何物质氧化;⑤能与水反应置换水中的氧;⑥CaF2难溶、AgF溶于水;⑦无含氧酸;⑧HF为弱酸。
(10)Ne:
(11)Na:①最外层电子数是次外层的,最内层的1/2;
②前18号元素原子半径最大;③氧化物对应的水化物为NaOH;
④能形成氧化物Na2O和过氧化物Na2O2;
⑤与K的合金形成原子反应堆的导热材料。
(12)Mg:①最外层电子数=最内层电子数,次外层电子数是最外层电子数的4倍;②Mg(OH)2是难溶性的中强碱;③Mg遇冷水难反应,遇热水放H2;④MgCl2为苦卤、MgSO4为泻盐。
(13)Al:①最外层比次外层少5个电子;②最外层电子数=电子层数;
③铝是金属元素但具有一定的非金属性;④Al2O3是两性氧化物;
⑤Al(OH)3是两性氢氧化物;⑥地壳中含量最多的金属元素
(14)Si:①最外层电子数是次外层的一半,最内层的2倍;②地壳中含量排第二位;③只有一种氧化物SiO2;④气态氢化物SiH4;⑤含氧酸为H4SiO4;⑥H2SiO3是唯一难溶酸。
(15)P:①最外层比次外层少2个电子;②氢化物为PH3;
③对应的酸为H3PO4、H3PO3;④常见白磷P4、红磷二种单质。
16)S:①最外层比次外层少2个电子;②1—18号元素中离子半径最大;③最外层与最内层电子数之和=次外层电子数;
④氢化物H2S、剧毒;⑤氧化物有SO2、SO3;
⑥对应的水化物H2SO3、H2SO4;
⑦对应的盐常见的有Na2S、NaHS、Na2SO3、NaHSO3、Na2SO4、NaHSO4。
(17)Cl:①最外层比次外层少一个电子,比最内层多5个电子;
②有多种化合价—1、+1、+3、+5、+7;
③对应的含氧酸有HClO、HClO2、HClO3、HClO4;④HClO4是目前发现的含氧酸中的最强酸。
(18)Ar(略)
重点是:H、C、N、O、F、Na、Mg、Al、Si P、S、Cl。
