短周期元素性质归纳
高一短周期元素推断知识点

高一短周期元素推断知识点短周期元素,又称为主族元素,是指位于周期表第2A、3A、4A、5A和6A族的元素。
这些元素在化学特性上有一定的相似性,但又存在一些差异。
理解短周期元素的性质和推断其化学行为是化学学习的基础之一。
本文将从电子结构、原子半径、电负性、离子半径和电离能等几个方面,分析和探讨短周期元素的重要知识点。
一、电子结构短周期元素的电子结构决定了其化学行为。
以第2周期的氢(H)、氦(He)、锂(Li)、铍(Be)、硼(B)、碳(C)和氮(N)为例,分析它们的电子结构可得:- 氢元素(1s1)只有一个s轨道上的单电子;- 氦元素(1s2)具有一个s轨道上的双电子;- 锂元素(1s2 2s1)有一个s轨道上的双电子和一个s轨道上的单电子;- 铍元素(1s2 2s2)有两个s轨道上的双电子;- 硼元素(1s2 2s2 2p1)有两个s轨道上的双电子和一个p轨道上的单电子;- 碳元素(1s2 2s2 2p2)有两个s轨道上的双电子和两个p轨道上的单电子;- 氮元素(1s2 2s2 2p3)有两个s轨道上的双电子和三个p轨道上的单电子。
从上述分析可知,周期表中短周期元素的电子结构显著特点是外层电子只存在于s轨道和p轨道上。
这种电子结构决定了短周期元素的离子化倾向和化合价。
二、原子半径原子半径是同一周期不同元素原子的半径大小。
在短周期元素中,原子半径由上至下逐渐增大,即同一族元素的原子半径随着周期数的增加而增大。
这是因为随着主量子数的增加,电子云几率分布越来越远离原子核,电子层之间相互屏蔽作用增强,使得原子半径增大。
三、电负性电负性是反映原子吸引和获取电子的能力的指标。
在短周期元素中,电负性依次递增,即同一周期内的元素,从左至右电负性逐渐增大。
这是由于内层电子的屏蔽效应相对稳定,但原子核的电荷数增加,吸引外层电子的能力增强。
四、离子半径离子半径是离子的半径大小,离子半径与原子半径有一定的关系。
在短周期元素中,正离子半径小于原子半径,负离子半径大于原子半径。
高考短周期元素知识点

高考短周期元素知识点化学作为一门重要的自然科学,涉及众多的理论和知识点。
其中,元素是化学研究的基础,而短周期元素则是高中化学的重要内容之一。
掌握短周期元素的知识对于高考化学考试至关重要。
在本文中,我们将深入探讨高考短周期元素的知识点。
短周期元素是指位于化学周期表第三周期和第四周期的元素。
它们有着独特的性质和特点,需要我们详细了解和记忆。
首先,我们来介绍一下短周期元素的共同特点。
1. 原子半径逐渐减小:在短周期元素中,原子半径从左向右逐渐减小。
这是因为原子核中质子数的增加,使得电子云向核心收缩,从而导致原子半径减小。
2. 电负性逐渐增加:随着原子核电荷数的增加,元素的电负性也会相应增加。
因此,短周期元素的电负性是逐渐增强的。
3. 第一电离能逐渐增大:短周期元素的第一电离能通常随着周期增加而增大。
这是因为原子半径减小,核电荷增加,电子与核之间的引力增强,需要克服更大的能量才能将电子从原子中移除。
通过了解短周期元素的共同特点,我们可以更好地理解它们的性质和变化规律。
接下来,我们将依次讨论短周期元素的各个特点。
1. 化合价和氧化态:短周期元素的化合价和氧化态通常具有一定的规律。
以第三周期元素为例,从左至右的元素的普通氧化态分别为+1、+2、+3和+4。
这是因为较小的原子半径和较大的电负性使得这些元素更容易失去电子,形成带正电荷的离子。
2. 价电子层的填充规律:在短周期元素中,电子的填充规律也有着一定的规律。
以第三周期元素为例,它们的4s和3d层是相关的。
当4s层填满后,电子开始填充3d层。
这个规律在正负电离电位和键能等方面有重要影响。
3. 化学反应活性:短周期元素的化学反应活性也有规律可循。
比如,从左到右,第三周期元素的金属性逐渐减弱,非金属性逐渐增强。
这是因为原子半径减小和电负性增大,使得金属元素失去电子容易,而非金属元素更感觉到了这种需要。
以上是短周期元素的一些重要特点和规律。
了解这些知识点,有助于我们更好地理解和掌握高考化学中与短周期元素相关的题目。
短周期元素的部分性质PPT文档共21页

短周期元素的部分性质
▪
26、要使整个人生都过得舒适、愉快,这是不可能的,因为人类必须具备一种能应付逆境的态度。——卢梭
▪
27、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。——罗曼·罗兰如乐之者。——孔子
▪
29、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬奇
▪
30、意志是一个强壮的盲人,倚靠在明眼的跛子肩上。——叔本华
谢谢!
21
化学元素周期表短周期和长周期

化学元素周期表短周期和长周期
短周期(一、二、三行)(元素有2、8、8种)长周期(四、五、六行)(元素有18、18、32种)不完全周期(七行)(元素有26种)
元素周期表长短周期分别指的是4、5、6三个周期和含有元素较少的第1、2、3周期,短周期有18种元素,在周期表中除了长短周期还有不完全周期,也就是还没有结束的第7周期。
周期的意思是主要是指元素的核外电子排布随着核电核数的递增呈周期性的变化,元素在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和元素之间的内在联系。
短周期:都是由主族元素组成的(每周期含元素种类较少:8个或2个)长周期:有主族和副族的元素共同组成(每周期含元素种类较多:18个或32个)。
化学之元素周期表的性质
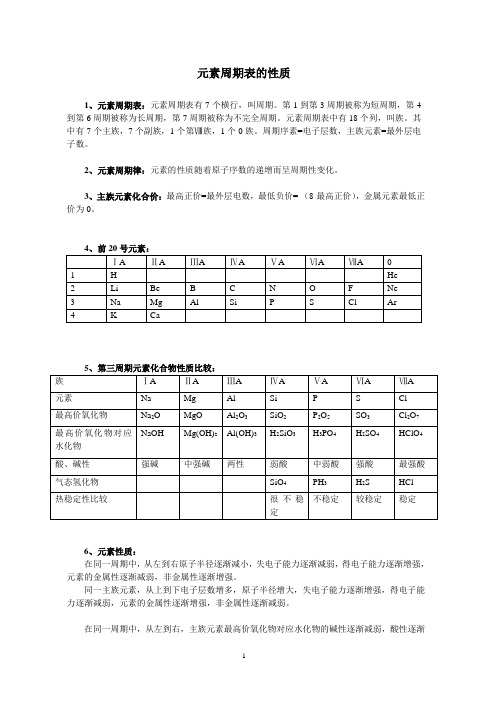
元素周期表的性质1、元素周期表:元素周期表有7个横行,叫周期。
第1到第3周期被称为短周期,第4到第6周期被称为长周期,第7周期被称为不完全周期。
元素周期表中有18个列,叫族。
其中有7个主族,7个副族,1个第Ⅷ族,1个0族。
周期序素=电子层数,主族元素=最外层电子数。
2、元素周期律:元素的性质随着原子序数的递增而呈周期性变化。
3、主族元素化合价:最高正价=最外层电数,最低负价=-(8-最高正价),金属元素最低正价为0。
4、前20号元素:ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 01 H He2 Li Be B C N O F Ne3 Na Mg Al Si P S Cl Ar4 K Ca5、第三周期元素化合物性质比较:族ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA元素Na Mg Al Si P S Cl最高价氧化物Na2O MgO Al2O3SiO2P2O5SO3Cl2O7NaOH Mg(OH)2Al(OH)3H2SiO3H3PO4H2SO4HClO4最高价氧化物对应水化物酸、碱性强碱中强碱两性弱酸中弱酸强酸最强酸气态氢化物SiO4PH3H2S HCl不稳定较稳定稳定热稳定性比较很不稳定6、元素性质:在同一周期中,从左到右原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强,元素的金属性逐渐减弱,非金属性逐渐增强。
同一主族元素,从上到下电子层数增多,原子半径增大,失电子能力逐渐增强,得电子能力逐渐减弱,元素的金属性逐渐增强,非金属性逐渐减弱。
在同一周期中,从左到右,主族元素最高价氧化物对应水化物的碱性逐渐减弱,酸性逐渐增强;它们气态氢化物的热稳定性逐渐增强。
在同一主族中,从上到下,元素最高价氧化物对应水化物的酸性逐渐减弱,碱性逐渐增强;它们的气态氢化物的热稳定性逐渐减弱。
原子半径金属性非金属性最高价氧化物对应水化物气态氢化物的稳定性酸性碱性同一横行减小减小增大减小增大增大同一列增大增大减小增大减小减小2011.11.12。
元素周期律知识点总结

元素周期律知识点总结元素周期律知识点总结总结是指对某一阶段的工作、学习或思想中的经验或情况加以总结和概括的书面材料,它能帮我们理顺知识结构,突出重点,突破难点,是时候写一份总结了。
但是总结有什么要求呢?下面是小编精心整理的元素周期律知识点总结,希望能够帮助到大家。
N(核素)Z→ 元素符号原子结构:决定原子呈电中性(AZX)Z个),无固定轨道运动特征小黑点的意义、小黑点密度的意义。
排布规律→ 电子层数周期序数及原子半径→ 原子(离子)的电子式、原子结构示意图原子核核外电子(Z个) 决定质子(Z个) 中子(A-Z)个——决定同位素种类原子(AZX) ——最外层电子数决定元素的化学性质1.微粒间数目关系质子数(Z)= 核电荷数 = 原子数序原子序数:按质子数由小大到的顺序给元素排序,所得序号为元素的原子序数。
质量数(A)= 质子数(Z)+ 中子数(N)中性原子:质子数 = 核外电子数阳离子:质子数 = 核外电子数+所带电荷数阴离子:质子数 = 核外电子数-所带电荷数2.原子表达式及其含义A Z ±b c± X dA 表示X原子的质量数;Z 表示元素X的质子数; d 表示微粒中X原子的个数;c± 表示微粒所带的电荷数;±b 表示微粒中X元素的化合价。
3.原子结构的特殊性(1~18号元素)1.原子核中没有中子的原子:11H。
2.最外层电子数与次外层电子数的倍数关系。
①最外层电子数与次外层电子数相等:4Be、18Ar;②最外层电子数是次外层电子数2倍:6C;③最外层电子数是次外层电子数3倍:8O;④最外层电子数是次外层电子数4倍:10Ne;⑤最外层电子数是次外层电子数1/2倍:3Li、14Si。
3.电子层数与最外层电子数相等:1H、4Be、13Al。
4.电子总数为最外层电子数2倍:4Be。
5.次外层电子数为最外层电子数2倍:3Li、14Si6.内层电子总数是最外层电子数2倍:3Li、15P。
1-18 短周期元素性质归纳

1-18 短周期元素性质归纳短周期元素性质详细归纳湖南省郴州市湘南中学:田万福 1号元素 H1、最外层电子数=电子层数主族序数=周期序数(Be,Al)2、原子半径最小,最轻的气体单质3、单质常做还原剂N+3H? 2NH(工业合成氨,放热反应) 322H+F=2HF(黑暗处就能反应) 22H+Cl=2HCl(光照爆炸,点燃苍白色火焰) 22CuO+H=Cu+HO(吸热反应) 224、制备实验室:Zn+HSO= ZnSO+H 24 42工业制法:C(s)+HO(g)= CO + H 225、同位素:质子数相同而中子数不同的核素 H D T (氕氘氚) 2号元素 He单质无化学键(稀有气体都无化学键,单原子分子)3号元素 Li1、最外层电子数是内层电子数的一半(P) 最外层电子数是最内层电子数的一半(Na)2、密度最小的金属,保存在石蜡油中,防止氧化3、与水反应生成碱和氢气,与O不能生成过氧化物 24号元素 Be1、最外层电子数,次外层电子数;最外层电子数,电子层数;2、氧化物为BeO;价态+,价;两性元素,其氧化物和氢氧化物为两性 5号元素 B最外层电子数比次外层多一个;氢化物BH;硼酸(HBO)可用于洗涤不小心溅在皮肤上的碱液 26336号元素 C1、最外层电子数是内层电子数的2倍最外层电子数是最内层电子数的2倍(Si)2、形成化合物种类最多(有机物)3、同素异形体:石墨,金刚石,C (氧气与臭氧,红磷与白磷,正交硫和单斜硫) 604、氧化物 AB AB型 2CO:有毒,可燃(淡蓝色火焰,S、H、CH、CHOH),还原性气体 2425CO:电子式温室效应,固态称为干冰,用于人工降雨(还有AgI) 2检验方法:使澄清石灰水变浑浊(注意与SO区别鉴定) 25、氢化物: 10电子体,正四面体结构6、连续氧化:C C(CH)——CO——CO——HCO 42237、NaCO与NaHCO鉴别 233当两者为固体时,加热的方法方程式当两者为溶液时,用CaCl溶液(为什么不能用Ca(OH)溶液) 227号元素 N1、空气中含量最多的元素,N是活泼的非金属,但N性质稳定,做保护气22、氧化物 AB AB型为主(还有NO,NO,NO,NO,NO)污染空气,形成光化学烟雾,酸雨 2223225NO:无色有毒气体,中毒原理与CO一样,遇氧气马上变为红棕色NO:红棕色气体(红棕色固体FeO,红棕色液体Br) 22322 NO(g)? NO (g) 放热反应 2 243、氢化物 10电子体,三角锥形,分子中有氢键,氮族中氢化物沸点最高,水溶液惟一呈碱性检验方法:使湿润的红色石蕊试纸变蓝色;遇HCl(g)产生大量白烟 4、连续氧化制HNO N(NH)NO——NO——HNO 3 23——2393,HNO因溶入NO而呈黄至棕黄色,开盖则逸出棕色浓雾,叫发烟硝酸。
元素周期表的周期性规律与化学性质

元素周期表的周期性规律与化学性质元素周期表是化学界最重要的工具之一,它将所有已知元素按照一定规律排列,为我们理解元素的物理性质和化学性质提供了重要线索。
元素周期表的周期性规律与化学性质存在着密切的联系。
元素周期表以元素的原子序数(即质子数)为基础进行排列,并将相似性质的元素归为一组。
这个排列方式揭示了元素间的周期性规律。
元素周期表的第一行是最轻的元素氢和最重的元素氦,随后是锂、铍等元素,一直到铅和锑等重元素。
这些元素按照一定规律在周期表中排列,每7个元素形成一个周期,共有7个周期。
元素周期表中的周期性规律体现在元素的物理性质和化学性质上。
首先是原子半径的周期性变化。
从左到右,原子半径逐渐减小,因为质子数的增加导致电子云对于核的吸引力增强,电子云收缩。
但在周期表的每个周期内,原子半径会随着主量子数(能量层的数量)的增加而增加。
这是因为在同一周期内,电子数增加,电子层依次填充,电子云逐渐扩展。
其次是原子电离能的周期性变化。
原子电离能是指从一个原子中去除一个电子所需的能量。
随着原子序数的增加,原子电离能逐渐增加。
这是由于随着电子数增加,电子与核之间的吸引力也增加,所需的能量也相应增加。
元素周期表中还存在着元素的电负性的周期性变化。
电负性是元素与其他元素形成化学键时对电子的吸引能力。
从左至右,元素的电负性逐渐增加。
这是由于原子核对电子的吸引力增强。
而在同一周期内,电负性随着原子序数的增加而减小。
这是因为原理能层的数量增加,电子云距离原子核越远,与原子核的吸引力相对较弱。
元素周期表中的周期性规律不仅仅适用于物理性质,也适用于化学性质。
元素的化学性质是由其原子结构和电子构型决定的。
元素往往与同一组内的元素表现出相似的化学性质,这是由于它们的电子结构相似。
例如,第一组元素称为碱金属,包括锂、钠、钾等。
这些元素都具有单价为+1的离子,因为它们容易失去一个电子。
碱金属都是非常活泼的金属,与非金属发生反应会产生剧烈的化学反应,如与水反应产生氢气。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
短周期元素性质详细归纳
湖南省郴州市湘南中学:田万福
1号元素H
1、最外层电子数=电子层数主族序数=周期序数(Be,Al)
2、原子半径最小,最轻的气体单质
3、单质常做还原剂
N2+H2 ⇋NH3(工业合成氨,放热反应)
H2+F2=2HF(黑暗处就能反应)
H2+Cl2=2HCl(光照爆炸,点燃苍白色火焰)
CuO+H2=Cu+H2O(吸热反应)
4、制备实验室:Zn+H2SO4=ZnSO4+H2
工业制法:C(s)+H2O(g)=CO+H2
5、同位素:质子数相同而中子数不同的核数H D T
2号元素He
单质无化学键(稀有气体都无化学键,单原子分子)
3号元素Li
1、最外层电子数是内层电子数的一半(P)最外层电子数是最内层电子数的一半(Na)
2、密度最小的金属,保存在石蜡油中,防止氧化
3、与水反应生成碱和氢气,与O2不能生成过氧化物
4号元素Be
1、最外层电子数=次外层电子数;最外层电子数=电子层数;
2、氧化物为BeO;价态+2价;两性元素,其氧化物和氢氧化物为两性
5号元素B
最外层电子数比次外层多一个;氢化物B2H6;硼酸(H3BO3)可用于洗涤不小心溅在皮肤上的碱液6号元素C
1、最外层电子数是内层电子数的2倍最外层电子数是最内层电子数的2倍(Si)
2、形成化合物种类最多(有机物)
3、同素异形体:石墨,金刚石,C60(氧气与臭氧,红磷与白磷,正交硫和单斜硫)
4、氧化物AB AB2型
CO:有毒,可燃(淡蓝色火焰,S、H2、CH4、C2H5OH),还原性气体
CO2:电子式温室效应,固态称为干冰,用于人工降雨(还有AgI)
检验方法:使澄清石灰水变浑浊(注意与SO2区别鉴定)
5、氢化物:10电子体,正四面体结构
6、连续氧化:C C(CH4)——CO——CO2——H2CO3
7、Na2CO3与NaHCO3鉴别
当两者为固体时,加热的方法方程式
当两者为溶液时,用CaCl2溶液(为什么不能用Ca(OH)2溶液)
7号元素N
1、空气中含量最多的元素,N是活泼的非金属,但N2性质稳定,做保护气
2、氧化物AB AB2型为主(还有N2O,NO,N2O3,NO2,N2O5)污染空气,形成光化学烟雾,酸雨NO:无色有毒气体,中毒原理与CO一样,遇氧气马上变为红棕色
NO2:红棕色气体(红棕色固体Fe2O3,红棕色液体Br2)
2 NO2 (g)⇋ N2O4(g)放热反应
3、氢化物H N H
H
10电子体,三角锥形,分子中有氢键,氮族中氢化物沸点最高,水溶液惟一
呈碱性
检验方法:使湿润的红色石蕊试纸变蓝色;遇HCl(g)产生大量白烟
4、连续氧化N2(NH3)——NO——NO2——HNO3
8号元素O
1、最外层电子数是内层电子数的2倍,也是电子层数的2倍
2、地壳含量最多的元素(O,Si,Al,Fe);有同素异形现象
3、2种氢化物都为液体,AB、A2B型
H2O 电子式:10电子体,分子晶体,有氢键,氧族中沸点最高的氢化物H2O2 电子式:18电子体,强氧化性,消毒杀菌
4、制备实验室制法:2H2O2=2H2O+O22KClO3=2KCl+3O2
9号元素F
1、非金属性最强,氧化性最强,单质有颜色(淡绿色),HF是最稳定的氢化物
2、 HF弱酸,其水溶液用于雕刻玻璃,方程式4HF+SiO2=SiF4+2H2O
10号元素Ne
11号元素Na
1、最外层电子数是最内层电子数的一半
2、银白色光泽,易被氧化变暗,保存在煤油中,钠钾合金是原子反应堆的导热材料,常温小呈液态
3、氧化物有两种,A2B2A2B
Na2O2的电子式:淡黄色固体(还有S,AgBr),强氧化剂,常做供氧来源
Na2O的电子式:白色固体,碱性氧化物,固体溶于水放热
Na2O2 + H2O = Na2O2 + CO2=
4、焰色反应,钠元素黄色(钾元素紫色,观察方法)
5、与水剧烈反应,浮、游、响、熔、红Na+H2O=
6、连续氧化Na——Na2O——Na2O2——NaOH
12号元素Mg
1、最外层电子数-最内层电子数,次外层电子数是最外层电子数的4倍
2、单质在N2,O2,CO2,Cl2中燃烧
3、 Mg(OH)2为难溶性中强碱;Mg遇冷水难反应,遇热水能放H2;MgCl2溶液又称苦卤;MgSO4为泻
盐。
13号元素Al
1、最外层电子数=电子层数,主族序数=周期数
2、地壳中含量最多的金属。
单质,氧化物,氢氧化物都能与强酸、强碱反应。
3、铝离子水解应用:明矾净水,Al2(SO4)3与NaHCO3为泡沫灭火器的药剂(完全双水解)
4、单质遇冷的浓硝酸和浓硫酸,有钝化现象
14号元素Si
1、最外层电子数是最内层电子数的2倍,最外层电子数是次外层的一半
2、单质是人工制得纯度最高的元素,常做半导体材料
3、 SiO2,天然二氧化硅称为硅石,石英晶体是结晶的二氧化硅。
酸性氧化物,不溶于水,光导纤维的
重要原料,对应H2SiO3也不溶于水,是惟一难溶酸。
4、硅酸盐的氧化物书写形式:活泼金属氧化物·较活泼金属氧化物·二氧化硅·水
5、硅酸盐工业,传统的无机非金属材料,水泥、玻璃、陶瓷
制玻璃的方程式
15号元素P
1、最外层电子数是内层电子数的一半,水中的富营养元素
2、有同素异形现象,红磷与白磷P4(一分子白磷有6根共价健,易自燃)
3、 P2O5具有很强的吸水性,常用作干燥剂
16号元素S
1、最外层电子数是电子层数的2倍,是最内层电子数的3倍
2、单质为黄色晶体,俗称硫磺(硫黄)易溶于CS2,S可用于除去液态金属Hg
3、同一主族元素形成两种化合物
SO2:含氧量50%,使品红褪色,表现漂白性,与有色物质生成不稳定的无色物质。
使溴水褪色,表现还原性。
2SO2+O2⇋2SO3 放热反应
SO3:含氧量60%,标准状况下固体。
4、H2S 电子式:18电子体,臭鸡蛋味气体,有毒
5、连续氧化:S(H2S)——SO2——SO3——H2SO4
6、浓硫酸特性,吸水性,脱水性,强氧化性
SO42-的检验:加盐酸,无现象,再滴加BaCl2,有白色沉淀生成
17号元素Cl
1、单质为黄绿色气体,有毒,最易液化的气体
液氯:液态的氯气,纯净物,储存在钢瓶中
氯水:氯气溶于水的溶液,溶质为氯气,有漂白性。
氯气的检验:使湿润的淀粉KI试纸变蓝
2、HCl 电子式:18电子体,水溶液称为盐酸
3、HClO4,最强的酸,HClO弱酸,强氧化性,漂白性
4、工业制备:电解饱和食盐水可制Cl2,
实验室制备:MnO2+HCl(浓)=
18号元素Ar
思考归纳1-18号元素:
1、单质是气体的有
2、各元素形成化合物是气体的有
3、属于10电子体的原子,分子,单核离子,原子团有那些:属于18电子体的原子,分子,单核离子,原子团有那些,具有强氧化性的有那些。
