有机化学九十六种反应机理及实例1——1~10
有机化学反应机理(整理版)资料
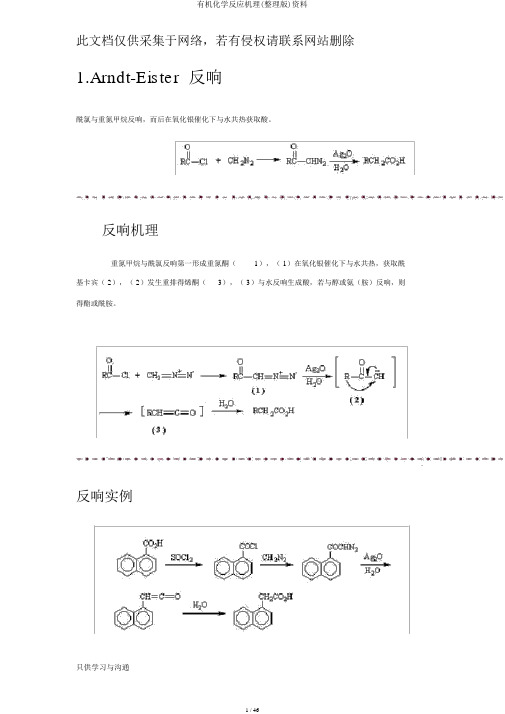
此文档仅供采集于网络,若有侵权请联系网站删除1.Arndt-Eister 反响酰氯与重氮甲烷反响,而后在氧化银催化下与水共热获取酸。
反响机理重氮甲烷与酰氯反响第一形成重氮酮(1),( 1)在氧化银催化下与水共热,获取酰基卡宾( 2),( 2)发生重排得烯酮(3),( 3)与水反响生成酸,若与醇或氨(胺)反响,则得酯或酰胺。
反响实例2.Baeyer----Villiger 反响反响机理过酸先与羰基进行亲核加成,而后酮羰基上的一个烃基带着一对电子迁徙到-O-O- 基团中与羰基碳原子直接相连的氧原子上,同时发生O-O 键异裂。
所以,这是一个重排反响拥有光学活性的3--- 苯基丁酮和过酸反响,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁徙,可是还是有必定的选择性,按迁徙能力其次序为:醛氧化的机理与此相像,但迁徙的是氢负离子,获取羧酸。
反响实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,此中三氟过氧乙酸是最好的氧化剂。
这种氧化剂的特色是反响速率快,反响温度一般在10~40 ℃之间,产率高。
3.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反响机理在酸作用下,肟第一发生质子化,而后脱去一分子水,同时与羟基处于反位的基团迁徙到缺电子的氮原子上,所形成的碳正离子与水反响获取酰胺。
迁徙基团假如是手性碳原子,则在迁徙前后其构型不变,比如:反响实例4.Birch 复原芬芳化合物用碱金属(钠、钾或锂)在液氨与醇(乙醇、异丙醇或仲丁醇)的混淆液中复原,苯环可被复原成非共轭的1, 4- 环己二烯化合物。
反响机理第一是钠和液氨作用生成溶剂化点子,而后苯获取一个电子生成自由基负离子(Ⅰ),这是苯环的л 电子系统中有7 个电子,加到苯环上那个电子处在苯环分子轨道的反键轨道上,自由基负离子还是个环状共轭系统,(Ⅰ) 表示的是部分共振式。
有机化学反应方程式大全

有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCH CH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3+CH 3CH 3X +CH 3CH 3+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH CH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】2CH33H323H32 CH CH2CH32CH CH=CH(CH3CH2CH2)3-H3CH2CH2C22CH3CH2B OCH2CH2CH33CH2CH2C2CH2CH3+O H-OHB-OCH2CH2CH3CH2CH2CH3H3CH2CH2B OCH2CH2CH3CH2CH2CH32CH2CH3HOO-B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO32【例】CH31)BH32)H2O2/OH-CH3HHOH3、X2加成C CBr2/CCl4C CBrBr【机理】CCC CBrBr CBr+C CBrOH2+-H+C CBrOH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
不对称的烯烃,亲核试剂进攻主要取决于空间效应。
2020年有机化学反应的96种反应类型精品版

有机化学反应机理一、Arbuzov 反应二、Arndt-Eister 反应三、Baeyer-villiger 反应四、Beckmann 重排五、Birch 还原六、Bouveault-Blanc 还原七、Bucherer 反应八、Bamberger,E. 重排九、Berthsen,A.Y 吖啶合成法十、Cannizzaro 反应十一、Chichibabin 反应十二、Claisen 酯缩合反应十三、Claisen-Schmidt 反应十四、Claisen 重排十五、Clemmensen 还原十六、Combes 喹啉合成法十七、Cope 消除反应十八、Cope 重排十九、Curtius 反应二十、Crigee,R 反应二十一、Dakin 反应二十二、Elbs 反应二十三、Edvhweiler-Clarke 反应二十四、Elbs,K 过硫酸钾氧化法二十五、Favorskii 反应二十六、Favorskii 重排二十七、Friedel-Crafts 烷基化反应二十八、Friedel-Crafts 酰基化反应二十九、Fries 重排三十、Fischer,O-Hepp,E 重排三十一、Gabriel 合成法三十二、Gattermann 反应三十三、Gattermann-Koch 反应三十四、Gomberg-Bachmann 反应三十五、Hantzsch 合成法三十六、Haworth 反应三十七、Hell-Volhard-Zelinski反应三十八、Hinsberg 反应三十九、Hofmann 烷基化四十、Hofmann 消除反应四十一、Hofmann 重排(降解)四十二、Houben-Hoesch 反应四十三、Hunsdiecker 反应四十四、Kiliani 氯化增碳法四十五、Knoevenagel 反应四十六、Koble 反应四十七、Koble-Schmitt 反应四十八、Kolbe,H.Syntbexis of Nitroparsffini 合成四十九、Leuckart 反应五十、Lossen 反应五十一、Mannich 反应五十二、Meerwein-Ponndorf 反应五十三、Michael 加成反应五十四、Martius,C.A. 重排五十五、Norrish Ⅰ和Ⅱ型裂五十六、Oppenauer 氧化五十七、Orton,K.J.P 重排五十八、Paal-Knorr 反应五十九、Pschorr 反应六十、Prileschajew,N 反应六十一、Prins,H.J 反应六十二、Pinacol 重排六十三、Perkin,W.H 反应六十四、Pictet-Spengler异喹啉合成法六十五、Reformatsky 反应六十六、Reimer-Tiemann 反应六十七、Reppe 合成法六十八、Robinson 缩环反应六十九、Rosenmund 还原七十、Ruff 递降反应七十一、Riley,H.L 氧化法七十二、Sandmeyer 反应七十三、Schiemann 反应七十四、Schmidt 反应七十五、Skraup 合成法七十六、Sommelet-Hauser 反应七十七、Stepen 还原-氰还原为醛七十八、Stevens 重排七十九、Strecker 氨基酸合成法八十、异喹啉合成法八十一、Schiemann,G. 反应八十二、Schmidin,J. 乙烯酮合成八十三、Tiffeneau-Demjanov 重排八十四、Tischenko,V.反应八十五、Thorpe,J.F. 缩合八十六、Tollens,B. 缩合八十七、Ullmann 反应八十八、Urech,F.羟腈合成法八十九、Vilsmeier 反应九十、Van Ekenstein,W,A 重排九十一、Williamson 合成法九十二、Wacker 反应九十三、Wagner-Meerwein 重排九十四、Wittig 反应九十五、Wittig-Horner 反应九十六、Wohl 递降反应Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
有机化学反应机理(总结最好的)(共143张)

酸碱催化剂:通过提供质子或离子促进反应进行 金属催化剂:利用金属的活性中心加速反应 过渡金属络合物催化剂:通过金属与配体的协同作用促进电子转移 酶催化剂:高度专一性地加速生物体内的有机反应
温度:温度对有机化学反应的速 率和产物有影响有些反应需要在 特定的温度下进行。
浓度:反应物的浓度直接影响反 应速率和产物有些反应需要在特 定的浓度下进行。
有机化学反应 机理在可持续 发展中发挥着 重要作用如利 用太阳能、风 能等可再生能 源进行有机合
成。
随着科技的不 断进步有机化 学反应机理的 应用前景将更 加广阔为绿色 化学和可持续 发展提供更多
可能性。
有机化学反应机理在合成中的应用:通过了解反应机理可以预测反应结果 优化合成路径提高合成效率和产率。
有机化学反应机理在药物设计中的应用:通过研究药物分子的反应机理 可以预测药物与生物靶点的相互作用为新药研发提供理论支持。
有机化学反应机理在材料科学中的应用:通过了解有机化学反应机理可以 预测和调控材料性能为新材料的设计和制备提供思路。
特点:需要酸或碱的催化反应条 件温和常温常压下即可进行。
添加标题
添加标题
类型:包括E1、E2、E1cb和 E2cb四种类型。
添加标题
添加标题
应用:在有机合成中广泛应用是 制备烯烃的重要方法之一。
定义:由单体合成聚合物的反应
特点:反应过程中有聚合度增长 的变化生成高分子化合物
添加标题
添加标题
类型:加聚反应、缩聚反应等
电子转移:在有 机化学反应中电 子转移是反应的 重要步骤它决定 了反应的活性和 选择性。
键合变化:键合 变化是指反应过 程中化学键的形 成和断裂它决定 了反应的产物和 产率。
有机化学反应机理(总结最好的) (共143张PPT).ppt

CH3
OH
C-O+ CCHH33 -H+
CH3
O
C-OCH3 CH3
CH3
CH3 78%
仅有少量空阻大的羧酸按此反应碱性水解
双分子反应一 步活化能较高
O
H+
CH3C-OH
+OH CH3C-OH HOC2H5
按加成--消除机理进行 反应,是酰氧键断裂
加成
OH CH3-C-OH
HO+ C2H5
质子转移
四面体正离子
OH CH3-C-O+ H2
OC2H5
-H2O 消除
+OH
-H+
CH3C-OC2H5
O CH3C-OC2H5
*2 碳正离子机理
实例:卤代烃溶剂解反应的反应机理(SN1)
进攻C+
CH3 CH3 C Br
CH3
慢 -Br-
CH3
CH3 C+
CH3
C2H5OH
快
-H+
CH3 +
CH3 C HOC2H5 CH3
CH3
CH3 C OC2H5
CH3
3 酯化反应
定义:羧酸与醇在酸的催化作用下失去一分子水 而生成酯的反应称为酯化反应
常用的催化剂有盐酸 、硫酸、苯磺酸等
n-C6H13 HO C H
CH3
(S)-2-辛醇
[]D= + 9.9o
构型翻转
n-C6H13 H C OH CH3
(R)-2-辛醇
[]D= - 9.9o
构型保持
如果一个反应涉及到一个不对称碳原子上的一根键的变化,则将新
键在旧键断裂方向形成的情况称为构型保持,而将新键在旧键断裂的相 反方向形成的情况称为构型翻转。这种构型的翻转也称为Walden转换。 在SN2反应中,得到构型翻转的产物。
大学有机化学反应机理集锦

酯化反应是一个可逆的反应,为了使正反应有利,通常采用的手段是: ①使原料之一过量; ②不断移走产物(例如除水;乙酸乙酯、乙酸、水可形成三元恒沸物 bp 70.4℃)。
1
2
01
有两种分子参与了决定反应速度关键步骤的亲核取代反应称为SN2 反应
02
实例:卤代烃双分子亲核取代反应的反应机理(SN2)
构型保持和构型翻转
如果一个反应涉及到一个不对称碳原子上的一根键的变化,则将新键在旧键断裂方向形成的情况称为构型保持,而将新键在旧键断裂的相反方向形成的情况称为构型翻转。这种构型的翻转也称为Walden转换。在SN2反应中,得到构型翻转的产物。
1
2
3
碳正离子机理进行的过程可表述如下:试剂首先解离成离子,正离子与烯烃反应形成碳正离子,这是决定反应速率的一步,π键断裂后,C—C键可以自由旋转,然后与带负电荷的离子结合,这时结合有两种可能,即生成顺式加成与反式加成两种产物。
4
YE
三分子过渡态机理(反式加成)
EY
(CH3)2CHCH=CHCH3 + Br2 (CH3)2CHCHBrCHBrCH3
亲核加成反应
羰基是一个具有极性的官能团,由于氧原子的电负性比碳原子的大,因此氧带有负电性,碳带有正电性,亲核试剂容易向带正电性的碳进攻,导致π键异裂,两个σ键形成。这就是羰基的亲核加成。
1
2
酸催化的反应机理
碱催化的反应机理
实例 丙酮与HCN的加成
01
(CH3)2C=O + HCN
02
(1) HNO3 + 2H2SO4 H3O+ + +NO2 + 2 HSO4-
有机化学的10种反应类型
在σ迁移反应中,σ键在共轭体系中进行迁移,形成环状过渡态,然后生成产物。σ迁移反 应通常涉及π电子和σ电子的相互作用,因此也被称为π-σ反应。
07
酯化反应和酯交换反应
Chapter
酯化反应
酸催化酯化
羧酸与醇在酸性催化剂存在下加热,生成酯和水 。
碱催化酯化
羧酸盐与醇在碱性催化剂存在下加热,生成酯和 相应的盐。
某些芳香族化合物在特定条件下,也可以发生加聚反应生成高分子 化合物。
缩聚反应
酰胺化缩聚反应
羧酸和胺在催化剂的作用下,发 生酰胺化缩聚反应生成聚酰胺。
酚醛缩聚反应
酚和醛在催化剂的作用下,发生 酚醛缩聚反应生成酚醛树脂。
尿素甲醛缩聚反应
尿素和甲醛在催化剂的作用下, 发生尿素甲醛缩聚反应生成脲醛 树脂。
02 反应过程中,酮肟的氮原子上的羟基和碳原子上 的氢原子发生迁移,形成新的碳氮键。
03 贝克曼重排是一种重要的有机合成方法,可用于 制备多种酰胺类化合物。
霍夫曼重排
霍夫曼重排是指酰胺在溴或氯的存在下,加热发生分子 内重排生成少一个碳原子的伯胺的反应。
反应过程中,酰胺的羰基碳原子上的氢原子和氮原子上 的烃基发生迁移,形成新的碳氮键。
烯烃和炔烃的亲电加成
烯烃和炔烃在亲电试剂(如卤素、氢卤酸、硫酸等)的作用 下,可以发生亲电加成反应,生成相应的卤代烃或硫酸酯等 。
芳香烃的亲电加成
芳香烃在亲电试剂(如硝酸、硫酸、氯化铁等)的作用下, 可以发生亲电取代反应,生成相应的硝基化合物、磺酸酯或 氯化物等。
自由基加成反应
烯烃和炔烃的自由基加成
酯化缩聚反应
羧酸和醇在催化剂的作用下,发 生酯化缩聚反应生成聚酯。
乙烯基化合物的缩聚反应
经典有机化学反应机理大全
Ph p-ClPh
OH NH2
HCHO HCOOH
Ph OH
p-ClPh
N
HCHO
NH2 HCOOH, 95oC
N
O
O O
NH2 HCHO HCOOH
O
N O
O
29
反应机理
H
R NH2 +
O
H
R N OH H
R N CH2 H
R
N CH3
H
+
O
H
H
or
CH RN
HH O
O
H+ R N OH
CH3
G
G
G
Na, NH3 (liquid)
Na, NH3 (liquid)
EtOH G=R, NR2, OR etc.
反应机理
EtOH
G= COO-, COOR, COR, CONR2, CN, Ar, SiR3 etc.
Na + NH3
Na+ + [e]- NH3 氨溶剂化的电子很活泼
R + e-
e R
O
OH
heat
O
heat O
反应机理
O
O
OH
heat
H
H3C
O
CH3 heat H3C
O CH3
H3C
O
CH3
H2C
H
H3C
OH CH3
17
16. Cope重排(1,5-二烯烃在加热下[3,3] σ迁移)
300oC
HO
O
heat
反应机理
Ph Ph
Ph
Ph
有机化学反应规律总结 非常齐全
有机化学反应条件总结 序号 反应条件 常见反应 举例
1
浓H2SO4加热
醇脱水成烯 CH3CH2OH℃浓17042SOHCH2=CH2↑+H2O(分子内脱水)脱去—OH(或—X)及相邻碳原子上的氢
2 醇脱水成醚
2CH3CH2OH℃浓14042SOHCH3CH2—O—CH2CH3+H2O
(分子间脱水) 3 酯化
4 苯硝化(水浴)
5 稀H2SO4加热
酯的水解
6 二糖及多糖水解
7 NaOH水溶
液
卤代烃水解生成醇 CH3CH2CH2-Cl+NaOHOH2CH3CH2CH2-OH+NaCl
(取代) 8 酯水解(彻底)
9 NaOH醇溶液加热 卤代烃消去 CH3CH2-CH2Cl+NaOH乙醇CH3CH=CH2+NaCl+H2O
10 Cu或Ag催化加热
醇去氢氧
化,生成醛或酮
脱去与羟基相连接碳原子上的氢和羟基中的氢
11 光照
与卤素X2
反应,烷烃
取代
12 苯环侧链卤代 3HC32CH +Cl
光照
3HC2CHCl +HCl
13 Fe或FeX3催化
与卤素X2
反应,苯环
上H被取代
14 溴水
不饱和烃加
成 序号 反应条件 常见反应 举例 15 浓溴水
苯酚的取代
反应
16 Ag(NH3)2OH、Cu(OH)2 醛的氧化反应 CHO
2+Cu(OH)△2
COOH
222+ CuO+2HO↓
17 KMnO4(H+) 烯等不饱和烃、醇、醛、苯的同系物被氧化为羧酸
18
不需要外加条件
烯烃炔烃与溴水加成
19 苯酚与浓溴水、NaOH、Na2CO3、FeCl3 ;醇与Na 有机化学官能团的引入总结 序号 引入的官能团 常见反应 举例 1 —OH 烯烃加水 2 醛酮加氢 3 卤代烃水解 4 酯的水解 5 —X 烷烃芳香烃取代 6 烯烃炔烃与X2 7 烯烃炔烃与HX加成 8 醇与HX取代 —OH +NaOH +H2O —ONa 序号 引入的官能团 常见反应 举例 9 碳碳双键 醇的消去
高中有机化学反应类型与反应机理
细说高中有机反应类型和反应机理纵观近几年高考,有机化学的比重相对稳定,都在二十几分,所涉及到的知识点主要为有机物官能团的性质(选择题)、有机反应类型的判断、有机结构、有机推断及有关计算。
而有关有机反应类型的判断,官能团性质的考查是学生错误率较高的知识点。
那么,如何有效地进行复习呢?我们知道,有机反应不同于无机反应,概念间有交叉,也有包含与被包含关系,有的反应类型较难判定。
若掌握了有机反应机理,则反应类型的判断以及官能团的性质就迎刃而解了。
一.反应类型:取代;加成;消去;氧化;还原;加聚;缩聚;酯化;水解;显色反应二.反应机理:1.取代反应-----等价替换(有进有出)a.定义:有机物分子中的某些原子或原子团,被其它的原子或原子团所代替的反应。
b.类型:烃的卤代、烃的硝化(磺化)、醇分子间脱水、醇与HX反应、酚的卤代、酯化(皂化)、水解(卤代烃、酯、二糖、多糖、蛋白质)、有机酸酐c.条件:①X2单质------ 烃的卤代、苯的同系物侧链卤代:光照苯的同系物苯环卤代:常温、铁屑;②浓溴水 ------ 酚的苯环卤代(邻、对位);③浓硫酸、加热------酯化、分子间脱水、醇与HX反应;④水解----- 氢氧化钠水溶液共热或稀硫酸共热或酶;⑤碱石灰、加热-------羧酸盐(去羧反应):2. 加成反应---开键加合(只进不出)a.定义:有机分子里不饱和的碳原子跟其它原子或原子团直接结合生成别的物质。
b.类型:烯、炔、二烯烃等不饱和烃的加成,苯和苯的同系物的加成,醛、酮的加成,油酸的氢化,油脂的硬化。
c.对象:加H2O、加X2、H2、HX、HCN等d.注意:①卤素可用水溶液,也可用溴的CCl4或者单质气体;②与H2加成一般用Ni作催化剂,对碳氧双键的加成中学阶段只限醛、酮,而不考虑羧基、酯基;③氢化反应的产物中碳的“架”或“环”不变,因此可根据氢化产物回推原来有机物的碳架或碳环;⑤与卤素、卤化氢的加成为分子式中羟基的引入提供先决条件。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机化学九十六种反应机理及实例1——1~10
一、Arbuzov 反应
亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:
卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a-或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:
如果反应所用的卤代烷R'X 的烷基和亚磷酸三烷基酯(RO)3P 的烷基相同(即R' = R),则Arbuzov反应如下:
这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯RP(OR')2 和次亚膦酸酯R2POR' 也能发生该类反应,例如:
1、反应机理:
一般认为是按SN2 进行的分子内重排反应:
反应实例:
二、Baeyer----Villiger 反应
1、反应机理
过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应
具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:
不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:
醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
2、反应实例
酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在
羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
这类氧化剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高。
三、Arndt-Eister 反应
酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
1、反应机理
重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
2、反应实例
四、Beckmann重排
肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:
1、反应机理
在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:
2、反应实例
五、Bouveault---Blanc 还原
脂肪族羧酸酯可用金属钠和醇还原得一级醇。
α,β-不饱和羧酸酯还原得相应的饱和醇。
芳香酸酯也可进行本反应,但收率较低。
本法在氢化锂铝还原酯的方法发现以前,广泛地被使用,非共轭的双键可不受影响。
1、反应机理
首先酯从金属钠获得一个电子还原为自由基负离子,然后从醇中夺取一个质子转变为自由基,再从钠得一个电子生成负离子,消除烷氧基成为醛,醛再经过相同的步骤还原成钠,再酸化得到相应的醇。
2、应用实例
醛酮也可以用本法还原,得到相应的醇:
六、Bucherer 反应
萘酚及其衍生物在亚硫酸或亚硫酸氢盐存在下和氨进行高温反应,可得萘胺衍生物,反应是可逆的。
反应时如用一级胺或二级胺与萘酚反应则制得二级或三级萘胺。
如有萘胺制萘酚,可将其加入到热的亚硫酸氢钠中,再加入碱,经煮沸除去氨而得。
1、反应机理
本反应的机理为加成消除过程,反应的第一步(无论从哪个方向开始)都是亚硫酸氢钠加成到环的双键上得到烯醇(℃)或烯胺(℃),它们再进行下一步互变异构为酮(℃)或亚胺(℃):
2、反应实例
七、Berthsen,A.Y 吖啶合成法
二芳基胺类与羧酸在无水ZnCl2存在下加热起缩合作用,生成吖啶类化合物。
1、反应机理
反应机理暂时不详。
2、反应实例
八、Chichibabin 反应
杂环碱类,与碱金属的氨基物一起加热时发生胺化反应,得到相应的氨基衍生物,如吡啶与氨基钠反应生成2-氨基啶,如果α位已被占据,则得γ-氨基吡啶,但产率很低。
本法是杂环上引入氨基的简便有效的方法,广泛适用于各种氮杂芳环,如苯并咪唑、异喹啉、丫啶和菲啶类化合物均能发生本反应。
喹啉、吡嗪、嘧啶、噻唑类化合物较为困难。
氨基化试剂除氨基钠、氨基钾外,还可以用取代的碱金属氨化物:
1、反应机理
反应机理还不是很清楚,可能是吡啶与氨基首先加成,(℃),(℃)转移一个负离子给质子给予体(AH),产生一分子氢气和形成小量的2-氨基吡啶(℃),此小量的(℃)又可以作为质子的给予体,最后的产物是2-氨基吡啶的钠盐,用水分解得到2-氨基吡啶:
2、反应实例
吡啶类化合物不易进行硝化,用硝基还原法制备氨基吡啶甚为困难。
本反应是在杂环上引入氨基的简便有效的方法,广泛适用于各种氮杂芳环,如苯并咪唑、异喹啉、吖啶和菲啶类化合物均能发生本反应。
九、Claisen 酯缩合反应
含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。
如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
二元羧酸酯的分子内酯缩合见Dieckmann缩合反应。
1、反应机理
乙酸乙酯的α-氢酸性很弱(pKa-24.5),而乙醇钠又是一个相对较弱的碱(乙醇的pKa~15.9),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。
但由于最后产物乙酰乙酸乙酯是一个比较强的酸,能与乙醇钠作用形成稳定的负离子,从而使平衡朝产物方向移动。
所以,尽管反应体系中的乙酸乙酯负离子浓度很低,但一形成后,就不断地反应,结果反应还是可以顺利完成。
常用的碱性缩合剂除乙醇钠外,还有叔丁醇钾、叔丁醇钠、氢化钾、氢化钠、三苯甲基钠、二异丙氨基锂(LDA)和Grignard试剂等。
2、反应实例
如果酯的α-碳上只有一个氢原子,由于酸性太弱,用乙醇钠难于形成负离子,需要用较强的碱才能把酯变为负离子。
如异丁酸乙酯在三苯甲基钠作用下,可以进行缩合,而在乙醇钠作用下则不能发生反应:
两种不同的酯也能发生酯缩合,理论上可得到四种不同的产物,称为混合酯缩合,在制备上没有太大意义。
如果其中一个酯分子中既无α-氢原子,而且烷氧羰基又比较活泼时,则仅生成一种缩合产物。
如苯甲酸酯、甲酸酯、草酸酯、碳酸酯等。
与其它含α-氢原子的酯反应时,都只生成一种缩合产物。
实际上这个反应不限于酯类自身的缩合,酯与含活泼亚甲基的化合物都可以发生这样的缩
合反应,这个反应可以用下列通式表示:
十、Claisen—Schmidt 反应
一个无α−氢原子的醛与一个带有α−氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇溶液存在下发生缩合反应,并失水得到α,β−不饱和醛或酮:
1、反应机理
2、反应实例
——END——。
