北京化工大学_18动力学机理推导速率方程
化学反应动力学方程求解

化学反应动力学方程求解化学反应动力学方程是研究化学反应速度与反应物浓度之间的关系的数学表达式。
解析这些方程可以帮助我们了解化学反应的速率规律以及影响反应速率的因素。
本文将介绍一些求解化学反应动力学方程的方法及其应用。
一、研究背景化学反应是物质转化过程中最基本的现象之一,了解反应速率及其变化规律对于实际生产和科学研究具有重要意义。
化学反应动力学方程可以描述反应速率与反应物浓度之间的函数关系,通过求解这些方程可以获得有关反应速度的定量信息。
二、方法一:平均速率法平均速率法是最简单直接的求解化学反应动力学方程的方法之一。
根据反应物浓度随时间的变化关系,观察在一定时间间隔内反应物浓度的变化量,然后计算平均速率。
例如,对于一个简单的一级反应A → 产物,其速率方程可以表示为rate = k[A],其中k为反应速率常数。
我们可以通过测定不同时间点上反应物浓度的浓度值,计算平均速率,然后绘制反应物浓度与时间的曲线。
三、方法二:伪一级反应法当反应物浓度较高时,一级反应的速率常数往往难以测定。
这时可以利用伪一级反应法来简化求解。
伪一级反应法是指将高反应物浓度下的高级反应抽象为一级反应,通过测定不同初始浓度下的反应速率,求取一个伪一级反应的速率常数。
在实验中选取适当的反应物浓度进行反应,测定其浓度随时间的变化情况后,可以得到伪一级反应的速率方程。
然后,通过对不同浓度下速率常数的测量,利用伪一级反应的速率方程求解得到反应速率常数。
四、方法三:积分法积分法是通过积分化简动力学方程,得到一个能直接表示浓度随反应时间变化关系的数学表达式。
在一些复杂的反应中,往往无法直接求解动力学方程,这时候可以应用积分法。
以二级反应为例,反应速率方程可以表示为rate = k[A]²。
通过对该方程积分,可以得到关于时间和浓度的关系方程,从而通过实验数据求解出反应速率常数。
五、应用案例1. 根据平均速率法和实验数据,求解一级反应动力学方程,进而得到反应速率常数。
化学反应的化学动力学方程

化学反应的化学动力学方程化学动力学是研究化学反应速率和影响因素的科学。
通过研究化学动力学方程,我们可以定量地描述反应速率与浓度之间的关系,从而了解反应的速率规律和机理。
本文将介绍化学反应的化学动力学方程,并探讨几个常见反应的动力学方程。
一、化学反应速率与化学动力学方程化学反应速率是指单位时间内反应物消失或生成物形成的量,通常用物质浓度的变化率表示。
反应速率与反应物的浓度密切相关,可以用以下一般化学动力学方程表示:v = k[A]^m[B]^n其中,v表示反应速率,k为速率常数,[A]和[B]分别表示反应物A和B的浓度,m和n分别为反应物A和B的反应级别。
化学动力学方程中的m和n可以为整数、分数或负数,代表了反应物浓度对反应速率的影响程度。
二、一级反应的化学动力学方程一级反应是指一个反应物的浓度对反应速率的影响是一次方关系。
一级反应的动力学方程可以表示为:v = k[A]其中,v为反应速率,k为速率常数,[A]表示反应物A的浓度。
一级反应的动力学方程表明,反应速率与反应物A的浓度成正比,反应速率随着[A]的增大而增大。
三、二级反应的化学动力学方程二级反应是指一个反应物或两个反应物的浓度对反应速率的影响是二次方关系。
二级反应的动力学方程可以表示为:v = k[A]^2其中,v为反应速率,k为速率常数,[A]表示反应物A的浓度。
二级反应的动力学方程表明,反应速率与[A]的平方成正比,反应速率随着[A]的增大呈二次倍数增加。
四、零级反应的化学动力学方程零级反应是指反应速率与反应物浓度无关,反应速率恒定不变。
零级反应的动力学方程可以表示为:v = k其中,v为反应速率,k为速率常数。
零级反应的动力学方程表明,反应速率不随反应物浓度的变化而变化。
五、反应级别的确定方法确定反应级别的方法可以通过实验数据的处理和分析来实现。
一般来说,通过改变反应物的初始浓度、温度等条件,测量多组实验数据,以线性回归法对实验数据进行分析和拟合,可以确定反应物浓度与反应速率之间的关系,并进一步确定动力学方程中反应级别的数值。
关于化学反应机理中反应速率系数k 的认定问题讨论

第23卷 第2期大学化学2008年4月关于化学反应机理中反应速率系数k的认定问题讨论李汝雄 吴新民(北京石油化工学院化工系 北京102617)当某基元反应中有关物质的分子数不等时,若有未指定物质的反应速率系数k,k的认定有两种不同的方法,由此推出的总反应的速率方程也会有差别。
这涉及化学反应速率系数的定义。
(1)化学反应0= B B的速率系数定义为:用反应进度 定义的反应速率v=1V dd t如v=k c n A以上V为反应体系的体积,t为反应时间,k为反应的速率系数,A代表反应物,B代表相关的任一物质。
此定义在理论上有其便利之处,但因为用到反应进度 ,而 与反应方程式的写法有关(如合成氨反应方程式常用的写法就有两种),因而相应的v和k都与反应方程式的写法有关。
应用该定义时,必须指定反应方程式,所以虽然用于书面较方便,但并不适于在工程实际如工厂中使用。
(2)反应物或产物变化速率系数k B:反应物A的消耗速率:v A=-1V d n Ad t,在恒容下v A=-d c Ad t,如v A=k A c n A。
产物P的生成速率:v P=1V d n Pd t,在恒容下v P=d c Pd t,如v P=k P c n A。
这里的反应物消耗速率系数k A或产物生成速率系数k P可统称为物质变化速率系数k B,k B与反应方程式的写法无关,但与物质B的选择有关。
k与k B的关系为k B| B|=k。
在做速率方程的积分时,由于 /V现仍未有命名,故使用k B较k方便。
k的上述两种定义各有特点,因此一般物理化学教科书中对两种定义均加以介绍,在使用中往往以某一种为主,但不排斥另一种。
下面介绍当反应中存在物质| B|不等的情况时,未指定物质的k应该如何认定。
例1:对于反应C H3C HO C H4+CO,机理为:C H3C HO k1C H3!+C H O!57∀C H3!+CH3CHO k2C H4+C H3CO!#C H3CO!k3C H3!+CO∃2C H3!k4C2H6试导出总反应的速率方程。
化学动力学

解:由于反应物配料符合化学计量比2pA0=pB0, 所以2pA=pB,代入速率方程得:
-dp/dt=kApA0.5pB1.5 =kApA0.5(2pA)1.5
-dp/dt=21.5kApA2 =kA′pA2
(kA′= 21.5kA )
对二级反应有
1 pA
1 pA0
k At
开始时:p0= 3.36kPa, 2pA0=pB0,, pC0=0, 所以 pA0=p0/3=1.12kPa 反应进行到t时刻时pB=2pA, pC0=pA0-pA
p=pA+2pA+pA0-pA=2pA+pA0 pA=(p-pA0)/2=(2.12kPa-1.12kPa)/2=0.5kPa
指数式:k
Ea
k0e RT
对数式: ln k ln k0 Ea [k] [k] RT
积分式:ln k2 Ea ( 1 1 )
k1
R T2 T1
微分式:
d
ln k /[k] dt
Ea RT 2
A:频率因子,又称指前因子 Ea:活化能
适用于基元和有反应级数 的非基元反应
§ 8-7 活化能
Activation energies
kt 1 ln
CB0CA
CA0 CB0 CA0 (CB0 CA0 CA )
kt
1
ln CB0CA
CA0 CB0 CA0CB
§ 8-4动力学计算举例
例题1:乙酸乙酯皂化反应:
CH3COOC2H5+NaOH→CH3COONa+C2H5OH
(A)
(B)
(C)
(D)
是 二 级 反 应 。 反 应 开 始 时 ( t=0 ) ,A 与 B 的 浓 度 都 是 0.02mol·dm-3, 在 21℃时,反应25min后,取出样品,立即终止反应进行定量分析,测 得溶液中剩余NaOH为0.529×10-2mol·dm-3,问:
《化工原理》第十八讲
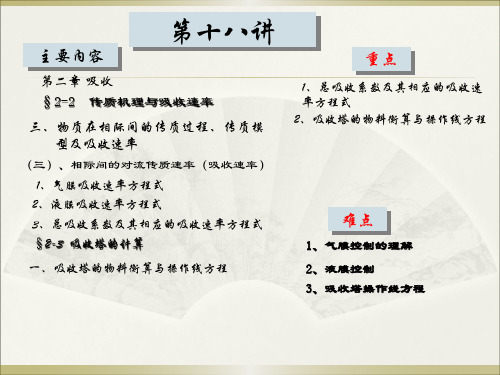
第十八讲
第二章 吸收 §2-2 传质机理与吸收速率
三、物质在相际间的传质过程、传质模 型及吸收速率
(三)、相际间的对流传质速率(吸收速率) 1、气膜吸收速率方程式 2、液膜吸收速率方程式 3、总吸收系数及其相应的吸收速率方程式 §2-3 吸收塔的计算
一、吸收塔的物料衡算与操作线方程
重点
1、总吸收系数及其相应的吸收速 率方程式 2、吸收塔的物料衡算与操作线方程
难点
1、气膜控制的理解 2、液膜控制 3、吸收塔操作线方程
§2-2 传质机理与吸收速率
三、物质在相际间的传质过程、传质模型及吸收速率 (三)、相际间的对流传质速率(吸收速率)
吸收速率
(absorption rate)
吸收的速率决定了吸收操作的生产强度,也是吸收 设备选型和设备设计的重要依据。
1、一相中的传质速率数学描述
NA KX X* X
KX:液相总吸收系数,kmol /(m2 s)
KX KLC
推导ky,kx,Ky之间的关系,并分析气膜控制和液膜控制的简 化公式。
思考:
1、气相总吸收系数有几个及其单位?其相应的推动力怎么表 示?它们之间的关系如何表达? 2、液相总吸收系数有几个及其单位?其相应的推动力怎么 表示?它们之间的关系如何表达?
V,Y2
L,X2
V—
单位时间内通过吸收塔的 惰性气体量,kmol(B)/s
L— 单位时间内通过吸收塔的 溶剂的量,kmol(S)/s
Y1,Y2— 进塔及出塔气体中溶质组分 的摩尔比,kmol(A)/kmol(B)
V,Y1
X1,X2— 出塔及进塔液体中溶质组分
L,X1
的摩尔比,kmol(A)/kmol(S)
化学动力学公式总结

第9章 化学动力学9.1 重要概念、规律和方法1.反应分子数和反应级数反应分子数和反应级数是两个不同的概念。
反应分子数是指在元反应中直接发生碰撞的粒子数,其值只能是1、2或3。
对于复合反应,则没有反应分子数之说。
若速率方程具有幂函数形式,其中幂的次数称为反应级数,它只表明物质浓度对反应速率的影响程度。
级数是纯经验数字,它可以是整数,也可以是分数;可以是正数,也可以是负数,还可以是零。
但是对于元反应而言,其反应级数恰等于反应分子数。
2.关于速率方程速率方程反映浓度对于反应速率的影响。
它是研究反应动力学唯观规律及微观机理的基础,是化学反应动力学性质的综合体现。
速率方程具有微分和积分两种形式,其实后者是前者的解,所以关键是微分式。
在确定反应级数或进行其他定量处理时,一定要写出速率方程微分式的具体形式7这才能为正确解决问题奠定基础。
在动力学实验中,为了使速率方程曲形式简化,,常采用以下两种原料配方:①按计量比投料。
例如,若反应A 十2B 十3C →p 的速率方程为 。
当按计量比投料时 ,则速率方程可简做成 ;②—种反应物初始浓度远小于其他反应物。
例如在上例中初始浓度a ,b ,c 满足a«b 且a«c ,则反应过程中c B ≈b ,c C ≈c ,于是速率方程简化为γβαC B A A c c kc dt dc =−/c c c ==k c k dt dc 3/==−+γβαγβC B A 3121'2n A A A c + ααγβAA A c k c c kb dt dc ''/==−总之,特定的配方往往能把一个多元幂函数简化成一元函数,结果将一个复杂问题变得简单。
在知道反应级数之后,动力学讨论或处理问题的基本程序为:①列出速率方程;②解微分方程;③由解出的结果讨论反应特点。
只要掌握这种处理方法,可以自行讨论各种级数的反应。
应该指出,动力学中的一些公式和规律往往是以特定的速率方程为前提的。
第七章 动力学 公式归纳
第七章动力学1.化学反应速率对定容条件下的化学反应aA + dD →gG + hH化学反应速率2.化学反应速率方程(动力学方程):对基元反应: a A + b B + ··· ···→产物质量作用定律a +b + ··· ------反应级数零级反应r=k ,k的量纲为mol.L-1.s-1一级反应r=kc,k的量纲为s-1;二级反应r=kc2 ,k的量纲为(mol·L -1)-1 ·s-13.经验速率方程复合反应a A + b B + ··· ···→产物经验速率方程k ---- 速率常数;有量纲。
nA、nB。
----- A物质、B物质的分级数。
n = nA + nB + ···----- 反应级数;4.简单级数反应的特征(重要)5. van’t Hoff 温度每升高10℃,反应速率大约增加2~4倍=2~4Arrhenius经验公式(1). 微分形式(2). 不定积分形式(3). 定积分形式(4). 指数形式C --- 积分常数 T :KR = 8.314 J / K·mol E a ---- 活化能 (J / mol) ;A--- 指前因子或频率因子(与k 的单位相同) 6.--- 活化分子的平均能量;--- 反应物分子的平均能量; J / mol --- 1mol 具有平均能量的分子变成活化分子所需要的最低能量; J / mol复合反应及近似处理(作参考,会自己推导)一.对峙反应(可逆反应) 1-1级反应达平衡时A 、B 的平衡浓度:二.平行反应A 物质消耗的总反应速率为: 积分得:三.连串反应 反应四. 链反应。
*E rE a E。
The Kinetics and Mechanisms of Chemical Reactions
The Kinetics and Mechanisms ofChemical Reactions化学反应的动力学和机理化学反应是物质发生变化的过程,而化学动力学则研究这种变化的速率和规律。
化学反应的动力学和机理对于掌握化学基础知识具有重要意义。
本文将对化学反应动力学和机理进行深入探讨。
一、化学反应动力学化学反应动力学主要研究化学反应的速率、反应动力学方程式的推导以及反应动力学的参数等内容。
1. 变化速率一个化学反应的速率可以通过初始反应速率确定。
对于反应物为A和B,产物为C和D的反应,初始反应速率可以表示为:v = –Δ[A]/aΔt = –Δ[B]/bΔt = Δ[C]/cΔt = Δ[D]/dΔt其中,Δ[A]和Δ[B]是指反应物A和B的摩尔数的减少量,Δ[C]和Δ[D]是指产物C和D的摩尔数的增加量,a、b、c和d是分别表示反应物和产物的反应系数。
2. 动力学方程和反应级数化学动力学反应方程是根据实验数据而推导出来的数学模型。
如果一个反应的速率与反应物A的浓度的一阶幂成正比,则反应的动力学方程为:v = k[A]其中,k(反应速率常数)是一个实验值,它表示在反应中每单位浓度的反应物A下,单位时间内形成单位量的产物B的速率。
如果一个反应物A的反应速率与其浓度的n次幂成正比,则反应的动力学方程可以表示为:v = k[A]^n这种化学反应被称为n级反应,其中n就是反应的级数。
3. 反应速率与温度化学反应的速率不仅与反应物的浓度和反应级数有关,而且还与温度有关。
反应速率随着温度的升高而增加,因为温度升高会增加反应物的动能,导致更多分子碰撞,从而加速反应速率。
因此,当我们在做化学实验时,需要控制温度以保证实验结果的精确性。
二、化学反应机理化学反应机理是指反应物在反应过程中的分子、离子、电子和原子之间的运动、变化和转移。
每一个化学反应都有一个独特的反应机理。
1. 元反应和反应中间体元反应是指反应机理中最小的单分子步骤。
化工原理电子课件北京化工大学.ppt
北京化工大学化工原理电子课件
以逆流为例推导 tm
假设:1)定态传热、定态流动,G1、 G2一定 2)cp1、cp2为常数,为进出口平均温度下的
3)K沿管长不变化。 4)热损失忽略不计。
tm
t1 t2 ln t1
t2
16
t1 T 1t2
t2 T2 t1
返回
T1
t1
t t2
北京化工大学化工原理电子课件
A dl
1 1 b d1 1 d1
K1 1 dm 2 d2
6
返回
北京化工大学化工原理电子课件
式中 K1——以换热管的外表面为基准的总传热系数;
dm——换热管的对数平均直径。
dm
(d1
d 2 ) / ln
d1 d2
以内表面为基准: 1 1 d 2 b d 2 1 K2 1 d1 dm 2
G1,T1
G2,t1
t2
dA T2
2
返回
北京化工大学化工原理电子课件
T Tw
冷 流 体
Q
热
tw
流
体 t
对流 导热 对流
•热流体
Q1 对流
固体壁面一侧
•固体壁面一侧
Q2 热传导
另一侧
•固体壁面另一侧
Q3 冷流体
对流
dQ KdA(T t)
3
返回
北京化工大学化工原理电子课件
(1)管外对流
dQ1 1dA1(T Tw )
4)当t1=t2
tm t1=t2
19
返回
北京化工大学化工原理电子课件
2、错流、折流时的 tm
tm t 'm
t
' m
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2) 链传递 (chain propagation):自由基与分子反应 产生新自由基。比分子间反应容易,活化能较 低。上例Ⅱ、Ⅲ。
生成一个或几个新的自由基
(3) 链终止 (chain termination):断链,E=0。上例Ⅳ。
自由基本身复合为分子,使链中止,第四步是销毁自由基的过 程,自由基的销毁必须有第三体转移能量,这可以是气相其 它分子,也可以是器壁,因此有气相销毁和器壁销毁之分。
Ea E3 U1 U 2
由此可见,复合反应的表观活化能是各种能量的
某种组合.
上一内容
下一内容 回主目录 返回
2016/4/21
例3、 平行一级反应
A
k1
B
k2
C
k=k1+k2 , 其活化能分别为E1, E2 试证明
k1E1 k2 E2 Ea k1 k2
1 d (k1 k 2 ) E d ln k 1 dk a 证: 2 (k1 k 2 ) dT RT dT k dT
[Cl] ?
d[Cl ] 2k1[Cl 2 ] k 2 [Cl][H 2 ] dt
k3[H][Cl2 ] - 2k4 [Cl]
2 (1)
d[H ] k2 [Cl][H 2 ] - k3[ H][Cl 2 ] (2) dt
上一内容
下一内容 回主目录 返回
2016/4/21
d [ p] r k3 [ E ] dt
上一内容
下一内容 回主目录 返回
2016/4/21
平衡浓度法:r1=r-1, r2=r-2 , (1)A + B C (2)C + D E (3)EF [C]= K1[A][B] [E]= K2[C][D]= K1 K2[A][B][D] ∴r = k3K1 K2[A][B][D] = k[A][B][D] 其中 k=k3 K1 K2
则上例: 即
k1 [Cl] k 4
12
(1) (2)
[Cl2 ]1 2
代入原方程
其中
上一内容
k1 d[ H 2 ] k2 dt k4
12
[Cl2 ]1 2 [ H 2 ] k [Cl2 ]1 2 [ H 2 ]
12
k1 k k2 k 4
作业(第四版)第十一章 43,44, 46
第五版 第十一章 44,45,47 预习: 第十一章 11.10
11.11 11.12
上一内容
下一内容
回主目录
返回
2016/4/21
四、复合反应速率近似处理法
速率方程由机理决定,可根据机理推导速率方程。 1、选取控制步骤法(速率决定步骤)
连串反应总速率等于最慢的一步的反应速率。
上一内容
下一内容 回主目录 返回
2016/4/21
1. 链反应的特点: 每一步均与自由基有关。自由基在反应过程中不 断再生,使反应得以自动维持。Free radical:高 活性,短寿命。 例如 Ⅰ Ⅱ H2 + Cl2 Cl2
k1
2HCl 机理为: 2Cl·
Cl· + H2
H· + Cl2
∵ k-1>>k2,即 k-1 + k2[H2]≈k-1 ∴
上一内容
1 d[HI] 2 dt
k1k2 [I2 ][H2 ] k [I2 ][H2 ] k1
返回
2016/4/21
下一内容
回主目录
由此可见:平衡假设与稳态假设统一,稳态假设是 根本,平衡假设是稳态假设的特例。
4. 由机理推导速率方程时应注意的问题
物理爆炸: 气体压缩;液体急剧气化等,超 过容器的耐压限
爆炸
化学爆炸:
热爆炸:强烈的放热反应 如:黄色炸药;爆竹 支链爆炸:有一定T、p范围 如:爆鸣气H2:O2=2:1
上一内容下一内容来自回主目录返回2016/4/21
H2和O2混合物爆炸区与T、p关系:
其中: 第一爆炸限几乎与温度无关,与容器大小有关; 第二爆炸限与温度有关,与容器大小无关; 第三爆炸限以上为热爆炸,是 H2 +O2 反应所特有。 上一内容 下一内容 回主目录 返回
例1:A+B→C→D→E
慢 快 快
例2:A+B↔C→D→E→F
快 慢 快 快
上一内容
下一内容
回主目录
返回
2016/4/21
稳态假设和平衡假设
例如
测得 机理:
H2 + Cl2
2HCl
1 d[H2 ] k [Cl2 ] 2 [H2 ] dt
Cl2
k1
2Cl·
k2 k3
Cl· + H2 H· + Cl2
2016/4/21
上一内容
下一内容
回主目录
返回
2016/4/21
例1
A
某复合反应,其反应机理
k+ kC, B+C k2 P
其中C是非常活泼的中间产物,试用稳态法导出其 总反应速率公式 k 2 k [ A][B] d [ P] k 2 [ B][ C ] 解: r k k 2 [ B] dt
d [C ] k [ A] k [C ] k 2 [ B][ C ] 0 dt k [ A] [C ] k k 2 [ B]
当k-<<k2[B]时,表现为一级;反之,表现为二级
上一内容
下一内容 回主目录 返回
2016/4/21
例 2 ( 1) A + B C K1 U1 (2)C +D E K2 U2 ( 3) E → F k3 E3 ( 4) F → P k4 E4 (3)为速率控制步骤,试导出其总反应速率公式和表 观活化能 解:因为(3)是速率控制步骤,所以
k2
k3
HCl + H·
HCl + Cl·
Ⅲ
Ⅳ
上一内容
……………………………
2Cl· + M
k4
Cl2 + M
返回
2016/4/21
下一内容
回主目录
2. 链反应的步骤: (1) 链引发 (chain initiation):产生自由基,活化能 大 (∵需要拆断化学键)。上例Ⅰ。
引发方式:热引发,引发剂引发,辐射引发等
HCl + H· HCl + Cl· Cl2 + M
返回
2016/4/21
2Cl· + M
上一内容
下一内容
k4
回主目录
机理:
Cl2
k1
2Cl·
k2
Cl· + H2 H· + Cl2
HCl + H· HCl + Cl·
k3
k4
2Cl· + M
则
Cl2 + M
d[H 2 ] k2 [Cl][H 2 ] dt
2
k1k 2 [ A] r kW k g
2
但在支链反应中, α >1,故k2[A](1- α)这一项为 负值,当α大到使k2[A](1- α) – (kW +kg ),则上 式的分母接近零,此时,反应速率趋于无限大, 即发生爆炸。
上一内容
下一内容 回主目录 返回
2016/4/21
支链爆炸(branch chain-explosive reactions)
k1E1 k2 E2 Ea k1 k2
上一内容
下一内容 回主目录 返回
2016/4/21
六 单分子反应机理(First-order reactions)
单分子反应也符合阿累尼乌斯方程,也需要有一个活 化过程,其活化反应机理如下: k1 k2 A+A A*+A A* P k-1 反应速率为:dCP/dt=k2CA* A*为活化分子可用稳态法处理: dCA*/dt=k1CA2-k-1CACA*-k2CA* =0
支链:
上一内容
下一内容
回主目录
返回
2016/4/21
假设发生下列链反应:
链引发:
链传递: 链终止:
A R
k1
RA P R
k2
稳态法:
R kg R
kW
在器壁表面销毁
在气相销毁
d [ R] k1[ A] k 2 [ R][ A] k 2 [ R][ A] (kW k g )[ R] 0 dt
2
1 d[HI] 2 dt
上一内容
下一内容
k1k2 [I2 ][H2 ] k [I2 ][H2 ] k1
回主目录 返回
2016/4/21
机理
I2
k1 k-1
2I
k2
快
2HI 慢
2I + H2
1 d[HI] [I] ? k2 [I ]2 [H 2 ] 2 dt d[I ] 2k1[I 2 ] - 2k1[I ]2 - 2k2 [I ]2 [H 2 ] 0 稳态假设 dt k1[I2 ] 1 d[HI] k1k2 [I2 ][H2 ] 2 [I ] 即 ∴ 2 dt k k [H ] k1 k2 [H2 ] 1 2 2
2. 稳态假设:
当反应达稳定后,高活性中间产物的浓度不 随时间而变化。
d[H 2 ] k2 [Cl][H 2 ] dt d[Cl ] 2k1[Cl2 ] k2 [Cl][H 2 ] dt k3[H][Cl2 ] - 2k4 [Cl]2 0 d[H ] k2 [Cl][H 2 ] - k3[ H][Cl 2 ] 0 dt (2)代入(1): 2k1[Cl2 ] - 2k4[Cl]2 0
