第六章 络合滴定(zcl)
第6章络合滴定黎

螯合物的稳定性高,是应用最广泛的络 合物,用作滴定剂、掩蔽剂和显色剂等。 分析中重要的螯合剂类型:
HEBEI NORMAL UNIVERSITY, College of Chemistry & Material Science
分析中重要的螯合剂类型
“OO型”螯合剂
O C -O H
H C -O H H C -O H
6.1.4 EDTA的螯合物
络合反应 M2+ +Y4-
EDTA络合物特点:
MY2-
(1)含有氨氮和羧氧配位原子,几 乎能与大多数金属离子配位。 (2)稳定性高:络合物中含多个5员 环
HEBEI NORMAL UNIVERSITY, College of Chemistry & Material Science
学习要求
1.了解络合滴定法的基本知识 2.掌握络合滴定法的基本概念及有关
计算 3.掌握络合滴定法的原理 4.掌握络合滴定法的实际应用
HEBEI NORMAL UNIVERSITY, College of Chemistry & Material Science
6.1分析化学中常用的络合物
6.1.1简单络合物
含硫螯合剂:“SS型”
例:二乙氨基二硫代甲酸钠(铜试剂)
C2H5
S
N-C
C2H5
SNa
C2H5
S
N-C
C2H5
S
1 2
Cu
含硫螯合剂:“SO型”
例:巯基乙酸
O C -O H H 2C -S H
O C-O
H2C -SH
1 2
Cd2+
HEBEI NORMAL UNIVERSITY, College of Chemistry & Material Science
第六章络合滴定法作业答案

第六章 络合滴定法作业答案4. 已知乙酰丙酮(L )与Al 3+络合物的累积形成常数lgβ1~lgβ3分别为8.6,15.5和21.3,AlL 3为主要型体时的pL 范围是多少?[AlL]与[AlL 2]相等时的pL 为多少?pL 为10.0时铝的主要型体又是什么? 解:因为由相邻两级络合物分布曲线的交点处有 pL=lgKiAl 3+ === AlL === AlL 2 === AlL 3 pL 8.6 6.9 5.8 ① AlL 3为主要型体时,∴pL<5.8② ][][2AlL AlL = 时, 9.6lg 2===K pL ③ 6.80.10>=pL ∴ Al 3+为主要型体。
5. 铬蓝黑R(EBR)指示剂的H 2In 2-是红色,HIn 2-是蓝色,In 3-是橙色。
它的pK a2=7.3,pK a3=13.5。
它与金属离子形成的络合物MIn 是红色。
试问指示剂在不同的pH 范围各呈什么颜色?变化点的pH 是多少?它在什么pH 范围内能用作金属离子指示剂?解:由题-=-=35.1324.7232In HIn InH a a pK pK(红色) (蓝色) (橙色) 根据指示剂的变色范围:pH=pKa±1 (1) pH ≤pKa 2-1=7.4-1=6.4, 显H 2In -的颜色(红色) pH ≥pKa 2+1=7.4+1=8.4, 显HIn 2-的颜色(蓝色) pH ≤pKa 3-1=13.5-1=12.5, 显HIn 2-的颜色(蓝色) pH ≥pKa 3+1=13.5+1=14.5, 显In 3-的颜色(橙色)pH=6.4~8.4,显混合色(红色和蓝色) pH=12.5~14.5,显混合色(蓝色和橙色) (2) 变色点的pHpH=7.4 (红色→蓝色) pH=13.5 (蓝色→橙色)(3) pH=8.3~12.5指示剂显蓝色,而MIn 显红色,颜色变化明显,可用作金属离子指示剂。
分析化学 第6章 络合滴定 c 混合离子选择滴定络合滴定应用.ppt
M+ Y
MY
H+
.H.Y.
HmY
N NY A
N ( A)
H+
Y (N ) 1 K NY [N ]
K NY CN
考虑掩蔽剂A的酸效应
Y+ N
NY
A
N..A.
H+
Y (N ) 1 K NY [N ] K NY CN / N ( A)
[A] [A]
A(H) 1
[ A']
H i
[
H
]i
[A] [HA] .... [HmA] [A]
掩蔽指数:衡量掩蔽效果的参数
N ( A) 1 i[ A]i
影响掩蔽效果的因素:
掩蔽剂与N形成的络合物的稳定性:β i越大,掩蔽效果越好 掩蔽剂的平衡浓度[A]越大,掩蔽效果越好
溶液的酸度:酸效应使[A]减小,酸度越大,掩蔽效果越差
10.滴定终点误差的计算
先求出pM '
pM
' ep
pM
' sp
Et%
10pM ' 10pM '
K
' MY
CMsp
100%
11.利用络合掩蔽进行选择滴定的计算
络合掩蔽选择滴定
M+ Y
MY
Y (N ) 1 K NY [N ] K NY CN / N ( A)
H+
.H.Y.
mol / L, Et = ?
lg KZnY lgK CdY16.5
解: CdI42- 的lg 1~lg4分别为2.4, 3.4, 5.0, 6.2
六、络合滴定

例如: [Zn(NH 3 ) 4 ]
2
K 总稳 4 K 稳1 K 稳 2 K 稳 3 K 稳 4
1
15 K 总不稳
4.络合物MLn的逐级离解平衡
ML n ML ( n 1) L ; K 不稳1 [ML n 1 ][L] [ML n ] [ML n 2 ][L] [ML n 1 ]
9
EDTA-M螯合物的立体结构(多个五元环)
M
10
11
2.EDTA的特点 H2Y2• EDTA具有广泛的络合性能,几乎能与所有的金属离子 形成络合物; • EDTA与金属离子形成的络合物的络合比简单,在一般 情况下,多为1:1;
• EDTA与金属离子形成的络合物大多数带电荷,因此能 溶于水,反应迅速;
子形成螯合物。螯合物由中心离 H2C 子和多基配位体所形成的,络合
H2 N CH2 CH2
物呈环状结构。
螯合物分级络合现象很简单, 稳定性高。
H2C N H2 N H2
螯合剂对金属离子具有一定
选择性。
乙二胺---铜
3
※三、 乙二胺四乙酸(EDTA)
1.EDTA性质:含有羧基和氨基的螯合剂,能与许多 硬酸、中间酸以及软酸型阳离子形成稳定络合物。
33
b. 共存离子效应
不考虑其它因素影响,只有N影响主反应
M
+
N
Y
MY
共存离子效应
NY
34
[NY]
共存离子效应系数:
[N] [Y]
1 K NY [N]
K NY
Y(N)
[Y] [Y]
[NY] [Y] [Y]
[Y]是 NY的平衡浓度与游离的 Y 平衡浓度之和 [N]是 N 的平衡浓度
第6章 配位滴定法

效应 效应 配位效应
EDTA 副反应
混合配 位效应
不利于主反应进行
利于主反应进行
提出问题: 用什么来表示副反应对主反应的影响呢?
为了表示副反应对主反应的影响,定量
表示副反应进行的程度,引入副反应系数α
副反应系数的定义式:
=未参加主反 该应 组组 分分 的的 平各 衡型 浓体 度的总浓度=XX
6.3.1副反应系数(α)
[Y ] [N1Y ] [N2Y ] [NnY ] [Y ]
Y Y (H ) Y (N1) Y (N2 ) Y (Nn ) n
当n=1时:
Y Y (H ) Y (N) 1 (二)金属离子的副反应及αM
1.辅助配位效应 由于其他配位剂存在使金属离子参加主反
应能力降低的现象
2.αM(L)
i
[MLi ] cM
[M]
i [M ] [ L]i (1 i[L]i )
i [ L]i
(1 i[L]i )
铜氨络合物各种型体的分布
1.0
0.8
Cu2+
Cu(NH3)42+
分布系数
分 布 0.6
Cu(NH3)22+
分 数
0.4 Cu(NH3)2+
Cu(NH3)32+
0.2
0.0
654321 lgK1-4 4.1 3.5 2.9 2.1
4.金属离子M的总的副反应系数
A若存在n种配位副反应: αM
M
M M
M(L1
)
M(L2
)
M(Ln
)
(n
1)
B若存在2种配位副反应:
练习:
M
M M
M(L1
络合滴定 分析化学课件

[MLn] n=K1K2 ·Kn= · · [M][L]n
表示络合物与
配体之间的关系
2 溶液中各级络合物的分布
M + L = ML ML + L = ML2
● ● ●
[ML] = 1 [M] [L] [ML2] = 2 [M] [L]2
● ● ●
MLn-1 + L = MLn
[MLn ]= n [M] [L]n
1=K1= 1010.26
2=K1K2= 1016.42
+
Y2- + H+ =
Y-
3=K1K2K3= 1019.09
4=K1K2K3K4= 1021.09 5=K1K2..K5= 1022.69 6=K1K2..K6 = 1023.59
H3
Y-
+
H+ = H4Y
H+ = H5 Y+
计算:pH=3.0、5.0时的lg ZnY(H), KZnHY=103.0
pH=3.0, αZnY(H)=1+10-3.0+3.0=2 , lgαZnY(H)= 0.3 pH=5.0, αZnY(H)=1+10-5.0+3.0=1, lgαZnY(H)= 0
2 条件稳定常数
[MY'] MY KMY = =KMY [M'][Y'] M Y
[H+][H4Y] [H5Y]
= 10-1.60
[H+][H3Y] Ka3= = 10-2.00 [H4Y] [H+][H2Y] Ka4= = 10-2.67 [H3Y]
H2Y2- =H+ + HY3HY3- =H+ + Y4-
第6章-络合滴定法
“络合滴定法”思考题及习题(1)络合物的组成有何特征?举例说明。
(2)举例说明下列术语的含义:(a)配体与配位原子;(b)配位数;(c)单齿配体与多齿配体;(d)螯合物与螯合剂。
(3)什么叫络合物的稳定常数和不稳定常数?二者关系如何?(4)什么叫络合物的逐级稳定常数和络合物累结稳定常数?二者关系如何? (5)螯合物与简单络合物有什么区别?形成螯合物的条件是什么?(6)乙二胺四乙酸与金属离子的络合反应有什么特点?为什么单齿络合剂很少在滴定中应用? (7)何谓络合物的条件稳定常数?是如何通过计算得到的?对判断能否准确滴定有何意义? (8)酸效应曲线是怎样绘制的?它在络合滴定中有什么用途?(9)何谓金属离子指示剂?作为金属离子指示剂应具备哪些条件?它们怎样来指示络合滴定终点?试举一例说明。
(10)pH=10时,Mg 2+和EDTA 络合物的条件稳定常数是多少(不考虑水解等反应)?能否用EDTA 溶液滴定Mg 2+?(11)在0.1mol/L Ag –CN -络合物的溶液中含有0.1mol/L CN -, 求溶液中Ag +浓度。
(12)在pH9.26的氨性缓冲液中,除氨络合物外的缓冲剂总浓度为0.20mol/L ,游离的C 2O 42—浓度为0.10mol/L 。
计算Cu 2+的αcu 。
(已知Cu(Ⅱ)—C 2O 42-络合物的lg β1 = 4.5, lg β2 = 8.9,Cu(Ⅱ)—OH —络合物的lg β1= 6)解:()()()22423-++=--OH Cu o c Cu NH Cu Cu αααα,()[]ii i NHCu NH 35113∑=+=βα[][]101010''3106.5105.5106.520.0333---⨯+⨯⨯⨯=+⨯==a a NH NHNH K H K C C NH δ=0.10(mol ·L -1)()586.12432.13302.11298.7131.41010101010101010101013-----⨯+⨯+⨯+⨯+⨯+=NH Cu α36.986.732.902.898.531.31010101010101=+++++=[]29.815.421242)(101010101122--=-⨯+⨯+=+=∑ii i O C Cu o c βα9.69.65.31010101=++=()28.174.4611010101][1=⨯+=+=---OH OH Cu βα(13)已知[M(NH 3)4]2+的lg β1~ lg β4为2.0,5.0,7.0,10.0,[M(OH)4]2-的lg β1~ lg β4为4.0,8.0,14.0,15.0。
02第6章-络合滴定法-滴定曲线
[M' ]sp
C M , sp K MY
化学计量点后
[MY] CM MY + Y′ [M' ] [Y]K MY [Y]K MY
EDTA滴定同浓度的Zn2+的滴定曲线
12 10 8
pM'
6 4 2 0 0 50 100 150 200
pM= ‒lg[M]
T/ %
化学计量点计算
Et . ( 查表(pMg)t=5.4 )
解: lgKMgY=lgKMgY -lgY(H) = 8.7- 0.5 = 8.2
(pMg)sp=
1 (lgK' MgY 2
+pcsp)= (8.2+2.0)/2=5.1
pMg = 5.4- 5.1= 0.3
Et =
100.3 - 10-0.3 (10
2' [Zn ] 2 [Zn ] αZn
lg Zn (7.0 3.2) 10.2 pZnsp pZnsp
[Y ] [Y ] Y
得
lg Y pYsp =pYsp (7.0 1.4) 8.3
pYsp pZn sp
滴定突跃计算
sp前, 按剩余M 浓度计. sp后, 按过量Y 浓度计.
黄绿
红 Bi3+ Pb2+ Zn2+ Fe3+ 紫红 红 Ca2+
[1-(2-吡啶偶氮)2-萘酚] (PAN)
(CuY-PAN)
紫红
紫红
Cu2+
Co2+ Ni2+
2. 指示剂的变色点:(pM)t
指示剂一般为有机弱酸
M + In K MIn K MIn MIn K MIn K' MIn M In In H 当[MIn]=[In]时, K'MIn=
第06章 络合滴定法
[M] [ML] [ML n ] [M] [M(OH)] [M(OH)2 ] [M(OH)n ] [M]
[M]
[M]
[M]
M(L) M(OH ) 1 M(L) M(OH )
6.3.1 副反应系数
3. 络合物 MY 的副反应及副反应系数 αMY:
6.4 滴定法的基本原理
6.4.3 滴定误差
6.5 准确滴定和分别滴定判别式
6.5.1 准确滴定判别式
6.5 准确滴定和分别滴定判别式
6.5.2 分别滴定判别式
6.6 络合滴定中酸度的控制
6.6.1 单一离子络合滴定的适宜酸度范围
6.6 络合滴定中酸度的控制
6.6.2 分别滴定的酸度控制
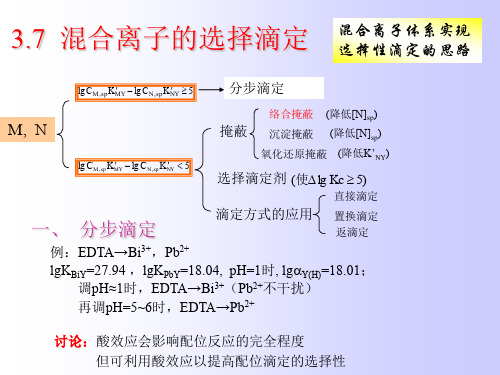
6.7 提高络合滴定选择性的途径
本课程的学习方法
• 预习,听讲,做好笔记(记录笔记及整理笔记) • 学会自学,做好作业,不许无故缺交或迟交作业 • 做好实验,发挥实验在学习中的作用 • 充分利用网络资源
本课程的考核方法
• 平时考核:预习、笔记及作业 —— 10% • 期末考试:笔试 —— 90%
第 六 章 络合滴定法
• 6.1 分析化学中常见的络合物 • 6.2 络合物的平衡常数 • 6.3 副反应系数和条件稳定常数 • 6.4 络合滴定法的基本原理 • 6.5 准确滴定和分别滴定判别式 • 6.6 络合滴定中酸度的控制 • 6.7 提高络合滴定选择性的途径 • 6.8 络合滴定方式及其应用
6.7.1 络合滴定掩蔽法
6.7 提高络合滴定选择性的途径
6.7.2 沉淀掩蔽法
6.7 提高络合滴定选择性的途径
6.7.3 氧化还原掩蔽法
6.7 提高络合滴定选择性的途径
第6章 络合滴定法
K a3
c(H+ ) c(H3Y-) c(H4Y )
102.0
H3Y- ⇌ H+ + H2Y 2-
K a4
c(H+ ) c(H2Y2- ) c(H3Y- )
102.67
H2Y2- ⇌ H+ + HY 3HY3- ⇌ H+ + Y 4-
K a5
c(H+ ) c(H Y3-) c(H2Y2- )
上述实验表明无自由NH3和Cu2+存在,有自由SO42-存在
2019/11/1
Analytical Chemistry
上一页 下一页
材料科学与化学工程学院
1913年瑞士人维尔纳因为在配位理 论上的贡献获得诺贝尔化学奖
配位键——空轨道与孤对电子作用
内界 [Cu(NH3 )4 ]SO4 外界
中心离子 配位原子 配位体 配位数(配体数目)
2019/11/1
Analytical Chemistry
上一页 下一页
3.“NO”型螯合剂
材料科学与化学工程学院
这类螯合剂含有N和O两种配位原子。如氨基乙酸
NH2CH2COOH、氨基丙酸CH2CH(NH2)COOH、邻 氨基苯甲酸等。氨基乙酸根离子与Cu2+形成的螯合物
如下式表示:
OCO
Cu
H2 N CH2
② 影响因素 A. 内因:电荷、半径、电子层结构。
B. 外因:酸度、副反应等。
2019/11/1
Analytical Chemistry
上一页 下一页
材料科学与化学工程学院
2、MLn型络合物的累积稳定常数
M+L
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
……
[MLi ] [MLi -1 ][L]
1 K '1 Kn
n Ki
i 1
n
累积稳定常数与平衡浓度的关系 多元络合物 lg n
M nL ML n
[MLi ] Ki [MLi -1 ][L]
lg Ki
i 1
n
MLi-1 L MLi
i 1 K '( ni 1) i K j Ki j 1
分析化学
主讲人:张存兰
第六章 络合滴定法
Chapter6 ComplLeabharlann xation titrations
• • • • • • • • 6.1分析化学中的常见络合物 6.2 络合物的平衡常数 6.3 副反应系数和条件稳定常数 6.4 金属离子指示剂 6.5 络合滴定法基本原理 6.6 络合滴定中酸度的控制 6.7 提高络合滴定选择性的途径 6.8 络合滴定方式及其应用 幻灯片4 幻灯片15 幻灯片29 幻灯片58 幻灯片71 幻灯片105 幻灯片125 幻灯片145
i [L] i ) i 1
i
据物料平衡:
cM [M]( 1
n
[ MLi ] i [ M][L ] i i cM [ M ](1 i [L ] )
i [L ] i 1 i [L ]
i
铜氨络合物各种型体的分布
1.0 0.8
分布系数
分 0.6 布 分 0.4 数
Ê Ï ý ² µ ²¼ Ö
lg K1 lg 1 4.7 lg K 2 lg 2 lg K1
0.8 0.6 0.4 0.2 0.0 6 5 4 3 2 1 0
7.7 4.7 3.0
lgK1 lgK2 lg K1 lg K 2 pL pL lg K 2 2 2)[AgL2]存在的主要范围, 4.7 3.0 3.0 3.85 pL lg K 2 3.0 2
第一节 分析化学中的常见络合物
一、络合滴定法定义
• 以络合反应为基础的一种滴定分析法。 • M+L ML K形或K稳 K稳=[ML] / [M][L] 二、无机络合剂与有机络合剂 • 1.单基配位体:提供一对电子以形成配价 键 的配位体。如:NH3、H2O、F- 等。 • 2.多基配位体:提供两对或更多对电子以 形成配价键的配位体。乙二胺等。 • 3.螯合物:多基配位体与同一个接受体形 成的具有环状结构的化合物。
1)[AgL]最大时,
六、平均配位数 n ——生成函数
c L [ L] n cM
推导过程(自学)
n
i [L]
i 1 i n i 1
n
i
1 i [L]
i
n f ([L], i )
平均配位数
据物料平衡:
cL [L] [ML] 2[ML2 ] .... n[MLn ]
Cu2+ Cu(NH3)42+ Cu(NH3)22+ Cu(NH3)32+
0.2 0.0
Cu(NH3)2+
6
lgK1-4
5
4.1 3.5 2.9
4
3
2.1
2
1
0 pNH3
例题
已知乙二胺(L)与Ag+形成的络合物lg1 和lg2分别为 4.7, 7.7。当[AgL]为最大值时的pL为多少?;AgL2为 主要型体时的pL范围是多少? 解: 1.0
N
..
O C
H2C
O
..
H2C N O C O
O CH2 CH2 Ca CH2 O C O O C CH2 O N
Ca-EDTA螯合物的立体构型
O C H2C N H2C C O O O C O Ca O O H2 C CH2 N CH2 C CH2 O
续前 EDTA络合物特点:
1.广泛,EDTA几乎能与所有的金属离子形成络合物; 广泛络合性→五元环螯合物→稳定、完全、迅速
乙二胺
H N CH2 CH2 +
N CH2
+ N H
CH2
CH2COO
-
CH2COOH
N
酸性 EDTA性质 配位性质 溶解度
EDTA(乙二胺四乙酸)结构 H H OOCH2C H N
+
-
CH2
CH2
H N
+
CH2COO
-
两个氨氮 四个羧氧
HOOCH2C
双极离子 乙二胺四乙酸:EDTA(结构) H4Y H6Y2+
比较酸的分布分数:
i [L ]i 1 i [L ]i
i f ( K a , pH )
cM [M] [ML] [ML 2 ] .... [ML n ]
cM [M] 1[M][L] 2 [M][L] 2 .... n [M][L ]n
B nH H n B
[Hi B] i [B][H]
四、质子化常数
[MLi ] i [M][L] [Hi B] i [B][H] 质子络合物: B nH H B [H n B] n n [H n-1B][H]
逐级质子化
i
i
逐级质子化
B H HB
pH < 1 强酸性溶液 → H6Y2+
pH 2.67~6.16 → 主要 H2Y2pH > 10.26碱性溶液 → Y4- 最佳配位型体
配位性质
EDTA 有 6 个配位基
HOOCH2C -OOCH2C
H N CH2 CH2 +
+ N H
CH2COO
-
CH2COOH
O C
2个氨氮配位原子 4个羧氧配位原子
累积稳定常数
[MY] K1 [M][Y]
多元络合物: 逐级络合
M L ML
M nL ML n
稳定常数
K1 [ML] [M][L]
……
MLi -1 L MLi K i
1 K1
i K j
j 1 i
[ML n ] MLn -1 L MLn K n [ML n -1 ][L]
分析化学中的络合物
简单配体络合物
螯合物
O H2C C
多核络合物
MLn
ML
O CH2 CH2 Ca O N CH2
MnL
[(H2O)4Fe OH OH
Cu(NH )
2 3 4
H2C N O C O
Fe(H2O)4]4+
O C O C CH2 O
三、 EDTA及其络合物
EDTA 乙二胺四乙酸
HOOCH2C -OOCH2C
M nL ML n
按分布分数定义:
[ML i ] i cM
各级络合物的分布分数(或摩尔分数)
多元络合物 分布分数定义
M nL ML n
[MLi ] [MLi ] i [M][L]i i x(MLi ) cM 据物料平衡: cM [M] [ML] [ML2 ] .... [MLn ]
+ 2 H+
CH2COOH
四元酸
六元酸
EDTA的物理性质 水中溶解度小,难溶于酸和有机溶剂; 易溶于NaOH或NH3溶液—Na2H2Y•2H2O • 溶解度
型体
H4Y Na2H2Y
溶解度 (22 º C)
0.2 g / L 111 g / L, 0.3 mol /L
EDTA的性质 HOOCH2C
质子化常数
H K1
酸离解常数
累积常数
H 1 K1
……
[HB] [B][H]
K an 1H K1
Hi-1B H
Hi B K iH
H K Hn B n
……
Hn-1B H
i 1 [H i B] K H a ( n i 1) K H j [H i -1B][H] Ki i j 1
酸性
H N CH2 CH2 +
-OOCH2C
+ N H
CH2COO
-
CH2COOH
H6Y2+
1.0 pKa1=0.9 0.8
H6Y 2+
pKa2=1.6 H5Y+
H2Y 2-
HY
pKa3=2.07 H4Y H3Y43Y
ý µ Ê ¼ Ï ²² Ö
分 Ka4=2.75 H5Y + 0.6 pKa6=10.34 pKa5=6.24 布 p H2Y2HY3Y4分 H3Y 数 0.4
1 [H n B] K a1 H [H n -1B][H] Kn
n K iH
i 1
n
思考:EDTA情况如何?
二、 五、各级络合物的分布分数(或摩尔分数)
在处理酸碱平衡中,经常要考虑[H+]对各种型体浓 度的影响。
例:
HAc
[HAc ] C HAc
同理,络合平衡也是酸碱平衡,也要考虑络 合剂对络合物各级存在形式分布的影响。 照猫画虎,多元络合物:
MLn型络合物的逐级稳定常数
1 K1 K' n
K总
1 1 K2 Kn K ' n 1 K '1
1 K'总
K 总 K1 K 2 K 2 Kn
K'总 K1 'K'2 K'3 K' n
三、累计稳定常数β
逐级累计稳定(形成)常数 将逐级稳定常数依次相乘即得到逐级累计稳定常数即:
讨论: KMY↑大,配合物稳定性↑高,配合反应↑完全
