热分析动力学
煅烧白云石的热解过程动力学研究

煅烧白云石的热解过程动力学研究白云石(CaCO3)是一种重要的矿石,广泛应用于建材、化工、冶金等领域。
煅烧白云石是将白云石加热至高温,使其发生热解反应,分解为氧化钙(CaO)和二氧化碳(CO2)。
研究煅烧白云石的热解过程动力学,对于优化生产工艺、提高产量和减少能源消耗具有重要意义。
煅烧白云石的热解过程涉及到复杂的化学反应和传质过程。
首先,在加热过程中,白云石逐渐升温,当达到一定温度时,开始发生热解反应。
白云石的热解属于固相反应,在高温下,固体分子之间的键能被打破,进而发生分解。
煅烧过程中,石灰石的结晶结构发生变化,原子重新排列形成氧化钙晶体。
煅烧白云石的热解动力学研究可以通过热重分析(TGA)等实验手段进行。
热重分析是一种常用的热分析方法,可以测定样品在加热过程中的质量变化,从而得到热解过程的动力学信息。
通过热重分析可以获取白云石在不同温度下的失重速率,进而获得热解反应速率常数。
热解反应速率常数(k)是研究煅烧过程动力学的重要参数。
研究表明,热解反应速率常数与温度密切相关。
随着温度的升高,反应活性增加,反应速率常数也随之增加。
在研究过程中,可以通过改变温度,获得不同温度下的热解反应速率常数。
然后,通过对不同温度下的速率常数进行拟合分析,得到温度对速率常数的影响。
进一步,可以利用阿累尼乌斯(Arrhenius)方程拟合实验数据,得到热解反应的活化能。
活化能是指在反应初态到过渡态之间必须克服的能量差,对热解反应过程的研究具有重要意义。
研究显示,热解反应的活化能主要与白云石的结构和矿物形态有关。
低活化能的热解反应可以有效提高煅烧过程的反应速率,减少能耗。
因此,了解并控制煅烧白云石的动力学参数,对于提高生产效率和降低能耗非常重要。
除了实验研究外,数值模拟方法也被广泛应用于煅烧白云石的热解过程动力学研究。
数值模拟方法可以通过建立热解反应的数学模型,模拟煅烧过程中的温度场、浓度场和反应速率等变化规律。
通过对模型进行求解,可以获得热解过程中的动力学参数。
dsc反应动力学

dsc反应动力学
差示扫描量热法(Differential Scanning Calorimetry,DSC)是一种热分析技术,用于测量物质在受控温度升降条件下的热量变化。
DSC可以用于研究物质的热性质、热稳定性、相变行为和反应动力学等。
DSC反应动力学是指利用DSC技术来研究化学反应过程中的速率和热动力学性质。
它通过在DSC仪器中对反应进行加热或冷却,并测量样品的热量变化,来分析反应的速率和热特征。
以下是DSC反应动力学研究中常见的几个参数和方法:
1.反应速率常数(rate constant):可通过DSC测量到的反应
速率数据,利用反应动力学模型计算得到。
反应速率常数
与反应速率成正比,用于描述反应速率的快慢程度。
2.反应活化能(activation energy):是指在化学反应中,为
了使反应发生,需要克服的能垒。
通过分析DSC测得的反
应速率随温度变化的关系(如Arrhenius方程),可以计算
得到反应的活化能。
3.反应级数(reaction order):反应级数描述了反应速率与
反应物浓度之间的关系。
根据DSC测量到的反应速率数据,可以通过拟合将其与反应物浓度相关联,从而确定反应级
数。
4.反应热(reaction heat):反应热是指化学反应过程中释放
或吸收的热量。
DSC可以精确地测量反应热的变化,通过
分析热功率曲线来研究反应的热动力学性质。
通过DSC反应动力学的研究,可以获得关于反应速率、活化能、反应级数和反应热等方面的信息。
这对于理解和优化化学反应机理、控制反应条件以及提升反应工艺效率具有重要的意义。
热分析方法的原理和应用

热分析方法的原理和应用1. 引言热分析方法是一种基于样品在高温条件下发生物理和化学变化的测定方法。
它通过对样品在不同温度下的质量变化、热效应及产物的分析,来研究样品的组成、结构和性质。
热分析方法广泛应用于材料科学、化学、环境科学、药物科学等领域,本文将介绍热分析方法的原理和应用。
2. 热分析方法的分类热分析方法可以分为多个子类,常见的热分析方法有: - 热重分析(TG) - 差热分析(DSC) - 热解气体分析(TGA/EGA) - 差热热膨胀(DTE) - 差热差热膨胀(DTA) - 热导率分析(TGA) - 动态热分析(DTA)3. 热分析方法原理3.1 热重分析(TG)热重分析是通过仪器测量样品在不同温度下质量的变化来分析样品的组成、热分解和气体介质中的吸附或消耗物质等。
原理是将样品在恒定升温速率下进行加热,通过测量质量的变化来分析样品的性质。
3.2 差热分析(DSC)差热分析是通过测量样品和参比物温度的差异来分析样品的热效应和相变行为。
原理是将样品和参比物同时加热,通过测量他们的温度差异来分析样品的热的吸放热、物相转变等。
3.3 热解气体分析(TGA/EGA)热解气体分析是通过测量样品在不同温度下释放的气体来分析样品的组成和热分解行为。
原理是样品在升温过程中,释放出的气体通过气体分析仪器进行分析,从而得到样品的组成信息。
3.4 差热热膨胀(DTE)差热热膨胀是通过测量样品和参比物的膨胀差异来分析样品的热膨胀性质。
原理是样品和参比物同时加热,通过测量他们的长度或体积变化差异来分析样品的热膨胀性质。
3.5 差热差热膨胀(DTA)差热差热膨胀是通过测量样品和参比物的温差和膨胀差异来分析样品的热效应和热膨胀性质的一种方法。
原理是样品和参比物同时加热,通过测量他们的温差和长度或体积变化差异来分析样品的热效应和热膨胀性质。
3.6 热导率分析(TGA)热导率分析是通过测量样品在不同温度下的热导率来分析样品的导热性质。
热分析技术的应用和原理

热分析技术的应用和原理简介热分析技术是一种广泛应用于材料科学、化学工程和环境科学等领域的实验方法。
它通过对材料在不同温度条件下的热行为进行研究,揭示了材料的性质和结构信息,为材料设计、加工和性能评价提供了重要依据。
本文将介绍热分析技术的应用和原理,并重点讨论热重分析和差示扫描量热分析两种常用的热分析方法。
应用热分析技术在许多领域都有广泛的应用,以下是热分析技术的一些典型应用:1.材料性能研究:热分析技术可以用于研究材料的热稳定性、热分解特性以及热变形行为。
通过分析材料在不同温度条件下的质量变化、热吸放能量以及尺寸变化等参数,可以评估材料的热稳定性和热稳定温度范围,为材料的应用提供参考。
2.陶瓷和玻璃制备:热分析技术可以用于研究陶瓷和玻璃材料的烧结行为、相变特性以及热膨胀性能。
通过对材料在升温和降温过程中的质量变化以及热吸放能量进行分析,可以确定陶瓷和玻璃材料的烧结温度范围、烧结速率以及热膨胀系数等关键参数。
3.化学反应动力学研究:热分析技术可以用于研究化学反应的动力学特性。
通过对反应物的热分解过程进行研究,可以确定反应的起始温度、反应速率以及反应的放热或吸热特性。
这些信息对于了解反应机理和优化反应条件具有重要意义。
4.环境污染的监测与控制:热分析技术可以用于监测和分析环境样品中的有机物和无机物。
例如,热重分析可以用于测定大气颗粒物中的有机物和无机物的含量分布和热解特性,从而评估空气中的污染程度并制定相应的治理措施。
原理热分析技术的原理主要基于材料在不同温度条件下的热行为。
根据热量传递的方式不同,热分析技术可分为热重分析和差示扫描量热分析两种常见方法。
热重分析(Thermogravimetric Analysis, TGA)热重分析是一种通过测量材料在升温过程中的质量变化来研究材料热行为的方法。
其原理基于样品在升温过程中发生物理变化或化学反应时,会引起样品质量的变化。
通过测量样品质量变化与温度的关系,可以揭示样品的热分解特性、相变行为以及热稳定性。
热分析技术及分类

升温速度对硫酸钙相邻峰谷的影响
合适
过快
(2)压力和气氛 ——对体积变化大试样,外界压力增大,热反应 温度向高温方向移动。
——气氛会影响差热曲线形态。
(3)热电偶热端位置 ——插入深度一致,装填薄而均匀。
(4)走纸速度(升温速度与记录速度的配合) ——走纸速度与升温速度相配合。 ——升温速度10K/min/走纸速度30cm/h。
DSC温度校正
选用不同温度点测定一系列标准化合物的熔点
常用标准物质熔融转变温度和能量 物质 铟(In) 锡(Sn) 231.88 60.47 铅(Pb) 327.47 23.01 锌(Zn) 419.47 108.39 K2SO4 585.0 ±0.5 33.27 K2CrO4 670.5 ±0.5 33.68
程序控制温度:指用固定的速率加热或冷却。
物理性质:包括物质的质量、温度、热焓、尺寸、 机械、升学、电学及磁学性质等。
热分析历史
1780年英国的Higgins使用天平研究石灰粘结剂和 生石灰受热重量变化。 1915年日本的本多光太郎提出“热天平” 概念。 二战以后,热分析技术飞快发展。 40年代末商业化电子管式差热分析仪问世。 1964年提出“差示扫描量热”的概念。 热分析已经形成一类拥有多种检测手段的仪器分 析方法。
(1)热容量和热导率的变化
应选择热容量及热导率和试样相近的作为参比物
反应前基线低于反应 后基线,表明反应后 试样热容减小。
反应前基线高于反应 后基线,表明反应后 试样热容增大。
(2)试样的颗粒度 ——试样颗粒越大,峰形趋于扁而宽。反之,颗 粒越小,热效应温度偏低,峰形变小。 ——颗粒度要求:100目-300目(0.04-0.15mm)
热微粒分析
5_热分析(DSC)
不同纺速PET卷绕丝的DSC曲线
第四十五页,编辑于星期二:十九点 三分。
不同纺速PET卷绕丝的DSC曲线解释
• 纺速越低,冷结晶的温度越接近其Tm ; • 随着纺速的增加,冷结晶的温度向低温移
动; • 直到纺速足够大,冷结晶峰消失。
第四十六页,编辑于星期二:十九点 三分。
PET冷结晶现象的产生原因
• 同一种聚合物,制备方法不同,结晶状态 就不同, Tm不同。
• 所以实验测得的熔点并不能表征聚合物本身的特 性。所以为了考察热力学平衡状态下的熔融行为,
必须用Tm。来表征
第三十三页,编辑于星期二:十九点 三分。
。
Tm 定义
• 与聚合物熔体平衡的一组晶体的熔点。
• 在下熔融的晶体是该聚合物最完善的结晶。 具有最小的自由能。
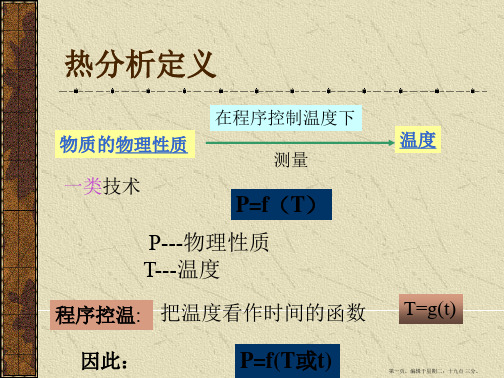
热分析定义
物质的物理性质
在程序控制温度下 测量
温度
一类技术
P=f(T)
P---物理性质 T---温度
程序控温: 把温度看作时间的函数 T=g(t)
因此:
P=f(T或t)
第一页,编辑于星期二:十九点 三分。
ICTA关于热分析方法的分类
加热
物质
冷却
热量变化
重量变化 长度变化
粘弹性变化 气体发生
DTA DSC
交联(固化)温度 分解温度
液晶晶型转变温度
结晶温度
第二十页,编辑于星期二:十九点 三分。
三种硫磺样品熔点(Tm)比较
美国
日本
中国
Tm
未处理样品 125.8
128
125
处理后不溶 125.5
129
118.5
硫样品
第二十一页,编辑于星期二:十九点 三分。
聚合物交联反应的动力学模式探索(上)

聚合物交联反应的动力学模式探索(上)徐梁,曾智强耐驰科学仪器商贸(上海)有限公司图1中可以看到,反应至少包含两个阶段。
第一阶段(吸热峰)为粉末涂料的熔融,第二阶段(放热宽峰)为涂料的交联反应。
对于聚合物交联反应机理的研究,热分析动力学是一种非常重要的手段。
使用动力学方式,可以计算得到交联反应的活化能、指前因子等特征动力学参数,并在此基础上进行动力学预测,计算材料在各种不同的工艺条件下的反应情况,以指导材料研究与工艺优化。
在具体的动力学计算方法方面,目前主要有两大类方法。
一类是较为传统的无模型动力学。
这一类包括Kissinger 、Friedman 、Ozawa-Flynn-Wall 等相关的计算方法,使用等转化率法从总体上获取交联反应的活化能/指前因子等动力学参数随反应进程的变化曲线。
另一类则是模型动力学的方法,将复杂的交联反应处理为一个个单独反应步骤的叠加,使用多元非线性回归的方式,为每一反应步骤分别计算活化能/指前因子/反应级数等动力学参数,由此建立完整的反应模型,并作为数据预测与应用之基础。
本文以电解淀积涂料与环氧树脂的交联固化为例,对聚合物交联反应的动力学计算方法进行了讨论。
着重对比了使用无模型动力学与模型动力学这两种方式的计算结果,分析了其各自的长处与不足之处,并对如何将这两种方式相结合,互相取长补短,以更好地服务于交联反应研究作了一些初步的探讨。
分析实例1. 电解淀积涂料的交联电解淀积涂料(EDC )是一种在汽车工业中得到广泛应用的涂料,其优点在于能够使用单层工艺形成具有优良耐腐蚀性的底漆。
涂料处于直流电场中,能够选择性地沉积在边、角或凸出部分。
此处我们使用DSC 方法,对EDC 样品分别使用2、5、10、20K/min 四种不同的升温速率进行了测试。
测试图我们首先使用较简单的无模型动力学进行数据处理。
较有代表性的无模型动力学计算方法主要有两种,一种为Friedman 方法(微分等转化率法,Friedman ,1966)。
热分析方法的原理和应用

、质量损失速率、温度的倒数,求出相邻点间的差值,再 使用公式,通过作图法求得活化能E与反应级数n
• 极值法 在TG、DTG曲线上取包括峰值在内的一系列重量~温
度值,使用公式,利用作图法求得活化能E、频率因子A 与反应级数n
TG 曲线
图中所示的反应单从 TG 曲线上看,有点像一个单一步骤的过程
DTG
DTG 曲线
但从微分(DTG)曲线则明显区分出分解分为两个相邻的阶段
Sample
热重分析仪(TG)原理图
Furnace
Ba la nc e
NETZSCH 热重分析仪: TG 209 C Iris®
FT(IR23g0a癈s )cell
药物熔点的测定
药物纯度的测定
❖ 依据van’t Hoff方程 :
T = T0 - (RT02c / DHo).(1/F)
c = (T0 - Tm).DH0 / RT0
T / K为样品熔化过程中某一瞬间的温度;T0 / K为纯
化合物的熔点;Tm /K为样品的熔点; F为温度T时被测
样品熔化的摩尔分数, DH0 为熔化焓,c为样品中杂
质的分数。 ❖ 以熔化过程中样品温度T对1/F作图, 应为一直线,其截
速率常数 k 的意义
阿仑尼乌斯方程:k = A ·e -Ea/RT • A:指前因子,又称频率因子,与活化分子转化成产物分
子的速率有关。 • E方a:能活参化与能反应。,反其应大体小系反中映具了有反活应化速能率E随a 的温“度活的化变分化子程”度
。随着温度的升高,活化分子数增多,更多的分子具有了 活化能。活化能较大的反应,升高温度能够显著加快反应 速率,活化能较小的反应则反之。 • R:摩尔气体常数,R = 8.314 J·K-1·mol-1
