北京大学有机化学课件(1)
合集下载
北京大学有机化学课件3

HS
HR
CH 3
潜非对称分子(原手性分 子)
H被OH取代
COOH
COOH
HO
H or H
OH
CH 3
CH 3
S-(+)-乳酸
R-(-)-乳酸
潜不对称碳原子(原手性碳原子)
2.含两个或多个不对称碳原子的手性分子
(1)旋光异构体的数目 (2)非对映体 (3)赤式和苏式 (4)差向异构体
(1) 旋光异构体的数目
HOH HOOC
C3右旋60o
HOH
旋转
HOH
180o
COOH HOOC
COOH HOH
C2左旋60o
交叉式(I) 有对称中心
HOH HOOC
OH H
COOH
交叉式(II)
HO
HOH
H HOOC
COOH
交叉式(III)
交叉式(II)与(III)是一对对映体,其内能相等, 在构象平衡中所占的百分含量相等
*1 平面偏振光 普通光通过尼可尔棱镜后产生只能在一个平面振动 的光。这种只能在一个平面振动的光为平面偏振光。
*2 旋光物质 能使平面偏振光旋转一定角度的物质称为旋光性物质。
*3 旋光度()
在旋光仪中被测出的使偏振光旋转的角度称为旋光度。
影响旋光度的因素
1. (a)被测物质; (b) 溶液的浓度; (c) 盛液管长度; 2. (d) 测定温度; (e) 所用光的波长
对称面( )
对称操作 反映(射)
判别手性的依据 有对称面无手性
S1=
对称轴(Cn)
S2= i
2 n
旋转
不能作为区别手性的依据
对称中心(i) (或反演中心)
有机化学实验全套教学课件

考核办法
➢ 笔试占30%,笔试不过,有机化学实验成 绩不过。
➢ 总成绩:30%笔试+20%出勤+20%操作 +30%实验报告
有机实验项目顺序
环己烯的制备 P83 1-溴丁烷的制备 P89 苯甲酸的制备及提纯 P108 乙酰苯胺的制备及提纯 P116 肉桂酸的制备 P145 正丁醚的制备 P101
➢药品不要沾在皮肤上,尤其是极毒的药品。实验完 毕后应立即洗手。称量任何药品都应使用工具,不得 用手直接接触。
实验室安全须知
中毒预防:
➢使用和处理有毒或腐蚀性物质时,应在通风柜中进 行,并戴上防护用品,尽可能避免有机物蒸气扩散在 实验室内。 ➢对沾染过有毒物质的仪器和用具,实验完毕应立即 采取适当方法处理以破坏或消除其毒性。 ➢不要在实验室进食、饮水,食物在实验室易沾染有 毒的化学物质。
仪器的领取与维护
➢每人在第一次上课时在准备室领取一套玻璃仪器,领取 后应按清单点数并洗净,不够需到准备室补齐。 ➢实验过程中应小心使用玻璃仪器,若发生仪器损坏,应 及时到准备室报告并领取新仪器,同时承担部分费用。 ➢每次实验后应将自己的所有玻璃仪器收好保存在柜中。 ➢所有课程结束后,清点仪器交还回准备室,缺损的需补 齐,并体
用于油类、有机溶剂、精密仪器、高压电气 设备。
二氧化碳 灭火器
液态CO2
用于电器设备失火及忌水的物质及有机物着 火。注意喷出的二氧化碳使温度骤降,手若 握在喇叭筒上易被冻伤。
NaHCO3等盐 用于油类、电器设备、可燃气体及遇水燃烧 干粉灭火器 类与适宜的润 等物质着火。
滑剂和防潮剂
实验室安全须知
爆炸预防:
➢常压操作加热反应时,切勿在封闭系统内进行。在 反应进行时,必须经常检查仪器装置的各部分有无堵 塞现象。 ➢减压蒸馏时,不得使用机械强度不大的仪器(如锥 形瓶、平底烧瓶、薄壁试管等)。必要时,要戴上防 护面罩或防护眼镜。
北京大学有机化学课件15缩合反应共67页

。——华盛顿 17、一个人即使已登上顶峰,也仍要自强不息。——罗素·贝克 18、最大的挑战和突破在于用人,而用人最大的突破在于信任人。——马云 19、自己活着,就是为了使别人过得更美好。——雷锋 20、要掌握书,莫被书掌握;要为生而读,莫为读而生。——布尔沃
北京大学有机化学课件15缩 合反应
26、机遇对于有准备的头脑有特别的 亲和力 。 27、自信是人格的核心。
28、目标的坚定是性格中最必要的力 量泉源 之一, 也是成 功的利 器之一 。没有 它,天 才也会 在矛盾 无定的 迷径中 ,徒劳 无功。- -查士 德斐尔 爵士。 29、困难就是机遇。--温斯顿.丘吉 尔。 30、我奋斗,所以我快乐。--格林斯 潘。
END
北京大学有机化学课件15缩 合反应
26、机遇对于有准备的头脑有特别的 亲和力 。 27、自信是人格的核心。
28、目标的坚定是性格中最必要的力 量泉源 之一, 也是成 功的利 器之一 。没有 它,天 才也会 在矛盾 无定的 迷径中 ,徒劳 无功。- -查士 德斐尔 爵士。 29、困难就是机遇。--温斯顿.丘吉 尔。 30、我奋斗,所以我快乐。--格林斯 潘。
END
北大有机课件第三章StereochemistryEnantiomerism

假手性碳:
CH3 H S Cl H S Cl H R Cl
CH3
CH3
H
Cl
CH3
Cl
H
Br
H
CH3
H
Br
CH3
苏式 (threo): 异侧 2-氯-3-溴丁烷
(2S, 3s, 4R)-2,3,4-三氯戊烷
(八) 构象异构和构型异构 (Conformation and Configuration):
CH3
CH3
H
H
H
CH3
Cl2 CH3
H
H
H
Cl
CH3
H H
H
CH3 H Cl2 CH3 CH3
Racemate
H
H
Cl
Cl
Cl
CH3 H
CH3 H
H
H
CH3
H
Cl2
Cl
H
H
CH3
H
Cl
Diastereomers
CH3 CH3 Cl2 Cl CH3
CH3 Cl
% ee ( 对映体过量百分率) = R % - S % % O.P (光学纯度百分率)= [ ]观察 [ ] 纯 100%
1. 化学分离法:
(±)-acid + (-)-base
Racemic 无旋光
有旋光
(+)-acid-(-)-base’salt H+ (+)-
(diastereomers)
acid
(-)-acid-(-)-base’salt H+ (-)-acid
(m.p., or s.有差别)
常用的生物碱: (-)-番木鳖碱, (-)-奎宁, (-)-马钱子碱, (+)-辛可宁
北京大学有机化学课件17

-
O
CH 2-OH H CH 2
-OH -
O
CH 2
O
O-
HO
15-25oC
SO3H
OH
OH
H2SO4(浓) 80-100oC H2SO4(浓) 80-100oC
SO3H
HO
SO3H
SO3H
H2SO4(稀)
OH
回流
应用:1 定位; 2 芳核位置保护基;3 引入酚羟基。
3 酚的硝化
OH OH
+ 稀HNO3(20%)
-H2O 室温
NO2
+ HO
NO2
35 % -40%
H+ H2O B(OH)2
苯基硼酸
15 % H2O2 CH3COOH
OB(OH)2
硼酸苯酯
H+ H2O
OH
+ B(OH)3
第四节 苯酚及其衍生物的反应
一 二 三 四 五 六 七 八 九 酸性 成醚反应和克莱森重排 成酯反应和弗里斯重排 酚芳环上的一般亲电取代反应 瑞穆尔--悌曼反应 柯尔伯--施密特反应 芳香醚的伯奇还原 苯酚与甲醛的缩合 三氯化铁试验
定义:苯及其衍生物在金属锂(或钠)的液氨、醇混合液 中反应,苯环被还原成1,4-环己二烯类化合物的反应 称为伯奇还原。
OH
CH2N2
OCH 3
Li NH3(l)
C2H5OH
OCH 3
1-甲氧基-1,4环己二烯
OH
HCl / H2O
O
O
HCl H2O
八 苯酚和甲醛的缩合
苯酚和甲醛在酸性条件下的反应
CH2=O + H
酰卤 苯酚 + 酸酐 羧酸
有机化学北大版第章对映异构
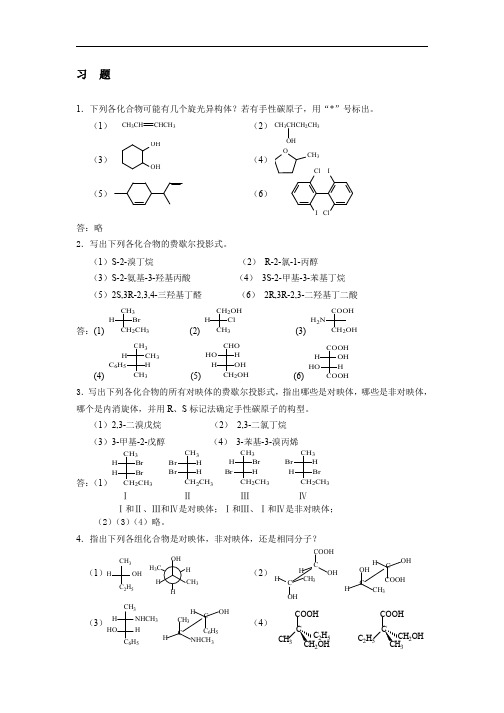
NHCH3
H
C6H5
H
H CH3
C
OH
C
C6H5
NHCH3
COOH
(2)
H
C H C CH3
OH
OH H
H OH
C
OH
C
COOH
CH3
COOH
(4)
C
CH3
C2H5 CH2OH
COOH
C
C2H5
CH2OH CH3
(5)
CH3
CH3
COOH
C2H5
H
CH3
H H
C2H5
H3C
H
COOH
CH3
(7)
H
D CH3CH2CHBr2
7.写出分子量最低的手性烷烃的所有对映体的费歇尔投影式,用 R、S 标记法确定手性碳
原子的构型。
H
答:
CH2CH3 CH3
CH2CH2CH3
CH2CH3
H
CH3
S-3-甲基己烷; CH(CH3)2
S-2,3-二甲基戊烷
8.用适当的立体结构式表示下列化合物,指出其中哪些是内消旋体?
CH3
Br
H
Br
H
CH2CH3
CH3
H
Br
Br
H
CH2CH3
CH3
Br
H
H
Br
CH2CH3
Ⅰ
Ⅱ
Ⅲ
Ⅳ
Ⅰ和Ⅱ、Ⅲ和Ⅳ是对映体;Ⅰ和Ⅲ、Ⅰ和Ⅳ是非对映体;
(2)(3)(4)略。
4.指出下列各组化合物是对映体,非对映体,还是相同分子?
(1)H
CH3 H3C
OH H
C2H5
绪论--有机化学课件
奥秘的伟大历程中,又迈进了一大步。 ②. 核糖核酸的合成
从1968年起,由中科院北京生物物理所、上海生物化学研
究所,上海有机所,上海细胞生物研究所,上海生物物理
所,北京大学生物系协作完成人工合成酵母丙氨酸转移核
糖核酸工作,这种核糖核酸由76个核糖核苷组成。
1979年底,对其中一个片断—核糖四十一核苷酸合成成功,
(2). 容易燃烧
例:乙醚、汽油、甲烷(沼气)等。
但CCl4不燃烧,而是灭火剂(扑灭电源内或
电源附近的火)。
8
(3). 熔点低 有机化合物熔点比较低,而无机化合物熔点较高。
例: NaCl m.p. 801℃ b .p. 1478℃
CH3CH2Cl m.p. -136. 4 ℃ b.p. 12.2 ℃
原因:NaCl 化学键是离子键,而CH3CH2Cl是共价键。 (4). 难溶于水
根据相似相溶原理,水是极性分子,而有机物 大多是非极性分子或极性较弱的分子。
9
(5). 反应速度慢 例: Cl- + Ag+
AgCl 快
RCl + Ag+
AgCl
RCl要和Ag+反应,首先要打开R-Cl键,使氯转变为
离子型,才能与Ag+反应。
O
O
N
O
H
N
O
H 35
2. 按官能团分类 官能团:决定有机化合物特性的原子或原子团。 含有相同官能团的化合物都有相似的性质。
例: CC
CC
X
官能团 双键 叁键 卤素
化合物 烯烃
炔烃 卤代烃
36
OH
羟基
O
羰基
COOH 羧基
醇 醛、酮 羧酸
从1968年起,由中科院北京生物物理所、上海生物化学研
究所,上海有机所,上海细胞生物研究所,上海生物物理
所,北京大学生物系协作完成人工合成酵母丙氨酸转移核
糖核酸工作,这种核糖核酸由76个核糖核苷组成。
1979年底,对其中一个片断—核糖四十一核苷酸合成成功,
(2). 容易燃烧
例:乙醚、汽油、甲烷(沼气)等。
但CCl4不燃烧,而是灭火剂(扑灭电源内或
电源附近的火)。
8
(3). 熔点低 有机化合物熔点比较低,而无机化合物熔点较高。
例: NaCl m.p. 801℃ b .p. 1478℃
CH3CH2Cl m.p. -136. 4 ℃ b.p. 12.2 ℃
原因:NaCl 化学键是离子键,而CH3CH2Cl是共价键。 (4). 难溶于水
根据相似相溶原理,水是极性分子,而有机物 大多是非极性分子或极性较弱的分子。
9
(5). 反应速度慢 例: Cl- + Ag+
AgCl 快
RCl + Ag+
AgCl
RCl要和Ag+反应,首先要打开R-Cl键,使氯转变为
离子型,才能与Ag+反应。
O
O
N
O
H
N
O
H 35
2. 按官能团分类 官能团:决定有机化合物特性的原子或原子团。 含有相同官能团的化合物都有相似的性质。
例: CC
CC
X
官能团 双键 叁键 卤素
化合物 烯烃
炔烃 卤代烃
36
OH
羟基
O
羰基
COOH 羧基
醇 醛、酮 羧酸
有机化学第一章 绪论
2020/5/15
1、有机化合物的提纯: 在18世纪末期,分离技术发展很快。人们开始
从动植物中提取一系列较纯的有机物,其代表人物: 舍勒(瑞典),他先后分离了多种有机酸:酒石酸 (1770年)、草酸(1776年)、乳酸(1780年)、 尿酸(1780年)、柠檬酸(1784年)、苹果酸 (1785年)。他为有机化学的发展立下了不可磨灭 的功劳。
A:亲电反应:由亲电试剂进攻反应物而发 生的反应叫做亲电反应。所谓亲电试剂是指在反 应过程中。能够接受电子的试剂。如:M+、H+等 缺电子体系。
B:亲核反应:由亲核试剂进攻反应物而发生 的反应叫做亲核反应。所谓亲核试剂是指在反应 过程中,能够给予电子的试剂。如 :HO-、碳负 离子等。
⑶ 周环反应(协同反应)
C + H D4= 338.9KJ/mol
C + 4H
H=
D1+D2
4
+D3 + D4=
415.25KJ/mol
2020/5/15
4、共价键的偶极矩:在共价键中,由于成键的 两个原子的电负性大小不同,使得成键的电子云 偏向电负性大的一端,电负性大的原子具有部分 负电核δ-,电负性小的原子具有部分正电核δ+。 由此定义偶极矩:µ=q.d
2020/5/15
现在,人们正在积极利用计算机进行有机合 成的设计,有机化学从其诞生至今的200年的历 程中,得到了飞速发展,成为一门独立的学科, 并在人们生活中起着重要作用。
三、有机化学的任务
1.发现新现象(新的有机物,新的来源、新的 合成方法、合成技巧,新的有机反应等) 2.研究新的规律(结构与性质的关系,反应机 理等) 3.提供新材料 (提供新的高科技材料,推动 国民经济和科学技术的发展) 4.探索生命的奥秘(生命与有机化学的结合)
1、有机化合物的提纯: 在18世纪末期,分离技术发展很快。人们开始
从动植物中提取一系列较纯的有机物,其代表人物: 舍勒(瑞典),他先后分离了多种有机酸:酒石酸 (1770年)、草酸(1776年)、乳酸(1780年)、 尿酸(1780年)、柠檬酸(1784年)、苹果酸 (1785年)。他为有机化学的发展立下了不可磨灭 的功劳。
A:亲电反应:由亲电试剂进攻反应物而发 生的反应叫做亲电反应。所谓亲电试剂是指在反 应过程中。能够接受电子的试剂。如:M+、H+等 缺电子体系。
B:亲核反应:由亲核试剂进攻反应物而发生 的反应叫做亲核反应。所谓亲核试剂是指在反应 过程中,能够给予电子的试剂。如 :HO-、碳负 离子等。
⑶ 周环反应(协同反应)
C + H D4= 338.9KJ/mol
C + 4H
H=
D1+D2
4
+D3 + D4=
415.25KJ/mol
2020/5/15
4、共价键的偶极矩:在共价键中,由于成键的 两个原子的电负性大小不同,使得成键的电子云 偏向电负性大的一端,电负性大的原子具有部分 负电核δ-,电负性小的原子具有部分正电核δ+。 由此定义偶极矩:µ=q.d
2020/5/15
现在,人们正在积极利用计算机进行有机合 成的设计,有机化学从其诞生至今的200年的历 程中,得到了飞速发展,成为一门独立的学科, 并在人们生活中起着重要作用。
三、有机化学的任务
1.发现新现象(新的有机物,新的来源、新的 合成方法、合成技巧,新的有机反应等) 2.研究新的规律(结构与性质的关系,反应机 理等) 3.提供新材料 (提供新的高科技材料,推动 国民经济和科学技术的发展) 4.探索生命的奥秘(生命与有机化学的结合)
北京大学有机化学课件4
3 o o o
R-Br + I-
RI + Br -
R:
CH3
150
CH3CH2
1
(CH3)2 CH
0.01
(CH3)3 C
0.001
V相对
烷基结构对SN1的影响
V3 RX > V2 RX > V1 RX > VCH X
o o o 3
R-Br + H2O
甲酸
R-OH + HBr
R:
CH3
1
CH3CH2
H CH3 C+ H
结构特点: 平面型,
R1 R2
+
C
R3
sp2杂化。
电性特点:亲电性 稳定性: 3oC+ > 2oC+ , 烯丙基C+ > 1oC+ > +CH3
CH3 H -H CH3 -e-
键解离能+电离能
+CH 3
越小,碳正离子 越稳定。
键解离能
电离能
影响碳正离子稳定性的因素
(3)双分子亲核取代反应(SN2)
(R)-CH3(CH2)CHCH3 + I I
*-
SN2
(S)-CH3(CH2)CHCH 3 + I I*
定义:有两种分子参与了决定反应速度关键 步骤的亲核取代反应称为SN2 反应。
SN2的特点
*1.这是一个一步反应,只有一个过渡态。过渡态的结构特 点是:中心碳是sp2杂化,它与五个基团相连,与中心碳相 连又未参与反应的三个基团与中心碳原子处于同一平面上, 进入基团 (亲核试剂) 和离去基团处在与该平面垂直,通过 中心碳原子的一条直线上,分别与中心碳的p轨道的二瓣结 合。 *2.所有产物的构型都发生了翻转。 *3.消旋化速度比取代反应的速度快一倍。 *4.该反应在大多数情况下,是一个二级动力学控制的反应。
R-Br + I-
RI + Br -
R:
CH3
150
CH3CH2
1
(CH3)2 CH
0.01
(CH3)3 C
0.001
V相对
烷基结构对SN1的影响
V3 RX > V2 RX > V1 RX > VCH X
o o o 3
R-Br + H2O
甲酸
R-OH + HBr
R:
CH3
1
CH3CH2
H CH3 C+ H
结构特点: 平面型,
R1 R2
+
C
R3
sp2杂化。
电性特点:亲电性 稳定性: 3oC+ > 2oC+ , 烯丙基C+ > 1oC+ > +CH3
CH3 H -H CH3 -e-
键解离能+电离能
+CH 3
越小,碳正离子 越稳定。
键解离能
电离能
影响碳正离子稳定性的因素
(3)双分子亲核取代反应(SN2)
(R)-CH3(CH2)CHCH3 + I I
*-
SN2
(S)-CH3(CH2)CHCH 3 + I I*
定义:有两种分子参与了决定反应速度关键 步骤的亲核取代反应称为SN2 反应。
SN2的特点
*1.这是一个一步反应,只有一个过渡态。过渡态的结构特 点是:中心碳是sp2杂化,它与五个基团相连,与中心碳相 连又未参与反应的三个基团与中心碳原子处于同一平面上, 进入基团 (亲核试剂) 和离去基团处在与该平面垂直,通过 中心碳原子的一条直线上,分别与中心碳的p轨道的二瓣结 合。 *2.所有产物的构型都发生了翻转。 *3.消旋化速度比取代反应的速度快一倍。 *4.该反应在大多数情况下,是一个二级动力学控制的反应。
简明物理有机化学教程(1)
作者:王剑波(北京大学化学学院 ) 版权所有:北京大学出版社
第1章 物理有机化学概述
出版时间:2013年10月
本章内容
1.1 引言 1.2 一些重要的基本概念 反应机理; 基元反应; 过渡态; 反应中间体 1.3 提出合理的反应机理: 确立反应机理的基本规则 1.4 研究反应机理的基本方法 产物的研究; 中间体的确立; 同位素标记; 同位素效应; 立体化学; 动力学 1.5 动力学研究的一般方法 反应的动力学级数; 简单反应的积分速度定律; 可逆反 应; 多步反应的动力学; 机理的推出 1.6 动力学分析实例 芳香化合物的硝化反应; 亚胺的水解
没有化学头脑的机理假设 仅从原子的组合考虑,可以设想反应物分子都分解为原子, 然后 再重新组合成产物分子。
有化学头脑的机理假设 根据我们对于类似反应的了解,可以设想这样一个合理的机理。
问题:碘离子是在什么时候离开的——是在羟基离子接上去之
前、之后还是接上去的同时(这和反应是SN1机理还是SN2机理 有关)?相对于碘的原来位臵,羟基离子接到碳原子的什么地方 (从产物的立体化学推断)?最后的问题是,这个反应为什么能发 生,尤其是它为什么能按照提出的机理所描述的具体方式发生?
动力学和机理
化学的核心是研究反应机理, 也就是测定分子进行化学反应 所发生的一些具体的变化和相互作用。 要完全描述一个有机反应的机理, 必须知道反应物分子转变 为产物分子的全过程中所有原子在不同时间的确切位臵-一个从来也没有完全实现过的理想目标。因为许多变化对 于任何能直接监测的方法来说发生得太快。 分子的振动和碰撞的时间标度(time scale)在10-12 ~ 10-14 秒 范围之内, 这比标准光谱监测要快得多。
Appearance of NMR spectra for system Undergoing two-site exchange (A B)
第1章 物理有机化学概述
出版时间:2013年10月
本章内容
1.1 引言 1.2 一些重要的基本概念 反应机理; 基元反应; 过渡态; 反应中间体 1.3 提出合理的反应机理: 确立反应机理的基本规则 1.4 研究反应机理的基本方法 产物的研究; 中间体的确立; 同位素标记; 同位素效应; 立体化学; 动力学 1.5 动力学研究的一般方法 反应的动力学级数; 简单反应的积分速度定律; 可逆反 应; 多步反应的动力学; 机理的推出 1.6 动力学分析实例 芳香化合物的硝化反应; 亚胺的水解
没有化学头脑的机理假设 仅从原子的组合考虑,可以设想反应物分子都分解为原子, 然后 再重新组合成产物分子。
有化学头脑的机理假设 根据我们对于类似反应的了解,可以设想这样一个合理的机理。
问题:碘离子是在什么时候离开的——是在羟基离子接上去之
前、之后还是接上去的同时(这和反应是SN1机理还是SN2机理 有关)?相对于碘的原来位臵,羟基离子接到碳原子的什么地方 (从产物的立体化学推断)?最后的问题是,这个反应为什么能发 生,尤其是它为什么能按照提出的机理所描述的具体方式发生?
动力学和机理
化学的核心是研究反应机理, 也就是测定分子进行化学反应 所发生的一些具体的变化和相互作用。 要完全描述一个有机反应的机理, 必须知道反应物分子转变 为产物分子的全过程中所有原子在不同时间的确切位臵-一个从来也没有完全实现过的理想目标。因为许多变化对 于任何能直接监测的方法来说发生得太快。 分子的振动和碰撞的时间标度(time scale)在10-12 ~ 10-14 秒 范围之内, 这比标准光谱监测要快得多。
Appearance of NMR spectra for system Undergoing two-site exchange (A B)
