艾塞那肽注射液说明书
常见降糖药物一览表

西药身分为格列原脲
消渴丸
1~3次/天;餐前半小时
单胍类
减少周围构造对于胰岛素的敏感性
胃肠讲反应
乳酸性酸中毒
两甲单胍
两甲单胍
250
2~3次/天;餐中或者餐后服
格华行
500
α—糖苷酶压造剂
延缓碳火化合物的落解,减缓肠讲葡萄糖的吸支速度
背胀
排气
阿卡波糖
拜唐苹;卡专仄
50
3次/天;餐前吞服或者餐中嚼服
注射要领
进餐时间
贮躲热躲于2-8℃冰箱中
超
短
效
劣泌乐
好脯胰岛素注射液
胰岛素类似物
10-15min
4-5h
IH
注射后15分钟之内进餐
正正在使用可正在<25℃28天
诺战钝®
门冬胰胰岛素注射液
胰岛素类似物
10-15min
1-2h
4-6h
IH
注射后10分钟之内进餐
使用中没有超出30℃存搁4周
短
效
劣泌林
沉组人胰岛素注射液
30/70混同沉组人胰岛素注射液(30%短效+70%中效)
人胰岛素
IH
混同劣泌林70/30
粗蛋黑锌沉组人胰岛素混同注射液(30%短效+70%中效)
人胰岛素
IH
劣泌乐25
粗蛋黑锌沉组好脯胰岛素混同注射液(25%速效+75%中效)
胰岛素类似物
15min
30-70
min
16-24h
IH
紧邻餐前注射,需要时餐后坐时注射
格列吡嗪
好吡哒
5
2~3次/天;餐前半小时
瑞易宁控释片
5
2022年河南省药品目录(民族药与门诊特定药品名单)

我省药品目录内的民族药药品分类代码药品分类编号药品名称备注Z I民族药Z I01藏药乙1藏降脂胶囊乙2七味胃痛胶囊乙3秦皮接骨胶囊乙4益心康泰胶囊乙5珍龙醒脑胶囊Z I02蒙药乙6协日嘎四味汤胶囊Z I03维药乙7百癣夏塔热分散片门诊特定药品名单序号药品名称备注1玛巴洛沙韦片本品适用于12周岁及以上单纯性甲型和乙型流感患者,包括既往健康的患者以及存在流感并发症高风险的患者㊂2索磷维伏片本品适用于治疗既往接受过含直接抗病毒药物(D A A)方案㊁无肝硬化或伴代偿性肝硬化(C h i l d-P u g h A)的成人慢性丙型肝炎病毒(H C V)感染㊂3达诺瑞韦钠片与盐酸拉维达韦片等联合用于治疗初治的非肝硬化的基因1b型慢性丙型肝炎成人患者(用法用量详见盐酸拉维达韦片说明书)㊂4盐酸拉维达韦片盐酸拉维达韦片联合利托那韦强化的达诺瑞韦钠片和利巴韦林,用于治疗初治的基因l b型慢性丙型肝炎病毒感染的非肝硬化成人患者㊂盐酸拉维达韦片不得作为单药治疗㊂5磷酸依米他韦胶囊磷酸依米他韦胶囊需与索磷布韦片联合,用于治疗成人基因1型非肝硬化慢性丙型肝炎㊂磷酸依米他韦胶囊不得作为单药治疗㊂6苯环喹溴铵鼻喷雾剂本品适用于改善变应性鼻炎引起的流涕㊁鼻塞㊁鼻痒和喷嚏症状㊂7注射用全氟丙烷人血白蛋白微球用于常规超声心动图显影不够清晰者,增强显像效果,增加病变识别率及病变定性的准确性,增强左心室内膜边界的识别㊂8注射用全氟丁烷微球本品仅用于诊断使用:注射用全氟丁烷微球是一种超声造影剂,用于肝脏局灶性病变血管相和K u p f f e r相的超声成像㊂9环泊酚注射液本品适用于:消化道内镜检查中的镇静;全身麻醉诱导㊂序号药品名称备注10注射用甲苯磺酸瑞马唑仑本品适用于胃镜㊁结肠镜检查的镇静㊂11注射用苯磺酸瑞马唑仑本品适用于结肠镜检查的镇静㊂12水合氯醛/糖浆组合包装儿童检查㊁操作前的镇静㊁催眠㊂13司美格鲁肽注射液本品适用于成人2型糖尿病患者的血糖控制:在饮食控制和运动基础上,接受二甲双胍和/或磺脲类药物治疗血糖仍控制不佳的成人2型糖尿病患者㊂适用于降低伴有心血管疾病的2型糖尿病成人患者的主要心血管不良事件(心血管死亡㊁非致死性心肌梗死或非致死性卒中)风险㊂14艾塞那肽注射液限二甲双胍等口服降糖药或胰岛素控制效果不佳的B M Iȡ25的患者,首次处方时需由二级及以上医疗机构专科医师开具处方㊂15利拉鲁肽注射液限二甲双胍等口服降糖药或胰岛素控制效果不佳的B M Iȡ25的患者,首次处方时需由二级及以上医疗机构专科医师开具处方㊂16利司那肽注射液限二甲双胍等口服降糖药或胰岛素控制效果不佳的B M Iȡ25的患者,首次处方时需由二级及以上医疗机构专科医师开具处方㊂17贝那鲁肽注射液限二甲双胍等口服降糖药或胰岛素控制效果不佳的B M Iȡ25的患者,首次处方时需由二级及以上医疗机构专科医师开具处方㊂18度拉糖肽注射液限二甲双胍等口服降糖药或胰岛素控制效果不佳的B M Iȡ25的患者,首次处方时需由二级及以上医疗机构专科医师开具处方㊂19聚乙二醇洛塞那肽注射液限二甲双胍等口服降糖药或胰岛素控制效果不佳的B M Iȡ25的患者,首次处方时需由二级及以上医疗机构专科医师开具处方㊂20二甲双胍恩格列净片(Ⅰ)本品配合饮食控制和运动,适用于正在接受恩格列净和盐酸二甲双胍治疗的2型糖尿病成人患者,用于改善这些患者的血糖控制㊂序号药品名称备注21艾米替诺福韦片本品适用于慢性乙型肝炎成人患者的治疗㊂22恩替卡韦口服溶液恩替卡韦适用于病毒复制活跃,血清丙氨酸氨基转移酶(A L T)持续升高或肝脏组织学显示有活动性病变的慢性成人乙型肝炎的治疗(包括代偿及失代偿期肝病患者)㊂也适用于治疗2岁至<18岁慢性H B V感染代偿性肝病的核苷初治儿童患者,有病毒复制活跃和血清A L T 水平持续升高的证据或中度至重度炎症和/或纤维化的组织学证据㊂23人凝血因子Ⅸ用于凝血因子Ⅸ缺乏症(B型血友病)患者的出血治疗㊂24醋酸艾替班特注射液用于治疗成人㊁青少年和ȡ2岁儿童的遗传性血管性水肿(H A E)急性发作㊂25海曲泊帕乙醇胺片1.本品适用于既往对糖皮质激素㊁免疫球蛋白等治疗反应不佳的慢性原发免疫性血小板减少症(I T P)成人患者,使血小板计数升高并减少或防止出血㊂本品仅用于因血小板减少和临床条件导致出血风险增加的I T P患者㊂2.本品适用于对免疫抑制治疗(I S T)疗效不佳的重型再生障碍性贫血(S A A)成人患者㊂基于一项I I期单臂试验的结果附条件批准本适应症㊂该适应症的完全批准将取决于正在进行的确证性临床试验的结果㊂26马来酸阿伐曲泊帕片限择期行诊断性操作或者手术的慢性肝病相关血小板减少症的成年患者㊂27甲苯磺酸多纳非尼片本品用于既往未接受过全身系统性治疗的不可切除肝细胞癌患者㊂28盐酸恩沙替尼胶囊适用于此前接受过克唑替尼治疗后进展的或者对克唑替尼不耐受的间变性淋巴瘤激酶(A L K)阳性的局部晚期或转移性非小细胞肺癌(N S C L C)患者的治疗㊂序号药品名称备注29甲磺酸伏美替尼片本品用于既往经表皮生长因子受体(E GF R )酪氨酸激酶抑制剂(T K I )治疗时或治疗后出现疾病进展,并且经检测确认存在E GF R T 790M 突变阳性的局部晚期或转移性非小细胞性肺癌(N S C L C )成人患者的治疗㊂该适应症是基于一项包括220例不可手术切除的局部晚期或转移性㊁经第一/第二代E GF R T K I 治疗进展并伴有EG F R T 790M 突变阳性㊁或原发性E G F R T 790M 突变阳性N S C L C 患者的I I b 期临床试验的结果给予的附条件批准㊂该适应症的完全批准将取决于正在进行的确证性随机对照试验证实本品的临床获益㊂30达可替尼片单药用于表皮生长因子受体(E GF R )19号外显子缺失突变或21号外显子L 858R 置换突变的局部晚期或转移性非小细胞肺癌(N S C L C )患者的一线治疗㊂31奥布替尼片本品适用于治疗:1.既往至少接受过一种治疗的成人套细胞淋巴瘤(M C L )患者㊂2.既往至少接受过一种治疗的成人慢性淋巴细胞白血病(C L L )/小淋巴细胞淋巴瘤(S L L )患者㊂上述适应症分别基于一项单臂临床试验的客观缓解率结果给予的附条件批准㊂本品的完全批准将取决于正在开展中的确证性随机对照临床试验结果㊂32奥妥珠单抗注射液本品与化疗联合,用于初治的I I 期伴有巨大肿块㊁I I I 期或I V 期滤泡性淋巴瘤成人患者,达到至少部分缓解的患者随后用奥妥珠单抗维持治疗㊂33阿齐沙坦片高血压㊂34氨氯地平叶酸片(I I )用于治疗伴有血浆同型半胱氨酸水平升高的原发性高血压㊂氨氯地平降低血压,叶酸降低血同型半胱氨酸水平,升高血叶酸水平㊂35氟唑帕利胶囊1.用于既往经过二线及以上化疗的伴有胚系B R C A 突变(g B R C A m )的铂敏感复发性卵巢癌㊁输卵管癌或原发性腹膜癌患者的治疗㊂2.用于铂敏感的复发性上皮性卵巢癌㊁输卵管癌或原发性腹膜癌成人患者在含铂化疗达到完全缓解或部分缓解后的维持治疗㊂序号药品名称备注36帕米帕利胶囊用于既往经过二线及以上化疗的伴有胚系B R C A(g B R C A)突变的复发性晚期卵巢癌㊁输卵管癌或原发性腹膜癌患者的治疗㊂该适应症是基于一项包括113例既往经过二线及以上化疗的伴有g B R C A突变的复发性晚期卵巢癌㊁输卵管癌或原发性腹膜癌患者中开展的开放性㊁多中心㊁单臂㊁I I期临床试验结果给予的附条件批准㊂该适应症的完全批准将取决于正在进行的确证性试验证实本品在该人群的临床获益㊂37阿贝西利片本品适用于激素受体(H R)阳性㊁人表皮生长因子受体2(H E R2)阴性的局部晚期或转移性乳腺癌:1.与芳香化酶抑制剂联合使用作为绝经后女性患者的初始内分泌治疗;2.与氟维司群联合用于既往曾接受内分泌治疗后出现疾病进展的患者㊂38甲磺酸艾立布林注射液本品适用于既往接受过至少两种化疗方案的局部晚期或转移性乳腺癌患者㊂既往的化疗方案应包含一种蒽环类和一种紫杉烷类药物㊂39马来酸奈拉替尼片适用于人类表皮生长因子受体2(H E R2)阳性的早期乳腺癌成年患者,在接受含曲妥珠单抗辅助治疗之后的强化辅助治疗㊂40索凡替尼胶囊本品单药适用于无法手术切除的局部晚期或转移性㊁进展期非功能性㊁分化良好(G1㊁G2)的胰腺和非胰腺来源的神经内分泌瘤㊂41达雷妥尤单抗注射液本品适用于:1.与来那度胺和地塞米松联合用药或与硼替佐米和地塞米松联合用药治疗既往至少接受过一线治疗的多发性骨髓瘤成年患者㊂2.单药治疗复发和难治性多发性骨髓瘤成年患者,患者既往接受过包括蛋白酶体抑制剂和免疫调节剂的治疗且最后一次治疗时出现疾病进展㊂42泊马度胺胶囊本品与地塞米松联用,适用于既往接受过至少两种治疗(包括来那度胺和一种蛋白酶体抑制剂),且在最后一次治疗期间或治疗结束后60天内发生疾病进展的成年多发性骨髓瘤患者㊂序号药品名称备注43阿帕他胺片1.转移性内分泌治疗敏感性前列腺癌(mH S P C )成年患者㊂2.有高危转移风险的非转移性去势抵抗性前列腺癌(NM-C R P C )成年患者㊂44达罗他胺片适用于治疗有高危转移风险的非转移性去势抵抗性前列腺癌(NM-C R P C )成年患者㊂45注射用维迪西妥单抗本品适用于至少接受过2个系统化疗的H E R 2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)的患者,H E R 2过表达定义为H E R 2免疫组织化学检查结果为2+或3+㊂该适应症是基于一项H E R 2过表达的局部晚期或转移性胃癌患者(包括胃食管结合部腺癌)的I I期单臂临床试验结果给予的附条件批准㊂该适应症的完全获批将取决于正在开展中的确证性随机对照临床试验能否证实本品在该人群的临床获益㊂46咪达唑仑口服溶液用于儿童诊断或治疗性操作前以及操作过程中的镇静/抗焦虑/遗忘;也可用于儿童术前镇静/抗焦虑/遗忘㊂47诺西那生钠注射液本品用于治疗5q 脊髓性肌萎缩症㊂48氨吡啶缓释片本品用于改善多发性硬化合并步行障碍(E D S S 评分4-7分)的成年患者的步行能力㊂49阿加糖酶α注射用浓溶液本品用于确诊为法布雷病(α-半乳糖苷酶A 缺乏症)患者的长期酶替代治疗㊂本品适用于成人㊁儿童和青少年㊂尚未确定本品在0-6岁儿童中的安全性和有效性㊂50甘露特钠胶囊用于轻度至中度阿尔茨海默病,改善患者认知功能㊂51注射用利培酮微球(I I )用于治疗急性和慢性精神分裂症以及其它各种精神病性状态的明显的阳性症状和明显的阴性症状㊂可减轻与精神分裂症有关的情感症状㊂序号药品名称备注52注射用盐酸兰地洛尔1.手术过程中发生的下列快速性心律失常的紧急治疗:心房纤颤㊁心房扑动㊁窦性心动过速㊂2.手术后循环系统动态监护时发生的快速性心律失常的紧急治疗:心房纤颤㊁心房扑动㊁窦性心动过速㊂3.心功能不全患者发生下列快速性心律失常的治疗:心房纤颤㊁心房扑动㊂53海博麦布片本品作为饮食控制以外的辅助治疗,可单独或与HMG-C o A还原酶抑制剂(他汀类)联合用于治疗原发性(杂合子家族性或非家族性)高胆固醇血症,可降低总胆固醇(T C)㊁低密度脂蛋白胆固醇(L D L-C)㊁载脂蛋白B(A p o B)水平㊂54依洛尤单抗注射液1.降低心血管事件的风险:在已有动脉粥样硬化性心血管疾病的成人患者中,降低心肌梗死㊁卒中以及冠脉血运重建的风险㊂通过:与最大耐受剂量的他汀类药物联合用药,伴随或不伴随其他降脂疗法,或者在他汀类药物不耐受或禁忌使用的患者中,单独用药或与其他降脂疗法联合用药㊂2.原发性高胆固醇血症(包括杂合子型家族性高胆固醇血症)和混合型血脂异常:可作为饮食的辅助疗法,用于成人原发性高胆固醇血症(杂合子家族性和非家族性)或混合型血脂异常患者的治疗,以降低低密度脂蛋白胆固醇(L D L-C)水平:在接受最大耐受剂量的他汀类药物治疗仍无法达到L D L-C目标的患者中,与他汀类药物㊁或者与他汀类药物及其他降脂疗法联合用药,或者在他汀类药物不耐受或禁忌使用的患者中,单独用药或与其他降脂疗法联合用药㊂3.纯合子型家族性高胆固醇血症:用于成人或12岁以上青少年的纯合子型家族性高胆固醇血症㊂可与饮食疗法和其他降低密度脂蛋白胆固醇(L D L-C)治疗(例如他汀类药物㊁依折麦布㊁L D L分离术)合用,用于患有纯合子型家族性高胆固醇血症(H o F H)且需要进一步降低L D L-C的患者㊂序号药品名称备注55阿利西尤单抗注射液1.心血管事件预防:在确诊为动脉粥样硬化性心血管疾病的成人患者中,降低心肌梗死㊁卒中㊁需要住院的不稳定性心绞痛的风险㊂通过:与最大耐受剂量的他汀类药物联合用药,伴随或不伴随其他降脂疗法,或者在他汀类药物不耐受或禁忌使用的患者中,单独用药或与其他降脂疗法联合用药㊂2.原发性高胆固醇血症(包括杂合子型家族性和非家族性)和混合型血脂异常:可作为饮食的辅助疗法,用于成人原发性高胆固醇血症(杂合子型家族性和非家族性)或混合型血脂异常患者的治疗,以降低低密度脂蛋白胆固醇(L D L-C)水平㊂在接受最大耐受剂量的他汀类药物治疗仍无法达到L D L-C目标的患者中,与他汀类药物㊁或者与他汀类药物及其他降脂疗法联合用药,或者在他汀类药物不耐受或禁忌使用的患者中,单独用药或与其他降脂疗法联合用药㊂56环硅酸锆钠散本品适用于治疗成人高钾血症㊂使用限制:因起效迟缓,本品不应该用于危及生命的高钾血症的紧急治疗㊂57氯苯唑酸软胶囊本品适用于治疗成人野生型或遗传型转甲状腺素蛋白淀粉样变性心肌病(A T T R-C M),以减少心血管死亡及心血管相关住院㊂58克霉唑阴道膨胀栓用于念珠菌性外阴阴道病㊂59环孢素滴眼液(Ⅱ)本品可促进干眼症患者的泪液分泌,适用于与角结膜干燥症相关的眼部炎症所导致的泪液生成减少的患者㊂60注射用泰它西普本品与常规治疗联合,适用于在常规治疗基础上仍具有高疾病活动(例如:抗d s-D N A抗体阳性及低补体㊁S E L E N A-S L E D A I评分ȡ8)的活动性㊁自身抗体阳性的系统性红斑狼疮(S L E)成年患者㊂该适应症是基于一项接受常规治疗仍具有高疾病活动的系统性红斑狼疮成年患者的I I期临床试验结果给予的附条件批准㊂本适应症的完全获批将取决于确证性随机对照临床试验能否证实本品在该患者人群的临床获益㊂序号药品名称备注61乌司奴单抗注射液1.斑块状银屑病:本品适用于对环孢素㊁甲氨蝶呤(MT X)或P U V A(补骨脂素和紫外线A)等其他系统性治疗不应答㊁有禁忌或无法耐受的成年中重度斑块状银屑病患者㊂2.克罗恩病:本品适用于对传统治疗或肿瘤坏死因子α(T N F-α)拮抗剂应答不足㊁失应答或无法耐受的成年中重度活动性克罗恩病患者㊂62乌司奴单抗注射液(静脉输注)本品适用于对传统治疗或肿瘤坏死因子α(T N F-α)拮抗剂应答不足㊁失应答或无法耐受的成年中重度活动性克罗恩病患者㊂63克立硼罗软膏适用于2岁及以上轻度至中度特应性皮炎患者的局部外用治疗㊂64依奇珠单抗注射液本品用于治疗适合系统治疗或光疗的中度至重度斑块型银屑病成人患者㊂65化湿败毒颗粒化湿解毒,宣肺泄热㊂用于湿毒侵肺所致的疫病,症见发热㊁咳嗽㊁乏力㊁胸闷㊁恶心㊁肌肉酸痛㊁咽干咽痛㊁食欲减退㊁口中粘腻不爽等㊂66宣肺败毒颗粒宣肺化湿,清热透邪,泻肺解毒㊂用于湿毒郁肺所致的疫病㊂症见发热,咳嗽,咽部不适,喘促气短,乏力,纳呆,大便不畅;舌质暗红,苔黄腻或黄燥,脉滑数或弦滑㊂67关黄母颗粒补益肝肾,滋阴降火㊂用于女性更年期综合征(绝经前后诸证)中医辨证属肝肾阴虚证,症见烘热汗出,头晕,耳鸣,腰膝酸软或足跟痛,少寐多梦,急躁易怒等㊂68芍麻止痉颗粒69桑枝总生物碱片70艾曲泊帕乙醇胺片本品适用于既往对糖皮质激素㊁免疫球蛋白等治疗反应不佳的成人和12岁及以上儿童慢性免疫性(特发性)血小板减少症(I T P)患者,使血小板计数升高并减少或防止出血㊂本品仅用于因血小板减少和临床条件导致出血风险增加的I T P患者㊂序号药品名称备注71康替唑胺片本品适用于治疗由对本品敏感的金黄色葡萄球菌(甲氧西林敏感和耐药的菌株)㊁化脓性链球菌或无乳链球菌引起的复杂性皮肤和软组织感染㊂为减少细菌耐药的发生,确保康替唑胺及其他抗菌药物的疗效,本品应仅用于治疗已确诊或高度怀疑由敏感菌引起的感染㊂本品不适用于治疗革兰阴性菌感染㊂如确诊或怀疑合并有革兰阴性菌感染,建议联合应用抗革兰阴性菌药物进行治疗㊂在选择或调整抗菌药物治疗方案时,应考虑进行细菌培养和药敏试验以分离并鉴定感染病原菌,确定其对本品的敏感性㊂如果没有这些试验的药敏数据做参考,则应根据当地细菌耐药性和抗菌药物敏感性等流行病学情况进行经验性治疗㊂在获得以上药敏结果之前可以先使用本品进行治疗,获得药敏结果后再选择进行针对性的病原治疗㊂72苹果酸奈诺沙星氯化钠注射液为减少耐药菌的产生,保证奈诺沙星及其他抗菌药物的有效性,本品只用于治疗已证明或高度怀疑由敏感细菌引起的感染㊂在选择或修改抗菌药物治疗方案时,应考虑细菌培养和药敏试验的结果㊂如果没有这些试验的数据做参考,则应根据当地流行病学和病原菌敏感性进行经验性治疗㊂在治疗前应进行细菌培养和药敏试验以分离并鉴定感染病原菌,确定其对本品的敏感性㊂在获得以上检验结果之前可以先使用本品进行治疗,得到检验结果之后再选择适当的治疗方法㊂在此类中的其他药物相同,使用本品进行治疗时,在治疗期间应定期进行细菌培养和药敏试验以掌握病原菌是否对抗菌药物持续敏感,并在细菌出现耐药性后能够及时发现㊂本品可用于治疗对奈诺沙星呈现敏感的肺炎链球菌㊁金黄色葡萄球菌㊁流感嗜血杆菌㊁副流感嗜血杆菌㊁卡他莫拉菌㊁肺炎克雷伯菌㊁铜绿假单胞菌以及肺炎支原体㊁肺炎衣原体和嗜肺军团菌所致的成人(ȡ18岁)社区获得性肺炎㊂在使用本品时可依据患者病情严重程度及耐受性选用注射剂或口服制剂,也可选用治疗初期予以注射剂静脉输注,病情趋缓解后继以口服给药的序贯疗法㊂73注射用两性霉素B 胆固醇硫酸酯复合物本品适用于患有深部真菌感染的患者;因肾损伤或药物毒性而不能使用有效剂量的两性霉素B的患者,或已经接受过两性霉素B治疗无效的患者均可使用㊂序号药品名称备注74注射用磷酸左奥硝唑酯二钠为减少耐药菌的产生,保证磷酸左奥硝唑酯二钠㊁左奥硝唑㊁奥硝唑及其他抗菌药物的有效性,磷酸左奥硝唑酯二钠只用于治疗或预防已证明或高度怀疑由敏感细菌引起的感染㊂在选择或修改抗菌药物治疗方案时,应考虑细菌培养和药敏试验结果㊂如果没有这些试验的数据做参考,则应当根据当地流行病学和病原菌敏感性进行经验性治疗㊂在治疗前应进行细菌培养和药敏试验以分离并鉴定感染病原菌,确定其对该抗菌药物的敏感性,在获得以上药敏结果之前可以先使用该抗菌药物进行治疗,得到药敏结果后再选择进行针对病原菌的治疗㊂在治疗期间应定期进行细菌培养和药敏试验以掌握病原菌是否对抗菌药物持续敏感,并在细菌出现耐药性后能够及时发现㊂本品仅适用于不宜口服给药的患者㊂本品适应症为:1.本品适用于治疗肠道和肝脏严重的阿米巴病㊂2.本品适用于治疗奥硝唑敏感厌氧菌引起的手术后感染㊂3.本品适用于预防外科手术导致的敏感厌氧菌感染㊂调整限定支付范围门诊特定药品名单序号药品名称备注1艾尔巴韦格拉瑞韦片本品用于治疗成人慢性丙型肝炎(C H C)感染㊂2索磷布韦维帕他韦片本品用于治疗成人慢性丙型肝炎病毒(H C V)感染㊂3来迪派韦索磷布韦片本品适用于治疗成人和12至<18岁青少年的慢性丙型肝炎病毒(H C V)感染㊂4注射用重组人凝血因子Ⅶa 用于下列患者群体出血的治疗,以及外科手术或有创操作出血的防治:1.凝血因子V I I I或I X的抑制物>5个B e t h e s d a单位(B U)的先天性血友病患者;预计对注射凝血因子V I I I或凝血因子I X,具有高记忆应答的先天性血友病患者;2.获得性血友病患者;3.先天性凝血因子V I I(F V I I)缺乏症患者;4.具有血小板膜糖蛋白I I b-I I I a(G P I I b-I I I a)和/或人白细胞抗原(H L A)抗体和既往或现在对血小板输注无效或不佳的血小板无力症患者㊂5罗沙司他胶囊本品适用于慢性肾脏病(C K D)引起的贫血,包括透析及非透析患者㊂序号药品名称备注6信迪利单抗注射液1.本品适用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的治疗㊂本适应症是基于一项单臂临床试验的客观缓解率和缓解持续时间结果给予的有条件批准㊂本适应症的完全批准将取决于正在开展中的确证性随机对照临床试验能否证实信迪利单抗治疗相对于标准治疗的显著临床获益㊂2.信迪利单抗联合培美曲塞和铂类化疗,用于未经系统治疗的表皮生长因子受体(E G F R)基因突变阴性和间变性淋巴瘤激酶(A L K)阴性的晚期或复发性非鳞状细胞非小细胞肺癌的治疗㊂3.信迪利单抗联合吉西他滨和铂类化疗,用于不可手术切除的晚期或复发性鳞状细胞非小细胞肺癌的一线治疗㊂4.信迪利单抗联合贝伐珠单抗,用于既往未接受过系统治疗的不可切除或转移性肝细胞癌的一线治疗㊂7替雷利珠单抗注射液1.经典型霍奇金淋巴瘤:本品适用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的治疗㊂本适应症是基于一项单臂临床试验的客观缓解率和缓解持续时间结果给予的附条件批准㊂本适应症的完全批准将取决于正在开展中的确证性随机对照临床试验能否证实本品治疗相对于标准治疗的显著临床获益㊂2.尿路上皮癌:本品适用于P D-L1高表达的含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性尿路上皮癌的治疗㊂本适应症是基于一项单臂临床试验的客观缓解率和缓解持续时间结果给予的附条件批准㊂本适应症的完全批准将取决于正在开展中的确证性随机对照临床试验能否证实本品治疗相对于标准治疗的显著临床获益㊂3.非小细胞肺癌:本品联合紫杉醇和卡铂用于不可手术切除的局部晚期或转移性鳞状非小细胞肺癌的一线治疗㊂本品联合培美曲塞和铂类化疗用于表皮生长因子受体(E G F R)基因突变阴性和间变性淋巴瘤激酶(A L K)阴性㊁不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌的一线治疗㊂4.肝细胞癌:本品适用于至少经过一种全身治疗的肝细胞癌(H C C)的治疗㊂本适应症是基于一项I I期临床试验的客观缓解率和总生存期结果给予的附条件批准㊂本适应症的完全批准将取决于正在开展中的确证性随机对照临床试验能否证实本品治疗相对于标准治疗的显著临床获益㊂。
滋阴益气活血法联合艾塞那肽对2型糖尿病患者血糖及体重的影响

滋阴益气活血法联合艾塞那肽对2型糖尿病患者血糖及体重的影响刘婵娟【摘要】将76例口服二甲双胍和/或磺脲类药物血糖控制欠佳者按随机对照分组方法分为对照组与治疗组.两组患者在原治疗基础基础上,对照组给予艾塞那肽注射液;治疗组给予自拟滋阴益气活血方剂联合艾塞那肽注射液.观察两组治疗前后空腹血糖(FBG)、餐后2h血糖(2hPG)、糖化血红蛋白(HbA1c)、BMI值变化情况.结果两组治疗前BMI、FBG、2h PG和HbA1c差异均无统计学意义(P>0.05).两组FBG、2h PG和HbA1c均较治疗前显著降低,差异有统计学意义(P<0.05),治疗后组间比较无统计学意义(P>0.05).治疗后对照组较治疗前BMI值无显著变化(P>0.05);治疗组较治疗前BMI值显著降低,差异有统计学意义(P>0.05).滋阴益气活血法结合艾塞那肽可以降低2型糖尿病患者血糖及体重,且较单独使用艾塞那肽的疗效更佳,可作为治疗2型糖尿病的中西医结合疗法在临床中推广使用.【期刊名称】《现代诊断与治疗》【年(卷),期】2017(028)016【总页数】2页(P2971-2972)【关键词】滋阴益气活血法;艾塞那肽;2型糖尿病;临床研究【作者】刘婵娟【作者单位】深圳市龙华区中心医院,广东深圳 518110【正文语种】中文【中图分类】R587.1糖尿病是一种多发疾病,目前尚无根治的方法。
本研究以现代医模式生物-心理-社会医学模式出发,以提高糖尿病患者生命质量为目的,针对滋阴益气活血法联合艾塞那肽对2型糖尿病患者血糖及体重的影响进行临床观察分析,报道如下。
1.1 诊断标准1.1.1 中医诊断标准诊断标准参照《中医内科学》[1]制定:诊断病名为消渴,临床表现为口渴多饮﹑多食﹑小便频数﹑量多,口燥咽干﹑舌红少苔﹑脉弦。
1.1.2 西医诊断标准糖尿病的诊断参照:美国糖尿病协会于1997年发表的糖尿病诊断标准与分型的文件表述[2]。
常见降糖药物一览表

肝功能损害
马来酸罗格列酮
文迪雅
4
1~2次/天;空腹或进餐时服用
盐酸吡格列酮
艾可拓;卡司平
15
1次/天;空腹或进餐时服用
非磺酰脲类促胰岛素分泌药(格列奈类)
刺激胰岛β细胞分泌胰岛素
低血糖
瑞格列奈
诺和龙;孚来迪
0.5;1;2
3次/日;
餐时服或餐前30分钟内服用
不进餐不服药
那格列奈
唐力
120
GLP-1肠促胰素类似物
瑞易宁控释片
5
1次/天;餐前半小时
整片吞服,不能嚼碎 分开或碾碎
康贝克缓释胶囊
10
格列喹酮
糖适平
30
1~3次/天;餐前半小时
格列美脲
亚莫利佑苏
1;2
1次/天;早餐前即刻服用
如不吃早餐,建议在第一次正餐之前即刻服用
伊瑞
2
含磺脲类的中西药结合制剂
同磺脲类
同磺脲类
西药成分为格列本脲
消渴丸
2.5/10丸
1~3次/天;餐前半小时
胰岛素类似物
10-20min
1-4h
14-24h
IH
紧邻餐前注射,必要时餐后立即注射
正在使用可在不超过30℃存放4周
双胍类
增加周围组织对胰岛素的敏感性
胃肠道反应
乳酸性酸中毒
二甲双胍
二甲双胍
250
2~3次/天;餐中或餐后服
格华止
500
α—糖苷酶抑制剂
延缓碳水化合物的降解,减慢肠道葡萄糖的吸收速度
腹胀
排气
阿卡波糖
拜唐苹;卡博平
50
3次/天;餐前吞服或餐中嚼服
如不吃主食则不服药
4种降糖药物治疗新诊断2型糖尿病的疗效对比分析

4种降糖药物治疗新诊断2型糖尿病的疗效对比分析张新霞;杨启悦【摘要】目的对比分析4种降糖药物治疗新诊断2型糖尿病(T2DM)的疗效.方法纳入128例新诊断T2DM患者为研究对象,随机分为4组,各32例,A组予以二甲双胍,B组予以艾塞那肽,C组予以胰岛素,D组予以噻唑烷二酮,比较4组治疗前后血糖相关参数、胰升糖素样肽-1 (GL Pd)水平、胰岛素敏感性、不良反应与体重变化.结果治疗后,4组HbAlc、FPG、2 h-PG均显著降低,且B、C、D3组均明显低于A组(P<0.05),而这3组间无明显差异(P>0.05);B组GLP-1水平明显高于其他3组(P<0.05);A组胰岛敏感性指数(ISI)、Cederholm胰岛素敏感性指数(ISIced)及定量胰岛素敏感性检测指数(QUICKI)明显小于其他3组(P<0.05),其他3组间则均无显著差异(P>0.05).结论 4种降糖药物均能有效控制新诊断T2DM患者的血糖水平,其中胰岛素、艾塞那肽和噻唑烷二酮的降糖效果均优于二甲双胍,且艾塞那肽提升G1P-1的作用最显著,值得进一步深入研究.【期刊名称】《西南国防医药》【年(卷),期】2018(028)007【总页数】3页(P620-622)【关键词】降糖药物;2型糖尿病;胰升糖素样肽-1;血糖;疗效【作者】张新霞;杨启悦【作者单位】610075成都,成都中医药大学附属医院内分泌科;610075成都,成都中医药大学附属医院内分泌科【正文语种】中文【中图分类】R587糖尿病是一种常见慢性代谢性疾病,主要病理变化表现为胰岛素分泌不足或生物活性降低,导致糖、蛋白质及脂肪代谢异常。
研究显示,胰升糖素样肽-1(GLP-1)水平异常是引发2型糖尿病(T2DM)的主要病理生理机制之一[1]。
早期发现、及时诊断并接受早期治疗可促进新诊断T2DM的快速康复。
但目前市面上降糖药物有很多,各种药物对T2DM患者血糖及其他指标的影响也各有不同,如何选择安全有效的药物治疗新诊断T2DM成为目前的研究热点之一。
安徽省国家谈判药品“双通道”管理目录(2021年版)

29
艾塞那肽
注射剂
*
限二甲双胍等口服降糖药或胰岛素控制效果不佳的BMI≥25的患者,首次处方时需由二级及以上医疗机构专科医师开具处方。
2020年1月1日至2021年12月31日
30
呋喹替尼
口服常释剂型
94.5元(1mg/粒)
限转移性结直肠癌患者的三线治疗。
2020年1月1日至2021年12月31日
2021日至2022年12月31序号药品名称剂型医保支付标准备注协议有效期28重组人脑利钠肽注射剂445元05mg支限二级及以上医疗机构用于规范治疗效果不佳的急性失代偿性心力衰竭短期治疗单次住院支付不超过3日至2021年12月31限二甲双胍等口服降糖药或胰岛素控制效果不佳的bmi25的患者首次处方时需由二级及以上医疗机构专科医师开具处方
2020年1月1日至2021年12月31日
41
克唑替尼
口服常释剂型
*
限间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌患者或 ROS1阳性的晚期非小细胞肺癌患者。
2021年3月1日至2022年12月31日
42
乌美溴铵维兰特罗
吸入粉雾剂
219元((乌美溴铵62.5μg,维兰特罗25μg)*30吸)
贝伐珠单抗
注射剂
*
限晚期转移性结直肠癌或晚期非鳞非小细胞肺癌。
2020年1月1日至2021年12月31日
18
尼妥珠单抗
注射剂
*
限与放疗联合治疗表皮生长因子受体(EGFR)表达阳性的III/IV期鼻咽癌。
2020年1月1日至2021年12月31日
19
阿达木单抗
注射剂
1290元(40mg/0.4ml 预填充式注射笔,
抗肿瘤药物信息

盒 瓶 盒 盒 盒 盒 盒 袋 盒 盒 支 支 支 支 盒 支 盒 支 盒 盒 盒 盒 支 盒 听 袋 支 盒 支 支 支 支 瓶 支 支 支 支 盒 盒 支 支 盒 瓶 瓶 瓶 瓶 瓶
山东罗欣药业股 上海复旦张江生 上海罗氏制药有限公司 德国 R0TTENDORF PHARMA GMBH 惠氏制药有限公司 德国勃林格殷格翰国际公司Boehringer 沈阳福宁药业有 日本三菱制药株 南京绿叶思科药 四川科瑞德制药 瑞士诺华制药有限公司 Aventis Pharma Aventis Pharma 齐鲁制药有限公司 卫材(中国)药业 比利时杨森制药公司 江苏恒瑞医药股份有限公司 江苏恒瑞医药股份有限公司 美国默沙东 北京紫光制药有 意大利Pharmacia epjohn S.P.A 德国苏威制药 天津药业集团新郑股份有限公司 萌蒂(中国)制药 Milupa GmbH &C 瑞典Fresenius Kabi AB 法国皮尔法伯 西班牙诺华 深圳市塞百诺基因技术有限公司 雪兰诺公司意大 北京三元基因工程有限公司 先灵葆雅授权比 北京双鹭药业股份有限公司 麒麟鲲鹏(中国)生物药业有限公司 麒麟鲲鹏(中国)生物药业有限公司 山东先声麦得津生物制药有限公司 沈阳三生制药股份有限公司 奥地利SG 上海丽珠制药有限公司 法国博福-益普生制药Beaufour Ipsen 山西普德药业股 意大利Alfa Wassermann S.P.A. 浙江海正药业股份有限公司 湖北科益药业股份有限公司 湖北科益药业股份有限公司 意大利福斯卡玛 重庆药友制药有限责任公司
注射用甲磺酸去铁胺 注射用两性霉素B脂质体 注射用磷酸肌酸钠 注射用硫酸长春地辛 注射用硫酸长春新碱 注射用洛铂 注射用门冬氨酸鸟氨酸 注射用奈达铂 注射用哌拉西林钠/三唑巴坦钠 注射用培美曲塞钠 注射用曲妥珠单抗 注射用替考拉宁 注射用胸腺五肽 注射用亚胺培南西司他丁钠 注射用盐酸吡柔比星 注射用盐酸博莱霉素 注射用盐酸托泊替康 注射用异环磷酰胺 注射用右丙亚胺 注射用重组人白介素-2(125Ala) 注射用重组人白细胞介素-11 注射用重组人凝血因子Ⅶa(冻干) 注射用唑来膦酸 注射用唑来膦酸 紫杉醇注射液 紫杉醇注射液 佐匹克隆片
胰岛素制剂贮藏要求2016.6.
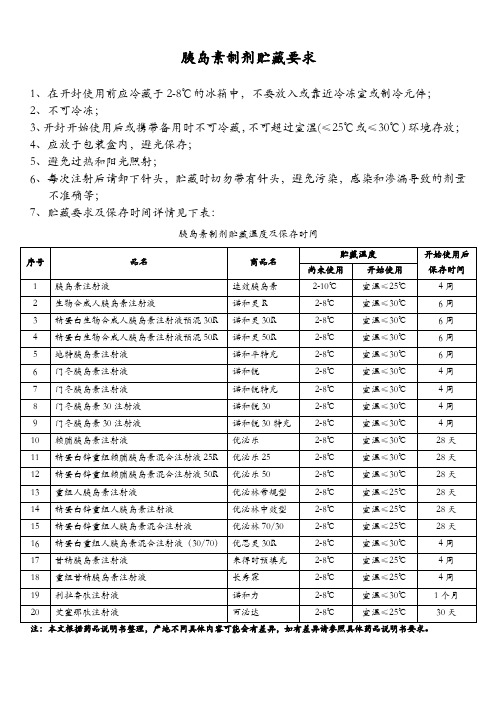
1、在开封使用前应冷藏于2-8℃的冰箱中,不要放入或靠近冷冻室或制冷元件;
2、不可冷冻;
3、开封开始使用后或携带备用时不可冷藏,不可超过室温(≤25℃或≤30℃)环境存放;
4、应放于包装盒内,避光保存;
5、避免过热和阳光照射;
6、每次注射后请卸下针头,贮藏时切勿带有针头,避免污染,感染和渗漏导致的剂量不准确等;
诺和锐30特充
2-8℃
室温≤30℃
4周
10
赖脯胰岛素注射液
优泌乐
2-8℃
室温≤30℃
28天
11
精蛋白锌重组赖脯胰岛素混合注射液25R
优泌乐25
2-8℃
室温≤30℃
28天
12
精蛋白锌重组赖脯胰岛素混合注射液50R
优泌乐50
2-8℃
室温≤30℃
28天
13
重组人胰岛素注射液
优泌林常规型
2-8℃
室温≤25℃
28天
14
精蛋白锌重组人胰岛素注射液优泌林中效型源自2-8℃室温≤25℃
28天
15
精蛋白锌重组人胰岛素混合注射液
优泌林70/30
2-8℃
室温≤25℃
28天
16
精蛋白重组人胰岛素混合注射液(30/70)
优思灵30R
2-8℃
室温≤30℃
4周
17
甘精胰岛素注射液
来得时预填充
2-8℃
室温≤25℃
4周
18
重组甘精胰岛素注射液
长秀霖
2-8℃
室温≤25℃
4周
19
利拉鲁肽注射液
诺和力
2-8℃
室温≤30℃
1个月
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
核准日期:年月日艾塞那肽注射液说明书请仔细阅读说明书并在医师指导下使用对艾塞那肽及其它成份过敏者禁用【药物名称】通用名称:艾塞那肽注射液英文名称:Exenatide Injection汉语拼音:Aisainatai Zhusheye【成份】本品主要成份为艾塞那肽。
化学结构式:分子式:C184H282N50O60S分子量:4186.6辅料:甘露醇、醋酸钠三水合物、间甲酚(2.00-2.4mg/ml)、冰醋酸、注射用水。
【性状】本品为无色澄明液体【适应症】本品用于改善2型糖尿病患者的血糖控制,适用于单用二甲双胍、磺酰脲类,以及二甲双胍合用磺酰脲类,血糖仍控制不佳的患者。
【规格】(1)5μg剂量刻度注射笔:0.25 mg/ml,1.2 ml/支,单次注射药量5μg,内含60次注射的药量。
(2)10μg剂量刻度注射笔:0.25 mg/ml,2.4 ml/支,单次注射药量10μg,内含60次注射的药量。
【用法用量】本品的起始剂量为每次5微克(μg),每日2次,在早餐和晚餐前60分钟内(或每天的2顿主餐前;给药间隔大约6小时或更长)皮下注射。
不应在餐后注射本品。
根据临床应答,在治疗1个月后剂量可增加至10微克。
每日2次。
每次给药应在大腿、腹部或上臂皮下注射给药。
本品推荐用于接受二甲双胍、一种磺酰脲类、二甲双胍合用一种磺酰脲类治疗,血糖仍控制不佳的2型糖尿病患者。
在二甲双胍治疗的基础上加用本品时,可继续使用二甲双胍的目前剂量,因为合用本品发生低血糖而需要进行调整二甲双胍剂量的可能性较低。
在磺酰脲类治疗基础上加用本品,应该考虑降低磺酰脲类的剂量,以降低低血糖发生的风险。
(参照【注意事项】,低血糖)本品为无色澄明液体,当溶液有颗粒、浑浊或变色时不得使用。
过有效期后不得使用。
尚无本品静脉或肌肉注射的安全性和有效性资料。
注射笔使用指南注射笔的详细操作图示和注射指导请参见本品包装盒中所附“注射笔使用手册”。
重要提示使用本注射笔前请仔细阅读“注射笔使用手册”,如果不完全按照使用手册操作可能会出现剂量错误、注射笔损坏或者发生感染。
·每次使用前请检查注射笔上的标签,确认其为自己所用的5μg或10μg注射笔。
·每支新笔第一次使用前,必须按照新笔设置的要求进行设置。
此设置仅在新笔第一次使用前进行。
·如果注射笔有任何部分的破裂或损坏,则不得使用。
·不推荐盲人或视力损伤者使用本注射笔。
如需使用应在接受过本品培训的人的帮助下使用。
·不得将此本品的注射笔中的药液移到其他注射器或药瓶中使用·确认本品笔芯中的药液是澄明、无色且无颗粒物。
如果不是,则不得使用。
·请按照医务人员推荐的无菌注射技术进行操作。
·注射笔从第1次设定后最多可用30天。
首次使用至30天后,既使用笔内尚余药液,也应丢弃。
当开始使用艾塞那肽注射笔时,请将第1次使用的日期和30天后的日期记录在使用手册的空白处。
注射笔特点·预装注射笔内含有60次皮下注射的药量,可供30天使用。
·对5μg注射笔每次注射剂量固定为5微克,对10μg注射笔每次注射剂量固定为10微克。
针头·本品包装盒内无注射笔针头。
注射笔可使用:-29(细)、30或31(更细)号规格的一次性针头。
请询问医生何种型号和长度的针头合适您使用。
·每次注射都应使用新针头。
每次注射完成后均应移除针头以防止艾塞那肽注射液泄露,也可防止产生气泡、减少针头堵塞而将感染的风险减到最低。
·不得与他人共用你的注射笔或针头。
·使用前一定要确认针头牢固地安装在注射笔上。
针头未安装好之前不得按注射按钮。
·使用过的针头弃于放锐器用的容器中或按医生的要求妥善处理。
不得将注射笔在带有针头时丢弃。
·医生及医务工作者应按当地要求或管理规定处理注射针头。
清洁·如果需要,可以用一块干净、潮湿的布擦拭注射笔的表面。
·在正常使用过程中,注射笔芯顶部的外侧可能会出现一些白色的颗粒。
可以用酒精纱布或酒精棉签擦去。
【不良反应】临床研究数据与二甲双胍、一种磺酰脲类或二者合用*数据来源于3项30周安慰剂对照临床试验(艾塞那肽组N=963)艾塞那肽与一种磺酰脲类合用,或艾塞那肽与二甲双胍及一种磺酰脲类合用,与对照组(安慰剂合用磺酰脲,或安慰剂合用一种磺酰脲及二甲双胍)相比低血糖的发生率增加,并表现出与艾塞那肽和磺酰脲类呈剂量依赖性。
大多数低血糖的程度为轻到中度,可通过口服碳水化合物缓解。
(见【注意事项】)为减少与磺酰脲类合用时发生低血糖的风险,应考虑降低磺酰脲类药物的原有剂量。
(见【用法用量】)然而,本品与二甲双胍何用时,相对于安慰剂合用二甲双胍对照组,低血糖的发生率并未升高。
报告的最常见的不良反应为具有剂量依赖性的轻度到中度恶心。
大多数治疗开始时出现恶心的患者,症状的发生频度和严重程度会随着继续治疗时间的延长而减轻。
在30周安慰剂对照研究中,患者因不良反应事件退出临床试验的发生率在艾塞那肽治疗组为7%,而在安慰剂组为3%。
导致艾塞那肽治疗组患者退出试验的最常见不良反应为恶心(占3%)和呕吐(占1%);在安慰剂组,<1%的患者因恶心退出试验,0%因呕吐退出试验。
在52周的开放延长试验中所观察到的不良事件类型与30周对照试验中所观察到的相似。
自发报告自本品上市以来,报告了下述其它的不良反应:胃肠道不适:腹胀、腹痛、嗳气、便秘、胃肠胀气(少见),急性胰腺炎(罕见)。
(见【注意事项】)一般状况和注射部位反应:注射部位反应(常见)。
变态反应:过敏反应(非常罕见)。
研究发现:合用华法林时INR升高且有些报告伴有出血。
(见【注意事项】及【药物相互作用】)代谢和营养异常:脱水(罕见),通常伴有恶心、呕吐和/或腹泻,体重减轻。
(见【注意事项】)神经系统异常:味觉障碍(少见),嗜睡(罕见)。
皮肤和皮下组织异常:瘙痒症和/或荨麻疹、斑丘疹、血管性水肿(罕见)、脱发(罕见)。
肾及尿路异常:肾功能改变,包括急性肾功能衰竭、慢性肾功能衰竭恶化、肾功能损伤、血清肌酐升高(罕见)。
(见【注意事项】)免疫原性与蛋白和多肽药物的潜在免疫原性特征一致,在接受本品治疗后,患者可能产生抗艾塞那肽抗体。
大多数产生抗体的患者,其抗体滴度随时间延长而降低。
在安慰剂对照临床试验中,治疗30周时38%患者产生了低滴度的抗艾塞那肽抗体。
这组患者血糖控制(HbA1c)水平通常与无抗体滴度患者的相似。
治疗30周时,另有6 %的患者产生较高的抗体,其中约一半(在30周对照试验中为艾塞那肽组患者的3%)患者的血糖对本品应答反应衰减; 其余患者的血糖应答与未产生抗体的患者相似。
【禁忌】本品禁用于对艾塞那肽或本品其其它成分过敏的患者。
【注意事项】对于胰岛素依赖患者本品不可以替代胰岛素。
本品不适合1型糖尿病患者或糖尿病酮酸中毒的治疗。
接受本品治疗的患者在上市后报告中有急性胰腺炎的病例,应告知患者剧烈的腹痛并有可能伴有呕吐是急性胰腺炎的典型症状。
一旦疑似胰腺炎,应停止使用本品及其它可疑的药物,同时进行确诊检查及适时的治疗。
对确诊为胰腺炎但并未确定由其它原因引起的胰腺炎,不推荐恢复使用本品。
不推荐本品用于终末期肾脏疾病或严重肾功能不全(肌苷清除率<30ml/min)患者。
接受透析的终末期肾脏疾病患者,由于胃肠道不良反应,不能很好地耐受单剂量5微克本品。
尚未进行本品在严重胃肠道疾病(包括胃轻瘫)患者中的研究。
本品通常可引起为肠道不良反应,包括恶心、呕吐和腹泻。
因此,不推荐本品用于严重胃肠道疾病患者。
本品对18岁以下患者的安全性和有效性尚未确立。
(参见【药代动力学】)尚未进行本品与胰岛素、D-苯丙氨酸衍生物、氯茴苯酸类、a-葡萄糖苷酶抑制剂、普兰林态(amylinomimetics)或二肽基肽酶IV抑制剂(dipeptidyl peptidase-4 inhibitors)合用的研究已有罕见的自发报告有肾功能改变,包括血清肌酐升高,肾功能损伤,慢性肾功能衰竭恶化和急性肾功能衰竭,有些需要血液透析。
部分上述情况发生在接受一种或多种影响肾功能/水化状态的药理学制剂和/或出现恶心、呕吐/腹泻这些可能影响水化状态症状的患者中。
合用药物包括血管紧张素转化酶抑制剂,非甾体抗炎药和利尿药。
停止使用产生潜在病因的药物(包括艾塞那肽)并给予支持性治疗,观察到肾功能改变可以逆转。
在临床前和临床研究中未见艾塞那肽对肾脏有直接危害。
(参见【不良反应】中“自发报告”)罕见急性胰腺炎的自发报告。
应告知患者急性胰腺炎的典型症状:持续、剧烈的腹痛。
并且一旦疑似为胰腺炎,应停止使用艾塞那肽。
给予支持性治疗后胰腺炎可治愈,但有非常罕见的病例出现胰腺坏死、出血性胰腺炎和/或死亡。
如果确诊为胰腺炎,不推荐恢复使用艾塞那肽。
自本品上市以来,有一些关于华法林和本品合用后出现INR(国际标准化比率)升高、有时伴有出血的自发报告。
(参见【药物相互作用】及【不良反应】)艾塞那肽治疗的患者中,有报告体重快速减轻每周超过1.5Kg的事件。
这种体重减轻的程度可能会产生有害的后果。
低血糖与安慰剂合用磺酰脲类相比,本品合用磺酰脲类低血糖发生率升高。
为了降低本品合用磺酰脲类发生低血糖的风险,可考虑减少磺酰脲类药物的剂量。
(参见【用法用量】)然而,与安慰剂合用二甲双胍相比,未观察到本品合用二甲双胍后低血糖的发生率增高。
与安慰剂合用噻唑烷二酮类相比,本品合用噻唑烷二酮类后低血糖的发生率相似。
当本品作为单一疗法使用时,低血糖的发生率为5%,而安慰剂为1%.在健康志愿者的随机、双盲、对照研究中,本品不会改变反调节激素对胰岛素诱发的低血糖的应答。
对驾驶和操作机器的影响当艾塞那肽与磺酰脲类药物合用时,应告知患者在驾驶或操作机器时采取必要措施防止发生低血糖。
【孕妇及哺乳期妇女用药】妊娠根据AUC,当小鼠的全身暴露量为人体最大推荐剂量(20微克/天)暴露量的3倍时,艾塞那肽可能造成小鼠胚胎和新生仔生长迟滞及骨骼效应。
,根据AUC,当兔全身暴露量(AUC)相当于人体最大推荐剂量(20微克/天)暴露量的12倍时,艾塞那肽可能造成兔骨骼效应。
尚无妊娠妇女的足够资料和良好的对照临床研究。
因此,只有本品对胎儿的潜在益处大于潜在风险时,才考虑妊娠期间使用本品。
雌性小鼠从交配前2周开始至交配再至妊娠第7天,皮下注射剂量6 、 68 或760 微克/公斤/天的艾塞那肽,即使剂量高达760微克/公斤/天,根据AUC,全身暴露量为人体最大推荐剂量(20微克/天)暴露量的390倍时,亦未见胚胎毒性效应。
在小鼠妊娠的第6天到15天(器官发生期),皮下注射剂量6 、68 、460 、760微克/公斤/天的艾塞那肽,在6微克/公斤/天剂量组,观察到腭裂(有些伴有缺口)以及不规则的肋骨和颅骨的骨化,根据AUC,此全身暴露量相当于人体最大推荐剂量(20微克/天)暴露量的3倍时。
