【三维设计】2015年高考化学一轮复习精品课件:热点专题课 化学反应速率、化学平衡的图像分析
【三维设计】2015高考(江苏用)化学一轮配套课件:专题8 第4单元 难溶电解质的沉淀溶解平衡
提示:前者 c(Cl-)浓度大,AgCl 在其中的溶解度小。
化学
首页
上一页
下一页
末页
第四单元
难溶电解质的沉淀溶解平衡
结束
(6)(2012· 江苏高考)向浓度均为 0.1 mol· L-1 NaCl 和 NaI 混合溶液中 滴加少量 AgNO3 溶液,出现黄色沉淀,说明 Ksp(AgCl)>Ksp(AgI)。 (√ )
第四单元
难溶电解质的沉淀溶解平衡
结束
第四单元
难溶电解质的沉淀溶解平衡
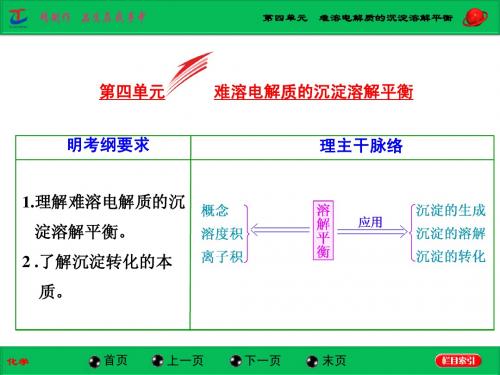
明考纲要求
理主干脉络
1.理解难溶电解质的沉
淀溶解平衡。 2 .了解沉淀转化的本 质。
化学
首页
上一页
下一页
末页
第四单元
难溶电解质的沉淀溶解平衡
结束
一、沉淀溶解平衡原理 1.概念
在一定温度下,当难溶电解质溶于水形成饱和溶液时,溶解 ____ 速率和沉淀 ____速率相等的状态。
答案:除去NaCl溶液中的BaCl2可用适量Na2SO4溶液,Ba2
②矿物转化:CuSO4 溶液遇 ZnS 转化为 CuS,离子方程式
2+ 2+ 为: ZnS+Cu ===CuS+Zn 。
化学
首页
上一页
下一页
末页
第四单元
难溶电解质的沉淀溶解平衡
结束
1.判断正误(正确的打“√”,错误的打“×”)。
(1)(2013· 重庆高考)AgCl 沉淀易转化为 AgI 沉淀且 K(AgX)= c(Ag+)· c(X-),故 K(AgI)<K(AgCl)。 (√ )
高三化学高考备考一轮复习化学反应速率与化学平衡图像课件

B.t2时改变的条件:向容器中加入C
C.平衡时A的体积分数φ:φ(Ⅱ)>φ(Ⅰ)
D.平衡常数K:K(Ⅱ)<K(Ⅰ)
B.根据图像变化曲线可知,t2~t3过程中,t2时v正瞬间不变,平衡过程中不断增大,则说
明反应向逆反应方向移动,且不是“突变”图像,属于“渐变”过程,所以排除温度与催化剂等
B.t1时,c(X) =c(Y) =c(Z)
Z
X
C.t2时,Y的消耗速率大于生成速率
Y
D.t3后,c(Z)=2c0—c(Y)
【分析】由题中信息可知,反应X=Z经历两步:①X→Y;②Y→2Z。因此,图中呈不断
减小趋势的a线为X的浓度c随时间t的变化曲线,呈不断增大趋势的线为Z的浓度c随时间t
的变化曲线,先增大后减小的线为Y的浓度c随时间t的变化曲线。
(四)化学反应速率与化学平衡图像
10.(2022·广东)反应X=Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随
时间t的变化曲线如图所示。下列说法不正确的是
A.a为c(X)随t的变化曲线
B.t1时,c(X) =c(Y) =c(Z)
C.t2时,Y的消耗速率大于生成速率
Z
X
Y
D.t3后,c(Z)=2c0—c(Y)
化学反应速率与化学平衡图像
命题方向
2023届
高考化学复习
回眸高考
模型建构
考题预测
教学策略
命题方向
2023届
高考化学复习
回眸高考
模型建构
考题预测
教学策略
回眸高考
(一)化学反应速率的测定与实验数据处理
(二)化学平衡状态的判断与理解
【三维设计】(人教通用版)2015届高考化学一轮总复习讲义 第一节 化学反应的热效应解析

第一节化学反应的热效应一、焓变 反应热 1.定义反应热:化学反应过程中放出或吸收的热量,符号:ΔH , 单位:kJ/mol (或kJ·mol -1)。
焓变:生成物与反应物的内能差,ΔH =H (生成物)-H (反应物)。
恒压条件下的反应热等于焓变。
2.吸热反应与放热反应 (1)从能量高低角度理解(2)从化学键角度理解二、热化学方程式1.热化学方程式表示参加反应的物质的量和反应热的关系的化学方程式。
2.意义热化学方程式不仅能够表明化学反应中的物质变化,也能表明化学反应中的能量变化。
如2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1:表示在25℃、101 kPa条件下,2_mol气态H2和1_mol气态O2反应生成2_mol液态H2O所放出的热量为571.6_kJ。
三、燃烧热和中和热四、盖斯定律及应用1.含义不管化学反应是一步完成还是分几步完成,其反应热是相同的,它只与反应体系的始态和终态有关,而与反应途径无关。
2.应用间接计算某些反应(反应热无法直接测得)的反应热。
如,则有ΔH=ΔH1+ΔH2。
两个关系:①⎭⎬⎫A ――→ΔH 11aBaA ――→ΔH 2B ΔH 2=a·ΔH 1②AΔH 1ΔH 2B ,ΔH 1=-ΔH 2。
五、能源1.判断下列描述的正误(正确的打“√”,错误的打“×”)。
(1)伴随着能量变化的物质变化都是化学变化。
( )(2)同温同压下,H 2(g)+Cl 2(g)===2HCl(g)在光照和点燃条件下的ΔH 不同。
( ) (3)在稀溶液中,H +(aq)+OH -(aq)===H 2O(l)ΔH =-57.3 kJ/mol ,若将含0.5 mol H 2SO 4的浓H 2SO 4与含1 mol NaOH 的溶液混合,放出的热量大于57.3 kJ 。
( )(4)已知相同条件下2SO 2(g)+O 23(g) ΔH 1,反应2SO 2(s)+O 23(g)ΔH 2,则ΔH 1>ΔH 2。
高考化学一轮复习专题七化学反应速率与化学平衡课件

正反
平衡转化率是指平衡时已转化了的某反应物的量与转化前该反应物的量 之比,用来表示反应限度。对于反应aA+bB cC+dD,反应物A的平衡转 化率可以表示为: α(A)= A 的 ×初 10始 0%浓 。度 -A 的 平 衡 浓 度
A 的 初 始 浓 度
生成物的产率是实际产量占理论产量的百分数。一般来说,转化率越高,原 料利用率越高,产率越高。 产率= 产物×实 10际 0%质量
(2)对于反应前后气体体积不变的反应,改变压强时,正、逆反应速率会同 等程度地改变。因此,对于反应前后气体体积可变的反应,如N2(g)+3H2(g) 2NH3(g),压缩体积,正反应速率增大程度大于逆反应速率增大程度,即v正>v逆,反 应正向移动。
12/12/2021
增大反应物的浓度,正反应速率急剧增大,然后逐渐减小,逆反应速率逐渐 增大,最终v正=v逆,重新建立平衡。 催化剂同等程度降低正、逆反应所需活化能,即同等程度地改变正、逆反 应速率,与反应物或生成物的状态无关,如图所示。此时仍v正=v逆,平衡不移 动。
c a (A) c。b (B对) 于该化学反应aA(g)+bB(g) cC
(g)+dD(g)的任意状态,浓度商Qc= c c (C。) 若c d Q(Dc>) K,则该反应向 逆
ca (A) cb (B)
反应 方向进行;若Qc=K,则该反应达到平衡;若Qc<K,则该反应向
应 方向进行。
12/12/2021
考点清单
考点一 化学反应速率 一、化学反应速率 1.表示方法 用单位时间内反应物或生成物的① 物质的量浓度 的变化来表示, 通常用单位时间内反应物浓度的② 减少 或生成物浓度的③ 增 加 来表示。不管用哪种物质表示,均为正值。
高考化学一轮复习 专题7 化学反应速率与化学平衡 3 第三单元 化学平衡的移动课件

1.01 5.07 10.1
25.3
50.7
673
99.2 99.6 99.7
99.8
99.9
723
97.5 98.9 99.2
99.5
99.6
773
93.5 96.9 97.8
98.6
99.0
12/11/2021
下列说法不正确的是 A.一定压强下降低温度,SO2 平衡转化率增大 B.在不同温度、压强下,转化相同物质的量的 SO2 所需要的时间相等 C.使用催化剂可以缩短反应达到平衡所需的时间 D.工业生产通常不采取加压措施是因为常压下 SO2 转化率已相当高
即能分析出正反应为__放_____热反应。
12/11/2021
四、特殊图像 1.如图,对于化学反应:mA(g)+nB(g) pC(g)+qD(g),M 点前,表示化学反应从反 应物开始,则 v 正>v 逆;M 点为刚达到的平衡点;M 点后为平衡受温度的影响情况,即 升温,A%增大(C%减小),平衡左移,ΔH__<_____0。
12/11/2021
5.下列实验事实不能用平衡移动原理解释的是( )
A.
B.
t/℃
25
Kw/10-14
1.01
50
100
5.47
55.0
12/11/2021
C.
D.
c(氨水)/(mol·L-1)
pH
0.1
0.01
11.1
10.6
12/11/2021
解析:选 C。A.二氧化氮气体中存在平衡:2NO2 N2O4,体系的温度变化会使平衡发 生移动。B.不同温度下水的电离平衡常数不同,温度升高促进水的电离,电离平衡常数 增大。C.向过氧化氢溶液中加入二氧化锰,加速了过氧化氢的分解,这是二氧化锰的 催化作用,不能用平衡移动原理解释。D.氨水的浓度减小为原来的十分之一,但其 pH 的变化小于 1,说明氨水在稀释的过程中平衡:NH3·H2O NH4++OH-发生了移动。
高考化学一轮复习 专题7 化学反应速率与化学平衡 1 第一单元 化学反应速率课件

温度/℃
NO 达到所列转化率需要时间/s
50%
90%
98%
30
12
250
2 830
1.0
90
25
510
5 760
30
0.2
3.9
36
8.0
90
0.6
7.9
74
12/11/2021
根据表中数据,下列说法正确的是
()
A.升高温度,反应速率加快
B.增大压强,反应速率变慢
C.在 1.0×105 Pa、90 ℃条件下,当转化率为 98%时反应已达平衡
1.表示方法 通常用单位时间内反应物浓度的__减__少___或生成物浓度的__增__加___来表示。 2.数学表达式及单位 表达式:v=ΔΔct ,单位为_m__o_l_·L__-_1_·m__i_n_-_1或____m_o_l_·_L_-_1_·_s-__1 。 3.规律 同一反应在同一时间内,用不同物质来表示的反应速率可能__不__同___,但反应速率的数 值之比等于这些物质在化学方程式中的___化__学__计__量__数___之比。
答案:D
()
12/11/2021
3.(2019·浙江 4 月选考,T22)高温高压液态水具有接近常温下弱酸的 c(H+)或弱碱的 c(OH-),油脂在其中能以较快的反应速率水解。与常温常压水相比,下列说法不正确
的是
()
A.高温高压液态水中,体系温度升高,油脂水解反应速率加快
B.高温高压液态水中,油脂与水的互溶能力增强,油脂水解反应速率加快 C.高温高压液态水中,c(H+)增大,可催化油脂水解反应,且产生的酸进一步催化水
(1)化学反应速率
及其简单计算
b T18 T21 T21
高三化学一轮复习 专题讲座十化学反应速率、化学平衡计算通关课件
专题讲座十 化学反应速率、化学平衡计算 通关
一、“一式”巧解有关化学反应速率计算题
化学反应速率是表示反应进行快慢的物理量,它用单位
时间内反应物浓度的减少或生成物浓度的增加来表示,
单位有 mol·L-1·h-1、mol·L-1·min-1、mol·L-1·s-1 等。计
算公式如下:
ΔnB
v(B)=ΔcΔtB=
C.反应开始到 10 s 时,平均反应速率:v(X)=v(Y)=
0.039 5 mol·L-1·s-1
D.反应的化学方程式为 2X(g)+
2Z(g)
专题讲座十
解析 0~10 s,X 减少 0.79 mol、Y 减少 0.79 mol,Z 增加
1.58 mol,物质的量变化之比为 1∶1∶2,故反应的化学方
A BC D
n(CO2)/mol n(H2)/mol n(CO)/mol
3 10 1 2 10 1 1 2 3 0.5
n(H2O)/mol 5 2 3 2
专题讲座十
(4)在 830 ℃时,在 2 L 的密闭容器中加入 4 mol CO(g)和 6 mol H2O(g)达到平衡时,CO 的转化率是__________。 解析 (1)由表格可知,升温,化学平衡常数减小,故正反应 为放热反应。 (2)升高温度,正、逆反应速率均增大;容器体积不变的情况 下,升高温度,则容器内混合气体的压强增大。 (3)830 ℃时,化学平衡常数为 1,即若 n(CO2)×n(H2)<n(CO) ×n(H2O),则反应向正反应方向进行,符合此要求的是 B、C。
专题讲座十
二、有关化学平衡计算的“三步曲” 化学平衡的计算一般涉及到各组分的物质的量、浓度、 转化率、百分含量、气体混合物的密度、平均摩尔质量、 压强等,通常的思路是写出平衡式,列出相关量(起始量、 变化量、平衡量),确定各量之间的关系,列出比例式或 等式或依据平衡常数求解。
高考化学一轮复习 专题7 化学反应速率与化学平衡 3 第三单元 化学平衡的移动课件
2 . (2020·扬 州 高 三 质 检 ) 一 定 条 件 下 的 密 闭 容 器 中 : 4NH3(g) + 5O2(g) 6H2O(g) ΔH=-905.9 kJ·mol-1, 下列叙述正确的是 A.4 mol NH3 和 5 mol O2 反应,达到平衡时放出热量为 905.9 kJ B.平衡时 v 正(O2)=v 逆(NO) C.平衡后减小压强, 混合气体平均摩尔质量增大
利于合成氨反应的平衡右移,B 符合题意;采用高温会使合成氨反应的平衡左移,但
500 ℃下催化剂的活性较高,C 不符合题意;循环操作与平衡移动没有直接关系,D 不
符合题意。
12/11/2021
5.下列实验事实不能用平衡移动原理解释的是
A.
B.
t/℃
Kw/10-14
25
50
100
1.01
5.47
55.0
1.恒温恒容条件下反应前后体积改变的反应
判断方法:极值等量即等效。
例如: 2SO2(g)+O2(g) 2SO3(g)
①
2 mol 1 mol
0
②
0
0
2 mol
③ 0.5 mol 0.25 mol 1.5 mol
④ a mol
b mol c mol
12/11/2021
上述①②③三种配比,按化学方程式的化学计量数关系均转化为反应物,则 SO2 均为 2 mol,O2 均为 1 mol,三者建立的平衡状态完全相同。 ④中 a、b、c 三者的关系满足 c+a=2,2c+b=1 时,即与上述平衡等效。
12/11/2021
3.恒温条件下反应前后体积不变的反应 判断方法:无论是恒温恒容,还是恒温恒压,只要极值等比即等效,因为压强改变对 该类反应的化学平衡无影响。 例如:H2(g)+I2(g) 2HI(g) ① 1 mol 1 mol 0 ② 2 mol 2 mol 1 mol ③ a mol b mol c mol ①②两种情况下,nn((HI22))=1,故互为等效平衡。 ③中 a、b、c 三者关系满足22cc++ba=1 或ab=1,c≥0 时,即与①②平衡等效。
【三维设计】高考化学一轮复习 第七章第三节 化学平衡常数 化学反应进行的方向课件 新人教版
2.应用 (1)利用K可以推测可逆反应进行的程度.
K的大小表示可逆反应进行的程度,K大说明反应进行 的程度大,反应物的转化率大.K小说明反应进行的 程度小,反应物的转化率小.
(2)借助平衡常数,可以判断一个化学反应是否达到化学平衡 状态.
对于可逆反应 aA(g)+bB(g)
cC(g)+dD(g),在一定温
D.NH4HCO3(s)+CH3COOH(aq) === CO2(g)+CH3COONH4(aq)+H2O(l)
合的是
()
A.平衡态Ⅰ与平衡态Ⅱ的正反应速率相等 B.平衡移动的原因可能是增大了反应物浓度 C.平衡移动的原因可能是增大了压强 D.平衡状态Ⅰ和平衡状态Ⅱ的平衡常数的大小关系为
K1<K2
解析:由图知,平衡态Ⅱ的正反应速率比平衡态Ⅰ大, A错误;增大反应物浓度,正反应速率突然增大,逆反 应速率不变,平衡右移,达到新平衡,B项与图象相符; 如果增大压强,虽然平衡向正反应方向移动,但应该是 正逆反应速率都增大,与图象不符,所以C是错误的; 平衡常数只与温度有关,K1等于K2,D错误. 答案:B
[例1] (2009·海南高考)在25℃时,密闭容器中X、Y、Z 三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/mol·L-1 0.1 0.2 0
平衡浓度/mol·L-1 0.05 0.05 0.1
下列说法错误的是
()
A.反应达到平衡时,X 的转化率为 50%
B.反应可表示为 X+3Y 2Z,其平衡常数为 1600
C.增大压强使平衡向生成 Z 的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
[名师精析] 平衡常数是温度的函数,所以增大压强不可 能使平衡常数增大,D 选项正确、C 选项错误;根据表 中数据(0.1-0.05)∶(0.2-0.05)∶(0.1-0)=1∶3∶2 可推 导出:X+3Y 2Z,K=1600.
【三维设计】2015高考(江苏用)化学一轮习题详解课件课时跟踪检测(20)化学平衡状态 化学平衡的移动
2.解析:A 项,该反应中增大压强平衡向正反应方向移动,则氨气的体 积分数增大,并且压强越大,化学反应速率越大,达到化学平衡的时 间越少,与图像不符,错误;B 项,因该反应是放热反应,升高温度 化学平衡向逆反应移动,则氮气的转化率降低,与图像中转化率增大 不符,错误;C 项,反应平衡后,增大氮气的量,则这一瞬间正反应 速率增大,逆反应速率不变,然后正反应速率在不断减小,逆反应速 率不断增大,直到新的平衡,与图像符合,正确;D 项,因催化剂对 化学平衡无影响,但催化剂加快化学反应速率,则有催化剂时达到化 学平衡的时间少,与图像不符,错误。 答案:C
8.解析:A 项,从右图分析,甲容器平衡时 c(A)为 0.78 mol/L,而 乙容器平衡时 c(A)为 0.5 mol/L,起始时投料,甲是乙的两倍,相 当于甲为 2 倍的乙加压, 如果平衡不移动。 则 A 的浓度应为 2 倍, 但现小于 2 倍,则说明加压时,平衡正向移动,故 x=1,错;B 项,在恒容容器中充入稀有气体,对平衡无影响,错;C 项,甲 容器的平衡是正向移动,对乙升温时,平衡是逆向移动,故两者 体积分数不可以相同,错;D 项,再向 A 中压入 2 mol A、2 mol B,则达新平衡时,A 的浓度比原平衡大,但小于 2 倍,正确。 答案:D
6.解析:A 项,根据图像可知,t2 时刻 C 的浓度增大,但平衡不移 动。这说明改变的条件应该是增大压强造成的。增大压强平衡不 移动,所以反应前后体积不变,则有 x=1+1=2,不正确;B 项, 加入催化剂平衡不移动,但 C 的浓度也不变。而图像中 C 的浓度 增大,因此改变的条件不是催化剂,B 错误;C 项,D 为固体, 减少 D 的量,不影响平衡移动,C 的浓度不发生变化,错误;D 项,t1~t3 间温度相同,平衡常数相同,由图可知平衡时 C 的浓度 为 0.5 mol/L,则:
