高考化学一轮复习气体的实验室制备、净化和收集
最新高三化学讲义:专题讲座五 气体的实验室制备净化和收集

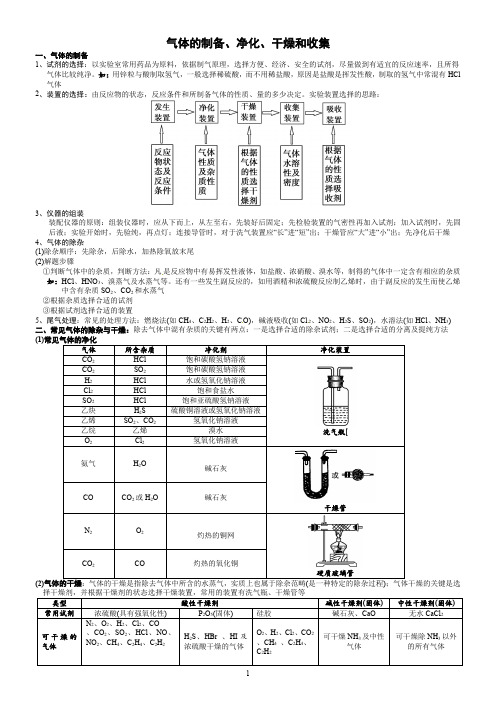
专题讲座五 气体的实验室制备、净化和收集1.气体制备实验的基本过程(1)气体制备实验装置一般包含以下几部分错误!―→错误!―→错误!―→(2)气体制备的一般实验操作步骤1组装(从下到上,从左到右);2检验装置的气密性;3加入药品;4排尽装置内的空气;5验纯;⑥反应;⑦拆除装置。
2.气体发生装置依据制备气体所需的反应物状态和反应条件,可将制备气体的发生装置分为三类: (1)固体+固体错误!气体发生装置:制备气体:O 2、NH 3、CH 4等注意事项:1试管口应稍向下倾斜,以防止产生的水蒸气在试管口冷凝后倒流,而使试管破裂。
2铁夹应夹在距试管口1/3处。
3固体药品应平铺在试管底部。
4胶塞上的导管伸入试管里面不能过长,否则会影响气体导出。
5如用排水集气法收集气体,当停止制气时,应先从水槽中把导管撤出,然后再撤走酒精灯,防止水倒吸。
(2)固体+液体或液体+液体错误!气体 发生装置:制备气体:Cl 2、C 2H 4等尾气处 理装置注意事项:1烧瓶应固定在铁架台上。
2先把固体药品放入烧瓶中,再缓缓加入液体。
3分液漏斗应盖上盖,注意盖上的凹槽对准分液漏斗颈部的小孔。
4对烧瓶加热时要垫上石棉网。
(3)固体+液体(不加热)―→气体发生装置:制备气体:H2、CO2、NO2、SO2、NO等注意事项:1块状固体与液体的混合物在常温下反应制备气体,可用启普发生器制备,当制取气体的量不多时,也可采用简易装置。
2简易装置中长颈漏斗的下口应伸入液面以下,否则起不到液封作用而无法使用。
3加入块状固体药品的大小要适宜。
4加入液体的量要适当。
5最初使用时应待容器内原有的空气排净后,再收集气体。
⑥在导管口点燃氢气或其他可燃性气体时,必须先检验纯度。
3.气体的除杂方法除杂试剂选择的依据:主体气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性、可燃性。
除杂原则:(1)不损失主体气体,(2)不引入新的杂质气体,(3)在密闭装置内进行,(4)先除易除的气体。
2020届高考化学一轮专题气体的制备、净化、干燥和收集答题方法(8页)
(2)解题步骤
①判断气体中的杂质,判断方法:凡 是反应物中有易挥发性液体,如盐酸、浓硝酸、溴水等,制得的气体中一定含有相应的杂质
如:HCl、HNO3、溴蒸气及水蒸气等。还有一些发生副反应的,如用酒精和浓硫酸反应制乙烯时,由于副反应的发生而使乙烯
中含有杂质 SO2、CO2 和水蒸气
②根据杂质选择合适的试剂
②装置:见图乙
(11)氨的工业制法:N2+3H2
3、二氧化硫的制备 (1)反应原理:Na2SO3+H2SO4(浓) (2)发生装置:“固 液 气 ”型 (3)装置图:
2NH3 Na2SO4+SO2↑+H2O
(4)净化装置:通入浓 H2SO4 (除水蒸气) 4
(5)收集装置:向上排气法 (6)尾气处理装置:用强碱溶液吸收多余 SO2,防止污染空气 (SO2+2NaOH (7)检验方法:先通入品红试液,褪色,加热后又恢复原红色 4、乙烯的实验室制法 (1)药品及其比例:无水乙醇、浓硫酸 (体积比为 1:3)
3、仪器的组装
装配仪器的原则:组装仪器时,应从下而上,从左至右,先装好后固定;先检验装置的气密性再加入试剂;加入试剂时,先固
后液;实验开始时,先验纯,再点灯;连接导管时,对于洗气装置应“长”进“短”出;干燥管应“大”进“小”出;先净化后干燥
4、气体的除杂
(1)除杂顺序:先除杂,后除水,加热除氧放末尾
MnCl2+Cl2↑+2H2O
(实验室通常用该法制 Cl2)
2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O (快速制取 Cl2,不需要加热)
(2)发生装置:“固 液 气 ”型 (3)实验仪器:铁架台、酒精灯、石棉网、圆底烧瓶、分液漏斗、导气管、洗气瓶、 集气瓶 (4)装置图:
2018届高考化学一轮复习专题突破气体的实验室制备净化和收集课件苏教版

1
mol, 2Al+2NaOH+2H2O 2NaAlO2+3H2↑ 54 g 3 mol m(Al) 0.015 mol m(Al)=0.27 g,w(Al)=27.0%。
。
-21-
(5)本实验应对量气管多次读数,读数时应注意:①恢复至室温; ② ;③视线与凹 液面最低处相平。 (6)实验④获 得以下数据(所有气体体积均已换算成标准状况 ) 对量气管 对量气管 编号 镁铝合金质量 第一次读数 第二次读数
① ② ③
1.0 g 1.0 g 1.0 g
10.0 mL 10.0 mL 10.0 mL
-1-
1.实验室制备气体的基本过程 (1)气体制备实验装置一般包含以下几部分。
发生装置 净化装置 干燥装置 尾气处理装置
(2)气体制备的一般实验操作步骤。 ①组装(从下到上,从左到右);②检验装置的气密性;③加入药品; ④排尽装置内的空气;⑤验纯;⑥反应;⑦拆除装置。
-2-
2.常见气体制备的发生装置
-9-
4.气体的干燥 (1)常见干燥剂。 ①酸性干燥剂,如浓硫酸、浓磷酸、P2O5、硅胶等,可以干燥CO2、 SO2、Cl2、O2、H2、N2、CO等酸性或中性气体。 ②注意:上述干燥剂不能干燥氨气,H2S、HI还原性气体不能用浓 硫酸干燥。 (2)碱性干燥剂。 ①碱性干燥剂,如碱石灰、生石灰、固体氢氧化钠等,可以干燥 NH3、O2、H2、N2、CO等碱性或中性气体。 ②注意:上述干燥剂不能干燥CO2、HCl、Cl2等酸性气体。 (3)中性干燥剂。 中性干燥剂,如无水氯化钙,一般可以干燥除NH3之外的其他任何 气体。
制备少量 氨气
制备并收集少量 NO2 气体
制备少量 氧气
解析:A选项,铜与浓硫酸反应需要加热,错误;C选项,二氧化氮气 体溶于水,不能用排水法收集,错误;D选项,Na2O2溶于水,固液不能 分离,该装置不能随时控制反应进行,错误。 答案:B
复习专题高中化学气体的实验室制备净化和收集

复习专题:气体的实验室制备、净化和收集1.气体制备实验的基本过程(1)气体制备实验装置一般包含以下几部分发生装置―→净化装置―→干燥装置―(2)气体制备的一般实验操作步骤①组装(从下到上,从左到右);②检验装置的气密性;③加入药品;④排尽装置内的空气;⑤验纯;⑥反应;⑦拆除装置。
2.气体发生装置依据制备气体所需的反应物状态和反应条件,可将制备气体的发生装置分为三类:△(1)固体+固体――→气体发生装置:制备气体:O2、NH3、CH4等注意事项:①试管口应稍向下倾斜,以防止产生的水蒸气在试管口冷凝后倒流,而使试管破裂。
②铁夹应夹在距试管口1/3处。
③固体药品应平铺在试管底部。
④胶塞上的导管伸入试管里面不能过长,否则会影响气体导出。
⑤如用排水集气法收集气体,当停止制气时,应先从水槽中把导管撤出,然后再撤走酒精灯,防止水倒吸。
△(2)固体+液体或液体+液体――→气体发生装置:制备气体:Cl2、C2H4等注意事项:①烧瓶应固定在铁架台上。
②先把固体药品放入烧瓶中,再缓缓加入液体。
③分液漏斗应盖上盖,注意盖上的凹槽对准分液漏斗颈部的小孔。
④对烧瓶加热时要垫上石棉网。
(3)固体+液体(不加热)―→气体1发生装置:制备气体:H2、CO2、NO2、SO2、NO等注意事项:①块状固体与液体的混合物在常温下反应制备气体,可用启普发生器制备,当制取气体的量不多时,也可采用简易装置。
②简易装置中长颈漏斗的下口应伸入液面以下,否则起不到液封作用而无法使用。
③加入块状固体药品的大小要适宜。
④加入液体的量要适当。
⑤最初使用时应待容器内原有的空气排净后,再收集气体。
⑥在导管口点燃氢气或其他可燃性气体时,必须先检验纯度。
3.气体的除杂方法除杂试剂选择的依据:主体气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性、可燃性。
除杂原则:(1)不损失主体气体,(2)不引入新的杂质气体,(3)在密闭装置内进行,(4)先除易除的气体。
2021届一轮复习人教版常见气体的实验室制备、净化、收集和检验课件

4.(2018·)实验室中某些气体的制取、收集及尾气处理装置如图所示(省略 夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )B
选项 A B C D
a中的物质 浓氨水 浓硫酸 稀硝酸 浓盐酸
b中的物质 CaO
Na2SO3 Cu
MnO2
c中收集的气体ห้องสมุดไป่ตู้
NH3 SO2 NO2 Cl2
上方罩一个干而冷的烧杯
里有水雾生成
①用湿润的红色石蕊试纸检验
变蓝
②把待检气体收集在集气瓶里,盖上玻璃片,用 玻璃棒蘸取浓盐酸,开启玻璃片放在瓶口上方
生成白烟
待检物
操作步骤
现象
SO2
在洁净试管里加入5 mL品红溶液,再通入 品红溶液褪色,加热后又恢复红
待检气体,再加热待颜色变化后
色
CO2 闻气味,并将其通入澄清石灰水中
(1)制备气体的装置在加入反应物之前均应先检查装置的气密性。该装置所
制气体应满足固体(液体)和液体不需加热制备气体。符合此条件的制备氧气的反应
可为H2O2在MnO2作催化剂时分解,或Na2O2与H2O反应。该装置可制备的气体有 H2、CO2、O2、NH3等。(2)ClO-、Cl-在酸性条件下发生反应生成Cl2。漂白粉在 空气中放置会部分变为CaCO3,浓盐酸有很强的挥发性,因而制取的Cl2中常含有 HCl、CO2和H2O(g)。
3. (1)除杂试剂选择的依据:主体气体和杂质气体性质上的差异,如溶解性、酸碱 性、氧化性、还原性。 除杂原则:①不损失主体气体;②不引入新的杂质气体;③在密闭装置内进行 ;④先除易除的杂质气体。
(2)气体干燥净化装置
1.NH4HCO3固体受热分解得NH3、CO2、H2O等混合气体,如何除去CO2、 H2O得纯净的NH3?
气体的实验室制备、净化和收集

CO2(SO2):________________________。 (4)含有O2杂质的气体 ①CO2(O2):__________;②N2(O2):___________。 (5)HCl(Cl2):____________。
二、气体的发生装置:
(1)固体+固体――△→气体
制备气体:O2、NH3、CH4等 注意事项:粉末状固体应在试管口放一团棉花 ①试管口应稍向下倾斜,以防止产生的水蒸气在试管口 冷凝后倒流,而使试管破裂。
③固体药品应平铺在试管底部。 ④胶塞上的导管伸入试管内不能过长,否则会影响气体导出
⑤如用排水集气法收集气体,当停止制气时,应先从水 槽中把导管撤出,然后再撤走酒精灯,防止水倒吸。
三、气体的除杂方法:
除杂试剂选择的依据:主体气体和杂质气体性质上的差
异,如溶解性、酸碱性、氧化性、还原性、可燃性。
除杂原则:
(1)不损失主体气体, (2)不引入新的杂质气体, (3)在密闭装置内进行, (4)先除易除的气体。
一般可从以下几个方面考虑: ①易溶于水的杂质可用水吸收;
②酸性杂质可用碱性物质吸收;
四、气体的干燥
(1)选用干燥剂应根据气体的性质和干燥剂的性质而定, 其原则是干燥剂只能吸收气体中的水分,而不能与气体 发生反应。
①酸性干燥剂,如浓H2SO4、P2O5、硅胶等。一般用来 干燥酸性或中性气体,而不能用来干燥碱性气体。
②碱性干燥剂,如生石灰、固体NaOH、碱石灰等。碱性 干燥剂不能干燥酸性气体,如碱石灰不能干燥Cl2、CO2、 HCl等。
高中化学专题讲座-气体的实验室制备、净化和收集
中学化学专题讲座气体的试验室制备、净化和收集1.气体制备试验的基本过程(1)气体制备试验装置一般包含以下几部分发生装置―→净扮装置―→干燥装置―→尾气处理装置 (2)气体制备的一般试验操作步骤①组装(从下到上,从左到右);②检验装置的气密性;③加入药品;④排尽装置内的空气;⑤验纯;⑥反应;⑦拆除装置。
2.气体发生装置依据制备气体所需的反应物状态和反应条件,可将制备气体的发生装置分为三类: (1)固体+固体――→△气体 发生装置:制备气体:O 2、NH 3、CH 4等留意事项:①试管口应稍向下倾斜,以防止产生的水蒸气在试管口冷凝后倒流,而使试管炸裂。
②铁夹应夹在距试管口1/3处。
③固体药品应平铺在试管底部。
④胶塞上的导管伸入试管内不能过长,否则会影响气体导出。
⑤如用排水集气法收集气体,当停止制气时,应先从水槽中把导管撤出,然后再撤走酒精灯,防止水倒吸。
(2)固体+液体或液体+液体――→△气体 发生装置:(a) (b) (c) 制备气体:Cl 2、C 2H 4等留意事项:①烧瓶应固定在铁架台上。
②先把固体药品放入烧瓶中,再缓缓加入液体。
③分液漏斗应盖上盖,留意盖上的凹槽对准分液漏斗颈部的小孔。
④对烧瓶加热时要垫上石棉网。
⑤液体+液体――→△气体时要加沸石,防止暴沸,如用(b)装置制取乙烯时需加碎瓷片。
⑥(c)装置中导管的作用是平衡气压,便于分液漏斗中的液体顺当滴下。
(3)固体+液体(不加热)―→气体发生装置:制备气体:H2、CO2、NO2、SO2、NO等留意事项:①块状固体及液体的混合物在常温下反应制备气体,可用启普发生器制备,当制取气体的量不多时,也可采纳简易装置。
②简易装置中长颈漏斗的下口应伸入液面以下,否则起不到液封作用而无法运用。
③加入块状固体药品的大小要相宜。
④加入液体的量要适当。
⑤最初运用时应待容器内原有的空气排净后,再收集气体。
⑥在导管口点燃氢气或其他可燃性气体时,必需先检验纯度。
高中化学专题讲座 气体的实验室制备、净化和收集
高中化学专题讲座气体的实验室制备、净化和收集1.气体制备实验的基本过程(1)气体制备实验装置一般包含以下几部分发生装置―→净化装置―→干燥装置―→尾气处理装置 (2)气体制备的一般实验操作步骤①组装(从下到上,从左到右);②检验装置的气密性;③加入药品;④排尽装置内的空气;⑤验纯;⑥反应;⑦拆除装置。
2.气体发生装置依据制备气体所需的反应物状态和反应条件,可将制备气体的发生装置分为三类: (1)固体+固体――→△气体 发生装置:制备气体:O 2、NH 3、CH 4等注意事项:①试管口应稍向下倾斜,以防止产生的水蒸气在试管口冷凝后倒流,而使试管炸裂。
②铁夹应夹在距试管口1/3处。
③固体药品应平铺在试管底部。
④胶塞上的导管伸入试管内不能过长,否则会影响气体导出。
⑤如用排水集气法收集气体,当停止制气时,应先从水槽中把导管撤出,然后再撤走酒精灯,防止水倒吸。
(2)固体+液体或液体+液体――→△气体 发生装置:(a) (b) (c) 制备气体:Cl 2、C 2H 4等注意事项:①烧瓶应固定在铁架台上。
②先把固体药品放入烧瓶中,再缓缓加入液体。
③分液漏斗应盖上盖,注意盖上的凹槽对准分液漏斗颈部的小孔。
④对烧瓶加热时要垫上石棉网。
⑤液体+液体――→△气体时要加沸石,防止暴沸,如用(b)装置制取乙烯时需加碎瓷片。
⑥(c)装置中导管的作用是平衡气压,便于分液漏斗中的液体顺利滴下。
(3)固体+液体(不加热)―→气体 发生装置:制备气体:H 2、CO 2、NO 2、SO 2、NO 等注意事项:①块状固体与液体的混合物在常温下反应制备气体,可用启普发生器制备,当制取气体的量不多时,也可采用简易装置。
②简易装置中长颈漏斗的下口应伸入液面以下,否则起不到液封作用而无法使用。
③加入块状固体药品的大小要适宜。
④加入液体的量要适当。
⑤最初使用时应待容器内原有的空气排净后,再收集气体。
⑥在导管口点燃氢气或其他可燃性气体时,必须先检验纯度。
高中化学专题讲座-气体的实验室制备、净化和收集
高中化学专题讲座气体的实验室制备、净化和收集1.气体制备实验的基本过程(1)气体制备实验装置一般包含以下几部分发生装置―→净化装置―→干燥装置―→尾气处理装置 (2)气体制备的一般实验操作步骤①组装(从下到上,从左到右);②检验装置的气密性;③加入药品;④排尽装置内的空气;⑤验纯;⑥反应;⑦拆除装置。
2.气体发生装置依据制备气体所需的反应物状态和反应条件,可将制备气体的发生装置分为三类: (1)固体+固体――→△气体 发生装置:制备气体:O 2、NH 3、CH 4等注意事项:①试管口应稍向下倾斜,以防止产生的水蒸气在试管口冷凝后倒流,而使试管炸裂。
②铁夹应夹在距试管口1/3处。
③固体药品应平铺在试管底部。
④胶塞上的导管伸入试管内不能过长,否则会影响气体导出。
⑤如用排水集气法收集气体,当停止制气时,应先从水槽中把导管撤出,然后再撤走酒精灯,防止水倒吸。
(2)固体+液体或液体+液体――→△气体 发生装置:(a) (b) (c) 制备气体:Cl 2、C 2H 4等注意事项:①烧瓶应固定在铁架台上。
②先把固体药品放入烧瓶中,再缓缓加入液体。
③分液漏斗应盖上盖,注意盖上的凹槽对准分液漏斗颈部的小孔。
④对烧瓶加热时要垫上石棉网。
⑤液体+液体――→△气体时要加沸石,防止暴沸,如用(b)装置制取乙烯时需加碎瓷片。
⑥(c)装置中导管的作用是平衡气压,便于分液漏斗中的液体顺利滴下。
(3)固体+液体(不加热)―→气体 发生装置:制备气体:H2、CO2、NO2、SO2、NO等注意事项:①块状固体与液体的混合物在常温下反应制备气体,可用启普发生器制备,当制取气体的量不多时,也可采用简易装置。
②简易装置中长颈漏斗的下口应伸入液面以下,否则起不到液封作用而无法使用。
③加入块状固体药品的大小要适宜。
④加入液体的量要适当。
⑤最初使用时应待容器内原有的空气排净后,再收集气体。
⑥在导管口点燃氢气或其他可燃性气体时,必须先检验纯度。
化学复习:第4章 第6讲 建模思想——气体的实验室制备、净化和收集
即时巩固 1. 《 Inorganic Synthesis》 《无机合成》一书中,
有一如图所示的装置, 用以制备少量某种干燥纯净的 气体。该装置中所装的药品正确的是 ( )
选项 A B C D
a 中所装药品 浓盐酸 浓硫酸
b 中所 制取气体 装药品 浓硫酸 浓盐酸 浓 c HCl HCl NH3 NH3
①使用长颈 漏斗时, 要使 漏斗颈插入 液面以下 ②启普发生 器只适用块 状固体和液 体反应, 且块 状固体不溶 于水③使用 分液漏斗, 既 向上排空 可以增加装 气法 置的气密性, 又可以控制 液体流速
Cl2 N O
C2 H4
向上排 注 空气法 ①氯气有毒, 意尾气用 NaOH 溶液吸 排水法 收。 ②收集 NO 用 排水法, 既可防 止 NO 被氧化, 又可除去可能 浓硫酸 C2H5OH————→ C2H4↑ 混有的 NO2。 170℃ 排水法 ③制 C2H4 时应 +H2O 加碎瓷片, 防止 暴沸
△ MnO2+4HCl(浓) ===== MnCl2+2H2O+Cl2↑(也可 用 KMnO4 代替 MnO2) △ 3Cu+8HNO3(稀)===== 3Cu(NO3)2+2NO↑+4H2O
科目一考试 / 2016年科目一模 拟考试题
科目二考试 2016年科目二考试技巧、 考试内容、考试视频
浓 NaOH 溶液 浓氨水 浓氨水 NaOH 溶液
解析
若将浓硫酸加入到浓盐酸中,无法得到干燥
纯净的气体,而是将浓盐酸加入到浓硫酸中,故 A 项正 确,B 项错误;浓氨水与浓 NaOH 溶液混合后浓度变小 不易挥发出 NH3,且得不到干燥的 NH3,故 C、D 错误。 答案 A
2. 实验室中需要 22.4 L(标准状况)SO2 气体。化学小 组同学依据化学方程式 Zn+2H2SO4(浓) ZnSO4+ SO2↑+2H2O 计算后, 取 65.0 g 锌粒与 98%的浓 H2SO4(ρ =1.84 g/cm3)110 mL 充分反应,锌全部溶解,对于制得的 气体,有同学认为可能混有杂质。
