钾离子的相对原子质量
人教版初中九年级化学上册第三单元《物质构成的奥秘》知识点总结(含答案解析)

一、选择题1.关于下列四种粒子的说法正确的是A.X、Y、M均是已形成稳定结构离子B.粒子Y若失去一个电子就可以变成原子C.它们表示四种元素D.上述粒子中有两个是离子,两个是原子D解析:DA、最外层电子数达到8电子,为相对稳定结构,则X、Y、M均是已形成相对稳定结构,但M的质子数=核外电子数,为原子,不是离子,故A不正确;B、在原子中,质子数=核外电子数,Y的质子数为19,核外电子数为18,则粒子Y若得到一个电子就可以变成原子,故B不正确;C、元素是具有相同质子数的一类原子的总称,质子数分别为17、19、18、17,则它们表示三种元素,故C不正确;D、X是氯离子,Y是钾离子,M是氩原子,N是氯原子,上述粒子中有两个是离子,两个是原子,故D正确。
故选D。
2.下列说法正确的是A.同种分子构成的物质是纯净物,纯净物一定由同种分子构成B.所有的原子都是由质子、中子和电子构成C.金属元素有正化合价,因此非金属元素一定没有正化合价D.最外层电子数是8的原子一定是稀有气体元素的原子D解析:DA、同种分子构成的物质是纯净物,但纯净物不一定由同种分子构成,也可能是原子或离子构成,故选项说法错误。
B、并不是所有的原子都是由质子、中子、电子构成,如氢原子没有中子,选项说法错误。
C、在化合物中,金属元素通常显正价,显正价的不都是金属元素,例如在二氧化碳中碳元素显正价,就不是金属元素,故选项说法错误。
D、最外层电子数为8的原子一定是稀有气体元素的原子,例如氖原子,选项说法正确。
故选:D。
3.宜昌磷矿资源丰富。
已知一个磷原子核内含有15个质子,相对原子质量为31,则磷原子的核外电子数为A.8B.15C.16D.31B解析:B【分析】原子中,核内质子数=核电荷数=核外电子数,已知核内质子数为15,则核外电子数为15;故选B。
【点睛】4.下列说法正确的是()A.钠原子失去一个电子就变成稀有气体元素氖的原子B.氯原子得到一个电子后,就变成了与氩原子核外电子排布相同的阴离子C.两种离子,核外电子排布相同,化学性质一定相同D.原子最外层电子数少于4个的元素,一定是金属元素B解析:BA、原子失去电子后原子核没有变化,故质子数不会变化,所以原子的种类就不会变化;错误;B、氩原子核外有18个电子,而氯原子得到一个电子后核外也有18个电子,故会变成了和氩原子电子层结构相同的阴离子;正确;C、两种粒子,核外电子排布情况相同,化学性质不一定相同,例如氖原子和钠离子,只能说都比较稳定,但化学性质不可能相同;错误;D、原子最外层电子数小于4的元素,不一定是金属元素,如氢原子;错误;故选:B。
2020年江苏高中学业水平合格考化学试卷真题及答案详解

江苏省2020年普通高中学业水平合格性考试试题化学可能用到的相对原子质量:H-1C-12O-16Na-23Mg-24S-32Cl-35.5K-39Ca-40Fe-56一、选择题:本大题共26小题,每小题3分,共计78分。
在每小题的四个选项中,只有一个选项符合题目要求。
1.2019年,我国第一艘国产航空母舰山东舰正式列装。
优质钢材是建造航空母舰的基础材料,钢材中含量最高的元素是()A.铁B.碳C.硅D.锰2.为充分利用资源和保护环境,近年来逐步实施了生活垃圾的分类处理。
废弃的塑料袋、纸张、橡胶制品均属于()A.单质B.有机物C.盐D.氧化物3.许多化学物质在日常生活中有俗名。
下列物质的俗名与化学式对应正确的是()A.双氧水—Na2O2B.小苏打—NaOHC.胆矾—Cu(OH)2D.干冰—CO24.如图仪器中名称为圆底烧瓶的是()A.D.B.C.5.标准状况下,1molO2的体积约为()A.5.6L B.11.2L C.22.4L D.33.6L6.实验室有少量汞不慎撒落,处理方法是将硫黄粉撒在汞的表面,发生反应的化学方程式为Hg+S=HgS,该反应属于()A.置换反应B.化合反应C.分解反应D.复分解反应7.大米是中国人的主食之一,其中含量最高的营养物质是淀粉。
淀粉属于()A.糖类B.油脂C.蛋白质D.无机盐8.下列变化属于化学变化的是()A.金属腐蚀B.碘的升华C.氨气液化D.矿石粉碎9.下列物质含有离子键的是()A .CO 2B .N 2C .KClD .H 2O10.海水中蕴藏着丰富的化学资源,每千克海水中氯化物的含量如图所示,其中物质的量浓度最大的金属离子是A .K +B .Ca 2+C .Mg 2+D .Na +11.下列化学用语表示正确的是()A .苯的结构简式:C HB .氢分子的电子式:H:HC .氧原子的结构示意图:D .硝酸钾的电离方程式:KNO 3=K ++N 5++3O 2-高温12.反应4Al +3MnO 23Mn +2Al 2O 3可用来制取Mn ,下列有关该反应的说法正确的是A .Al 是还原剂C .Al 的化合价降低B .MnO 2发生氧化反应D .MnO 2中O 被还原13.规范操作是实验的基本要求。
山西省太原师范院附属中学2022学年中考三模化学试题(含解析)

2022学年中考化学模似试卷注意事项:1.答题前,考生先将自己的姓名、准考证号填写清楚,将条形码准确粘贴在考生信息条形码粘贴区。
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、笔迹清楚。
3.请按照题号顺序在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
4.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
一、单选题(本大题共15小题,共30分)1.下列关于“化学与生活”的认识不正确的是()A.在食品加工中,加入大量的食品添加剂,使食品既保鲜又美观B.食用铁强化酱油,有助于预防缺铁性贫血C.抵制使用一次性塑料袋,有利于长沙市创建文明城市D.回收处理废旧电池,有利于长沙市“两型”社会的建设2.下列物质的溶液长期放置在空气中,溶液质量因发生化学变化而减小的是A.石灰水B.饱和食盐水C.苛性钠溶液D.浓硫酸3.我国科学家率先用铝合金和石墨烯按一定比例混合制成“烯合金”,该材料有望生产出“一分钟充满电的电池”。
下列关于“烯合金”的说法不正确的是( )A.常温下稳定B.是一种混合物C.具有导电性D.属于有机合成材料4.关注健康,预防疾病。
下列叙述正确的是()A.防止有害元素对人体的侵害是人类健康生活的重要保证B.缺碘会得甲状腺肿大,某人得了甲状腺肿大,应适当的补充碘元素C.缺乏维生素A会得坏血病,缺乏维生素C会得夜盲症D.人体中的氧、碳、氢、氮主要以无机盐的形式存在于水溶液中5.生活离不开化学。
下列做法错误的是A.蚊虫叮咬时在人的皮肤内分泌出蚁酸.可在叮咬处涂抹食醋以减轻痛痒B.自来水用煮沸的方法既可杀菌又可降低水的硬度C.面团发酵后会产生酸味,可加入少量的纯碱后再揉成馒头D.可用洗洁精洗去餐具上的油污6.根据下列实验现象可以判断某溶液一定呈碱性的是()A.溶液中滴入石蕊仍为紫色B.溶液中滴入酚酞显红色C.溶液中滴入石蕊显红色D.溶液中滴入酚酞不显色7.下列说法正确的是A.不同元素本质的区别是原子的最外层电子数不同B.海绵能吸水,说明分子间有间隔C.符号“Cu”既能表示该种元素,又能表示该元素的一个原子,还能表示该种物质D.Na和Na+的化学性质不同是因为质子数不同8.下列物质由分子组成的是A.铁B.氯化钠C.水D.硝酸钾9.钾在元素周期表中信息如右图。
江苏镇江市九年级化学上册第三单元《物质构成的奥秘》(含答案)

一、选择题1.关于下列四种粒子的说法正确的是A.X、Y、M均是已形成稳定结构离子B.粒子Y若失去一个电子就可以变成原子C.它们表示四种元素D.上述粒子中有两个是离子,两个是原子D解析:DA、最外层电子数达到8电子,为相对稳定结构,则X、Y、M均是已形成相对稳定结构,但M的质子数=核外电子数,为原子,不是离子,故A不正确;B、在原子中,质子数=核外电子数,Y的质子数为19,核外电子数为18,则粒子Y若得到一个电子就可以变成原子,故B不正确;C、元素是具有相同质子数的一类原子的总称,质子数分别为17、19、18、17,则它们表示三种元素,故C不正确;D、X是氯离子,Y是钾离子,M是氩原子,N是氯原子,上述粒子中有两个是离子,两个是原子,故D正确。
故选D。
2.原子簇是若干原子的聚集体,有望开发成新材料,某铝原子簇由13个铝原子构成其最外层电子数的总和为40时相对稳定,下图为铝原子的结构示意图,则该稳定铝原子簇的微粒符号是A.Al3+B.13Al3+C.13Al-D.Al13-D解析:D铝原子最外层电子数是3,其最外层电子数的总和为40时相对稳定,说明该稳定铝原子簇Al。
带1个单位负电荷,微粒符号可以表示为-13故选:D。
3.等质量的钠、镁、铝、钙四种金属中,含原子数最少的金属是A.钠B.镁C.铝D.钙D解析:D【分析】原子的相对原子质量反映了其实际质量,当质量都相等的前提下,相对原子质量越大,所含的原子数越少。
钠、镁、铝、钙的相对原子质量分别是23、24、27、40,当质量相同时,含原子数最少的是相对原子质量最大的金属,即为钙;故选D。
4.逻辑推理是一种重要的化学思维方法,以下说法中正确的是A.分子和原子都不带电,所以不带电的微粒都是分子和原子B.H2O和的H2O2的分子构成不同,所以它们的化学性质不同C.原子是化学变化中的最小粒子,所以原子任何情况下不能再分D.O2-、Na+、Mg2+、Cl-的最外层电子数均为8,所以离子最外层电子数均为8B解析:BA、分子和原子都不带电,但不带电的微粒除了分子、原子还可以是中子等,错误;B、水是由水分子构成的,过氧化氢是由过氧化氢分子构成的,分子的构成不同,化学性质不同,正确;C、原子在化学变化中不可分,不在化学变化中,原子可分为原子核和电子,错误;D、离子如锂离子,最外层电子数为2,不是8,错误;故选B。
元素的相对原子质量和相对分子质量的计算

元素的相对原子质量和相对分子质量的计算相对原子质量:1.定义:元素原子质量与碳-12原子质量的1/12的比值,称为该元素的相对原子质量。
2.表示方法:无单位,通常省略不写。
3.计算公式:相对原子质量 = (元素原子质量)/(碳-12原子质量的1/12)4.性质:相对原子质量是一个比值,不随元素原子的实际质量变化而变化。
5.应用:用于化学方程式计算、物质的量计算等。
相对分子质量:1.定义:分子中各原子的相对原子质量之和,称为该分子的相对分子质量。
2.表示方法:无单位,通常省略不写。
3.计算公式:相对分子质量= Σ(各原子的相对原子质量 × 原子个数)4.性质:相对分子质量是一个标量,具有加法性。
5.应用:用于物质的量计算、化学方程式计算等。
6.计算相对原子质量时,以碳-12原子质量的1/12作为标准,其他元素的相对原子质量与之比较得出。
7.计算相对分子质量时,需要注意分子中各原子的个数,以及原子的相对原子质量。
8.在化学方程式计算中,相对原子质量和相对分子质量可作为系数进行约分和化简。
9.相对原子质量和相对分子质量的数值仅供参考,实际质量可能存在一定的误差。
元素的相对原子质量和相对分子质量的计算是化学中的基本概念,掌握它们的定义、计算方法和应用对于中学生来说至关重要。
通过学习这些知识点,可以更好地理解和解决化学问题。
习题及方法:已知氢的相对原子质量为1,氧的相对原子质量为16,求水分子(H2O)的相对分子质量。
根据相对分子质量的计算公式,水的相对分子质量 = 2 × 氢的相对原子质量 + 氧的相对原子质量 = 2 × 1 + 16 = 18。
某元素的原子质量是碳-12原子质量的1/12的1.5倍,该元素的相对原子质量是多少?设该元素的原子质量为M,则相对原子质量 = M / (碳-12原子质量的1/12) = M / 1/12 = 12M。
根据题意,12M = 1.5 × 1/12,解得M = 1/8。
磷酸二氢钾相对原子质量

磷酸二氢钾相对原子质量
磷酸二氢钾的相对原子质量是多少?磷酸二氢钾是一种无色晶体,广泛用作食品添加剂、肥料和试剂等。
其化学式为KH2PO4,由一个钾离子、一个磷酸根离子和两个氢离子组成。
根据元素周期表,钾的相对原子质量为39.1,磷为30.97,氧为16,氢为1。
因此,磷酸二氢钾的相对原子质量可以通过简单的计算得出:
相对原子质量 = 39.1 + 30.97 + 16 + 1 + 1 = 87.07
这意味着,每个分子的磷酸二氢钾相对原子质量为87.07,每克磷酸二氢钾包含的分子数取决于其摩尔质量。
例如,每克磷酸二氢钾包含的分子数为0.0115摩尔,因为1摩尔磷酸二氢钾的摩尔质量为87.07克。
- 1 -。
2024届四川省成都市名校中考一模化学试题含解析

2024届四川省成都市名校中考一模化学试题考生请注意:1.答题前请将考场、试室号、座位号、考生号、姓名写在试卷密封线内,不得在试卷上作任何标记。
2.第一部分选择题每小题选出答案后,需将答案写在试卷指定的括号内,第二部分非选择题答案写在试卷题目指定的位置上。
3.考生必须保证答题卡的整洁。
考试结束后,请将本试卷和答题卡一并交回。
一、选择题(本题包括12个小题,每小题3分,共36分.每小题只有一个选项符合题意)1.下列说法中,完全正确的是A.吃水果和蔬菜可以补充维生素;铁是人体必需的微量元素B.金属都能与酸溶液反应;合金的熔点低于它的成分金属C.硝酸钾(KNO3)属于复合肥;加速溶解可用温度计搅拌D.用甲醛溶液浸泡海产品以防变质;高温下CO能将赤铁矿冶炼成纯铁2.我国古代科技高度发达,对中国古代著作涉及化学的叙述,下列解读不正确的是()A.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应B.《本草纲目》中“灶中所烧薪柴之灰,以灰淋汁,取碱浣衣”中的“碱”是K2CO3C.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金D.“青蒿一握,以水二升渍,绞取汁”,该过程属于化学变化3.常温下,往盛有一定量液体甲的烧杯中逐渐加人固体乙并充分搅拌。
如图所示中横坐标工表示固体乙的质量,纵坐标y表示烧杯中的某物理量(见下表)。
下列实验与图像对应关系合理的是甲乙yA 稀盐酸氧化铜溶液的质量B 水氢氧化钠溶液的质量C 饱和石灰水生石灰溶质的质量D 硝酸银溶液铜粉溶质的质量A.A B.B C.C D.D4.一定质量的铜和镁组成的混合物与足量稀盐酸反应,过滤后,将滤渣在空气中加热,充分反应所得产物的质量恰好等于原混合物的质量。
那么原混合物中镁的质量分数是A.80% B.64% C.50% D.20%5.图表资料为我们提供很多信息,下列说法错误的是()A.根据原子结构示意图,能推断原子的中子数B.根据元素周期表,能查找元素的原子序数、元素符号、相对原子质量C.根据金属活动性顺序表,能判断金属是否容易被稀盐酸腐蚀D.根据溶解度曲线,能判断从溶液中获取晶体的方法6.以下物质中,属于酸的是A.H2O2B.H2SO4C.KMnO4D.Ca(HCO3)27.下列鉴别物质的方法错误的是()A.用酚酞鉴别食盐水和稀醋酸B.用水鉴别生石灰和石灰石C.用燃着的木条鉴别空气和二氧化碳D.用氯化钡溶液鉴别稀盐酸和稀硫酸8.如图A是钾元素在元素周期表中的部分信息,图B是钾原子的结构示意图,下列判断不正确的是A.钾的相对原子质量是39.10 B.钾原子在化学反应中容易失去电子C.钾元素在元素周期表中排在第四周期D.钾元素和钾离子的电子层数相同9.下列图示的实验操作正确的是()A.过滤B.称取氯化钠C.稀释浓硫酸D.测溶液的pH值10.化学反应前后肯定没有发生变化的是()①原子数目;②分子数目;③元素种类;④物质种类;⑤原子种类;⑥物质的总质量。
四川省达州市2024年中考化学真题(含答案)
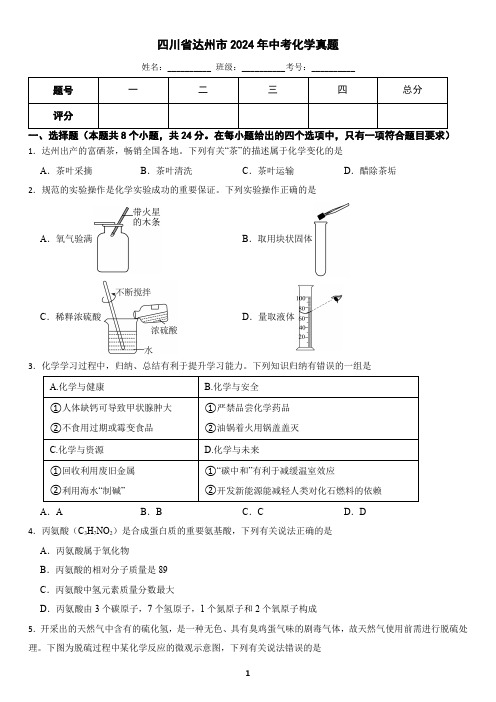
A.茶叶采摘
B.茶叶清洗
C.茶叶运输
D.醋除茶垢
2.规范的实验操作是化学实验成功的重要保证。下列实验操作正确的是
A.氧气验满
B.取用块状固体
C.稀释浓硫酸
D.量取液体
3.化学学习过程中,归纳、总结有利于提升学习能力。下列知识归纳有错误的一组是
A.化学与健康
B.化学与安全
①人体缺钙可导致甲状腺肿大 ②不食用过期或霉变食品
B、由微观示意图可知,该反应方程式为:
一定条件
砨
砨 ,反应物分子个数比为 2:1,符合题
意; C、反应前氢元素化合价为+1 价,硫为-2 价,氧为 0 价,反应后硫为 0 价,氢为+1 价,氧为-2 价,反应中 硫和氧元素化合价发生了改变,不符合题意; D、天然气具有可燃性,进行脱硫处理时会使天然气与氧气混合,必须采取防毒、防爆等安全措施,不符合题 意。 故答案为:B。 【分析】A、根据化学反应前后原子种类和个数不变分析; B、根据微观图示写出反应方程式,从而确定分子个数比分析; C、根据单质中元素化合价为 0,化合物中元素化合价代数和为 0 分析; D、根据天然气的可燃性,与氧气混合易发生爆炸分析。 6.【答案】A 【解析】【解答】A、钾离子、钠离子、硫酸根离子、氯离子相互之间不能结合成气体、沉淀或水,不能发生反 应,可以大量共存,且不存在带有颜色的离子。符合题意; B、亚铁离子在溶液中为浅绿色,且氢离子、亚铁离子和碳酸根离子能发生反应,不能大量共存。不符合题意; C、氢离子和氢氧化根离子能发生反应,不能大量共存。不符合题意; D、铜离子在溶液中为蓝色,钡离子和硫酸根离子能发生反应,不能大量共存。不符合题意; 故答案为:A。 【分析】共存问题即为各物质是否能发生反应,能发生反应则不能共存,不能发生反应则能共存。解题的关键
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
钾离子的相对原子质量
题目:钾离子的相对原子质量
钾离子是指钾原子失去一个电子而形成的带正电的离子,其化学符号
为K+。钾离子在自然界中非常广泛存在,是生命体系中必不可少的元
素之一。与此同时,钾离子也是研究元素的原子结构和性质方面的热
门话题。本文将从不同的角度探讨钾离子的相对原子质量。
一、相对原子质量的定义
相对原子质量是指一个元素原子质量与碳同位素12C原子质量的比值,
通常表示为Ar。例如,钾的相对原子质量就是39.1。
二、钾离子的原子结构
钾原子的原子核中含有19个质子和中子,电子数目为19个。当钾原
子失去一个电子后,就会形成带正电的离子,即钾离子。由于钾原子
失去的电子是来自最外层的电子,因此钾离子的电子层数比钾原子少
一个。此外,钾离子与钾原子具有相同的原子核构成,因此原子核中
的质子和中子数目不变。
三、相对原子质量的计算
相对原子质量的计算需要知道同位素的相对丰度。钾原子的相对原子
质量是39.1,其同位素有两种,即39K和41K,在自然界中相对丰度
分别为93.2581%和6.7302%。因此,钾的相对原子质量可以计算如下:
(39.1×0.932581)+(41×0.067302)=39.1
根据这个计算方法,可以得到钾离子的相对原子质量为39.1。
四、钾离子在生命体系中的作用
钾离子在人体中起着非常重要的作用,其主要功能包括:维持细胞内
外的渗透压平衡、调节神经肌肉的兴奋性、参与某些酶的活性调节等。
因此,人体内钾离子的含量过多或不足都会对健康产生危害。
五、结语
总之,钾离子的相对原子质量是39.1,其原子结构和作用机理也是相
当有趣的研究课题。在实际应用中,了解钾离子的性质和特点有助于
更好地利用和管理它,保障人类健康和经济发展。
