甘胆酸测定试剂盒(均相酶免疫法)产品技术要求zhongshengbeikong
总胆汁酸测定试剂盒(酶循环法)产品技术要求aiweide

总胆汁酸测定试剂盒(酶循环法)适用范围:本试剂用于体外定量测定人体血清中总胆汁酸的含量。
1.1 包装规格a) 试剂1:2×45 mL,试剂2:2×15 mL;b) 试剂1:4×60 mL,试剂2:4×20mL;c) 试剂1:2×60mL,试剂2:2×20mL。
1.2主要组成成分1.2.1试剂1主要组分磷酸氢二钠-柠檬酸缓冲液100mmol/L氧化型硫代辅酶(THIO-NAD) 950mg/L还原型辅酶(NADH) 6g/L聚氧乙烯油醇醚适量1.2.2试剂2主要组分Tris缓冲液100mmol/L3α-羟基类固醇脱氢酶(3α-HSDH) 12.5KU/L聚氧乙烯油醇醚适量2.1外观试剂1:浅黄绿色澄清液体;试剂2:无色澄清液体。
2.2试剂装量应不低于试剂瓶标示装量。
2.3 试剂空白2.3.1试剂空白吸光度:在405nm处测定试剂空白吸光度,应≤0.8。
2.3.2试剂空白吸光度变化率:在405nm处测定空白吸光度变化率|△A/min|≤0.05。
2.4分析灵敏度测定TBA含量为10 µmol/L样本时,其|△A/min|应≥0.01。
2.5线性范围2.5.1测试浓度在[0,180] µmol/LL范围内,线性回归的相关系数(r)应不低于0.990;2.5.2测试浓度在[0,20] µmol/L范围内,线性绝对偏差应不超过±2µmol/L;测试浓度在(20,180] µmol/L范围内,线性相对偏差应不超过±10%。
2.6 测量精密度2.6.1重复性:重复测试三个水平的样本,所得结果的变异系数(CV)应不大于5%。
2.6.2批间差:抽取3个不同批号的试剂,对同一份样本进行重复测定,相对极差≤10%。
2.7准确度比对试验:相关系数r≥0.975,各个浓度点中≤20 µmol /L的绝对偏差不超过±2µmol /L。
总胆汁酸测定试剂盒(酶循环法)产品技术要求九强

总胆汁酸测定试剂盒(酶循环法)适用范围:用于体外定量测定人血清或血浆中的总胆汁酸的含量。
1.1 包装规格见表1。
表1 包装规格1.2 组成成分见表2。
表2 组成成分2.1 外观试剂1为黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为无色或淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白2.3.1 试剂空白吸光度A405nm下测定空白吸光度应≤0.8000。
2.3.2 试剂空白吸光度变化率A405nm下测定的空白吸光度变化率(ΔA/min)应≤0.0400。
2.4 准确度与已上市的产品进行比对试验:在[5,180]μmol/L区间内,相关系数r ≥0.975,在[5,40]μmol/L区间内测定的偏差应不超过±4μmol/L,在(40,180]μmol/L区间内测定的偏差应不超过±10%。
2.5 分析灵敏度样本浓度为40μmol/L时,其吸光度变化在0.0200~0.0800之间。
2.6 线性范围在[5,180]μmol/L区间内,线性相关系数r≥0.99,在[5,20]μmol/L区间内测定的偏差应不超过±2μmol/L,在(20,180]μmol/L区间内测定的偏差应≤10%。
2.7 测量精密度2.7.1 重复性对不同浓度的同一血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于5%。
2.7.2 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 稳定性试剂盒在2℃~8℃密封避光保存,有效期为12个月。
在试剂盒有效期满后一个月以内,应符合2.1、2.3、2.4、2.5、2.6、2.7.1的要求。
总胆汁酸(TBA)测定试剂盒(循环酶法)产品技术要求科方

1外观性状
1.1试剂盒各组分应齐全、完整、无液体渗漏;中文包装标签应清晰,准确、牢固;
1.2R1 组分应为澄清透明、无絮状物、无肉眼可见颗粒及沉淀的液体。
1.3R2 组分应为澄清透明、无絮状物、无肉眼可见颗粒及沉淀的液体。
2
试剂盒装量
试剂净含量应不小于标示值。
3准确度
与比对试剂盒做比对试验,两组结果的相关系数 r 应≥0.975,相对偏差应≤10%。
4灵敏度
测定TBA含量为50.0μmol/L的样品时,平均每分钟吸光度变化值(△A/min)≥0.08。
5试剂空白
在温度37℃、波长405nm条件下检测,试剂空白吸光度≤0.40(比色杯光径1.0cm);试剂空白吸光度变化率(△A/min)≤0.1(比色杯光径1.0cm)。
6线性范围
a)线性范围(0.5-150)μmol/L,相关系数 r 应≥0.990; b)(0.5~5.0)μmol/L范围内偏差绝对值不大于1.0μmol/L;(5.0以上
~150)μmol/L范围内线性偏差应≤15%。
7测量精密度
7.1重复性
CV%应≤5%。
7.2批间差
相对偏差(R)应≤8%。
8特异性
胆红素≤342μmol/L,甘油三酯≤5.6mmol/L,血红蛋白≤2.0g/L,维生素
C≤0.3g/L 对测定结果造成的干扰,偏倚在±15%内。
心型脂肪酸结合蛋白测定试剂盒(胶乳免疫比浊法)产品技术要求zhongshengbeikong

心型脂肪酸结合蛋白测定试剂盒(胶乳免疫比浊法)适用范围:本试剂用于体外定量测定人血清中心型脂肪酸结合蛋白的浓度。
1.1包装规格液体双剂型试剂1(R1):38mL×2,试剂2(R2):14mL×2;试剂1(R1):19mL×2,试剂2(R2):7mL×2;试剂1(R1):19mL×1,试剂2(R2):7mL×1;试剂1(R1):57mL×2,试剂2(R2):21mL×2。
1.2主要组成成分1.2.1 试剂1(R1)主要组分(液体)甘氨酸 100mmol/L 1.2.2 试剂2(R2)主要组分(液体)羊抗人H-FABP抗体包被胶乳颗粒 2mg/mL2.1 外观试剂盒中各组件的外观应满足:2.1.1 试剂1(R1)应为无色或浅黄色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.1.2 试剂2(R2)应为乳白色液体,无杂质、无絮状物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长700nm处(光径1cm),试剂空白吸光度(A)应≤1.300。
2.4 准确度用中生试剂和已上市同类试剂分别测定40个在线性范围内不同浓度的样本,在[2.5,120]ng/mL范围内,比对两组数据的相关系数(r)及测值的偏差,要求r≥0.975;在(20,120]ng/mL区间内,相对偏差应不超过±10%;在[2.5,20]ng/mL区间内,绝对偏差应不超过±2.0ng/mL。
2.5 分析灵敏度对应于浓度为30ng/mL的H-FABP所引起的吸光度变化的绝对值(△A)应在0.020~0.150的范围内。
2.6 重复性重复测定高、低浓度样本,变异系数(CV)应≤ 10%。
2.7 批间差测定同一样本,批间差(R)应≤ 10%。
2.8 线性范围在[2.5,120]ng/mL范围内,线性相关系数(r)应≥0.990,在(20,120]ng/mL范围内,线性相对偏差应不超过±10%;在[2.5,20]ng/mL范围内,线性绝对偏差应不超过±2.0ng/mL。
总胆汁酸测定试剂盒(酶循环法)产品技术要求jiuqiang

总胆汁酸测定试剂盒(酶循环法)适用范围:用于体外定量测定人血清或血浆中的总胆汁酸(TBA)的含量。
1.1 包装规格包装规格见表1。
表1 包装规格1.2 主要组成成分主要组成成分见表2。
表2 主要组成成分注:不同批号的校准品赋值有差异,具体赋值详见靶值单。
2. 性能指标2.1 外观试剂1为黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为无色或淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;校准品为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白2.3.1 试剂空白吸光度A405nm下测定空白吸光度应≤0.8000。
2.3.2 试剂空白吸光度A405nm下测定的空白吸光度变化率(ΔA/min)应≤0.0400。
2.4 准确度与已上市的产品进行比对试验:在[5,180]μmol/L区间内,相关系数r ≥0.975,在[5,40]μmol/L区间内测定的绝对偏差应不超过±6μmol/L,在(40,180]μmol/L区间内测定的相对偏差应不超过±15%。
2.5 分析灵敏度样本浓度为40μmol/L时,其吸光度变化在0.0200~0.0800之间。
2.6 线性区间在[5,180]μmol/L区间内,线性相关系数r≥0.99,在[5,20]μmol/L区间内测定的绝对偏差应不超过±2μmol/L,在(20,180]μmol/L区间内测定的相对偏差应不超过±10%。
2.7 测量精密度2.7.1 重复性对高、低不同浓度的同一血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于5%。
2.7.2 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 稳定性试剂盒在2℃~8℃密封避光保存,有效期为18个月。
在试剂盒有效期满后一个月以内,应符合2.1、2.3、2.4、2.5、2.6、2.7.1的要求。
总胆汁酸测定试剂盒(酶循环法)产品技术要求meigaoyi

总胆汁酸测定试剂盒(酶循环法)适用范围:用于定量检测人血清中总胆汁酸(TBA)浓度。
1.1包装规格a) 试剂1:2×45ml,试剂2:2×15ml;b) 试剂1:4×45ml,试剂2:4×15ml;c) 试剂1:6×60ml,试剂2:2×60ml;d)试剂1:3×60ml,试剂2:3×20ml;e)试剂1:2×300ml,试剂2:2×100ml;f)试剂1:12×16.8ml,试剂2:12×5.6ml;g)试剂1:2×54ml,试剂2:2×18ml;h)试剂1:1×30ml,试剂2:1×10ml。
1.2试剂主要组成成分试剂1主要组成成分甘氨酸缓冲液25 mmol/Lβ-硫烟酰胺腺嘌呤二核苷氧化型(Thio-NAD) 1 mmol/L试剂2主要组成成分Tris缓冲液25 mmol/L烟酰胺腺嘌呤二核苷还原型(NADH)10 mmol/L3α-羟类固醇脱氢酶(3α-HSD)12500 U/L2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2 试剂1应为淡黄色透明溶液;试剂2应为无色或淡黄色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白2.3.1 试剂空白吸光度测定试剂空白吸光度,应<0.5。
2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率△A/min≤0.04。
2.4 分析灵敏度测试150umol/L的被测物时,吸光度变化率(ΔA/min)应不低于0.02。
2.5 准确度回收率90%~110% 范围内。
2.6 精密度2.6.1批内精密度批内变异系数应不大于5%。
2.6.2批间精密度批间相对极差应不大于10%。
2.7 线性区间2.7.1在[2,180)umol/L区间内,线性回归的相关系数(r)应不低于0.990;2.7.2在(50,180)umol/L区间内,相对偏差不超过±15%;2.7.3在[2,50]umol/L区间内,绝对偏差不超过±5umol/L。
生化多项质控品产品技术要求zhongshengbeikong
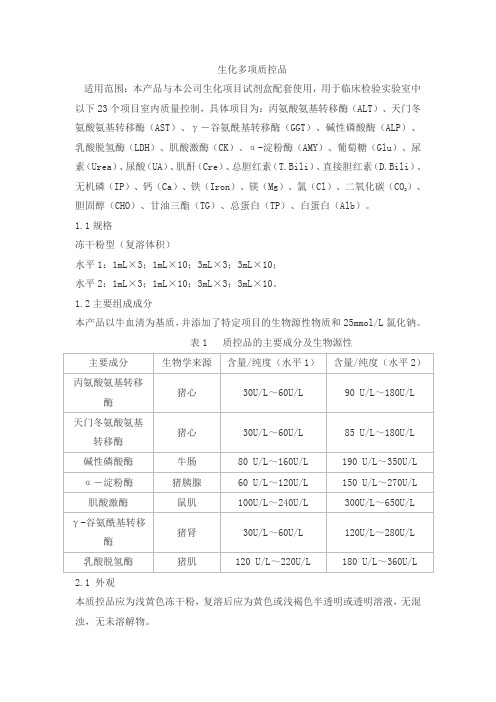
生化多项质控品适用范围:本产品与本公司生化项目试剂盒配套使用,用于临床检验实验室中以下23个项目室内质量控制,具体项目为:丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、γ-谷氨酰基转移酶(GGT)、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、α-淀粉酶(AMY)、葡萄糖(Glu)、尿素(Urea)、尿酸(UA)、肌酐(Cre)、总胆红素(T.Bili)、直接胆红素(D.Bili)、无机磷(IP)、钙(Ca)、铁(Iron)、镁(Mg)、氯(Cl)、二氧化碳(CO)、2胆固醇(CHO)、甘油三酯(TG)、总蛋白(TP)、白蛋白(Alb)。
1.1规格冻干粉型(复溶体积)水平1:1mL×3;1mL×10;3mL×3;3mL×10;水平2:1mL×3;1mL×10;3mL×3;3mL×10。
1.2主要组成成分本产品以牛血清为基质,并添加了特定项目的生物源性物质和25mmol/L氯化钠。
表1 质控品的主要成分及生物源性2.1 外观本质控品应为浅黄色冻干粉,复溶后应为黄色或浅褐色半透明或透明溶液,无混浊,无未溶解物。
2.2 赋值有效性测定本质控品,测定结果应在各项目质控范围内。
2.3瓶间差本质控品中铁项目瓶间差的变异系数(CV)应≤8%;本质控品中其余项目瓶间差的变异系数(CV)应≤5%。
2.4 含水量含水量应≤5%。
2.5稳定性2.5.1效期稳定性原包装质控品在2℃~8℃条件下避光贮存,有效期为18个月。
在有效期满后3个月内,质控品性能应符合2.1、2.2、2.3要求。
2.5.2复溶稳定性在15℃~25℃稳定期满后2小时内,质控品性能应符合2.1、2.2、2.3要求。
在2℃~8℃稳定期满后2小时内,质控品性能应符合2.1、2.2、2.3要求。
在-25℃~-15℃稳定期满后8小时内,质控品性能应符合2.1、2.2、2.3要求。
总胆汁酸测定试剂盒(酶循环法)产品技术要求九强

总胆汁酸测定试剂盒(酶循环法)适用范围:本试剂盒用于体外定量测定人血清或血浆中的总胆汁酸(TBA)的含量。
1.1 包装规格包装规格见表1。
表1 包装规格1.2 主要组成成分主要组成成分见表2。
表2 主要组成成分注:不同批号的校准品赋值有差异,具体赋值详见靶值单。
2.1 外观试剂1为黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;校准品为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白2.3.1 试剂空白吸光度A405nm下测定空白吸光度应≤0.8000。
2.3.2 试剂空白吸光度变化率A405nm下测定的空白吸光度变化率(ΔA/min)应≤ 0.0400。
2.4 准确度与已上市的产品进行比对试验:在[5,180]μmol/L区间内,相关系数r ≥0.975,在[5,40]μmol/L区间内测定的绝对偏差应不超过±6μmol/L,在(40,180]μmol/L区间内测定的相对偏差应不超过±15%。
2.5 分析灵敏度样本浓度为40μmol/L时,其吸光度变化在0.0200~0.0800之间。
2.6 线性区间在[5,180]μmol/L区间内,线性相关系数r≥0.99,在[5,20]μmol/L区间内测定的绝对偏差应不超过±2μmol/L,在(20,180]μmol/L区间内测定的相对偏差应不超过±10%。
2.7 测量精密度2.7.1 重复性对高、低不同浓度的血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于5%。
2.7.2 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 稳定性试剂盒在2℃~8℃密封避光保存,有效期为18个月。
在试剂盒有效期满后一个月以内,应符合2.1、2.3、2.4、2.5、2.6、2.7.1的要求。
2.9校准品溯源性按照《GB/T 21415-2008体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,提供所用产品校准的来源、赋值过程以及测量不确定度,试剂盒校准品溯源至企业工作校准品,与积水医疗株式会社校准品比对赋值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甘胆酸测定试剂盒(均相酶免疫法)
适用范围:本试剂用于体外定量测定人血清中甘胆酸的含量。
1.1规格
液体双剂型
试剂1(R1):60mL×2,试剂2(R2):15mL×2;
试剂1(R1):40mL×2,试剂2(R2):10mL×2;
试剂1(R1):20mL×2,试剂2(R2):10mL×1;
选配校准品(6个浓度):1mL×6;
选配质控品(2个水平):1mL×2。
1.2规格划分说明
根据净含量划分规格。
1.3主要组成成分
试剂盒由试剂1(R1)液体、试剂2(R2)液体、选配校准品液体和选配质控品液体组成。
1.3.1 试剂1(R1)液体:
三羟甲基氨基甲烷(Tris)50mmol/L 葡萄糖六磷酸
(G-6-P) 0.1mmol/L NAD+
0.1mmol/L
抗甘胆酸多克隆抗
体≤1.0%
1.3.2 试剂2(R2)液体:
三羟甲基氨基甲烷(Tris)100mmol/L 葡萄糖六磷酸脱氢酶-甘胆酸偶联物≤1.0%
1.3.3校准品液体:Tris缓冲液基质
甘胆酸定值范围:浓度1:0µg/L;浓度2:500µg/L~3500µg/L;浓度3:3500µg/L~7500µg/L;浓度4:7500µg/L~15000 µg/L;浓度5:15000µg/L~30000 µg/L;浓度6:30000µg/L~55000 µg/L。
(每批定值)
1.3.4 质控品液体:Tris缓冲液基质
甘胆酸定值范围:水平1:1000µg/L~6000µg/L;水平2:
5000µg/L~25000µg/L。
(每批定值)
2.1 外观
试剂盒中各组件的外观应满足:
a) 试剂1(R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;
b) 试剂2(R2)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;
c) 校准品应为无色或淡黄色澄清液体,无混浊,无未溶解物,外包装完整无破损;
d) 质控品应为无色或淡黄色澄清液体,无混浊,无未溶解物,外包装完整无破损。
2.2 净含量
液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度
在波长340nm(光径1cm)处,试剂空白吸光度(A)应≤2.5000。
2.4准确度
测定甘胆酸纯品, 回收率应在80%~120%范围内。
2.5分析灵敏度
对应于浓度为10000µg/L的甘胆酸所引起的吸光度差值(△A)的绝对值应在0.05~0.35的范围内。
2.6重复性
重复测定高、低浓度样本,变异系数(CV)应≤10%。
2.7批间差
测定同一样本,批间差(R)应≤10%。
2.8线性范围
在[800,50000] µg/L范围内,线性相关系数(r)应≥0.990;
在[800,5000] µg/L范围内,线性绝对偏差应不超过±750µg/L;
在(5000,50000] µg/L范围内,线性相对偏差应不超过±15%。
2.9质控品定值有效性
测定结果应在质控范围内。
2.10稳定性
原包装的试剂盒在2℃~8℃避光贮存,有效期为12个月。
有效期满后3个月以内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8、2.9的要求。
2.11校准品溯源性
校准品溯源性应符合GB/T 21415-2008的要求,并提供相关溯源过程、测定值不确定度等内容。
校准品溯源至Sigma甘胆酸纯品。
