2015年版《中国药典》(一部)中裸花紫珠胶囊质量标准20140725公示
2015版药典三部

第4 级为高风险的原材料。这类原材料主要 包括已知具有生物作用机制的毒性化学物质, 如甲氯蝶呤、霍乱毒素、金黄色葡萄菌素孔 道溶血素、金黄色葡萄菌素肠毒素A 和B 以 及中毒性休克综合征毒素,以及大部分成分 复杂的动物源性组织和体液,如用于细胞培 养基成分的牛血淸、用于细胞消化或蛋白质 水解的动物来源的酶以及用于选择或去除免 疫靶向性成分的腹水来源的抗体或蛋白质。
风险等级分级及用于生产的质量控制要求: 根据辅料的来源、生产以及对生物制品潜 在的毒性和安全性的影响等,将辅料按风 险等级从低到高分为四级,同原材料分等 级,具体参看2015年版药典。
重组人干扰素a2b注射液
3.1原液检定 3.1.6外源性DNA残留量: 应不高于1支/瓶应不高于10ng(通则3407)
菌毒种的索取、分发与运输
应符合《病原微生物实验室生物安全管理 条例》等国家相关管理规定。(删除具体 要求,按国家生物安全相关规定执行,避 免遗漏并保证及时更新)
二、生物制品国家标准物质制备和标定规程
标准物质的种类
1.国家生物标准品,系指用国际生物标准品 标定的,或由我国自行研制的(尚无国际生 物标准品者)用于定量测定某一制品含量、 效价或毒性的标准物质,其含量以毫克(mg) 表示,生物学活性以国际单位(IU)、特定 单位(AU)或单位(U)[增订]表示。
熔封或严封:系指将容器熔封或用适宜的 材料严封,以防止空气与水分的侵入并防 止污染。
阴凉处:系指不超过20℃; 凉暗处:系指避光并不超过20℃; 冷处:系指2~10 ℃; 常温(室温):系指10~30 ℃;
生物制品的贮藏、运输应符合“生物制品 贮藏和运输规程”的规定。
毒菌种登记程序
第3 级为中等风险的原材料。这类原材料非 药用,包括生物制品生产用培养基成分、非 动物来源蛋白水解酶、用于靶向纯化的单克 隆抗体,以及用于生物制品提取、纯化、灭 活的化学试剂等。这类生物制品原材料的质 量控制要求应高于前两个等级的原材料,为 使其符合生产用原材料的要求,使用时可能 需进一步加工、纯化处理或增加病毒灭活和 (或)去除步骤等。
2015年第4期药品质量公告

二、在生产环节监督抽样检验不符合标准规定的药品名单
序 号 1 药品名称 标示生产单位 批号 20141201 规格 每支装 10ml 检品来源 杭州天目山药业股份有限 公司 检验依据 《中国药典》2010年版一部 不合格项目 [含量测定] 检验机构 杭州市食品药品检验研究院
百合固金口 杭州天目山药业股份有限公司 服液
附件
浙 江 省 药 品 质 量 公 告
(2015年第4期,总第66期)
一、抽样检验不符合标准规定且假冒标示生产单位生产的假药
序 号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 药品名称 白芍 白及 白术 白芷 川木通 地龙 地龙 防风 防风 钩藤 谷精草 骨碎补 骨碎补 瓜蒌 标示生产单位 芍花堂国药股份有限公司 天马(安徽)中药饮片科技有限 公司 安徽贺林中药饮片科技有限公 司 芍花堂国药股份有限公司 黄山华仁堂药业(饮片)有限公 司 黄山华仁堂药业(饮片)有限公 司 安徽新兴中药材饮片有限公司 安徽源和堂药业股份有限公司 安徽泰源中药饮片有限公司 铜陵禾田中药饮片有限公司 天马(安徽)中药饮片科技有限 公司 黄山华仁堂药业(饮片)有限公 司 亳州市长生中药饮片有限公司 安徽省金芙蓉中药饮片有限公 司 批号 150315 140702 150110 150120 20130501 20140701 20141216 140605 140216 20141101 120901 20140801 140903 150406 规格 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 饮片 检品来源 兰溪詹氏中医骨伤医院 检验依据 核查结果 假冒生产 假冒生产 假冒生产 假冒生产 假冒生产 假冒生产 假冒生产 假冒生产 假冒生产 假冒生产 假冒生产 假冒生产 假冒生产 假冒生产 检验机构 金华市食品药品检验检测研究院 杭州市食品药品检验研究院 嘉兴市食品药品检验检测院 金华市食品药品检验检测研究院 杭州市食品药品检验研究院 杭州市食品药品检验研究院 丽水市食品药品检验所 杭州市食品药品检验研究院 金华市食品药品检验检测研究院 丽水市食品药品检验所 杭州市食品药品检验研究院 杭州市食品药品检验研究院 宁波市药品检验所 金华市食品药品检验检测研究院
[2015年版]中国药典四部凡例
![[2015年版]中国药典四部凡例](https://img.taocdn.com/s3/m/b3fa374d2f60ddccdb38a01c.png)
《中国药典》2015年版四部凡例总则一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。
《中国药典》一经颁布实施,其同品种的上版标准或其原国家标准即同时停止使用。
《中国药典》由一部、二部、三部、四部及其增补本组成。
一部收载中药,二部收载化学药品,三部收载生物制品,四部收载通则和药用辅料。
除特别注明版次外,《中国药典》均指现行版《中国药典》。
本部为《中国药典》四部。
二、国家药品标准由凡例与正文及其引用的通则共同构成。
本部药典收载的凡例与通则对未载入本部药典的其他药品标准具同等效力。
三、凡例是为正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、通则与药品质量检定有关的共性问题的统一规定。
四、凡例和通则中采用“除另有规定外”这一用语,表示存在与凡例或通则有关规定不一致的情况时,则在正文中另作规定,并按此规定执行。
五、正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。
六、正文所设各项规定是针对符合《药品生产质量管理规范》Good Manufacturing Practices,GMP)的产品而言。
任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。
七、《中国药典》的英文名称为Pharmacopoeia of the People’s Republic of China;英文简称为Chinese Pharmacopoeia;英文缩写为 ChP。
正文八、《中国药典》各品种项下收载的内容为标准正文。
正文系根据药物自身的理化与生物学特性,按照批准的处方来源、生产工艺、贮藏运输条件等所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。
九、药用辅料标准正文内容一般包括:(1)品名(包括中文名、汉语拼音与英文名);(2)有机物的结构式;(3)分子式、分子量与CAS编号;(4)来源;(5)制法;(6)性状;(7)鉴别;(8)理化检查;(9)含量测定;(10)类别;(11)贮藏;(12)标示等。
药品质量公告2014年
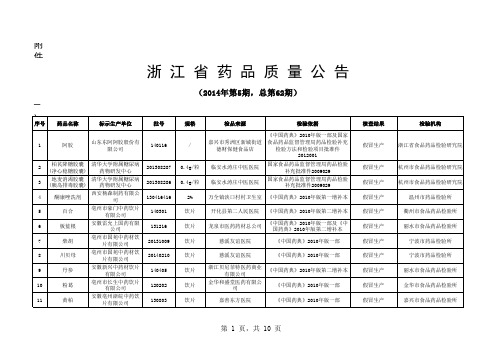
衢江区乌巨山中药材合 [检查](二氧化硫 《中国药典》2010年版第二增补本 作社 残留量) 浙江华宇药业股份有限 《中国药典》2010年版第二增补本 公司 杭州惠远实业有限公司 《中国药典》2010年版一部 [浸出物] [检查](水分); [浸出物]
5
延胡索
20140305
《中国药典》2010年版一部及国家 [性状];[鉴 食品药品监督管理局药品检验补充 浙江凯润制药有限公司 别](1)显微特征; 检验方法和检验项目批准件 [检查](金胺O) 2010006
《国家药品标准》化学药品地方标 [检查](可见异物) 准上升国家标准第十四册 《中国药典》2010年版第一增补本 [含量测定]
《卫生部药品标准》中药成方制剂 [检查](水分,装 第八册 量差异) 《卫生部药品标准》中药成方制剂 第七册 [检查](水分)
15
绍兴市食品药品检验所
16
每8丸相当 湖州慕韩斋医药连锁有 于原生药3g 限公司鸿丰药店
1
阿胶
140116
/
假冒生产
浙江省食品药品检验研究院
2 3 4 5 6 7 8 9 10 11
柏芪降糖胶囊 清华大学附属糖尿病 (净心稳糖胶囊) 药物研发中心 地麦消渴胶囊 清华大学附属糖尿病 (胰岛排毒胶囊) 药物研发中心 西安杨森制药有限公 酮康唑洗剂 司 亳州市豪门中药饮片 百合 有限公司 安徽雷允上国药有限 板蓝根 公司 亳州市国苑中药材饮 柴胡 片有限公司 亳州市国苑中药材饮 川贝母 片有限公司 安徽新兴中药材饮片 丹参 有限公司 亳州市长生中药饮片 粉葛 有限公司 安徽亳州浙皖中药饮 黄柏 片有限公司
22
延胡索
130901
假冒生产
杭州市食品药品检验研究院
中国药典2015年版勘误表
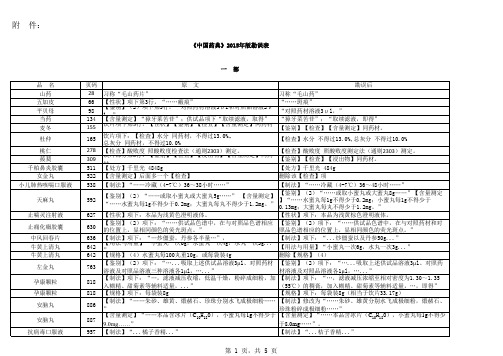
附 件:《中国药典》2015年版勘误表一 部鼻炎康片1689【鉴别】(4)“……吸取〔鉴别〕(3)项下的供试品溶液……”【鉴别】(4) “……吸取〔鉴别〕(2)项下的供试品溶液……”功劳去火片756【功能与主治】项下:“清热开音。
用于风热犯肺引起的失音声哑;风热犯肺引起的急性咽炎出现的咽痛、咽干灼热、咽粘膜充血【功能与主治】项下:“ 清热解毒。
用于实热火毒所致的急性咽喉炎、急性胆囊炎、急性肠炎。
”心悦胶囊720【功能与主治】项下:“……利血……”【功能与主治】项下:“……和血……”品 名页码原 文勘误后米力农399【标注】 本品说明书中应注明乳酸的处方量。
应挪至“米力农注射液”标准最后谷胱甘肽片512【贮藏】 密封,置凉阴干燥处保存。
【贮藏】 密封,置阴凉干燥处保存。
注射用阿魏酸钠578【贮藏】 遮光,密封保存【贮藏】 遮光,密闭保存单硝酸异山梨酯片693【含量测定】取本品20片,……,置250ml量瓶中【含量测定】取本品20片,……,置25ml量瓶中氢溴酸加兰他敏片781英文名:Galanthamine Hydrobromide Tablets 英文名:Galantamine Hydrobromide Tablets 盐酸氟西泮1035附:杂质Ⅱ 分子量:369.30附:杂质Ⅱ 分子量:385.34烟酸占替诺氯化钠注射液1182【含量限度】“……107.0%,含氯化钠(NaCl)应为标示量的95.0%~105.0%”维生素B 61234【有关物质】“照含量测定项下的色谱条件,取对照溶液10μl 注入液相色谱仪,精密量取供试品溶液与对照溶液各10μl ”【有关物质】“照含量测定项下的色谱条件,精密量取供试品溶液与对照溶液各10μl ”富马酸喹硫平1441【有关物质】“精密量取适量,用流动相定量稀释制成每1ml 中约含富马酸喹硫平1μg 的溶液,作为对照溶液。
”【有关物质】“精密量取适量,用流动相定量稀释制成每1ml 中约含喹硫平1μg 的溶液,作为对照溶液。
对《中国药典》2015年版一部含雄黄制剂标准的建议

对《中国药典》2015年版一部含雄黄制剂标准的建议贾超;李景辉;朱琳【摘要】Objective To improve the standard for preparations containing realgar in Chinese Pharmacopoeia (2015 edition Volume Ⅰ).Methods The seleted items of realgar-containing preparation standard in Chinese Pharmacopoeia (2015 edition Volume Ⅰ) were analyzedstatistically.Results There were 37 preparations containing realgar in Chinese Pharmacopoeia (2015 edition Volume Ⅰ).There were some problems in the quality standard text,including processing and identification of realgar,limit test of arsenic trioxide,determination of realgar content and attention items.Conclusion Suggestions on improvement of standard of preparations containing realgar.%目的完善《中国药典》2015年版一部含雄黄制剂的标准.方法对《中国药典》2015年版一部收载的含雄黄制剂标准中雄黄相关项目进行统计分析.结果《中国药典》2015年版一部共收载含雄黄的制剂37个,在质量标准正文中雄黄炮制、雄黄鉴别、三氧化二砷限量检查、雄黄含量测定及注意等项目中存在一些问题.结论提出完善含雄黄制剂标准的建议.【期刊名称】《实用药物与临床》【年(卷),期】2017(020)010【总页数】4页(P1225-1228)【关键词】《中国药典》;雄黄;制剂【作者】贾超;李景辉;朱琳【作者单位】辽宁省本溪市药品检验所,辽宁本溪117000;辽宁省本溪市药品检验所,辽宁本溪117000;辽宁省本溪市药品检验所,辽宁本溪117000【正文语种】中文雄黄为硫化物类矿物雄黄族雄黄,主含二硫化二砷(As2S2);具有解毒杀虫、燥湿祛痰、截疟的功能;用于痈肿疔疮、蛇虫咬伤、虫积腹痛、惊痫、疟疾。
红药胶囊质量标准
XXXXXXXXX有限公司
一、目的:建立红药胶囊质量标准,确保成品的质量。
二、范围:本规定适用于红药胶囊质量控制。
三、责任:
四、内容:
1.标准来源
国家食品药品监督管理局标准 YBZ07232009;《中国药典》2015年版四部2.技术要求
3.贮存条件:密封。
4.有效期:24个月。
5.产品名称及产品代码:红药胶囊;J
6
6.对应的产品处方编号:无此项内容。
7.产品规格和包装形式:
7.1规格:0.25g/粒×12粒/板×2板/盒×300盒/箱。
7.2内包装:铝塑泡罩、复合膜包装。
7.3外包装:300克白卡纸盒,五层瓦楞纸箱。
8.相关标准操作规程:红药胶囊检验标准操作规程(SOP-ZL-JG(CP)-014)、物料取样标准标准操作规程(SOP-ZL-QA-001)。
9.注意事项
9.1孕妇忌服;经期停服。
9.2搬运:小心、轻放,不能倒置。
9.3堆码:不多于五层。
9.4防止受潮,无吸潮、结块、潮解等现象。
10.文件附件:共0份。
11.修订及变更历史:。
中国药典溶出度_溶出度-2015中国药典
中国药典201兹舉版0931溶出度与释放度测定法溶出度系指活性药物从片剂、胶囊剂或颗粒剂等普通制剂在规定条件下溶出的速率和程度,在缓释制剂、控释制剂、肠溶制剂及透皮贴剂等制剂中也称释放度。
仪器装置第一法(篮法>(1)转篮分篮体与篮轴两部分,均为不锈钢或其他惰性材料制成,其形状尺寸如图1所示。
篮体A由方孔筛网 (丝径为 0. 28mm士 0. 03mm,网孔为 0. 40mm士 0. 04mm) 制成,呈圆柱形,转篮内径为20.2mm±0mm,上下两端都有封边。
篮轴B的直径为 75mm士0.35mm,轴的末端连一圆盘,作为转篮的盖;盖上有一通气孔(孔径为 Omm土0.5mm);盖边系两层,上层直径与转篮外径相同,下层直径与转篮内径相同;盖上的3个弹簧片与中心呈120。
角。
(2)溶出杯一般由硬质玻璃或其他惰性材料制成的底部为半球形的1000ml杯状容器,内径为102mm 土 4mm(圆柱部分内径最大值和内径最小值之差不得大于0.5mm),高为185mm ±25mm;溶出杯配有适宜的盖子,盖上有适当的孔,中心孔为篮轴的位置,其他孔供取样或测量温度用。
溶出杯置恒温水浴或其他适当的加热装置中。
(3)篮轴与电动机相连,由速度调节装置控制电动机的转速,使篮轴的转速在各品种项下规定转速的士4%范围之内。
运转时整套装置应保持平稳,均不能产生明显的晃动或振动(包括装置所处的环境)。
转篮旋转时,篮轴与溶出杯的垂直轴在任一点的偏离均不得大于2mm,转篮下缘的摆动幅度不得偏离轴心 Omm。
(4)仪器一般配有6套以上测定装置。
75±0.3575±0.3520.2 士 0 -IO.IS8+|..9£ZZolr+lofs■ 70±5,0 -单位咖图1转篮装置图2搅拌桨装置第二法(桨法>除将转篮换成搅拌桨外,其他装置和要求与第一法相0931溶出度与释放度测定法同。
搅拌桨的下端及桨叶部分可涂适当的惰性材料(如聚四氟乙烯),其形状尺寸如图2所示。
药品质量标准
药品质量标准
(1) 判断依据:我国现行的药品标准有国家药典(中国药典)、局标准(国家食品药品监管局药品标准)。
(2) 《中国药典》的基本结构和主要内容
《中华人民共和国药典》简称《中国药典》,英文缩写Ch.P
建国以来,我国已经先后出版了八版药典:
1953年版、1963年版、1977年版、1985年版、1990年版、1995年版、2000年版,2005年版。
现行版:2005年版,分三部,一部收
载药材、饮片等,二部收载化学药品、抗生素等,三部收载生物制品。
中国药典的内容:凡例、正文、附录和索引。
凡例部分包括标准规定、检验方法和限度、残留溶剂、标准品、对照品、计量、精确度、试药、试液、指示剂、包装、标签等。
《中国药典》2015年版勘误
附 件:《中国药典》2015年版勘误表(201一 部二 部雷贝拉唑钠肠溶胶囊1480英文名:Rabeprazole Sodium Enteric-coated Capsules磷酸肌酸钠1568异常毒性 取本品,用注射用水溶解并制成每1ml中含磷酸肌酸钠60mg的溶液,依法检查(通则1141),应符合规定(供无菌分装用)。
磷酸氢钙片1580【检查】其他 除崩解时限外,应符合片剂项下有关的各项规定(通则0101)。
依托度酸666【检查】有关物质雌二醇缓释贴片1507【检查】溶出度 分别取出溶出杯中全部溶液并即时加入温度为37.0℃±0.5℃的溶出介质1000ml,水杨酸108【检查】有关物质各杂质峰面积的和不得大于对照溶液主峰面积(0.2%)。
三 部四 部品 名页码原 文涂剂21【装量】……二氧化硅455【硫酸盐】……依法检查(通则0801)……乙交酯丙交酯共聚物(5050)(供注射446用)丁香油460【含量测定】测定法 ……另精密取 β-丁香烯、丁香酚与乙酸丁香酚对照品适量,……465【折光率】本品的折光率(通则0621)……466【脂肪酸组成】……进样口温度为206℃,……大豆磷脂468【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg、200μg的混合溶液,……469【微生物限度】……还不得检出大肠埃希和沙门菌。
470【磷脂酰胆碱、磷脂酰乙醇胺含量】 ……用三氯甲烷-甲醇(2:1)溶解,制成每1ml含上述对照品分别为50μg、100μg、100μg、200μg、200μg、200μg的混合溶液,……木糖醇479【总糖】……取5ml,作为对照品溶液;……正丁醇489【相对密度】 本品的相对密度(通则0612)……交联聚维酮506【含量测定】 ……照氮测定法(通则0704第二法)测定,……阿拉伯胶516【鉴别】……供试品溶液所显斑点的位置与颜色应与乳糖、阿拉伯糖和鼠李糖对照品溶液的斑点相同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
裸花紫珠胶囊
Luohuazizhu Jiaonang
【处方】 裸花紫珠干浸膏200g
【制法】 取裸花紫珠干浸膏,加淀粉适量,制粒,干燥,装入胶囊,制成1000粒(规格1)或667粒(规格2),即得。
【性状】 本品为硬胶囊,内容物为深棕色至棕黑色的颗粒和粉末;味涩、微苦。
【鉴别】 取本品内容物1g ,加水150ml ,煎煮,保持微沸1小时,放冷,离心,取上清液加氯化钠5g ,振摇使溶解,用乙酸乙酯40ml 振摇提取,取乙酸乙酯液,回收溶液至干,残渣加甲醇1ml 使溶解,作为供试品溶液。
另取裸花紫珠对照药材1g ,同法制成对照药材溶液。
照薄层色谱法(附录ⅥB )试验,吸取上述两种溶液各10~20μl ,分别点于同一用0.5%氢氧化钠溶液制备的硅胶G 薄层板上,以乙酸乙酯-甲醇-浓氨试液(17:2:1)为展开剂,展开,取出,晾干,喷以3%三氯化铝乙醇溶液,105℃加热5分钟,在紫外光(365nm )下检视。
供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点。
【检查】 应符合胶囊剂项下有关的各项规定(附录 I L )。
【含量测定】 照高效液相色谱法(附录Ⅵ D)测定。
色谱条件与系统适用性试验 以十八烷基硅烷键合硅胶为填充剂,以乙腈为流动相A ,以0.1%甲酸溶液为流动相B ,按下表中的规定进行梯度洗脱;木犀 草苷检测波长为350nm 、毛蕊花糖苷检测波长为330nm ;柱温为35℃。
理论板数按木犀草苷峰和毛蕊花糖苷峰计算均应不低于5000。
对照品溶液的制备 取木犀草苷对照品、毛蕊花糖苷对照品适量,精密称定,分别加70%甲醇制成每1ml 含木犀草苷20μg 、毛蕊花糖苷40μg 的溶液,即得。
供试品溶液的制备 取装量差异项下的本品内容物,研细,取约1g ,精密称定,置具塞锥形瓶中,精密加入70%甲醇50ml ,称定重量,超声处理(功率500W ,频率40kHz )40分钟,放冷,再称定重量,用70%甲醇补足减失的重量,时间(分钟)
流动相A 流动相B 0~50
50~51
51~61 14 14→80 80 86 86→20 20
摇匀,滤过,取续滤液,作为木犀草苷供试品溶液。
另精密量取续滤液5ml,置50ml量瓶中,加70%甲醇稀释至刻度,摇匀,作为毛蕊花糖苷供试品溶液。
测定法分别精密吸取对照品溶液与供试品溶液各10µl,注入液相色谱仪,测定,即得。
本品每粒含裸花紫珠以木犀草苷(C21H20O11)计,规格(1)不得少于0.20mg,规格(2)不得少于0.30 mg;以毛蕊花糖苷(C29H36O15)计,规格(1)不得少于3.2mg;规格(2)不得少于4.8mg。
【功能与主治】消炎,解毒,收敛,止血。
用于细菌感染引起的炎症,急性传染性肝炎,呼吸道和消化道出血。
【用法与用量】口服。
规格(1)一次3~5粒、规格(2)一次2~3粒,一日3~4次。
【规格】(1) 每粒装0.3g(含干浸膏0.2g)(2) 每粒装0.4g(含干浸膏0.3g)
【贮藏】密封。
附:裸花紫珠干浸膏质量标准见“裸花紫珠片”项下。
