2019中考专题酸碱盐鉴别鉴定推断导学案
酸碱盐的鉴别、鉴定和推断 学程

酸碱盐的鉴别、鉴定和推断学程班级: 姓名: 小组: 等级:〖学习目标〗1. 利用物质间反应规律掌握酸碱盐基本的鉴定与鉴别方法。
2、根据反应现象与物质性质,进行物质推断,判断物质存在。
(重点、难点)。
〖学习过程〗模块一自学一、自学任务特殊的化学反应现象(一)变色(1)酸与酸碱指示剂反应(2)碱与酸碱指示剂反应(二)生成沉淀(1)白色沉淀①难溶于稀硝酸的:BaSO4、AgCl②溶于酸且产生大量气泡的:BaCO3、CaCO3③溶于酸不产生气泡的:Mg(OH)2(2)蓝色沉淀:(3)红褐色沉淀:(三)放出气体(1)活泼金属与酸反应放出氢气(请举例)(2)碳酸盐与酸(请举例)(3)放出氨气(请举例)二、自学指导1.请同学们依据学习目标完成自学任务。
2.完成任务后,同桌两人交流答案,相互补充,相互指导。
三、自学检测升学指导P122例一、例二四、自学困惑模块二合学一、合学任务有一包白色粉末,可能有CaCO3、Na2SO4、KNO3、CuSO4、Na2CO3中的一种或几种组成,为鉴别其组成,现进行如下实验:(1)将此固体加水溶解,得无色溶液(2)在此溶液中加入氯化钡溶液,生成白色沉淀(3)在过滤后的白色沉淀中加入足量的稀硝酸,沉淀不消失由此推断:该粉末中一定含有,一定不含有。
二、合学指导1、请同学们独立完成任务,然后小组讨论。
2、同学们,请相信自己,你是最优秀的。
三、合学检测指导P122习题1、2、5、6四、合学困惑五、教师精讲模块三省学一、省学任务1.请同学们以思维导图的方式或者你喜欢的其他方式构建本节课的知识体系、2.请发挥你的聪明才智,完成下面的练习二、省学指导1、根据物质间反应规律,结合实验现象质量进行物质鉴别与推断2.独立完成后小组内订正,不能明确的标明,班内统一答案。
三、省学练习指导P123习题3、7 P124习题8、9、10四、省学自评1.我的收获(知识方面、能力方面、情感态度价值观方面、学习方式等方面)。
酸碱盐导学案

酸碱盐导学案一、概念介绍酸碱盐是化学中常见的三类物质。
它们在我们的日常生活中发挥着重要的作用。
本导学案将带领你了解酸、碱和盐的基本概念和性质。
1. 酸酸是一类味道酸酸的化合物,能溶于水并产生氢离子(H+)的物质。
酸可以与碱中和,产生盐和水。
常见的酸包括硫酸、盐酸和醋酸等。
2. 碱碱是一类味道苦的化合物,能溶于水并产生氢氧离子(OH-)的物质。
碱与酸反应可以中和,产生盐和水。
常见的碱包括氢氧化钠、氢氧化铝和氢氧化铜等。
3. 盐盐是由酸和碱中和而成的化合物。
盐包含正离子和负离子,常见的盐有氯化钠、硫酸铜和磷酸二氢钙等。
二、酸碱指示剂酸碱指示剂是一种能够根据溶液的酸碱性发生颜色变化的物质。
常见的酸碱指示剂有甲基橙、酚酞和蓝石蕊等。
通过酸碱指示剂,我们可以简单地判断溶液是酸性还是碱性。
三、酸碱中和反应酸碱中和反应是酸和碱反应生成盐和水的过程。
此反应可获得大量的热能,称为中和反应的热效应。
例如酸碱中和反应:NaOH + HCl → NaCl + H2O四、酸碱性和pH值溶液的酸碱性可以通过pH值来表示,pH值是对溶液酸碱程度的衡量指标。
酸性溶液pH值小于7,碱性溶液pH值大于7,中性溶液pH 值等于7。
五、酸碱盐的应用1. 酸的应用:a. 电池酸:用于电池,例如铅酸电池。
b. 柠檬酸:食品加工的酸味剂,用于制作柠檬饮料和草莓酱等。
2. 碱的应用:a. 氨水:清洁和消毒剂,用于去污染和杀菌。
b. 精制钠:制备肥皂和玻璃,用于清洁和玻璃制造。
3. 盐的应用:a. 食用盐:调味品,用于食物的调味。
b. 硫酸铜:农业杀虫剂,用于杀虫和防治病害。
六、实验探究通过实验我们可以进一步了解酸碱的性质和反应。
实验1:酸碱中和反应材料:醋酸、氢氧化钠、酸碱指示剂、试管、滴管步骤:1. 取一支试管,加入少量的醋酸。
2. 加入2-3滴酸碱指示剂。
3. 用滴管滴加少量的氢氧化钠。
4. 观察溶液颜色的变化。
实验2:酸碱溶液的pH值测定材料:酸、碱、pH试纸、试管、滴管步骤:1. 取试管,加入一些待测溶液。
酸碱盐的推断课件

白色沉淀 溶于酸且产生大量气泡CaCO3等
特 殊 生成沉淀
溶于酸不产生气泡的 Mg(OH)2
反
蓝色沉 淀:Cu(OH)2
应 现
红褐色沉淀:Fe(OH)3
象
复分解反应:碳酸盐与酸,(CO2)
放出气体
铵盐与碱
(NH3)
置换反应:活泼金属与酸 (H2)
分解反应:过氧化氢分解 、硫酸钠、硝酸钾、硫酸铜、
为了验证猜想C,小红继不续可向以该。因溶为液氢中氧滴化加钡能氯和化碳钡酸溶钠液反应至生不成再氢产氧生化钠, 沉干扰淀对,溶过液滤中,是否你含认有为氢她氧接化钠下的来确还定应该进行什么实验?—————— ——————。在小红所作的实验中,若把氯化钡溶液换成氢氧化 钡溶液可以吗?为什么?—————————————————— ————————————————。
沉淀不消失
以上实验不能判断该混合物中是否含有 NaCl ,
若要检验此物质是否存在,应向过滤后的无色溶液中加
入的试剂依次是 Ba(NO3)2 、 AgNO3 、稀硝酸
达标检测:
1、某无色气体可能含有CH4、CO、CO2、N2中的 一种或几种,现将气体依次通过下面的装置,观察到 A装置未见浑浊,D装置内无水硫酸铜变蓝,最终还 收集到一定量的干燥气体(假设每部反应都是完全 的)。请回答下列问题:
有一瓶气体,它是由CO、CO2、CH4中 的一种或几种组成的,将其分别进行如下实 验:
a.将气体通入紫色石蕊试液 ,无明显现象;
b.在导管口将气体点燃,在火焰上方罩一个干 冷的烧杯,烧杯壁上有水珠,将烧杯迅速倒 过来加入澄清的石灰水振荡,石灰水变浑浊。
c.
请回答该气体中一定没有 ,一定
有
,可能有
酸碱盐复习推断题复习课件教学设计(初化人教版)

课题名称
酸碱盐复习-推断题专项
教师
学校
设计理念
本教学遵循由易入难、从感官认识到理性认识的一个过程,“以学生发展为本”为指导思想进行教学设计。注重学法指导,紧扣研究推断题的主线,通过对比的教学手段,指导学生按照由个别到一般的顺序认识化学物质;增强学生的合作学习意识。引导学生自主归纳、总结,体现新课程理念。
【学生】回答问题
思考
填写导学案
展示中考考点,通过总结使知识条理化系统化,明确中考考点。
通过总结增强对比性充分把握物质的颜色特征
4.【以反应条件为突破口】
点燃:
通电:
催化剂:
高温:
【回答】根据条件回忆化学反应
总结到学案上
通过总结增强对比性充分把握化学反应的条件特征
5.【以化学反应的基本类型为突破口】
(1)常见的能发生分解反应的物质:
(2)不溶于水但溶于酸的某些常见白色沉淀:
(3)红褐色沉淀:
(4)蓝色沉淀:
2.【以特征颜色为突破口---固态物质】
红色固体:
黑色固体:
淡黄色固体:
3.【以特征颜色为突破口---溶液】
含有铜离子(Cu2+)的溶液为,例如:
含有铁离子(Fe3+)的溶液为,例如:
含有亚铁离子(Fe2+)的溶液为,例如:
(2)常见的能发生置换反应的物质:
【回答】根据条件回忆化学反应
基本类型总结到学案上
通过总结增强对比性充分把握化学反应的基本类型特征
6.[找到配对离子](联系在一起——不能大量共存的)
H+OH-CO32-Fe CuO
OH-H+Fe3+Cu2+CO2NH4+
2019年上海中考化学优质讲义-酸碱盐实验(学生版)
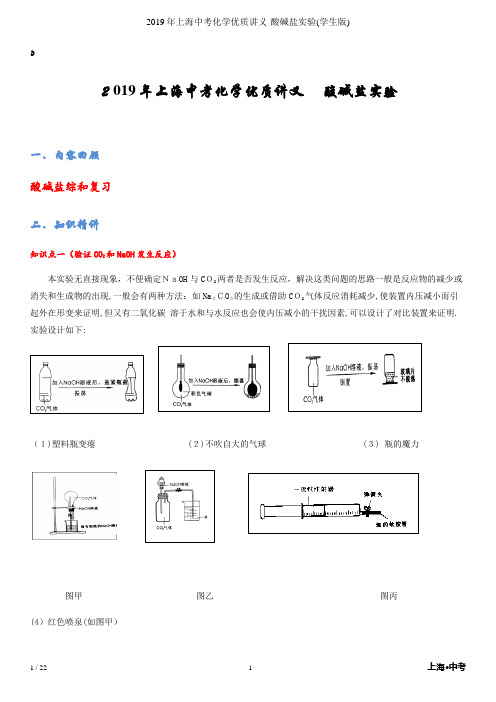
ﻩ2019年上海中考化学优质讲义 酸碱盐实验一、内容回顾 酸碱盐综和复习 二、知识精讲知识点一(验证CO 2和NaOH 发生反应)本实验无直接现象,不便确定NaOH 与C O2两者是否发生反应,解决这类问题的思路一般是反应物的减少或消失和生成物的出现,一般会有两种方法:如Na 2CO 3的生成或借助C O2气体反应消耗减少,使装置内压减小而引起外在形变来证明,但又有二氧化碳 溶于水和与水反应也会使内压减小的干扰因素,可以设计了对比装置来证明.实验设计如下:(1)塑料瓶变瘪(2)不吹自大的气球 (3) 瓶的魔力图甲 图乙 图丙 (4)红色喷泉(如图甲)红色喷泉说明:烧杯中用滴有酚酞的NaOH溶液是为了便于观察,将胶头滴管中的NaOH溶液挤入烧瓶中一段时间后,打开止水夹,如果看到有红色喷泉现象,则证明NaOH溶液与CO2发生了反应。
(5)烧杯中的水有何变化(如图乙)红色喷泉说明:烧杯中用滴有酚酞的NaOH溶液是为了便于观察,将胶头滴管中的NaOH溶液挤入烧瓶中一段时间后,打开止水夹,如果看到有红色喷泉现象,则证明NaOH溶液与CO2发生了反应。
(5)烧杯中的水有何变化(如图乙)说明:将分液漏斗中的NaOH溶液滴入装有二氧化碳的广口瓶一段时间后,打开止水夹,观察到因为内压减小烧杯中的水会沿导管进入到广口瓶中,则证明了NaOH溶液与CO2发生了反应。
(6)注射器中的活塞有何变化(如图丙)说明:用一支规格为50ml的一次性注射器(要求注射器的润滑性好),先抽取20ml的NaOH溶液,不要让针管内的液面上和软胶管里留有空气;再从盛有CO2的集气瓶里抽取20ml的CO2此时活塞处于40ml刻度处,立即把弹簧夹夹在软胶管上用力振荡针管内的溶液多次,停止振荡后活塞会自行向前慢慢推进,则说明NaOH溶液与CO2发生了反应.知识点二(变质问题)氢氧化钠变质:1.原因:敞口放置,与空气中的二氧化碳反应,生成了碳酸钠。
2.检验氢氧化钠变质的方法:①取少量样品于试管中,滴加稀盐酸(或稀硫酸),如果产生气泡,说明已变质。
中考2019-2020年化学精品复习专题之框架推断导学案
中考2019-2020年化学精品复习专题之框架推断导学案框架推断一、学习目标1、熟悉常见物质的物理性质和化学性质2、掌握推断题的一般解题方法3、进一步熟悉九年级上册重要化学方程式的书写二、本课重难点:1、掌握推断框架题的一般方法 2、准确的找到突破口三、知识储备。
1、特殊颜色四、典型例题分析例1、现有A 、B 、C 、D 四种物质,A 为红色固体, B 、D 为黑色固体,C 为无色气体,请按下图推断 A 、B 、C 、D 各为什么物质?例3、有ABCDE 五种物质,其中A 和E 均为黑色固体, A 与B 反应时,当B 的量不同时,可能生成D 或C 两种 产物,根据其转化关系回答下列问题。
1、若CE 是___________ 2、若D 能使澄清石灰水变浑浊,则E 是__________ ____________________;________________________________________ ____________________;____________________________________________________________小结:推断题常用突破点1、________________;2、________________3、__________________;4、______________________ 五、小试牛刀1、有一无色液体A ,在通电条件下,可以产生B 和H 两种单质气体。
其它关系如图所示,(1)写出有关物质的化学式:A 是______,B_______,C_______,D_______,E_______F_______,G_______,H________。
(2)写出化学方程式①____________________________________;②_________________________________; ③____________________________④____________________________⑤)若乙的溶液为浅绿色,Y 是红色固体,则X 关系,回答下列问题____________________________。
(完整版)2019-2020年九年级化学下册第十、十一单元《酸碱盐》学案新人教版
2019-2020年九年级化学下册第十、十一单元《酸碱盐》学案新人教版一、读读默默1、酸、碱、盐的组成「酸是由 _______________ 组成的化合物女口:硫酸(_____________)、盐酸( _______ )、硝酸()碱是由___________________ 成的化合物女口:氢氧化钠、氢氧化钙、氨水(_______________ )盐是由_______________________________ 组成的化合物女口:氯化钠、碳酸钠( _★酸、碱、盐的水溶液可以导电(原因:溶于水时解离形成 _____________________________________ )2、酸的通性(具有相似性质的原因:________________________________ )(1)与酸碱指示剂作用:___________________________ ,__________________________(2)与金属反应生成______________ (条件:__________ 金属才能置换出酸中的氢;)(3)金属氧化物+酸T +(4)酸+ 碱T + _(5 )盐+酸T + _________3、碱的通性(具有相似性质的原因:__________________________________________________ )(1 )碱溶液与酸碱指示剂的反应: _____________________________ , __________________________(2)___________________________ 非金属氧化物+碱T__(3)酸+ 碱T + _(4 )盐+ 碱T____ + _________4、盐的化学性质(1盐+金属T+(条件:, )(2)盐+酸T+(3)盐+ 碱T+(4+ 盐T+) 盐★复分解反应的条件 ________________________________________________ (生成物)5、中和反应______________________________________实质:_________________________应用:(1)_________________ (2) ______________。
酸碱盐的鉴别专题复习学案
《酸、碱、盐的鉴别》专题复习的学案一、重点知识再现:酸、碱、盐的化学性质1、酸的化学性质(5)2、碱的化学性质(4)3、盐的化学性质(4)a: a: a、b: b: b、c: c: c、d: d: d、e:二、酸、碱、盐三类物质的鉴别思路(一)、需要加入其他试剂的鉴别1、如果物质间有明显的溶解性差异、溶解时的吸热或放热现象、水溶液的颜色差异时,可以用水直接鉴别。
例题1:以下几组物质能用水直接鉴别的是()A、NH4Cl固体和NaOH固体B、蔗糖和食盐C、NaCl固体和KCl固体D、CaCO3和Mg(OH)2例题2:现有四瓶标签模糊的白色固体试剂,它们分别是CaCO3、NaOH、CuSO4、NaCl 。
试设计合理的实验方案加以鉴别。
2、若物质间有明显的酸碱性差别,可以选用紫色石蕊溶液或pH试纸来鉴别。
例题3:现有三种未知的无色溶液,分别是稀盐酸、氯化钠溶液、氢氧化钠溶液,请设计实验方案加以鉴别。
3、如果鉴别的是多种溶液时:(1)若溶液中有酸时,可选用Na2CO3等可溶性碳酸盐来鉴别。
例题4:设计鉴别HCl、NaCl、Ca(OH)2三种溶液的方法。
(2)若组中的溶液有碳酸盐时,可以选用酸来鉴别。
(如:鉴别Na2CO3溶液、NaOH溶液)(3)若组中的溶液有含Ag+的溶液时,一般选用稀盐酸。
(如:鉴别NaCl溶液、AgNO3溶液)(4)若组中的溶液有含Ba2+的溶液时,一般选用稀硫酸。
(如:鉴别Na2CO3溶液、BaCl2溶液、NaNO3溶液)(二)、无试剂的鉴别(即:不需要其他试剂,用组内的试剂就可以鉴别的。
)这类鉴别的方法一般有三种:1、特征现象法:利用物质的物理性质(如颜色等)的不同,通过感官找出与众不同的物质,然后利用最先鉴别出来的物质作为试剂将剩余的物质连环鉴别。
例题5:(1)不用其他试剂,请设计方案鉴别以下四种溶液:NaOH 溶液、Na2SO4溶液、CuSO4溶液、NH4Cl溶液(2)现有以下四种溶液:Fe(NO3)3溶液、稀盐酸、NaOH溶液、MgCl2溶液,请设计仅用组内试剂就能鉴别的方案。
专题八 酸碱盐的鉴定与鉴别
其中一只试管中 另一只试管中
原溶液是: 原溶液是:
【知识梳理】
酸
碱
1
【鉴别】
例 1:写出一次性区别下列各组物质的试剂 HCl Ca(OH)2 KCl 溶液( 例 2:不用其他试剂如何鉴别下列四种溶液。 AgNO3、 KOH、 NaCl、 FeCl3
)
Na2CO3
Na2SO4
BaCl2
HCl
练习一:
如下猜想: A:可能为氢氧化钠,B:可能为碳酸钠,C: 可能为氢氧化钠和碳酸钠的混合物。 为检验猜想作如下实验:
2
(1):小刚取少量白色粉末,滴加稀盐酸,由气体生成。由此可断定该粉末是 碳酸钠,结论正确吗?请说明理由 (2):小军取少量白色粉末溶于水,向所得溶液中滴加酚酞试液变红,由此,小军认为该粉末是 氢氧化钠,结论正确吗?请说明理由 。 (3):小红取少量白色粉末溶于水,向所得溶液中滴加氯化钡溶液,由白色沉淀生成,由此可判断 白色粉末中含有——————— (4)为了验证猜想 C,小红继续向该溶液中滴加氯化钡溶液至 不再产生沉淀,过滤,你认为她接下来还应该进行什么实验? 。 在小红所作的实验中,若把氯化钡溶液换成氢氧化钡溶液可以吗?为什么? ——————————————————————————————————。
1:现有两瓶失去标签的无色溶液,分别是氢氧化钠溶液和澄清的石灰水,请你帮助他们贴上标签, 完成下列报告。 操作步骤 现象 结论
2:在实验室里,小刚想用蓝色石蕊试纸鉴别稀硫酸,氢氧化钠和碳酸钠三瓶无色溶液,请你帮助 他完成实验。 (1)、首先被鉴别出来的一种试剂是 ,依据的现象是 (2)、利用现有条件将另外两瓶溶液鉴别出来 实验步骤 实验现象和结论 有关反应的化学方程式
。
【鉴定】
酸、碱、盐的鉴别、鉴定和推断PPT课件 鲁教版
1、多种试剂分步鉴别法(分 组法)
通常待测物都是无色溶液或白色固体
无色溶液一般用酸碱指示剂分成酸性、 中性、碱性几组
白色固体一般可加水,根据溶解性分 组,每一组中根据物质的特性再次选 择合适的试剂。
例题:
• 鉴H2别SON4a五O种H、无N色a溶2C液O3、KNO3、HCl、
NaOH Na2CO3 KNO3
•
5、付出努力却没能实现的梦想,爱了很久却没能在一起的人,活得用力却平淡寂寞的青春,遗憾是每一次小的挫折,它磨去最初柔软的心智、让我们懂得累积时间的力量;那些孤独沉寂的时光,让我们学会守候内心的平和与坚定。那些脆弱的不完美,都会在努力和坚持下,改变模样。
•
11、失败不可怕,可怕的是从来没有努力过,还怡然自得地安慰自己,连一点点的懊悔都被麻木所掩盖下去。不能怕,没什么比自己背叛自己更可怕。
32、命好不如习惯好。养成好习惯,一辈子受用不尽。
•
33、比别人多一点执着,你就会创造奇迹。
•
15、如果没有人为你遮风挡雨,那就学会自己披荆斩棘,面对一切,用倔强的骄傲,活出无人能及的精彩。
•
16、成功的秘诀在于永不改变既定的目标。若不给自己设限,则人生中就没有限制你发挥的藩篱。幸福不会遗漏任何人,迟早有一天它会找到你。
•
15、所有的辉煌和伟大,一定伴随着挫折和跌倒;所有的风光背后,一定都是一串串揉和着泪水和汗水的脚印。
•
12、跌倒了,一定要爬起来。不爬起来,别人会看不起你,你自己也会失去机会。在人前微笑,在人后落泪,可这是每个人都要学会的成长。
•
13、要相信,这个世界上永远能够依靠的只有你自己。所以,管别人怎么看,坚持自己的坚持,直到坚持不下去为止。
•
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
课题:专题八 酸碱盐的鉴别鉴定和推断
一.学习目标
1.熟悉特殊反应现象,进一步熟悉酸碱盐的化学性质。
2.掌握酸碱盐的鉴别鉴定方法,知道其本质区别。
3.了解常见离子的检验方法,灵活运用各种方法进行酸碱盐的推断。
4.学习对信息的筛选,运用自己已有的知识经验,提高自己分析和推理问题的能力。
5.树立化学服务于生活意识,感受学习化学的重要性。
二.重难点
(一)重点:理解物质鉴别的含义及物质鉴别推断的一般方法
(二)难点:会利用常见离子的检验方法进行酸碱盐的鉴别和鉴定推断
三.学法指导:合作探究法 归纳总结法 分析法
四.复习过程
【复习交流】:常见离子的鉴定
鉴定离子 所用试剂 现象
酸性溶液H+
碱性溶液OH-
碳酸盐CO32-
SO42-
Cl-
NH4+
Fe3+
Cu2+
【抢答】:
1、不溶于硝酸的白色沉淀: 、 。
2、溶于硝酸和盐酸并产生气体的白色沉淀: 、 。
3、溶于酸不产生气体的白色沉淀 。
4、酸与活泼金属反应生成_______气体,能生成CO2的反应物_______
能生成NH3的反应物_______
模块一:酸碱盐的鉴别
【合作探究一】
用最简单的方法请鉴别下列各组物质:
(1)氯化钠溶液与氯化铁溶液(2)食醋和食盐水(3)碳酸钙粉末与氯化钠粉末
(4)稀盐酸与浓盐酸(5)氢氧化钠粉末与硫酸铜粉末
2
【方法归纳】:
【合作探究二】用一种试剂鉴别稀硫酸和澄清石灰水
1.写出鉴别上述两种溶液的化学试剂 、 、
、 、 、 、 、
、 、 。
2. 选择一种试剂简述鉴别方法
【方法归纳】:
【拓展提高】:
请你只用一种试剂一次性鉴别下列物质:
稀H2SO4、 Ca(OH)2、 NaCl 用 鉴别
【方法归纳】:
【合作探究三】
不用其他任何试剂,怎样鉴别下列两组溶液?
1、 NaOH CuSO4 HCl 2、 Na2CO3 HCl CaCl2
【方法归纳】:
【举一反三】:
不用其他任何试剂,就能鉴别出来的是( )
A.FeCl3 HCl NaOH B.KNO3 MgCl2 NaOH
C.Na2CO3 HCl BaCl2 D.NaCl AgNO3 HCl
【联系生活】
自来水生产中通常使用少量氯气杀菌消毒,氯气与水反应的产物之一是盐酸.
市场上有些不法商贩为牟取暴利,用自来水冒充纯净水(蒸馏水)出售。
你会利用所学知识选用一种化学试剂来鉴别其真伪吗?
模块二:酸碱盐的鉴定
【合作探究四】
实验室有一瓶失去标签的无色溶液, 初步判断可能是稀硫酸,你如何鉴定这是
一瓶稀硫酸?
【方法归纳】:
【举一反三】
为了确认某一溶液为稀盐酸,所需的药品为( )
A.碳酸钠溶液和澄清石灰水 B.石蕊试液、氯化钡溶液和稀硝酸
C.锌粒、硝酸银溶液和稀硝酸 D.硝酸银溶液和稀硝酸
3
模块三:酸碱盐的推断
【合作探究五】
描述型 有一包固体粉末,可能含有CaCO3 、Na2SO4 、KNO3、 CuSO4 、 Na2CO3 五
种物质中的一种或几种,为鉴别其成分,现进行以下实验:
⑴将此固体加水溶解,得无色溶液;
⑵在此溶液中加入氯化钡溶液,生成白色沉淀;
⑶在过滤后的白色沉淀中加入足量的稀硝酸,沉淀不消失。
由此判断:该粉末中一定含有 ,一定不含 ,可能含
有 。
【合作探究六】
框图型 化学使世界变得绚丽多彩.如图是物质之间发生化学反应的颜色变化
(1)请你在编号②、③处各填入一种物质.②是 ;③是 ;
(2)请你写出编号①稀硫酸的化学性质 .
(3)若编号④的物质是盐.请你写出符合编号④的一个化学方程式:
反应类型是
【方法归纳】:解答推断题的关键
【认识提升】
鉴别、鉴定、推断的区别和联系是什么?
【课堂小结】:
谈收获与感悟
浅绿色溶液
蓝色溶液 稀硫酸 白色 沉淀 红色
溶液
②
① ③
④
指示剂 单质 氧化物
碱或盐
4
【课堂检测】
1.只要用水就能直接鉴别的一组物质是( )
A. Na2CO3、CuSO4、CaCO3 B. AgCl、BaSO4、CuSO4
C. NaCl、CaCl2、BaCl2 D. BaCl2、AgCl、CaCO3
2.只用一种物质就能将稀硫酸、水、澄清石灰水三种无色液体一次鉴别出来,可供选
用的物质是:①pH试纸 ②酚酞试液 ③稀盐酸 ④碳酸钠溶液 ⑤石蕊试液,其中能用
于鉴别的是( )
A、①④⑤ B、①②⑤ C、①②③ D、③④⑤
3.不用外加其它任何试剂,就可将① CuSO4 ② MgCl2 ③ Ba(OH)2 ④ NaCl四种溶液
鉴别 开来,则鉴别出物质的正确顺序是( )
A ①②③④ B ①③②④ C ③①②④ D ④①③②
4.(2013青岛市)现有A、B、C、D、E五种物质,分别为盐酸、硫酸铜、氢氧化钙、
铁粉和氧化钙中的一种.其中,A的浓溶液是无色液体,有刺激性气味,在空气中会形成
白雾;B为单质;D是“波尔多液”的主要成分之一;E是熟石灰的主要成分.请回答下列
问题:
(1)写出C、D两种物质的化学式:C ,D .
(2)在图中将能相互反应的物质之间用断线“﹣﹣”连线,通过一步反应能直接转
化的两种物质之间用箭号“→”连线(从反应物指向生成物).
【作业】:
某化工厂排放的污水中,常溶有某些对人体有害的物质。通过目测,初步认为可能含
有Fe3+、Ba2+、Na+、OH-、Cl-、CO32-、SO42-;为了进一步确认,进行实验检测:
(1)取污水仔细观察,呈无色、透明、均一状态。
(2)向取样的污水中,滴入稀硫酸,有大量白色沉淀产生,再加稀硝酸,白色沉淀
不消失。
(3)用pH试纸测定污水的pH值,试纸显深蓝色。由此可知,该污水中,肯定含有
离子是 。肯定没有的离子是 ,可能含有的离子
是 。
