乌苯美司胶囊含量均匀度测定方法学验证
药物分析:片剂含量均匀度和溶出度的检查

-1.含量均匀度(content uniformity)系指⼩剂量⽚剂、膜剂、胶囊剂或注射⽤⽆菌粉末等制剂每⽚(个)含量偏离标⽰量的程度。
凡检查此项不再检查装量差异。
1)含量均匀度检查所⽤⽅法为含量测定⽅法时检查结果判定除另有规定外,取供试品10⽚(个),按照各药品项下规定的⽅法,分别测定每⽚(个)以标⽰量为100的相对含量X,求其均值X和标准差S以及标⽰量预均值之差的绝对值A(A=100-X);如A+1.80S≤15.0,则供试品的含量均匀度符合规定;若A+S>15.0,则不符合规定;若A+1.80S>15.0,且A+S<15.0,则应另取20⽚(个)进⾏复试,根据初试结果计算30⽚(个)的均值X、标准差S和标⽰量与均值之差的绝对值A;如A+1.45S≤15.0,则供试品的含量均匀度符合规定;若A+1.45S>15.0,则不符合规定。
若该药品项下规定含量均匀度的限度为+_20%或其他百分数,应将上述各式判断式中的15.0改为20.0或其他相应值,但各判断式中的系数不变。
2)含量均匀度检查所有的⽅法与含量测定⽅法不同时,且未能从响应值(如吸收度)求出每⽚(个)含量时检查结果的判定,可取供试品10⽚(个)照该药品含量均匀度项下规定的⽅法,分别测定,得仪器测定法的响应值Y(可为吸收度、峰⾯积等),求其均值Y 。
另由含量测定法测得以标⽰量为100的含量XA,由XA除以响应值的均值Y,得⽐例系数K(K=XA/Y)。
将上述诸响应值Y与K相乘,求得每⽚标⽰量为100的相对百分含量X(X=KY),同上法求得X和S以及A,计算,判定结果,即得。
2.溶出度检查溶出度(dissolution)系指药物从⽚剂或胶囊剂等固体制剂在规定溶剂中溶出的速度和程度。
检查此项不检查崩解时限。
评介药物制剂质量的⼀个内在指标,是⼀种模拟⼝服固体制剂在胃肠道中崩解和溶出的体外试验法。
溶解度⼩于0.1%~1%的药物,在体内⼀般均受溶解速度的影响。
含量均匀度方法考量

含量均匀度方法考量《含量均匀度方法考量》嘿,朋友!今天来跟你唠唠含量均匀度这档子事儿,这可是个相当重要的话题哟!首先咱得搞清楚啥是含量均匀度。
你就把它想象成一个大蛋糕,咱们得保证每一块切下来的蛋糕里奶油、水果啥的分布都差不多,不能这块全是奶油,那块全是水果,对吧?含量均匀度就是要确保药品或者其他混合物里,关键成分分布得均匀合理。
那咋考量这个含量均匀度呢?听我给你慢慢道来。
第一步,取样!这就好比你去果园摘果子,可不能瞎摘,得有策略。
你得从不同的地方,东摘一个西摘一个,而且要保证摘的果子能代表整个果园的情况。
比如说药品,那得从不同批次、不同位置抽样,可别逮着一个地方使劲薅,不然得出的结果就像你只在一个角落看风景,以为那就是全世界啦!第二步,检测!这一步就像是给摘来的果子做“体检”。
得用专业的仪器和方法,看看果子里的成分到底有多少。
比如说化学分析、光谱检测啥的,这就好比是给果子照 X 光,啥成分都给它照得清清楚楚。
第三步,数据分析!这可是关键的一步,就像你玩数独游戏,得把那些检测出来的数据好好琢磨琢磨。
算平均值、标准差,看看数据的分布情况。
要是数据乱七八糟,就像一群调皮的孩子到处乱跑,那可不行,得找出原因来。
第四步,结果判断!这就像是老师批改作业,根据前面算出来的数据,判断这个含量均匀度到底合不合格。
如果合格,那皆大欢喜;要是不合格,那可得好好找找问题出在哪儿,是生产过程中哪个环节出了岔子,还是检测方法不对头。
我跟你说,我之前就碰到过这么一档子事儿。
有一次检测含量均匀度,前面步骤都做得好好的,结果到数据分析的时候,发现数据乱得像一团麻。
我那叫一个头大啊,重新检查了一遍,才发现是检测的时候仪器出了点小毛病,可把我给折腾惨了。
总之,考量含量均匀度这事儿,每一步都得小心谨慎,就像走钢丝一样,一步都不能出错。
取样要全面,检测要准确,数据分析要仔细,结果判断要公正。
朋友,记住这些步骤和要点,以后碰到含量均匀度的问题,咱就不怕啦!加油,祝你在这方面顺顺利利的!。
含量测定分析方法验证

含量测定分析方法验证在进行质量研究的过程中,一项重要的工作就是要对质量标准中所涉及到的分析方法进行方法学验证,以保证所用的分析方法确实能够用于在研药品的质量控制。
为规范对各种分析方法的验证要求,我国已于2005年颁布了分析方法验证的指导原则。
该指导原则对需要验证的分析方法及验证的具体指标做了比较详细的阐述。
但是文中未涉及各具体指标在验证时的可接受标准,国际上已颁布的指导原则中也未发现相关的要求。
另一方面,大多数药品研发单位在进行质量研究时,已逐步认识到分析方法验证的必要性与重要性,大都也在按照指导原则的要求进行分析方法验证,但验证完后却因没有一个明确的可接受标准,而难以判断该分析方法是否符合要求。
本文结合国外一些大型药品研发企业在此方面的要求,提出了在对含量测定方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。
1.准确度该指标主要是通过回收率来反映。
验证时一般要求分别配制浓度为80%、100%和120%的供试品溶液各三份,分别测定其含量,将实测值与理论值比较,计算回收率。
可接受的标准为:各浓度下的平均回收率均应在%%之间,9个回收率数据的相对标准差(RSD)应不大于%。
2.线性线性一般通过线性回归方程的形式来表示。
具体的验证方法为:在80%至120%的浓度范围内配制6份浓度不同的供试液,分别测定其主峰的面积,计算相应的含量。
以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。
可接受的标准为:回归线的相关系数(R)不得小于,Y轴截距应在100%响应值的2%以内,响应因子的相对标准差应不大于%。
3.精密度1)重复性配制6份相同浓度的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于%。
2)中间精密度配制6份相同浓度的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于%。
4.专属性可接受的标准为:空白对照应无干扰,主成分与各有关物质应能完全分离,分离度不得小于。
药物分析:片剂含量均匀度和溶出度的检查

1.含量均匀度(contentuniformity)系指小剂量片剂、膜剂、胶囊剂或注射用无菌粉末等制剂每片(个)含量偏离标示量的程度。
凡检查此项不再检查装量差异。
1)含量均匀度检查所用方法为含量测定方法时检查结果判定除另有规定外,取供试品10片(个),按照各药品项下规定的方法,分别测定每片(个)以标示量为100的相对含量X,求其均值X和标准差S以及标示量预均值之差的绝对值A(A=100-X);如A+1.80S≤15.0,则供试品的含量均匀度符合规定;若A+S>15.0,则不符合规定;若A+1.80S>15.0,且A+S<15.0,则应另取20片(个)进行复试,根据初试结果计算30片(个)的均值X、标准差S和标示量与均值之差的绝对值A;如A+1.45S≤15.0,则供试品的含量均匀度符合规定;若A+1.45S>15.0,则不符合规定。
若该药品项下规定含量均匀度的限度为+_20%或其他百分数,应将上述各式判断式中的15.0改为20.0或其他相应值,但各判断式中的系数不变。
2)含量均匀度检查所有的方法与含量测定方法不同时,且未能从响应值(如吸收度)求出每片(个)含量时检查结果的判定,可取供试品10片(个)照该药品含量均匀度项下规定的方法,分别测定,得仪器测定法的响应值Y(可为吸收度、峰面积等),求其均值Y。
另由含量测定法测得以标示量为100的含量XA,由XA除以响应值的均值Y,得比例系数K(K=XA/Y)。
将上述诸响应值Y与K相乘,求得每片标示量为100的相对百分含量X(X=KY),同上法求得X 和S以及A,计算,判定结果,即得。
2.溶出度检查溶出度(dissolution)系指药物从片剂或胶囊剂等固体制剂在规定溶剂中溶出的速度和程度。
检查此项不检查崩解时限。
评介药物制剂质量的一个内在指标,是一种模拟口服固体制剂在胃肠道中崩解和溶出的体外试验法。
415.7药物含量测定方法验证

Pharmaceutical Analysis
方法学验证内容
准确度
精密度
专属性
检测限
定量限
线性
范围
耐用性
药物含量测定方法验证
准确度(accuracy)
定义:指用该方法测 定的结果与真实值或 参考值接近的程度, 用回收率(%)表示。
药物含量测定方法验证
准确度(accu
药物含量测定方法验证
精密度 (precision)
定义:指在规定测 试条件下,同一个 均匀样品,经多次 取样测定所得结果 之间的接近程度。
药物含量测定方法验证
精密度 (precision)
考察分析方法在不同时间、不同人员、不同实验室 所获结果的重复性或重现性。
表示:标准偏差(SD) 或相对标准偏差(RSD)
原料药含量:用已知纯度对照品或供试品测定。
回收率%=测 加得入量量100%
制剂含量: 向制剂中加入已知量的被测物对照品进行 测定。
回收率%=测得量-本底量 加入量
100%
药物含量测定方法验证
准确度(accuracy)
➢ 同一浓度供试品(相当于100%浓度水平), 测定6份。
➢ 设计三个浓度,每个浓度测3份。
药物含量测定方法验证
精密度 (precision)
精密度包括:重复性、中间精密度、重现性。 02 中间精密度
同实验室; 不同时间; 不同分析者; 不同仪器测定 结果的变异程度。
03 重现性
不同实验室, 不同分析者测定结果的精密度。
药物含量测定方法验证
专属性(specificity)
定义:指有其他成分(杂质、降解物、辅料等) 可能存在情况下,采用的方法能准确测定出被 测物的能力 。
15版药典含量均匀度检查法
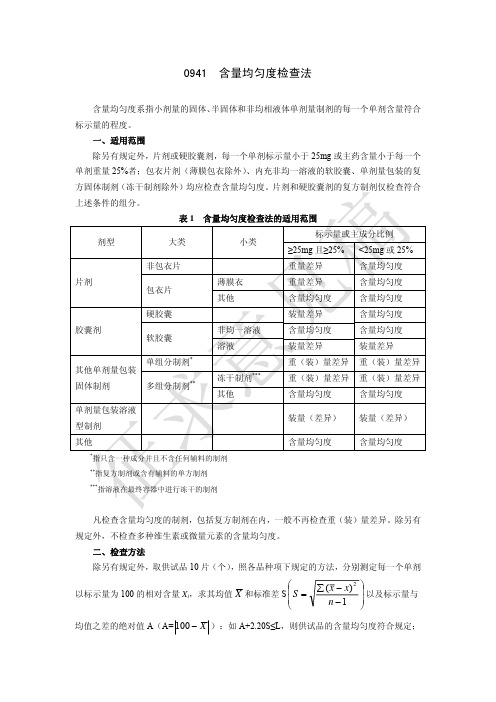
0941含量均匀度检查法含量均匀度系指小剂量的固体、 半固体和非均相液体单剂量制剂的每一个单剂含量符合 标示量的程度。
一、适用范围 除另有规定外,片剂或硬胶囊剂,每一个单剂标示量小于 25mg 或主药含量小于每一个 单剂重量 25%者;包衣片剂(薄膜包衣除外) 、内充非均一溶液的软胶囊、单剂量包装的复 方固体制剂(冻干制剂除外)均应检查含量均匀度。
片剂和硬胶囊剂的复方制剂仅检查符合 上述条件的组分。
表1 剂型 大类 非包衣片 片剂 包衣片 硬胶囊 胶囊剂 软胶囊 单组分制剂* 多组分制剂** 冻干制剂*** 其他 非均一溶液 溶液 薄膜衣 其他 含量均匀度检查法的适用范围 小类 标示量或主成分比例 ≥25mg 且≥25% 重量差异 重量差异 含量均匀度 装量差异 含量均匀度 装量差异 重(装)量差异 重(装)量差异 含量均匀度 装量(差异) 含量均匀度指只含一种成分并且不含任何辅料的制剂 指复方制剂或含有辅料的单方制剂 指溶液在最终容器中进行冻干的制剂<25mg 或 25% 含量均匀度 含量均匀度 含量均匀度 含量均匀度 含量均匀度 装量差异 重(装)量差异 重(装)量差异 含量均匀度 装量(差异) 含量均匀度其他单剂量包装 固体制剂 单剂量包装溶液 型制剂 其他******凡检查含量均匀度的制剂,包括复方制剂在内,一般不再检查重(装)量差异。
除另有 规定外,不检查多种维生素或微量元素的含量均匀度。
二、检查方法 除另有规定外,取供试品 10 片(个) ,照各品种项下规定的方法,分别测定每一个单剂⎛ 以标示量为 100 的相对含量 Xi,求其均值 X 和标准差 S ⎜ S = ⎜ ⎝∑ ( x − x) n −12⎞ ⎟ 以及标示量与 ⎟ ⎠均值之差的绝对值 A(A= 100 − X ):如 A+2.20S≤L,则供试品的含量均匀度符合规定;若 A+S>L,则不符合规定;若 A+2.20S>L,且 A+S≤L,则应另取 20 片(个)复试。
(完整版)含量均匀度检查法
含量均匀度检查法1 简述1.1 本法适用于含量均匀度检查。
1.2 在生产过程中,某些小剂量的剂型由于工艺或设备的原因,可引起含量均匀度的差异。
本检查法的目的在于控制每片(个)含量的均一性,以保证用药剂量的准确。
1.3 含量均匀度系指单剂量的固体制剂、半固体制剂和非均相液体制剂含量符合标示量的程度。
1.4 除另有规定外,片剂、硬胶囊剂、颗粒剂或散剂等,每一个单剂标示量小于25mg或主药含量小于每一个单剂重量25%者;药物间或药物与辅料间采用混粉工艺制成的注射用无菌粉末;内充非均相溶液的软胶囊;单剂量包装的口服混悬液、透皮贴剂和栓剂等品种项下规定含量均匀度应符合要求的制剂,均应检查含量均匀度。
复方制剂仅检查符合上述条件的组分,多种维生素或微量元素一般不检查含量均匀度。
1.5 凡检查含量均匀度的制剂,不再检查重(装)量差异;当全部主成分均进行含量均匀度检查时,复方制剂一般亦不再检查重(装)量差异。
1.6 含量均匀度的限度应符合各品种项下的规定。
2 仪器与用具按正文中该品种项下的规定。
3 试药与试液按正文中该品种项下的规定。
4 操作方法4.1 供试品初试10片(个),复试20片(个)。
4.2 除另有规定外,取供试品,照各品种项下规定的方法,分别测定每片(个)的响应值(如吸光度或峰面积等)或含量。
5 注意事项5.1 供试品的主药必须溶解完全,必要时可用乳钵研磨或超声处理,促使溶解, 并定量转移至量瓶中。
5.2 测定时溶液必须澄清,如过滤不清,可离心后,取澄清液测定。
5.3 用紫外-可见分光光度法测定含量均匀度时,所用溶剂需一次配够,当用量较大时,即使是同批号的溶剂,也应混合均匀后使用。
6 记录与计算6.1 应记录所用检测方法,所用仪器型号(或编号),以及每片(个)测得的响应值等数据。
6.2 根据测得的响应值,分别计算出每片(个)以标示量为100的相对含量X ,求其均值X 和标准差)1)((12--=∑=n X xS S ni i以及标示量与均值之差的绝对值)100(X A A -=。
化学药物评价-含量测定分析方法验证的可接受标准
含量测定分析方法验证的可接受标准本文介绍对含量测定方法进行验证时的可接受标准,仅供参考。
1.准确度该指标主要是通过回收率来反映。
验证时一般要求分别配制浓度为80%、100%和120%的供试品溶液各三份,分别测定其含量,将实测值与理论值比较,计算回收率。
可接受的标准为:各浓度下的平均回收率均应在98.0%-102.0%之间,9个回收率数据的相对标准差(RSD)应不大于2.0%。
2.线性线性一般通过线性回归方程的形式来表示。
具体的验证方法为:在80%至120%的浓度范围内配制6份浓度不同的供试液,分别测定其主峰的面积,计算相应的含量。
以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。
可接受的标准为:回归线的相关系数(R)不得小于0.998,Y轴截距应在100%响应值的2%以内,响应因子的相对标准差应不大于2.0%。
3.精密度1)重复性配制6份相同浓度的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于2.0%。
2)中间精密度配制6份相同浓度的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于2.0%。
4.专属性可接受的标准为:空白对照应无干扰,主成分与各有关物质应能完全分离,分离度不得小于2.0。
以二极管阵列检测器进行纯度分析时,主峰的纯度因子应大于980。
5.检测限主峰与噪音峰信号的强度比应不得小于3。
6.定量限主峰与噪音峰信号的强度比应不得小于10。
另外,配制6份最低定量限浓度的溶液,所测6份溶液主峰的保留时间的相对标准差应不大于2.0%。
7.耐用性分别考察流动相比例变化±5%、流动相pH值变化±0.2、柱温变化±5℃、流速相对值变化±20%时,仪器色谱行为的变化,每个条件下各测试两次。
可接受的标准为:主峰的拖尾因子不得大于2.0,主峰与杂质峰必须达到基线分离;各条件下的含量数据(n=6)的相对标准差应不大于2.0%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乌苯美司胶囊含量均匀度测定方法学验证
作者:姚阳
来源:《今日健康》2014年第03期
【摘要】乌苯美司胶囊可增强免疫功能,用于抗癌化疗、放疗的辅助治疗,老年性免疫功能缺
陷等。
该实验通过对苯美司胶囊2010年版中国药典二部的含量均匀度测定方法进行验证,结果表明该方法可以准确测定乌苯美司的含量均匀度,可用于产品的质量控制。
【关键词】乌苯美司胶囊含量均与度方法学验证
【中图分类号】 R927.2 【文献标识码】 A 【文章编号】 1671-5160(2014)03-0200-02
1 概述
本方法学验证研究所用样品信息:样品名称:乌苯美司胶囊,规格:30mg,批号:130101 130102 130103
2 试验研究内容
2.1 乌苯美司胶囊含量均匀度方法学验证
2.1.1 方法选择
参照乌苯美司胶囊含量测定项下检测方法拟定本方法,按照2010版《中国药典》附录中药品质量标准分析方法验证指导原则要求,对该方法进行了验证。
2.1.2 仪器及色谱条件
选用HPLC法作为含量均匀度的测定方法。
仪器:Waters2695液相色谱仪,2487紫外检测器,色谱柱柱:Inertsil ODS-3 5μ 150×4.6 (mm),柱温:40℃,流动相:甲醇-0.6%磷酸二氢钠溶液(45:55),流速:1.0ml/min,检测波长:254nm,试剂:甲醇(色谱纯)、磷酸二氢钠(AR)、水(重蒸水)
拟定方法:取本品1粒,置于研钵中研细,将细粉倾入25ml量瓶中,研钵用适量的
0.1mol/L盐酸溶液分次洗净,洗液并入量瓶中,充分振摇使乌苯美司溶解,用流动相稀释至刻度,摇匀,滤过,作为供试品溶液。
按照上述仪器及色谱条件,精密量取20ul注入液相色谱仪,记录色谱图;另取105℃干燥至恒重的乌苯美司对照品,精密称定,同法配制成每1ml约
含1.2mg乌苯美司的溶液,作为对照品溶液,同法测定,按外标法以峰面积计算,即得。
理论板数以乌苯美司峰计应不低于3500。
2.1.3 方法学考查
2.1.
3.1 检测波长的选择
精密称取乌苯美司对照品约30mg,置于25ml量瓶中,用适量的0.1mol/L盐酸溶液溶解后用流动相稀释至刻度,摇匀,作为供试品溶液。
照分光光度法(中国药典2010年版二部附录ⅣA),在200nm~400nm波长范围内进行扫描,在252nm、257nm与263nm的波长处有最大吸收。
另取空白辅料溶液,在200nm~400nm波长范围内进行扫描,空白辅料溶液在252nm、257nm与263nm的波长处均无紫外吸收。
参照本品含量测定项下的检测波长,故选择254nm 作为检测波长。
2.1.
3.2 干扰试验
称取处方量的辅料,按照上述方法配制空白辅料溶液,精密量取20ul注入液相色谱仪,按照上述色谱条件测定,记录色谱图,结果表明,空白辅料无干扰。
2.1.
3.3 线性关系考查
取乌苯美司对照品,分别配制浓度为0.4mg/ml,0.8mg/ml,1.2mg/ml,1.6mg/ml,
2.0mg/ml的溶液,精密量取20ul注入液相色谱仪,以浓度为横坐标,峰面积为纵坐标进行线性回归,试验结果表明,在0.4~2.0mg/ml的浓度范围内,浓度与峰面积呈良好线性关系。
线性方程为y=542549x+8510,r=0.9998。
2.1.
3.4 重复性试验
取样品,按拟定方法配制1份样品溶液,作为供试品溶液,连续测定6次;另取105℃干燥至恒重的乌苯美司对照品适量,精密称定,同法配制成每1ml约含1.2mg乌苯美司的溶液,作为对照品溶液,分别精密量取20ul供试品及对照品溶液,注入液相色谱仪,依法测定。
6个样品的含量(%)分别为:99.1,99.1,98.9,99.2,99.1,99.1,含量均值(%):99.1, RSD (%):0.10。
试验结果表明,该方法重复性良好。
2.1.
3.5 回收率考查
取乌苯美司对照品,按含量均匀度测定浓度的130%、100%和70%制备样品,每个浓度称取3份,分别与辅料混合,按拟定方法配制、测定,求出回收率。
乌苯美司胶囊含量均匀度主药回收率测定结果
试验结果表明,回收率良好。
2.1.
3.6 溶液稳定性试验
取本品颗粒,置于研钵中研细,将细粉倾入25ml量瓶中,研钵用适量的0.1mol/L盐酸溶液分次洗净,洗液并入量瓶中,充分振摇使乌苯美司溶解,用流动相稀释至刻度,摇匀,滤过,作为供试品溶液。
在室温下放置,分别于0,1,2,4,6,8小时取样20ul,注入液相色谱仪,按照拟定方法测定,记录测定值,各时间段含量(%)分别为:99.1,98.9,99.2,99.0,99.3,98.7,含量均值(%):99.1,RSD(%):0.09。
试验结果表明,该样品溶液在8小时内稳定性良好。
2.1.
3.7 耐用性试验
取本品颗粒,分别用不同色谱柱,不同流动相比例,按照拟定方法测定,记录色谱图,色谱图中杂质峰应与主峰分离度良好,理论塔板数应符合要求。
参照乌苯美司胶囊含量测定方法及中国药典乌苯美司胶囊含量均匀度方法,柱温均为40℃。
结果显示流动相比例为甲醇:盐相(45:55),甲醇:盐相(39:61),甲醇:盐相(51:49),色谱柱为色谱柱:
4.6*150mm Inertsil ODS-3,色谱柱4.6*150mmDiamonsil。
含量均匀度的测定结果在98.7%-99.1%之间,RSD(%):0.17。
表明该法耐用性良好。
2.1.4 含量均匀度测定法.
根据上述方法学验证的结果,最终确定含量均匀度测定方法为:
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以甲醇-0.6%磷酸二氢钠溶液(45∶55)为流动相;柱温为40℃;检测波长为254nm。
理论板数按乌苯美司峰计算不低于3500。
测定法取本品1粒,置于研钵中研细,将细粉倾入25ml量瓶中,研钵用适量的0.1mol/L 盐酸溶液分次洗净,洗液并入量瓶中,充分振摇使乌苯美司溶解,用流动相稀释至刻度,摇匀,滤过,作为供试品溶液。
精密量取20ul注入液相色谱仪,记录色谱图。
另取105℃干燥至恒重的乌苯美司对照品适量,精密称定,同法配制成每1ml约含1.2mg乌苯美司的溶液,作为对照品溶液,同法测定,按外标法以峰面积计算,即得。
2.1.5 含量均匀度测定结果
按照确定的方法对130101、130102、130103三批次乌苯美司胶囊进行含量均匀度测定,每批10个样品。
130101测定结果分别为(%):97.9,98.0,98.9,99.1,99.5,97.6,97.5,
97.8,99.9,100.3,A+1.80s=3.19;130102测定结果分别为(%):99.9,98.3,99.6,98.3,100.0,98.5,98.7,100.6,98.0,100.0,A+1.80s=2.47;130103测定结果分别为(%):98.5,99.9,98.0,98.1,100.2,98.2,99.8,100.5,99.6,98.7,A+1.80s=2.55;由试验结果可知,三批样品的含量均匀度均符合A+1.80s≤15.0的要求。
3 讨论
经过对乌苯美司胶囊含量均匀度测定方法从检测波长的选择,干扰试验,线性关系考查,重复性试验,回收率考查,溶液稳定性试验,耐用性试验等验证,证实该方法测定乌苯美司胶囊含量均匀度科学,准确,可用于产品的质量控制。
同时和上市同类产品的质量对比研究显示了2产品质量基本一致。
均符合药典规定的要求。
参考文献
[1] 《中国人民共和国药典》2010年版二部
[2] 吴金萍,朱晓燕,蔡旭萍.高效液相色谱法测定乌苯美司胶囊中乌苯美司含量[J].中国科技博览. 2010,(13)
[3] 王巍.乌苯美司胶囊含量测定方法方法学验证[J]《科协论坛(下半月刊)》.2013,(9)
[4] 刘仲义,黄萍.高效液相色谱法测定乌苯美司及其胶囊的含量[J]《药物分析杂志》 1993年第13卷第6期,396-399
作者简介:姚阳,1978.10.10,女,汉族,陕西西安人,陕西瑞盛生物科技有限公司,本科,执业药师。
