实验室分析用水检验原始记录表
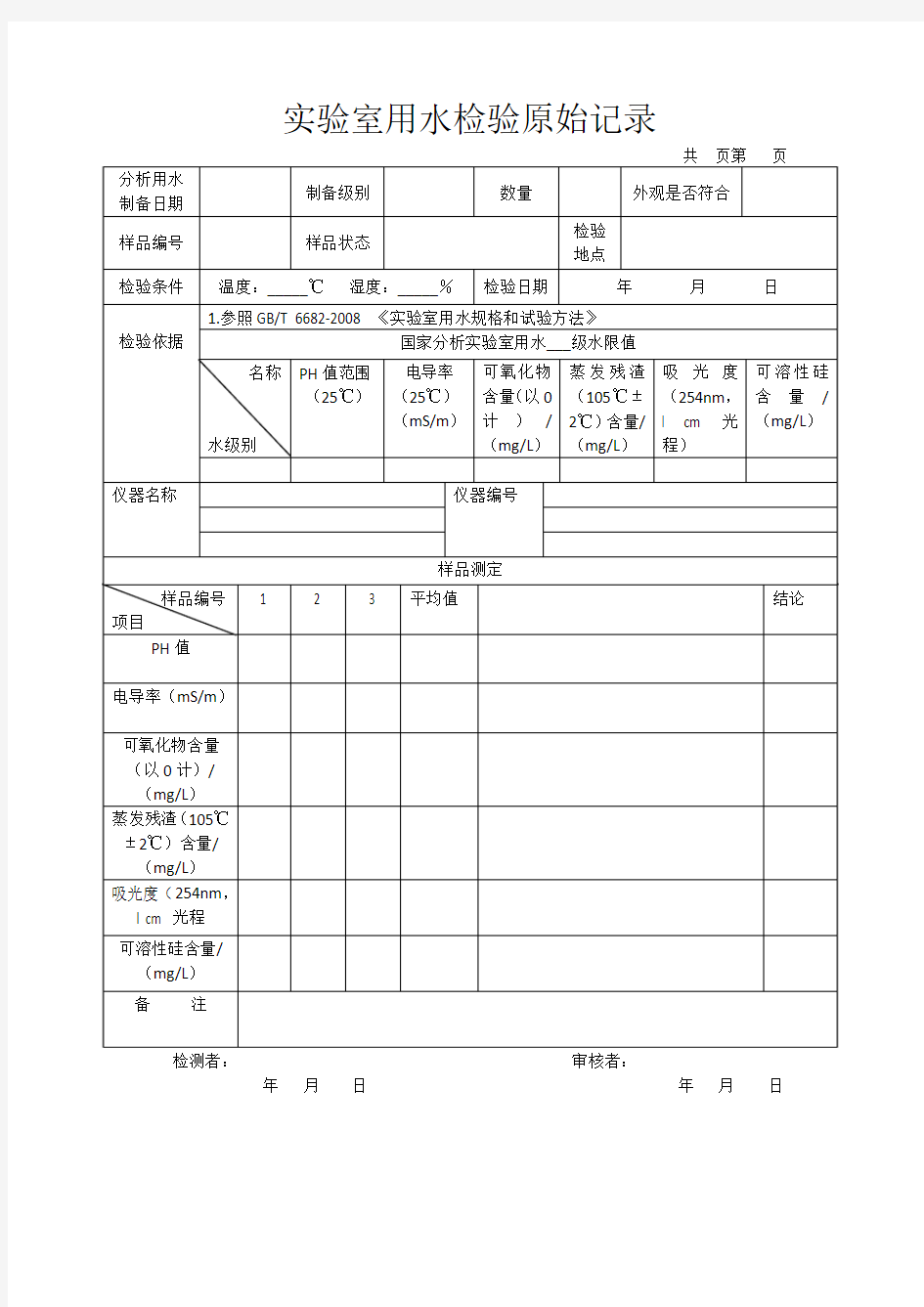
实验室用水检验原始记录
年月日年月日
工艺用水管理制度
文件编号: 工艺用水管理规定 1.0 目的 明确规定工艺用水的监控和检查,保证工艺用水的质量。 2.0 适用范围 适用于本公司工艺用水的制备、检测、使用和设备维护。 3.0 职责 3.1生产采购部负责工艺用水的制备、使用及设备维护的管理。 3.2 技术质量部负责工艺用水的检测。 4.0 工作程序 4.1 工艺用水的分类a.饮用水 b.纯化水 4.2 工艺用水的制备: 4.2.1 由受过专业培训的人员按设备操作规程操作设备,按工艺制水要求进行制水。操作员需每天清洁设备和场地,保持制水室内卫生干净。 4.2.2工艺用水需通过管道输送至洁净区内的使用点,管道应为不锈钢或其它无毒材料制作。 4.3 工艺用水及使用范围及用量配置 4 3.1根据生产工艺要求,对需要使用工艺用水的对象作如下表规定: 4.3.2工艺用水的用量在确定年最大生产能力方案时,按最大用水量和保险系数确定其制水设备能力的配置要求。 4.3.3 生产采购部每年要根据现行的生产能力和用水设备的变化情况进行一次总用水量分析,若总用水量超出制水设备生产能力时,应补充制水设备或采取适应的措施,确保工艺用水能满足生产需求。
4.5 取样方式和取样点 4.5.4取样所用器具和方式确保不能对检测指标产生影响,如盛放做微生物限度的器具必须先进行灭菌。 4.6 工艺用水贮存要求 4.6.1饮用水不储存,直接使用市政自来水; 4.6.2纯化水在室温条件下可用不锈钢贮缸贮存,贮存时间不得超过36小时。 4.6.3购买的注射用水应在12小时内使用。 4.7 管道贮罐消毒 4.7.1输送、贮存纯化水的管道和贮罐每3个月清洗、消毒1次。 消毒方法:用适量的2.5%次氯酸钠溶液注入纯化水贮罐中,按在线清洗消毒方式打开各管道阀门,足量循环消毒30min后排放,停机浸泡30分钟,如此反复3次停止,后还是冲洗,冲洗完毕后,将清洗水箱残液排完,注入符合RO装置原水指标的水(即RO装置前级水),以清洗相同条件进行清洗消毒。或用预处理的低压冲洗条件来冲洗消毒。冲洗完毕后,按规定的运行方式进行低压冲洗和高压运行,最初产物排入地沟,到出水指标合格后。最后,在各使用点取样,按《中国药典》2010版附录纯化水规定的项目检验合格方可使用。 4.8 维护和保养 4.8.1制水设备的机械过滤器、活性炭过滤器应每周进行一次正洗、反洗,除去设备运行中截留的杂质。反洗时间约15分钟,正洗时间约5分钟。 4.8.2制水设备中的过滤器或滤膜应每3个月清洗一次,压差阻力太大导致产水量明显减少时应进更换。 4.8.3 RO膜应定期清洗(可视水质情况而定)。 4.8.4设备上的紫外线灯管累计使用不超过800小时应更换。 4.9 操作人员应做好相关的监测记录和维护保养记录,检测人员应做好水质检测并保存好记录。 5.0 相关记录 5.1《纯化水日常监测记录》 5.2《纯化水检测报告》
实验室质量监督记录文本填写模板
附表2: 日常监督记录表(一) 监督检查日期监督员 监督内容人员及操作 对检测人员检测工作的监督记录 1、检测的项目是, 检测的参数是; 2、检测所依据的标准代号是; 监3、起止时间:2018年月日时分――2018年月日时分; 4、监督采用的方法:人员比对□设备比对□ 督 留样再测□常规试验□; 记 5、方法考核:已掌握□未掌握□差错点□;录 6、提问操作规程:提问条,答对条; 7、查记录/报告:查份,不合格份; 8、实际操作:熟练□不熟练□差错点□; 9、其他: 论结合格□不合格□ 不符合说明 监督情况属实□监督情况不属实□ 确认意见 被监督部门负责人: 日期:2018年月日
日常监督记录表(二) 监督检查日期监督员 监督内容设施及环境条件 对室设施和环境条件的监督记录: 1、本室的环境条件是:温度,湿度,其他; 2、是否配备相应的控制设施:是□否□; 3、是否按规定及时记录监控记录:是□否□; 4、当环境条件危及到检测结果时,检测人员是否停止工作,报告不符合, 对已检测的数据标明无效,并采取措施保证检测结果的有效性,待环境条 件恢复正常后再继续进行工作:是□否□;监 5、对不相容的相邻区域是否有效的隔离,同时应采取相应措施防止相互干 督 扰或交叉污染:是□否□; 记 6、对无菌区域,是否明确标识,并能有效地控制、监测和记录:是□否 录 □; 7、对影响检测质量的区域的进入和使用,是否加以了控制:是□否□; 8、实验区与办公区是否保持有良好的隔离,并加贴“实验受控区”或等同 标识,无关人员未经批准不随意进入实验区域:是□否□; 9、产生有害气体作业场所是否安装通风排气系统:是□否□; 10、其他: 论结合格□不合格□ 不符合说明 监督情况属实□监督情况不属实□ 确认意见 被监督部门负责人: 日期:2018年月日
纯化水检验操作规程
纯化水检验操作规程 1.适用范围 适用于纯化水检验。 2.职责 检验员:严格按SOP进行检验。 QC主管:监督检查执行情况。 3.性状 取本品10ml,置一洁净容器中,于光亮处对光观察,为无色透明,无细小颗粒及沉淀。 4.鉴别 4.1.试剂:甲基红、氢氧化钠、溴麝香草酚蓝、硝酸银、氯化钡、草酸铵、氢氧化钙、高锰酸 钾、氯化钾、二苯胺硫酸、对氨基苯磺酰胺 4.1.1.甲基红指示剂:取甲基红0.1g,加0.05mol/L氢氧化钠溶液7.4ml,使溶解,再加水稀释至 200ml,即得。PH4.2-6.3(红→黄)。 4.1.2.溴麝香草酚蓝指示剂:取溴麝香草酚蓝0.1g,加0.05mol/L氢氧化钠溶液3.2ml,使溶解,再 加水稀释至200ml,即得。PH6.0-7.6(黄→蓝)。 4.1.3.硝酸银试液:取硝酸银1.6987g,加水使溶解成100ml,即得。 4.1.4.氯化钡试液:取氯化钡细粉5g,加水使溶解成100ml,即得。 4.1. 5.草酸铵试液:取草酸铵3.5g,加水使溶解成100ml,即得。 4.1.6.氢氧化钙试液:取氢氧化钙3g,置玻璃瓶内,加水1000ml密塞,时时猛力振摇,放置1小 时,即得。用时倾取上层的清液。 4.1.7.高锰酸钾试液:取高锰酸钾约3.2g,加水1000ml煮沸15分钟,密塞,静置2日以上,用垂 熔玻璃滤器滤过,摇匀。(为0.02mol/L) 4.1.8.标准硝酸盐溶液:取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加 水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1ugNO3)。 4.1.9.标准亚硝酸盐溶液:取亚硝酸钠0.75g(按干燥品计算),加水溶解,稀释至100ml,摇匀, 精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1ugNO2)。 4.1.10.标准铅溶液:称取硝酸铅0.160g,置1000ml量瓶中,加硝酸5ml与水50ml溶解后,用 水稀释至刻度,摇匀,作为贮备液。临用前,精密量取贮备液10ml,置100ml量瓶中,
工艺用水检验规程
工艺用水 1. 目的:为本公司制取的纯化水提供检验要求、方法和依据。 2 检验要求: 2.1 纯化水:测电导率≤2μs/cm 1次/班。 2.2用蒸馏法制得的纯化水和注射用水:测PH值、氯化物、铵盐,1次/班,检测全性能1次/周。 3. 技术要求及检验方法: 3.1性状:本品为无色的澄明液体;无臭,无味。 3.2酸碱度取本品10mL,加甲基红指示液2滴。不得显红色;另取本品10mL加溴麝香草酚蓝指示液5滴。不得显蓝色。注射用水pH值应为5.0~7.0。10mL,加 3.3氯化物、硫酸盐与钙盐取本品。分置三支试管中,每管各50 mL。第一管中加硝酸5滴与硝酸银试液1mL,第二管中加氯化钡试液2mL,第三管中加草酸铵试液2mL,均不得发生浑浊。 3.4硝酸盐取本品5mL置试管中,于冰浴中冷却,加10%氯化钾溶液0.4mL与0.1%二苯胺硫酸溶液0.1 mL,摇匀,缓缓滴加硫酸5mL,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100mL,摇匀,精密量取1mL,加 )]0.3mL,水稀释成100 mL再精密量取10mL,加水稀释成100mL,摇匀,即得(每1mL相当于1μgNO 3 加无硝酸盐的水4.7mL,用同一方法处理后的颜色比较,不得更深(0.000 006%)。 3.5亚硝酸盐取本品10 mL,置纳氏色管中,加对氨基苯磺酰胺的稀盐酸溶液(1→100)1 mL 及盐酸萘乙二胺溶液(0.1→100)1mL,产生的粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.750g(按干燥品计算),加水溶解,稀释至100mL,摇匀,精密量取1mL,加水稀释成100mL,摇 )]0.2mL,加无匀,再精密量取1mL,加水稀释成50 mL,摇匀,即得(每1mL相当于1μgNO 2 亚硝酸盐的水9.8mL,用同一方法处理后的颜色比较,不得更深(0.000 002%)。 3.6氨去本品50mL,加碱性碘化汞钾试液 2 mL,放置15分钟;如显色,与氯化铵溶液(取氯化铵31.5mg,加无氨水适量使溶解并稀释成1000mL)1.5mL,加无氨水48mL与碱性碘化汞钾试液2mL制成的对照液比较,不得更深(0.000 03%)。 3.7二氧化碳取本品25 mL,置50 mL具塞量筒中,加氢氧化钙试液25mL密塞振药,放置1 标题:工艺用水检验规程
实验室质量记录汇总
第B\0版 SDXJ-ZJ-0 质量记录汇总 编号: SDXJ-ZJ-2016 编写人: 审核人: 批准人: 哈尔滨汽车交易市场机动车检测有限公司2016年06月15日发布 2016年06月28日实施质量记录目录 SDXJ/ZJ-1 会议记录 SDXJ/ZJ-2违规行为登记表 SDXJ/ZJ-3能力确认记录 SDXJ/ZJ-4培训计划表 SDXJ/ZJ-5培训记录及效果评估表 SDXJ/ZJ-6专业技术人员档案 SDXJ/ZJ-7人员监督计划 SDXJ/ZJ-8人员监督记录 SDXJ/ZJ-9环境条件记录 SDXJ/ZJ-10安全检查记录表 SDXJ/ZJ-11有毒有害物品处理登记表 SDXJ/ZJ-12化学试剂库存台帐 SDXJ/ZJ-13仪器设备\计量器具一览表 SDXJ/ZJ-14检定/校准结果证实记录 SDXJ/ZJ-15设备检验记录 SDXJ/ZJ-16设备维修保养运行履历本
SDXJ/ZJ-17设备履历档案 SDXJ/ZJ-18检定(校准)计划表 SDXJ/ZJ-19期间核查计划 SDXJ/ZJ-20期间核查记录 SDXJ/ZJ-21标准物质台帐 SDXJ/ZJ-22标准物质使用记录 SDXJ/ZJ-23化学溶液配制记录表 SDXJ/ZJ-24文件管理台帐 SDXJ/ZJ-25文件审核计划 SDXJ/ZJ-26文件审核记录 SDXJ/ZJ-27资料销毁审批表 SDXJ/ZJ-28技术标准或规范查新记录 SDXJ/ZJ-29数据处理软件评价记录 SDXJ/ZJ-30检测合同(协议)书 SDXJ/ZJ-31合同评审记录 SDXJ/ZJ-32新项目立项审批表 SDXJ/ZJ-33分包方评审表 SDXJ/ZJ-34合格服务方/供应商名录 SDXJ/ZJ-35合格服务方/供应商评价报告SDXJ/ZJ-36供应品到货验收单 SDXJ/ZJ-37供应品使用台帐 SDXJ/ZJ-38客户反馈信息/投诉处理及登记表SDXJ/ZJ-39客户满意度调查表 SDXJ/ZJ-40纠正(预防)措施及验证记录SDXJ/ZJ-41查(借)阅资料档案审批表SDXJ/ZJ-42年度审核计划 SDXJ/ZJ-43审核检查表 SDXJ/ZJ-44不符合项记录表 SDXJ/ZJ-45内部审核报告 SDXJ/ZJ-46年度管理评审计划 SDXJ/ZJ-47年度管理评审报告 SDXJ/ZJ-48标准方法证实记录
纯化水检测标准操作规程
1 目的 为检验人员提供正确的操作依据,保证纯化水的检测程序规范化、标准化。 2 范围 适用于本公司纯化水的检测。 3 职责 生产部负责为各用水部门提供合格的纯化水,质保部负责检验。 4 内容 4.1 性状鉴别 4.1.1 标准:本品为无色的澄明液体,无臭,无味。 4.1.2 检测方法:目测法。 4.2 酸碱度 4.2.1 试剂 a. 甲基红指示液:取甲基红0.1g,加0.05mol/L氢氧化钠溶液7.4ml使溶解,再加水稀释至200ml。变色范围pH4.2—6.3(红→黄)。 b. 0.05 mol/L氢氧化钠溶液:取0.2g分析纯氢氧化钠,用水稀释至100ml。 c. 溴麝香草酚蓝指示液:取溴麝香草酚蓝0.1g,加0.05mol/L氢氧化钠溶液3.2ml 使溶解,再加水稀释至200ml。变色范围pH6.0—7.6(黄→蓝)。 4.2.2 操作 取纯化水10ml,加甲基红指示液2滴,不得显红色;另取纯化水10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。 4.3 硝酸盐 4.3.1 试剂 a. 10%氯化钾溶液:取氯化钾10g,加水使溶解成100ml,即得。 b. 0.1%二苯胺硫酸溶液:取二苯胺0.1g,加硫酸100ml使溶解,即得。 c. 标准硝酸盐溶液:取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1μg NO3)。 4.3.2 操作
取本品5ml置试管中,于冰浴(0℃)中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000 006%)。 4.4 亚硝酸盐 4.4.1 试剂 a. 稀盐酸溶液:取盐酸234ml,加水使稀释至1000ml,即得。本液含HCl应为 9.5%-10.5%。 b. 对氨基苯磺酰胺的稀盐酸溶液(1→100):取氨基苯磺酰胺1g,加稀盐酸溶液使溶解成100ml。 c. 盐酸萘乙二胺溶液(0.1→100):取盐酸萘乙二胺0.1g,加水使溶解成100ml。 d. 标准亚硝酸盐溶液:取亚硝酸钠0.750g(按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50 ml,摇匀即得(每1ml相当于1μgNO2) 。 4.4.2 操作 取本品10ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml及盐酸萘乙二胺溶液(0.1→100)1ml,产生的粉红色,与标准亚硝酸盐溶液0.2ml,加无亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(0.000 002%)。 4.5 氨 4.5.1 试剂 a. 碱性碘化汞钾试液:取碘化钾10g,加水10ml溶解后,缓缓加入二氯化汞的饱和水溶液,随加随搅拌,至生成的红色沉淀不再溶解,加氢氧化钾30g,溶解后,再加二氯化汞的饱和水溶液1ml或1ml以上,并用适量的水稀释使成200ml,静置,使沉淀,即得。用时倾取上层的澄明液应用。 b. 氯化铵溶液:取氯化铵31.5mg,加无氨水适量使溶解并稀释成1000ml。 4.5.2 操作 取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液1.5ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(0.000 03%)。 4.6 电导率 用导率仪检测,按《电导率仪标准操作规程》操作。小于2.0μs/cm。 4.7 易氧化物 4.7.1 试剂 a. 稀硫酸:取硫酸57ml,加水稀释至1000ml即得。本液含H2SO4应为9.5%-10.5% b. 高锰酸钾滴定液(0.02mol/L):取高锰酸钾3.2g,加水1000ml,煮沸15分钟,
工艺用水检验取样标准程序
工艺用水检验取样标准程序 1.目的:建立工艺用水检验取样标准程序,规范取样操作。 2.范围:适用于公司内纯化水、注射用水常规检验时的取样及水系统验证时的检验取样操作。 3.职责:生产部制水岗位人员、检验人员对本规程的实施负责。 4.取样程序: 纯化水的检验取样包括:一般理化项目检验取样、微生物限度检验取样;注射用水的检验取样包括:一般理化项目检验取样、细菌内毒素检验取样、微生物限度检验取样。 4.1准备取样工具 4.1.1一般理化项目检验的取样用具:洁净干燥的具塞玻璃容器。 4.1.2细菌内毒素检查的取样用具: 4.1.2.1取样管:无热原的2mL安瓿或管制瓶(管制瓶需预先用重铬酸钾洗液浸泡过夜后,用纯化水冲洗干净,放置250℃电热干燥箱内烘烤60分钟以去除热原,冷却后备用)。 4.1.2.2铝箔或封口膜:用于封住取样管口。 4.1.3微生物限度检验的取样用具 4.1.3.1酒精灯、75%酒精棉球、打火机。 4.1.3.2无菌具塞三角烧瓶:将三角烧瓶洗净干燥后,置121℃湿热灭菌30分钟后烘干或180℃干烤2小时,冷却后备用。 4.2取样:带上取样用具及记号笔,到指定地点取样。 4.2.1一般理化项目检验的取样程序 4.2.1.1打开取样点出水阀,放水至少10秒钟,以排除取样盲管内积存的死水。 4.2.1.2打开取样瓶盖(注意瓶塞不要碰任何物品和手掌),将瓶口对准出水口水流,使水直接落入瓶内,接少量水样,荡洗取样瓶内壁后,将水倒掉,重复3次。 4.2.1.3同法接取水样,接够3倍检验量后,移开瓶口,立即盖紧瓶盖,关闭取样口阀门(注意瓶内水面与瓶口应留有一段空隙,以便在检验时可充分振荡混匀水
2015版药典工艺用水性能
工艺用水检验操作记录 记录: 1.性状:本品为 结果:□符合规定□不符合规定 标准规定:本品为无色的澄清液体;无臭,无味。 2.氯化物、硫酸盐与钙盐检查: 取本品,分置三支试管中,每管各50ml。第一管中加硝酸5滴与硝酸银试液1ml,第二管中加氯化钡试液2ml,第三管中加草酸铵试液2ml,结果: 结论:□符合规定□不符合规定 标准规定:均不得发生浑浊。 3.氨检查: 取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化铵31.5mg,加无氨水适量使溶解,并稀释成1000ml)1.5ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,结果: 结论:□符合规定□不符合规定 标准规定:不得更深(≤0.00003%)。
4.硝酸盐检查: 取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液〔取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1μgNO3)〕0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,结果: 结论:□符合规定□不符合规定 标准规定:不得更深(≤0.000006%)。 5.亚硝酸盐检查: 取本品10ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml与盐酸萘乙二胺溶液(0.1→100)1ml,产生的粉红色,与标准亚硝酸盐溶液〔取亚硝酸钠0.750g(按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1μgNO2)〕0.2ml,加入无亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,结果: 结论:□符合规定□不符合规定 标准规定:不得更深(≤0.000002%)。 6.二氧化碳检查: 取纯化水25ml,置50ml具塞量筒中,加氢氧化钙试液25ml,密塞振摇,放置,1小时内,结果:
工艺用水检验方法
1、目的 控制本公司工艺用水的质量,从而控制产品清洗的效果 2、范围 本标准适用于本公司的工艺用水检测方法。 3、制定依据 中国药典2005版(二部) 4、要求 4.1 性状:注射用水及纯化水应无臭、无味、无色澄明液体 4.2酸碱度:纯化水加甲基红2滴不得显红色,加溴麝香草酚蓝5滴,不得显蓝色。注射用水应在 5.0~7.0之间。 4.3 氯化物、硫酸盐、钙盐:注射用水及纯化水均不得发生浑浊 4.4 硝酸盐: 注射用水及纯化水显色不得超过标准对照液 4.5 亚硝酸盐: 注射用水及纯化水显色应不得超过标准对照液 4.6 氨: 注射用水及纯化水如显色、显色应不得超过对照液 4.7 二氧化碳: 注射用水及纯化水不得发生浑浊 4.8 易氧化物: 注射用水及纯化水粉红色不得完全消失 4.9 不挥发物: 注射用水及纯化水遗留残渣不得超过1mg 4.10 重金属: 注射用水及纯化水显色不得超过对照液 4.11 细菌内毒素: 注射用水每1mL中含内毒素量应小于0.25EU。 4.12 电阻率: 纯化水电阻率应≥0.5MΩ.cm 4.13 微生物限度: 取纯化水采用薄膜过滤法理后,依法查中国药典(附录XI J),纯化水细菌、霉菌和酵母菌总数每1mL不得超过100个,注射用水细菌、霉菌和酵母菌总数每100mL不得超过10个。 5、试验方法 5.1 外观 用目力观察及鼻子闻。 5.2 酸碱度:取纯化水及注射用水10mL加甲基红指示液2滴,不得显红色,另取10mL, 加溴麝香草酚兰指示液5滴,不得显兰色。 5.3 氯化物、硫酸盐、钙盐 取纯化水及注射用水分置三个试管中,每管50 mL,第一管加硝酸5滴与硝酸银试液1 mL,第二管加氯化钡试液2 mL,第三管加草酸铵试液2 mL,均不得发生浑浊。 5.4 硝酸盐 取本品5mL置试管中,于冰浴中冷地,加10%氯化钾0.4mL与0.1%二苯胺硫酸溶液0.1 mL,摇匀,缓缓滴加硫酸5mL,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝
3、食品碳酸钙检验原始记录
食品碳酸钙检验操作记录 品名取样地点总件数件取样总量g 检验依据质量标准 批号代表量Kg 取样件数件每件取样量g 取样器具清洁□已清洗□未清洗取样人取样日期检验人检验日期审核人 项目检验过程记录内控标准检验结果 外观目测产品颜色。无色、无味白色 粉末 □是□不是 碳酸钙含量1、制样:称取0.6g在200℃±5℃干燥4小时的样品(精确至0.0002g), 置于250ml烧杯中,用少量水润湿,滴加盐酸溶液至式样全部溶 解,定容至250ml容量瓶中,摇匀; 2、检测:吸取上述溶液25ml置于250ml锥形瓶中,加水30ml,5ml 三乙醇胺溶液,加0.1克钙试剂军酸钠盐指示剂,滴加氢氧化钠 溶液至试剂由蓝色变为酒红色,过量0.5ml,用EDTA标准溶液 滴定溶液至酒红色变为纯蓝色,同时做空白。 EDTA溶液浓度C:mol/L 样品耗EDTA溶液体积V1:ml V2: ml 空白耗EDTA溶液体积V0:ml 样品重量m:m1: g m2: g 结果:1:2: 平均值: 98.0--105.0% % 盐酸不溶物1、制样:称取干燥好的样品5g,精确至0.01g,置于高形烧杯中, 加水润湿后,缓慢加入25ml盐酸溶液,加热至沸腾,趁热用中速定 量滤纸过滤,用热水冲洗烧杯,洗涤至无氯离子,将滤纸连同不溶物 移入已恒定的瓷坩埚内,灰化后,于850℃--900℃灼烧至质量恒定 空坩埚质量M1:1、g 2、g 盐酸不溶物与坩埚质量M2:1、g 2、g 试料质量M:1、g 2、g 结果:1、2、 平均值: ≤0.20% % 游离碱1、制样:称取样品3.0±0.01g,置于100ml烧杯中,加入30ml新煮 沸放冷的水,摇匀,3分钟后干过滤。2、检测:用移液管移取20ml 滤液,加2滴酚酞指示剂,加入0.2ml盐酸标准滴定溶液。. 样品重量: 滴加盐酸标准溶液后红色消失即为合格红色消失□合格□不合格
实验室质量监督记录表
-- --- 实验室质量监督记录表 DECDC/BGGL-012 被监督人 监督项目 样品编号 监督日期 监督员 要素 检查内容 检查结果 纠正措施 人员 人员是否持证上岗,工作服是否穿戴齐整 采样点位的布设是否合理 样品 现场水样采集及采样记录的填写是否符合技术规 范要求 运输是否符合要 采集 水样的保存方法和条件是否正确, 求,样品的交接是否符合规范, 是否填写分析样品 流转登记单 使用的仪器设备检定是否在有效期内、 仪器设备是 否校准或按计划进行期间核查 仪器 仪器的精度、 量程是否符合方法的要求, 仪器设备 设备 操作是否符合规范 及 仪器设备是否贴有设备状态的标识 标准 仪器的存放和使用环境是否符合要求 物质 在使用前后是否对仪器进行了检查, 并按规定要求 填写了仪器设备使用记录,维修保养是否有记录 是否执行标准物质发放、领用登记制度 方法 依据、方法是否适用、是否受控和现行有效 实验室是否干净、 整洁,室内是否有与实验无关的 物品 实验室环境是否满足方法、 仪器和人员安全健康的 工作 要求 标签是否符合要求 环境 查配制的试剂是否在有效期内, 是否按规定及时对环境条件进行了监控记录 所有玻璃器皿是否干净,精度是否符合方法要求 样品是否在有效期内, 样品取样是否规范, 样品在 分析过程标识是否清楚 试剂配置是否符合要求, 对检测结果有影响的试剂 分析 和辅助物资是否符合相应要求 (如实验室用水、 化 操作 学试剂等) 分析操作是否熟练, 样品的分析操作过程是否符合 标准要求,工作曲线是否在有效期内 废液处理是否规范 记录 环境记录、 采样记录、 仪器使用记录等是否填写正 确,分析记录和数据处理是否正确, 审核是否符合 要求 平行样合格率是 质控 每批样是否有空白样品和平行样, 措施 否符合要求,样品的质控措施是否达到要求 确认 被监督人: 监督人 : 质量负责人: 意见 日 期: 日 期: 日 期:
壁纸检测原始记录
JS.QG-12-02.1 泰州市产品质量监督检验所 壁纸 检测原始记录 检测地点:轻工室 检测: 复核: 规格型号: 样品编号: 检测依据:QB/T4034-2010 检测仪器:见一览表 检测日期: 环境:温度: ℃ 湿度: % 主要用仪器设备一览表 序号 检验项目 单位 标准要求(一等品) 检 验 结 果 数据 处理 1 长度 mm ±1.5% 2 宽度 mm ±1.5% 3 每卷段数和段长 每卷 段数 段 最小 段长 m 4 外观 质量 色差 不应有明显差异 伤痕和皱折 不应有 气泡 不应有 套印 精度 偏差不大于1.5mm 露底 不应有 漏印 不应有 污染点 不应有目视明显的污染点 1.测量壁纸的长度时,从每批中随机抽取至少1%卷数; 2.10m/卷的成品壁纸每卷为一段;15/m 卷和50m/ 卷的成品壁纸每卷段数及段长应符合表1的规定。 序号 仪器名称 型号 精度 计量有效期 设备编号 1 钢卷尺 5m 1mm QG-041 2 直尺 1m 1级 QG-040-02
检测地点:轻工室 检测: 复核: 规格型号: 样品编号: 检测依据:QB/T4034-2010 检测仪器:见一览表 检测日期: 环境:温度: ℃ 湿度: % 主要用仪器设备一览表 序号 仪器名称 型号 精度 计量有效期 设备编号 1 钢卷尺 5m 1mm QG-041 2 直尺 1m 1级 QG-040-02 序号 检验项目 单位 标准要求(优等品) 检 验 结 果 数据 处理 1 长度 mm ±1.5% 2 宽度 mm ±1.5% 3 每卷段数和段长 每卷段数 段 最小段长 m 4 外观 质量 色差 不应有明显差异 伤痕和皱折 不应有 气泡 不应有 套印精度 偏差不大于1.5mm 露底 不应有 漏印 不应有 污染点 不应有 1.测量壁纸的长度时,从每批中随机抽取至少1%卷数; 2.10m/卷的成品壁纸每卷为一段;15/m 卷和50m/卷的成品壁纸每卷段数及段长应符合表1的规定。
质量监督记录表-IT
每月质量监督记录表 表单编号:部门:信息管理组日期:关键控制点监督项目/ 内容: 检查记录情况说明 1、部门或科室文件(含集团文件),其控制、回顾及修订等 1. □是□否 管理是否符合文控程序的要求?(以纸质版文件为准时,同 2. □是□否 时存在电子文件应符合正确备份存档的要求——有效防止恶 意访问和更改) 2、本部门或科室适用的外来文件(法律法规、行业标准、地 3. □是□否 方条例、国际通用准则等公司以外的文件),其控制管理是否 符合文控程序的要求? 4. □是□否 3、本部门或科室编写的文件是否发放至所有相关人员? 文件控制4、本部门或科室人员是否阅读并签署了所有相关的文件(包 括适用的集团、外来文件)? 5、是否维持了一份本本部门或科室的文件控制清单,应包括 部门适用的所有(跨部门、本部门、安全、外来等)文件? 6、工作现场文件是否均为现行有效版本,无效或作废文件是 否撤离工作现场? 7、文件格式是否满足文控程序的要求?(具体格式要求参见 该子公司文控程序) 8、本部门或科室编写的文件,其附属记录表格(包括正在使 用的记录)是否与文件内容或要求一一对应? 1. □是□否1、记录的格式是否正确:信息完整、唯一识别、字迹清晰、修改符合要求、记录人签名和日期等?(记录不得用铅笔, 修改应使用划改并签名) 2. □是□否2、若有电子记录,其访问、保护、修改和维护是否符合相应 记录控制记录控制程序的要求?(电子记录包括了仪器中的原始数据) 3、记录的贮存环境(如温度、湿度、防盗、防尘、防蛀等) 是否符合相关要求? 4、是否按照相关要求对记录进行定期归档存放,以易于存取 和检索;超过保存期的记录是否按要求销毁? 1、是否应制定程序文件对用于采集、处理、记录、报告、贮 1. □是□否 存或恢复检验数据和信息的信息系统进行维护,以保证正常 2. □是□否 运作并提供必要的环境和操作条件保持数据和信息的完整 3. □是□否 性,并记录; 4. □是□否 2、计算机设施及设备是否按规定进行定期清洁和妥善维 护? 5. □是□否 环境条件3、计算机设备的放置,是否符合消防、以及厂商的规定(如通风、静电、温度、湿度等)? 4、是否对通行区内的电线和计算机缆线设立保护?(如标记线路、使用线槽或嵌入墙体等) 5、是否为LIS 服务器和数据处理有关的计算机配备不间断电
工艺用水的检测
工艺用水的检测 药典收载的水有纯化水、注射用水、灭菌注射用水 1. 纯化水(Purified Water):为蒸馏法、离子交换法、反渗透法或其他适宜的方法制得供药用的水,不含任何附加剂。纯化水可作为配制普通药物制剂的溶剂或试验用水,不得用于注射剂的配制。 2. 注射用水(Water for Injection):是以纯化水作为原水,经特殊设计的蒸馏器蒸馏,冷凝冷却后经膜过滤制备而得的水。注射用水可作为配制注射剂用的溶剂。 3. 灭菌注射用水(Sterile Water for Injection):为注射用水依照注射剂生产工艺制备所得的水。
一.制备 纯化水为蒸馏法、离子交换法、反渗透法或其他适宜的方法制得供药用的水,不含任何附加剂。 1.蒸馏法为采用特殊设计的蒸馏器用蒸馏法制备的纯化水。 2.采用离子交换法、反渗透法、超滤法等非热处理制备的纯化水一般又称 去离子水。 3.离子交换法为采用阴阳离子交换器制备的纯化水。 离子交换树脂之去离子原理 阳离子交换树脂树脂分子中带有酸性交换基团-磺酸基
阴离子交换树脂树脂分子中带有碱性交换基团-季胺盐基 4. 反渗透法制备纯水技术是60年代发展起来的新技术。由于它操作工艺简单,除盐和除热源效率高,又比较经济。《美国药典》从19版开始收载此法,为制备注射用水的法定方法之一。 机制:反渗透是渗透的逆过程,是指借助一定的推力(如压力差、温度差等)迫使溶液中溶剂组分通过适当的半透膜从而阻留某一溶质组分的过程。 原水-原水加压泵-多介质过滤器-活性炭过滤器-软水器-精密过滤器-第一级反渗透-PH调节-中间水箱-第二级反渗透(反渗透膜表面带正电荷)-纯化水箱-纯水泵-紫外线杀菌器-微孔过滤器-用水点 二.检验 1.检验方法 【性状】本品为无色的澄明液体;无臭,无味。 【检查】酸碱度取本品10ml,加甲基红指示液2滴,不得显红色;另取10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。 氯化物、硫酸盐与钙盐取本品,分置三支试管中,每管各50ml。第一管中加硝酸5滴与硝酸银试液1ml,第二管中加氯化钡试液2ml,第三管中加草酸铵试液2ml,均不得发生浑浊。 硝酸盐取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液0.4ml 与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾
纯化水检验需要试剂配制
纯化水检验需要试剂 1.甲基红指示液 2.溴麝香草酚蓝 3.10%氯化钾溶液 4.0.1%二苯胺硫酸溶液 5.标准硝酸盐溶液 6.对氨基苯磺酰胺的稀盐酸溶液(1→100) 7.盐酸萘乙二胺溶液(0. 1→100) 8.标准亚硝酸盐溶液 9.碱性碘化汞钾 10.氯化铵溶液 11.高锰酸钾滴定液(0.02mol/L) 12.铅溶液(10ug/g) 13.醋酸盐缓冲液(ph3.5) 14.硫代乙酰胺试液
试液配制 1.甲基红指示液:取甲基红0.1g,加0.05mol/L氢氧化钠溶液7.4ml使溶解,再加水稀释至200ml,即得。 2.溴麝香草酚蓝指示液:取溴麝香草酚蓝0.1g,加0.05mol/L氢氧化钠溶液 3.2ml 使溶解,再加水稀释至200ml,即得。 3.10%氯化钾溶液:取10氯化钠,加水90ml,溶解即得。 4.0.1%二苯胺硫酸溶液:取二苯胺0.1g,加硫酸100ml,使溶解即得。 5..标准硝酸盐溶液:标准硝酸盐溶液:取硝酸钾0.163g,加水溶解稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取10ml,加水稀释成100 ml,摇匀,即得(每1 ml相当于1μgNO3) 6..对氨基苯磺酰胺的稀盐酸溶液(1→100):1g磺胺用稀盐酸稀释到100ml 7. 盐酸萘乙二胺溶液(0. 1→100):盐酸萘乙二胺溶液:0.1g萘乙二胺盐酸盐用水稀释到100ml。 8. 标准亚硝酸盐溶液:标准亚硝酸盐溶液:取亚硝酸钠0.750g(按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1 ml,加水稀释成50ml,摇匀,即得(每1ml相当于1μgNO2)。 9. 碱性碘化汞钾:取碘化钾10g,加水10ml溶解后,缓缓加入二氯化汞的饱和水溶液,随加随搅拌,至生成的红色沉淀不再溶解,加氢氧化钾30g,溶解后,再加二氯化汞的饱和水溶液1ml或1ml以上,并用适量的水稀释使成200ml,静置,使沉淀,即得,用时倾取上层的澄明液应用。 10. 氯化铵溶液:取氯化铵31.5mg,加无氨水适量使溶解并稀释成1000ml。 11. 高锰酸钾滴定液(0.02mol/L):取高锰酸钾3.2g,加水1000ml,煮沸15min,密塞,静置2日以上,用垂熔玻璃滤器滤过,摇匀。 12.标准铅溶液 标准铅溶液的贮备液:取硝酸铅0.1599g,置1000ml容量瓶,加硝酸5ml与水50ml溶解后,用水稀释至刻度,摇匀。标准铅溶液(非储备液):精密取铅溶液贮备液10ml,置100ml容量瓶,用水稀释摇匀,即得(1ml相当于10ug的Pb)。本液仅限当日使用。 13. 醋酸盐缓冲液(ph3.5):取醋酸铵25g,加水25ml溶解后,加7mol/L盐酸溶液38ml,用2mol/L盐酸溶液或5mol/L氨溶液准确调节pH值至3.5(电位法指示),用水稀释至100ml,即得。 14. 硫代乙酰胺试液;取硫代乙酰胺4g,加水使溶解成100ml,置冰箱中保存。临用前取混合液(由1mol/L氢氧化钠溶液15ml,水5.0ml及甘油20ml组成)5.0ml,加上述硫代乙酰胺溶液1.0ml,置水浴上加热20秒钟,冷却,立即使用。
北京医疗器械工艺用水检查要点指南(2014版)
医疗器械工艺用水检查要点指南(2014版) 工艺用水是许多医疗器械产品生产过程中不可缺少的,而其制备、检测、储存等影响工艺用水质量的过程,也直接或间接的影响着医疗器械产品的质量。医疗器械行业中所使用的工艺用水更由于医疗器械产品本身及其生产工艺的特性而具有一些自身的特点。 本检查要点指南旨在帮助北京市医疗器械监管人员增强对医疗器械工艺用水相关过程的认知和把握,指导全市医疗器械监管人员对医疗器械生产企业工艺用水控制水平的监督检查工作。同时,为医疗器械生产企业在工艺用水环节的管理要求提供参考。 当国家相关法规、标准、检查要求、制备方法发生变化时,应重新讨论以确保本指南持续符合要求。 一、适用范围 本指南可作为北京市食品药品监督管理局组织、实施的《医疗器械生产企业许可证》核发、变更、换证等现场检查、医疗器械质量管理体系考核、医疗器械生产质量管理规范检查、医疗器械生产监督检查等各项涉及工艺用水检查的参考资料。 二、检查要点及流程 以下检查要点的表述主要分为对现场情况和文件资料的检查两部分,但在实际检查过程中应特别注意现场查看、询问、记录的情况与企业的规定、文件、记录的符合性。 (一)现场观察企业工艺用水系统及制备环境 对于以下的检查内容,检查人员应进行适当的记录。 1.询问工艺用水系统的生产厂家名称; 2.询问制水人员制备的工艺用水种类(纯化水或/和注射用水或/和实验室分析用水等); 3.询问制水人员工艺用水的制备方法和流程; 4.现场查看工艺用水系统的材质和结构组成; 5.现场查看工艺用水系统设臵的采水监测点,出水点至少应设臵在进入纯化水储罐前、在线消毒设备前后、进入注射用水储罐前(如涉及)、各个涉及使用工艺用水的功能间使用点以及总进水点、总回水点;
工地试验室质量监督计划
xxxxxx 工地试验室 xxxxxx 工地试 验室
试验室质量监督计划 一、监督目的为贯彻公司质量方针,确保质量目标得以实现,制定本计 划。 二、监督范围及工作职责 (一)监督范围适用于本试验室所有试验检测工作。包括人员持证资格及资格保持、检测方法选择、仪器设备使用和维护、设施和环境条件控制、检测样品保管、安全防护、监测报告、结果评价等。 (二)工作职责 1、质量负责人负责组织制定年度质量监督计划,并对质量监督结果进行评价; 2、技术负责人负责组织检测人员的技术考核; 3、资料管理员负责检测标准、规范等文件的跟踪查新; 4、质量监督员负责监督质量监督工作的落实。 三、工作要求 年度质量目标:报告合格率为》98%报告及时率》98%重大事故 率为0
①人员:检测人员必须经过培训并考核合格,每半年对在岗检测人员进行一次技术考核。 ②仪器设备和标准物质 a、仪器设备按照规定的要求定期进行检定校准,在两次检定校准周期之间至少进行一次检查(一般一年一次),期间核查必须按计划进行,核查方法见各仪器期间核查作业指导书; b、本试验室使用的检测方法,大多是国家或行业发布的标准方法, 资料管理员每半年对标准进行一次跟踪查新,确认使用现行有效的规范; c、凡有标准样品的项目,每一年至少组织一次标样考核和一次试验室内比对(包括人员比对、检测方法比对等)。 四、质量监督的具体过程 (1)抽查时间:采用不定期的抽查方法; (2)抽查内容:仪器设备、试验室卫生、检测(试验)过程、原始记录,严格按照绩效考核制度当中要求的条款进行打分; (3)遇有比较重要的委托时,检测室负责人必须通知质量监督人员进行检测过程监督,以确保检测质量; (4)质量监督人员必须将抽查监督项目内容详细记录在检测试验 质量监督登记表中,并保存。 5. 记录表格
实验室原始记录管理
行政管理 SOP-实验室管 理 长沙晶易医药科技有限公司-- 原始实验记录管理 一、目的及使用范围为规范实验记录本的使用以及加强对原始记录的客观性、真实性和可靠性的管理,特制定此规定。本规定适用于本公司及中南大学药学院药剂学系所有原始记录相关事项。 二、原始实验记录内容 2.1原始实验记录具体内容 2.1.1原始实验记录的统一标准格式,要求原始记录必须有下列主要内容:项目 (课 题)名称、实验目的、研究内容、实验日期、实验条件、参考文献、实验材料、实验设计原理和方法、实验过程、实验结果、实验讨论及记录者签名。 2.2实验过程内容 2.2.1封面填写:要求写明本项目或课题的全名、编号、项目或课题负责人、实验记录人、实验起止时间。实验记录超过一本时,须按实验时间顺序编册。 2.2.2原始实验记录题头填写:须注明实验日期、空气温/ 湿度、实验参与人、实验题目等。 2.2.3原始实验记录的详细内容须包括下列主要内容:本次实验所需的实验条件及实验材料、实验具体研究内容及所要解决的问题,本次实验设计原理及研究方法、 2.2.4实验研究方法应根据近实验设计的方法详细记录本次实验所要采取的具体实验设计,技术路线、实验方法、工艺流程等内容。 2.2.5任一实验都应详细记录本次实验最适需温度、湿度,动物实验应注明动物实验室的级别、合格证书及发证单位。 2.2.6任一实验应将其实验材料的来源、样品的取样时间、原料特性等内容进行
记录。其实验设备、仪器的记录应包括仪器及设备的名称、厂家、生产批号、规格型号等信息。其原料药的记录应包括原料药的厂家、生产批号、批文、规格等信息。 2.2.7实验过程:详细记录本次实验过程中所出现的具体情况及所观察到的反应过 2.2.8实验结果:详细记录实验所获得的各种实验数据及反应现象,并做简要分析不得在实验记录本上随意涂改实验结果,如确需修改应征得项目或课题负责人签字同意。修改内容不得覆盖其原内容并注明修改时间和原因。 2.2.9如有参考其他文献应详细记录文献资料文题、作者、刊物(出版社)、页码、发表时间及期号(卷)等。如有要求应保留参考文献的复印件。 2.2.10当天实验结束时,所有参加实验的研究人员、记录员均应签名,并于当天交项目或课题负责人审核。 三、原始实验记录的书写规范要求 3.1原始实验记录是指在实验室中进行科学研究过程中,应用实验、观察、调查或资料分析等方法,根据实际情况直接记录或统计形成的各种数据、文字、图表、图片、照片、声像等原始资料,是进行科学实验过程中对所获得的原始资料的直接记录,可作为不同时期深入进行该课题研究的基础资料。 3.2实验记录必须用统一格式带有页码编号的专用实验记录本记录。 3.3实验记录本或记录纸应保持完整,不得缺页或挖补;如有缺、漏页,应详细说明原因;每次实验必须按年月日顺序记录实验日期和时间。 3.4实验记录必须做到及时、真实、准确、完整,防止漏记和随意涂改。严禁伪造和编造数据。 3.5实验记录应用字规范,字迹工整,统一用黑色字迹的钢笔或签字笔书写。不得使用铅笔或其它易褪色的书写工具书写;实验记录应使用规范的专业术语,计量单位应采用国际标准计量单位,有效数字的取舍应符合实验要求;常用的外文缩写(包括实验试剂的外文缩写)应符合规范,首次出现时必须用中文加以注释;属外文译文的应注明其外文全名称。 3.6文字记录应以中文工整书写,不得使用中英文外的字体书写。避免因使用外文出现文理不畅等问题导致今后的技术或法律纠纷。
