二氧化锰晶型转变研究
不同晶型二氧化锰的制备及其催化过氧化氢分解反应性能_张俊

不同晶型二氧化锰的制备及其催化过氧化氢分解反应性能张俊,李云平,王保玉,辛凌云,应坤(洛阳师范学院化学化工学院,河南洛阳471022)摘要:制备了不同晶型的二氧化锰,并研究了不同晶型的二氧化锰对催化过氧化氢分解反应速率的影响.结果表明,β-MnO 2(K 2CO 3)的催化活性最好.温度和用量对β-MnO 2(K 2CO 3)催化分解过氧化氢反应有着明显的影响,随着温度和用量的增加,过氧化氢催化分解的反应速率也不断增加.催化剂的重复使用效果并不理想.关键词:二氧化锰;催化剂;过氧化氢中图分类号:O612.7文献标识码:A文章编号:1009-4970(2012)05-0052-03H 2O 2广泛用于化工、纺织、造纸、军工、电子、航天、医药、食品、建筑及环境保护等行业,是一种“绿色”试剂.过氧化氢还能加速人体的衰老过程,缩短人的寿命,具有致癌危险性等.催化分解过氧化氢的研究对于进一步研究消除生物体代谢过程中的伴生物HO -,延缓衰老、防止癌变及其它疾病有重要意义[1].催化分解H 2O 2的研究主要集中在新型催化剂的开发上[2].已经研究过的催化剂有碱金属、碱土金属卤化物及卤酸盐、过渡金属化合物、贵金属、重金属的盐类、有机金属化合物、杂多酸及其盐等[3].但这些催化剂有的制备困难,价格昂贵,有的难以分离回收,催化剂不能重复使用,不符合绿色环保的要求.二氧化锰作为一种常见的催化剂,具有催化性能优良、环境友好、生产工艺路线周期短、成本低、环境污染小等特点.很多研究者使用化学法通过控制不同的反应条件已经合成出不同晶型结构和不同用途的化学二氧化锰[4,5],例如α-MnO 2、β-MnO 2、λ-MnO 2、δ-MnO 2等晶型的二氧化锰.不同晶型的二氧化锰的催化功能、使用寿命等各不相同[6].本文通过测定不同晶型、不同温度和不同用量的二氧化锰催化H 2O 2分解反应的速率常数,对影响H 2O 2催化分解的因素进行研究.1实验部分1.1仪器和试剂501超级恒温槽,上海市实验仪器厂;恒温恒压量气装置,自制;H 2O 2(浓度30%),MnSO 4·H 2O ,(NH 4)2S 2O 8,K 2CO 3,Ag 片,无水乙醇.所用试剂均为分析纯.1.2实验原理过氧化氢的分解反应式为H 2O 2→H 2O +1/2O 2该反应为一级反应,实验采用量气法测量t 时刻的V t ,以ln(V ɕ-V t )V ()ɕ对t 作图得一直线,斜率的数值即为速率常数k .1.3不同晶型MnO 2的制备1.3.1α-MnO 2制备[7]分别称取4mmol 的MnSO 4·H 2O 和4mmol (NH 4)2S 2O 8,倒入100mL 蒸馏水中,搅拌至完全溶解后,平放入2cm ˑ2cm 的Ag 片,静置三天后过滤,用去离子水、无水乙醇洗涤数次至滤液澄清,真空干燥,得黑色α-MnO 2粉末.1.3.2β-MnO 2制备[8]称取2.7g MnSO 4·H 2O 和3.7g (NH 4)2S 2O 8粉收稿日期:2011-09-28作者简介:张俊(1977-),男,河南孟州人,博士,副教授.2012年5月第31卷第5期洛阳师范学院学报Journal of Luoyang Normal University May.,2012Vol.31No.5末,用40mL去离子水溶解,磁力搅拌30min后冷却至室温,将溶液转移至150mL高压釜内,充入去离子水,控温120ħ,48h后,冷却至室温.反应完后,用去离子水和无水乙醇洗涤数次,然后在干燥箱控温70ħ干燥24h,即得到β-MnO2黑色粉末.1.3.3β-MnO2(K2CO3)制备[8]称取2.7g MnSO4·H2O和3.7g(NH4)2S2O8粉末,再加入适量K2CO3,用40mL去离子水溶解,磁力搅拌30min后冷却至室温,将溶液转移至150 mL高压釜内,充入去离子水,控温120ħ,48h后,冷却至室温.反应完后,用去离子水和无水乙醇洗涤数次,然后在干燥箱控温70ħ干燥24h,即得到β-MnO2(K2CO3)黑色粉末.1.3.4λ-MnO2制备[9]称取高锰酸钾20.00g,氯化钠7.5g和氯化锂22.5g,倒入研钵,混合研磨半个小时,后放入100mL 刚玉坩埚内,在马弗炉中600ħ加热反应5h,反应结束后自然冷却至室温,用去离子水和无水乙醇反复洗涤抽滤,将抽滤后所得到的物质置于真空干燥箱内90ħ烘干8h后,研磨得褐色粉末样品.1.3.5δ-MnO2的制备[10]配制等体积的0.2mol/L MnSO4和1.2mol/L KOH溶液,倒入烧杯中,并在不断搅拌下,逐渐加入(NH4)2S2O8,保持在常温下反应10h,静置12h后,真空抽滤分离,用用蒸馏水充分冲洗滤渣,至没有检测出SO2-4(用BaCl2溶液检测),再将过滤器上面刮下来的黑色物质在100ħ下烘6 8h,得δ-MnO2.1.4实验步骤实验采用量气法测量,实验步骤同文献[11].2结果与讨论2.1不同催化剂体系对过氧化氢分解反应的影响不同晶型二氧化锰对过氧化氢分解反应的影响结果见表1.由表1可见,不同晶型二氧化锰作为催化剂,催化过氧化氢分解反应的活性相差较大,其中β-MnO2的催化活性最好,λ-MnO2的催化表1不同晶型二氧化锰催化过氧化氢分解反应性能Run Catalyst Rate constant k/(1/s)R1α-MnO20.065830.994182β-MnO20.080650.991053β-MnO2(K2CO3)0.082840.993904λ-MnO20.004990.993545δ-MnO20.023560.99529反应条件:t=26ħ;催化剂0.015g;H2O2溶液10mL 活性最差.在β-MnO2制备过程中,适量添加K2CO3,得到的β-MnO2(K2CO3),虽然MnO2的晶型没有发生变化[8],但催化活性却有明显的提高.由于β-MnO2(K2CO3)的催化活性最好,对其做进一步的研究.2.2温度对2号β-MnO2(K2CO3)的影响温度对过氧化氢分解反应的影响结果见图1.由图1可以看出,温度对β-MnO2(K2CO3)催化分解过氧化氢反应有明显的影响,随着温度的增加,过氧化氢催化分解的反应速率逐渐增加.在30ħ以下温度较低的区间,β-MnO2(K2CO3)的催化活性随温度的升高增加较快,在30ħ到35ħ温度较高的区间,随着温度的升高,β-MnO2(K2CO3)的催化活性增加相对缓慢.图1β-MnO2(K2CO3)催化过氧化氢分解速率常数随温度变化曲线反应条件:β-MnO2(K2CO3)0.015g;H2O2溶液10mL.2.3催化剂用量对过氧化氢分解反应的影响图2为过氧化氢分解反应速率常数随β-MnO2(K2CO3)用量变化曲线.从图2可看出,催化剂用量对催化过氧化氢分解反应有明显的影响,随着催图2过氧化氢分解反应速率常数随β-MnO2(K2CO3)用量变化曲线反应条件:t=26ħ;H2O2溶液10mL.化剂用量的增加,过氧化氢的分解速率迅速增加,催化剂的催化活性效果与催化剂的用量基本成正比关系.在工业应用过程中,应严格控制催化剂的用量,以避免过氧化氢快速分解而发生爆炸.2.4β-MnO 2(K 2CO 3)催化剂重复使用图3是过氧化氢分解反应速率常数随催化剂重复使用次数关系曲线.由图3可以看出,催化剂的重复使用效果并不理想,催化剂每重复一次活性都有所降低,尤其是重复使用3次以后,活性降低的速率明显加快.所以,如何有效的活化使用过的β-MnO 2(K 2CO 3)催化剂,提高催化剂的使用效率还需要进一步的研究.图3过氧化氢分解反应速率常数随催化剂重复使用次数关系曲线反应条件:t =26ħ;β-MnO 2(K 2CO 3)0.015g ;H 2O 2溶液10mL3结论不同晶型二氧化锰作为催化剂催化过氧化氢分解反应的活性相差较大,其中β-MnO 2的催化活性最好.在β-MnO 2制备过程中,适量添加K 2CO 3,得到的β-MnO 2(K 2CO 3),催化活性有明显的提高.温度和用量对β-MnO 2(K 2CO 3)催化分解过氧化氢反应有着明显的影响,随着温度和用量的增加,过氧化氢催化分解的反应速率也不断增加.催化剂的重复使用效果并不理想,如何有效活化使用过的β-MnO 2(K 2CO 3)催化剂,提高催化剂的使用效率还需要进一步的研究.参考文献[1]张丽霞,庞承新,等.影响过氧化氢催化分解速率的因素[J ].广西师范学院学报:自然科学版,2008,(4):52-56.[2]姜成春,庞素艳,等.Fe (Ⅲ)催化过氧化氢分解影响因素分析[J ].环境科学学报,2007,(7):1197-1202.[3]吴洪达,黄映恒.过氧化氢的分解反应[J ].河池师专学报:自然科学版,2002,(2):27-30.[4]Wekesa M ,Ni Y.Mechanism of MnO 2-induced per -oxidedecomposition [J ].Tappi ,2003,2(9):23-27.[5]Zhang W X ,Yang Z H ,Wang X.Large -scale synthe -sis ofβ-MnO 2nanorods and their rapid and efficientcatalytic de-composition of methylene blue dye [J ].Catal Communication ,2006,7:408-411.[6]彭爱国,贺周初,肖伟,等.化学二氧化锰研究进展[J ],无机盐工业,2011,43(3):8-11.[7]罗建民,李娟,等.α-MnO 微球的制备及其电化学电容性质[J ].应用化学,2007,24(8):949-952.[8]段玉平,马贺,等.β-MnO 2纳米棒的电磁特性和多极化驰豫损耗[J ].无机化学学报,2009,25(9):1635-1641.[9]张春霞,陈野,等.熔盐法制备λ-MnO 2及其超级电容性能[J ].精细化工,2007,24(2):121-124.[10]王小敏,陈震,等.α、β、γ和δ-MnO 2吸附Li 的研究[J ].电池,2007,37(4):282-283.[11]王保玉,李云平,凌勋利.物理化学实验[M ].陕西:陕西科学技术出版社,2008,101.[责任编辑王保玉]Preparation and Hydrogen Peroxide Decomposition Reaction CatalyticProperties of the Manganese Dioxide with Different Crystal TypesZHANG Jun ,LI Yun-ping ,WANG Bao-yu ,XIN Ling-yun ,YING Kun(College of Chemistry and Chemical Engineering ,Luoyang Normal University ,Luoyang 471022,China )Abstract :The manganese dioxide with different crystal types is prepared.The catalytic properties of the samples are investigated in catalytic decomposition reaction of hydrogen peroxide.The results indicate that β-MnO 2(K 2CO 3)isthe best catalyst.Key words :manganese dioxide ;catalyst ;hydrogen peroxide。
二氧化锰应变

二氧化锰应变
二氧化锰是一种重要的化学物质,它具有很多应用,其中之一就是应变。
二氧化锰的应变性质是指它在受到外力作用时,会发生形态变化
或者化学反应,从而产生一些新的物质或者性质。
下面我们来详细了
解一下二氧化锰的应变性质。
首先,二氧化锰的应变性质主要表现在它的化学反应中。
二氧化锰可
以与许多物质发生反应,例如酸、碱、氧化剂、还原剂等等。
在这些
反应中,二氧化锰的分子结构会发生变化,从而产生新的物质或者性质。
例如,当二氧化锰与酸反应时,会产生二氧化碳和水,同时还会
释放出一些热量。
这种反应可以用来制备二氧化锰酸,它是一种重要
的氧化剂,可以用于许多化学反应中。
其次,二氧化锰的应变性质还表现在它的物理性质中。
二氧化锰是一
种黑色的固体,它的颜色和晶体结构都会随着温度和压力的变化而发
生变化。
当二氧化锰受到外力作用时,它的晶体结构会发生变化,从
而导致颜色的变化。
这种变化可以用来制备一些颜料和染料,例如黑
色颜料和染料。
最后,二氧化锰的应变性质还可以用来制备一些重要的化学品。
例如,二氧化锰可以用来制备氧化锰酸钾,它是一种重要的化学品,可以用
于制备火药、烟花等。
此外,二氧化锰还可以用来制备一些金属氧化物,例如氧化铁、氧化铜等。
总之,二氧化锰是一种非常重要的化学物质,它具有很多应用,其中
之一就是应变。
二氧化锰的应变性质可以用来制备一些重要的化学品,例如氧化锰酸钾、金属氧化物等。
此外,二氧化锰的应变性质还可以
用来制备一些颜料和染料,以及用于许多化学反应中。
二氧化锰晶胞氧的八面体空隙

二氧化锰晶胞氧的八面体空隙二氧化锰(MnO2)是一种具有重要应用价值的物质,它具有良好的催化性能和电化学性能,在环境净化、化工生产和能源储存等领域有着广泛的应用。
作为一种重要的过渡金属氧化物,二氧化锰的晶胞结构对其性能以及应用起着至关重要的作用。
本文将通过分析二氧化锰的晶胞结构及其八面体空隙的特点,探讨二氧化锰在催化和电化学领域的应用。
首先,我们来了解一下二氧化锰的晶胞结构。
二氧化锰常见的晶胞结构有两种,分别是金红石型结构和拉锰矿型结构。
金红石型结构的二氧化锰晶胞是由MnO6八面体构成的,这种结构具有较高的比表面积和孔隙度,因此在催化领域有着广泛的应用。
而拉锰矿型结构的二氧化锰晶胞是由MnO6八面体和MnO4四面体交替排列构成的,这种结构具有较好的电导率和电化学性能,因此在电化学领域有着重要的应用。
通过研究二氧化锰的晶胞结构,可以为其在催化和电化学领域的应用提供理论依据。
其次,我们来探讨二氧化锰晶胞中的八面体空隙。
八面体空隙是指晶体结构中八面体间隔的空间,它是重要的活性位点,对催化和电化学反应起着至关重要的作用。
在二氧化锰的晶胞结构中,八面体空隙的存在使得其具有较高的催化活性和电化学活性。
八面体空隙中的活性位点能够吸附和催化反应中的活性物种,从而促进反应的进行。
因此,八面体空隙的特性对二氧化锰的催化和电化学性能具有重要的影响。
最后,我们来讨论二氧化锰在催化和电化学领域的应用。
由于二氧化锰具有良好的催化和电化学性能,因此在环境净化、化工生产和能源储存等领域有着广泛的应用。
在催化领域,二氧化锰常用于催化氧化、还原和氧活化等反应中,如电池、燃料电池和光催化等领域。
在电化学领域,二氧化锰常用于电化学储能和电化学传感器等应用中,如电化学电容器、锂离子电池和电解水制氢等领域。
通过优化二氧化锰的晶胞结构和八面体空隙的特性,可以进一步提高其催化和电化学性能,为其在催化和电化学领域的应用提供更广阔的发展空间。
综上所述,二氧化锰作为一种重要的过渡金属氧化物,在催化和电化学领域有着广泛的应用前景。
实验5 循环伏安法研究不同晶型MnO2在KOH水溶液中的电化学行为

循环伏安法研究不同晶型MnO2在KOH水溶液中的电化学行为1. 实验背景碱性锌锰电池是一种性价比较高的电池,具有自放电小、可存放时间长、电流密度较高、安全性好、低温性能和防漏性能好等优点而广泛应用于民用和工业。
特别适用于闪光照相机、微型收录机、对讲机、剃须刀、手掌型彩电和游戏机、电动玩具、计算器、手电筒等仪器设备。
碱性锌锰电池以锌为负极,二氧化锰为正极,氢氧化钾溶液为电解液,熟称碱性电池,电压为1.5V。
电池符号:(-)Zn|KOH(7~9mol·dm-3) | MnO2 | C(+)电极反应:2MnO2+Zn+2H2O+2OH----2MnOOH+Zn(OH)42-二氧化锰具有多种晶形结构,如α-MnO2,β- MnO2,γ- MnO2,δ- MnO2,η- MnO2,ε-MnO2等。
在不同晶型的MnO2中, [MnO6]八面体以不同方式堆积连结,形成不同的隧道结构。
二氧化锰中一般均存在一定量的晶格缺陷,一些类型的二氧化锰在隧道中存在一些阳离子,如Na+,Ba2+,K+,Li+等阳离子。
不同结构的二氧化锰在电化学性质方面会有所不同,因而最终决定其应用方向。
例如,碱性锌锰电池中普遍采用EMD(γ- MnO2)作为正极材料,一次锂电池中采用具有γ和β混晶结构的MnO2,而具有尖晶石结构的LiMn2O4则有可能取代LiCoO2作为锂离子电池的电极材料。
正极材料的电化学性是影响碱锰电池放电性能的主要因素之一,因而通过适当的电化学方法来了解二氧化锰的电化学性能是必要的。
其中循环伏安法是一种常用的电化学研究方法,可用于电极反应的性质、机理和电极过程动力学参数的研究。
对于研究二氧化锰这样的粉末电极材料的电化学性能研究,循环伏安法同样也是一种有效的手段。
2. 实验原理2.1 三电极体系电化学测量三电极系统:工作电极,辅助电极(对电极),参比电极。
参比电极的作用是在测量过程中提供一个稳定的电极电位,对于一个三电极的测试系统,之所以要有一个参比电极,是因为有些时候工作电极和辅助电极(对电极)的电极电位在测试过程中都会发生变化的,为了确切的知道其中某一个电极的电位(通常我们关心的是工作电极的电极电位),就必须有一个在测试过程中电极电位恒定的电极作为参比来进行测量。
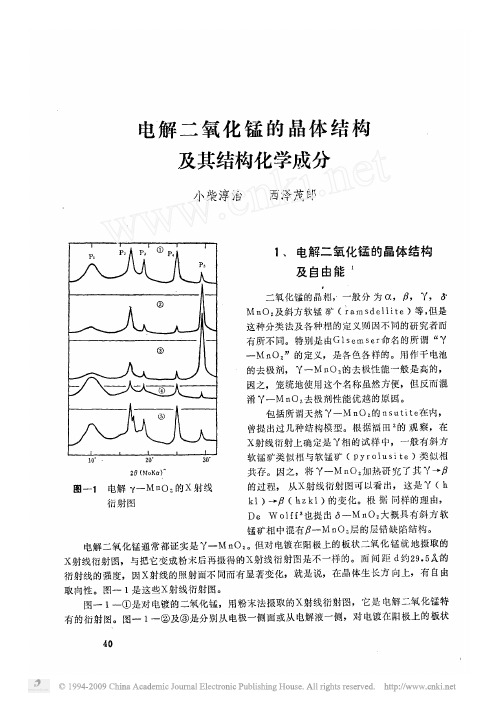
电解二氧化锰的晶体结构及其结构化学成分
价
,
价
,
全
原子 中
,
从活 性化热来看水分 电 解 二 氧 化 锰 有 电化 学 活 性 的 原 因
,
据 说是由 于 其水 分 的 关 系
,
。
关于 这 个 水分 已 有许 多
,
的研 究
。
虽然 还 是 定性 的
。
,
但大 体 上 已 判 明 水 分 与 电化 学 特 性 的 关 系
,
并且有必 要 区别 吸附
互 岌系
,
射线 衍 射 图 的 相
属于 斜 方
。
・
。
用 丫一
,
。
召系 的观 点
一
可以 说 明 如 下 的
表
带
曰 〕 ,
‘ 口 曰 毯 自
。
列举 了 根 据 图 一
,
、
射线
。
。
衍射图 值
奥
所求 得 的 而 间 距 观察
。
同时 还 给 出
歹
。
一
“
一
。
的数值
,
、 、
,
并加
,
、
〕 口
,』 尸 走自
。
珍
。
以 比较
克分 子 最
二
克 克分 子
”
・ ・
・
丫一
一
大卡 克分子
大 卡 克分子
‘
・
・ ・ ・ ・
・
…
刀一
△
・
。
二
一
・ ・
・
・
・
・
”
・
…
大 卡 克分 子
一
这是从图
mno2分解温度

mno2分解温度MnO2是一种重要的氧化锰物质,是锰的一种最高价氧化物。
在常温下,MnO2是一种黑色固体,它具有较高的分解温度。
MnO2的分解温度与其晶体结构和化学性质密切相关。
MnO2存在不同的晶体结构,包括六方晶型(MnO2-H),三方晶型(MnO2-R)和四方晶型(MnO2-B)。
不同的晶体结构决定了其热稳定性和分解温度。
一般而言,MnO2-H的分解温度较低,MnO2-R的分解温度较高。
MnO2的分解温度也受其化学性质的影响。
MnO2是一种强氧化剂,在高温下可以与许多物质反应,如有机物、硫化物、卤化物等。
这些反应会生成相应的产物,并释放出氧气。
这些反应可以被利用在化学工业中,如在制备化学品、制备氧气等方面。
根据文献资料,MnO2的分解温度在不同条件下有所变化。
一项研究表明,在常压下,MnO2的分解温度在500℃左右,而在高压下,该温度可以降低至300℃以下。
这表明MnO2的分解温度受压力的影响较大。
另一项研究指出,在氮气流动条件下,MnO2的分解温度为580℃,而在空气中,该温度可以降低至450℃左右。
这表明气氛的不同也对分解温度有一定影响。
在实际应用中,MnO2的分解温度往往通过实验测定得到。
一种常用的方法是热重分析法。
热重分析仪可以在控制升温速率的条件下测量样品的质量变化。
通过观察样品质量的变化曲线,可以确定MnO2的分解温度。
总之,MnO2的分解温度与其晶体结构、化学性质和环境条件密切相关。
通过研究和实验测定,可以确定不同条件下的MnO2分解温度,这对于了解和应用MnO2具有重要意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二氧化锰晶型转变研究郭学益,刘海涵,李栋,田庆华,徐刚中南大学冶金科学与工程学院,湖南长沙 (410083)E-mail:haihanshiye@摘要:采用热处理方式对γ-MnO2晶型转变进行了研究,考察了温度和时间对γ-MnO2晶型转变的影响。
由XRD射线衍射图谱发现,MnO2开始由γ晶型向β晶型的转变温度为300℃,350℃下热处理20小时能够完全转变成β-MnO2;在450℃下热处理5-20小时可完全转化为β-MnO2;在560℃下热处理2小时出现Mn2O3,热处理20小时后,Mn2O3含量将达到75.63%。
因此,MnO2晶型转变的主要影响条件是温度。
关键词:γ-MnO2;β-MnO2;晶型转变;热处理中图分类号:TQ026.8 文献标识码:A0. 前言二氧化锰有着较为复杂的晶型结构,如α、β、γ等五种主晶及30余种次晶[1],而其作为电池的正极材料及电容器阴极材料又需要不同的晶型结构,因此需要深入理解二氧化锰晶型转变机制。
通常MnO2的活性随其所含结晶水的增加而增强,结晶水能促进质子在固体相中的扩散,因此γ-MnO2是各种晶型MnO2中活性最佳的。
但在非水溶液中,MnO2所含的结晶水反而会使它的活性下降。
如在Li-MnO2电池正极材料中,以α-Mn02性能最差,含少量水分的γ-MnO2较差,无结晶水的β-MnO2较好,γβ-MnO2(混合)最好。
所以γ-MnO2在作为阴极材料之前,必须对其进行热处理,并且要除去水分,使晶型结构从γ-MnO2转变为γβ-MnO2相(混合,以β相含量为65%~80%为最优) [2-8]。
再者,在固体钽电解电容器的阴极材料也是二氧化锰。
由于它的电化学性能很大程度上决定于阴极,因此对二氧化锰要求很高,二氧化锰必须全部为β晶型,同时对其含量、粒度、比表面积、导电率等都有较高的要求[9-11]。
β-MnO2在电池及电容器上有着越来越广泛的应用,国内也开始对γ-MnO2和β-MnO2之间的晶型转变进行研究,但是都集中在将γ-MnO2转化成γβ-MnO2[12-14],而对于国内用量很大的固体钽电容器阴极用β-MnO2粉末的研究几乎没有。
本文主要研究γ-MnO2与β-MnO2之间的晶型转变机制。
1. 样品制备与检测设备1.1 γ-MnO2热处理样品的制备将γ-MnO2(湘潭电化集团产品电解二氧化锰)置于真空干燥箱中于70℃,0.05MPa真空度下干燥2小时。
取一小勺干燥的电解二氧化锰粉末,放入小瓷舟(30×60)内,铺满小瓷舟1~2mm,在SK—Ⅱ管式电阻炉内加热,采用WZK可控硅温度控制器控制温度,在空气℃的速度升温,升到指定温度后,调整加热电压,进行保温。
热处理过程气氛下,以10/min完成后,在室温下冷却,装样检测分析。
1.2分析表征-1-采用美国SDT Q600型同步热分析仪对试样进行热重-差热分析,温度测试范围为室温至800℃,升温速率10 /min ℃,空气气氛,空气流量为50ml/min ;采用日本理学Rigaku 3014型X-ray 衍射仪对热处理后的二氧化锰试样进行物相分析。
2. 结果与讨论2.1 γ-MnO2的DSC -TGA 分析及X -射线衍射结果203040506070805001000150020002500300035004000450050005500600065007000I n t e n s i t y (C p s )2θAB0100200300400500600700800900889092949698100DSCTGW e i g h t (%)Temperature(℃)T e m p e r a t u r e D i f f e r e n c e (μV )图1 γ-MnO2的DSC-TGA 图 图2 MnO2热处理前后的XRD 图谱Fig.1 DSC-TGA of γ-MnO2 Fig.2 X-ray diffraction pattern of untreated and treated EMD图1是实验试样γ-MnO 2的DSC-TGA 曲线,由图可以看出,在温度从室温上升到450℃的过程中,TG 曲线连续下降,表明样品在温度低于450℃的失重是一个连续的过程。
样品在560℃前后重量直线下降,此时发生分解反应,有失重现象发生。
试样在110℃时先脱去吸附水,然后再逐步脱去结合水,升至450℃时,此时的MnO 2已经全部转变为β-MnO 2。
试样在560℃前后失重率为8.225%,这与MnO 2分解生成Mn 2O 3以及生成的O 2的理论失重率8.275%较为一致,证明确实发生如下反应:2MnO 2 → Mn 2O 3 + 1/2O 2↑如图1所示,DSC 曲线具有两个强烈的吸热峰和一个较弱的放热峰。
曲线在110℃左右呈现一强烈的吸热峰,这是因为升温使试样中的吸附水蒸发,吸收大量的热量所致;在300℃出现小小的放热峰,这是由于试样开始进行晶型转变放热,同时又要抵消掉部分结合水蒸发所需要的热量,因此,放热峰不明显;在560℃有一个强烈的吸热峰是因为试样在此温度发生分解反应,吸收大量热量而成[15]。
2.2样品的高温相变过程X 射线衍射是确定MnO 2晶体结构的一种有效方法。
试验原料电解二氧化锰EMD 的XRD 衍射图谱如图2中A 图谱,由图可知,在2θ为22.64、34.68、37.22、38.88、56.60、57.08、65.60、68.90处附近出现了γ-MnO 2的衍射特征峰,各衍射峰的位置(2θ)、峰强(I )及半峰宽(d )与γ-MnO 2标准PDF 卡片的对应值完全一致,表明试验原料为γ-MnO 2。
B 图谱为经过450℃、10小时热处理后的MnO 2图谱,由图可知,其衍射特征峰与γ-MnO 2相比有一定偏移,-2-尤其在2θ为28.60、41.00、42.72、72.74处附近出现了β-MnO2的衍射特征峰,证明经过本实验热处理后的γ-MnO2已经完全转变成β-MnO2。
图3 不同条件下热处理后的EMD的 XRD谱图Fig.3 XRD patterns of EMD at different treat condition热处理温度及时间a:450℃,10h b:450℃,15hc:450℃,20h d:560℃,5h e:560℃,20h f:450℃,10h g:350℃,10h从图3不同温度条件下处理MnO2样品所得的XRD图谱可以看出,在对比1中, 450℃热处理条件下,不同热处理时间所得到的XRD衍射图谱的特征峰位置相同,只是在峰强和峰宽上有所差别,与β-MnO2的衍射图谱一一对应,证明所得产物为β-MnO2。
从图谱a、b、c 中可以看到,随着热处理时间的延长,生成的β-MnO2产物的X射线衍射峰变强变窄,分裂现象减弱,对称性增强,说明晶胞变得更完整,晶体结构更趋于有序,晶体结晶性能越好。
这是因为延长热处理时间,一方面是加热更加充分,使γ-MnO2能够充分吸收晶型转变所需的能量;另一方面热处理时间延长,有利于β-MnO2晶体的生长,使β-MnO2产物结晶更完整。
在560℃条件下,XRD谱图出现了新的特征峰。
从图谱d中可以看到,在2θ为32.87、56.66处出现了Mn2O3的特征峰,并且原来的β-MnO2特征峰开始减弱。
随着热处理时间的延长,β-MnO2的特征峰慢慢消失,而Mn2O3的特征峰开始变强,这与热重差热分析的结果完全一致。
可以根据XRD谱图定量计算出Mn2O3的含量,如图4所示,由XRD谱图可以确定该样品只存在β-MnO2和Mn2O3,参照PDF卡片得到β-MnO2的RIR值为2.7,Mn2O3的RIR值为4.5。
再根据XRD谱图列出各物相阀值的具体数据,如下表1。
算出每个阀值各物相的含量比例,根据峰高求出的平均值为β-MnO2含19.7%,Mn2O3含80.3%;根据峰面积求出的平均值为β-MnO2含28.6%,Mn2O3含71.4%。
最终得出Mn2O3含量为75.63%。
其它Mn2O3含量依次类推。
-3-表1 X 射线衍射物相定量分析Table 1 Quantitative analysis from XRD patterns物相\阀值(%) 0 10 20 30 40 50 60 70 平均用于定量匹配的衍射线数β-MnO 27 6 6 6 4 3 2 1 Mn 2O 322 6 3 1 1 1 1 1 各物相的含量(%) 用于定量匹配的衍射线强度——峰高值 β-MnO 221.8 24.224.326.515.512.415.3 17.8 19.7Mn 2O 378.2 75.875.773.584.587.684.7 82.2 80.3各物相的含量(%) 用于定量匹配的衍射线强度——峰面积β-MnO 226 32.132.936.326.122.326 26.7 28.6Mn 2O 374 67.967.163.773.977.774 73.3 71.40102030405060708090100M n 2O 3/%heat treatment/h2030405060708005000100001500020000250001 - Mn2O32 - MnO222221 21 1 111 111 1 111I n t e n s i t y (C p s )2θ1图4 560℃,20小时热处理后的EMD 的XRD 图 图5 560℃,不同热处理时间下Mn 2O 3的含量Fig .4 X-ray of treated EMD at 560℃,20h Fig .5 560, the content of Mn ℃2O 3 at different heattreatment time当在560℃加热20h 后,Mn 2O 3的含量达到75%以上。
图5为在560℃加热条件下,Mn 2O 3的含量曲线图,从图可以看出,Mn 2O 3含量与热处理时间呈线性关系。
试样在经过2小时热处理后,Mn 2O 3含量为2.64%;当经过10小时热处理后,Mn 2O 3含量占到了36.13%;当热处理20小时后,产品中的主要成分为Mn 2O 3,达到了75.63%。
在对比2中,分别为350℃、400℃热处理10小时条件下样品的XRD 衍射图谱。
由图可知,两条图谱中各衍射峰的位置均相同,证明所得样品均为β-MnO 2。
通过对这两条图谱的具体数据的比较分析得出:在400℃下的图谱衍射峰更窄更强,说明同样的处理时间内,升高温度,所得β-MnO 2的晶体结构更加完整,结晶度更高[16]。
3. 结论(1) γ-MnO 2在热处理过程中的变化过程为:γ-MnO 2→β-MnO 2→Mn 2O 3→Mn 3O 4,本实验研究发现:从350℃开始到450℃之间,在适当的热处理时间(5~20小时)下,γ-MnO 2可以完全转化为β-MnO 2。
