元素周期表(25页166题)
元素周期表精讲精练与习题
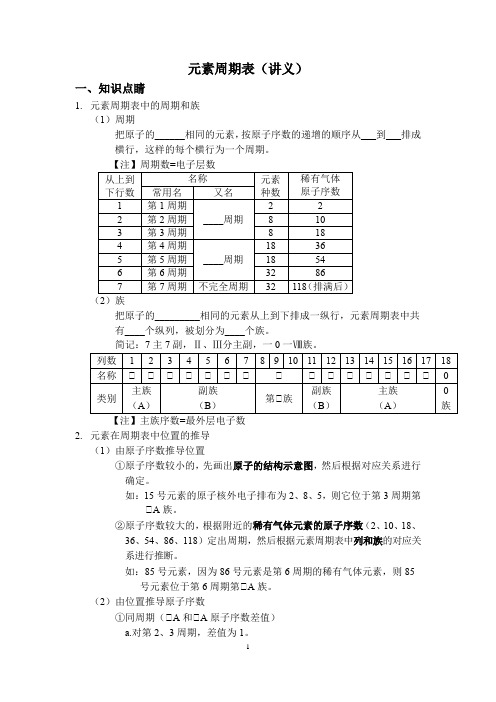
元素周期表(讲义)一、知识点睛1.元素周期表中的周期和族(1)周期把原子的______相同的元素,按原子序数的递增的顺序从___到___排成横行,这样的每个横行为一个周期。
【注】周期数=电子层数(2)族把原子的_________相同的元素从上到下排成一纵行,元素周期表中共有____个纵列,被划分为____个族。
简记:7主7副,Ⅱ、Ⅲ分主副,一0一Ⅷ族。
【注】主族序数=最外层电子数2.元素在周期表中位置的推导(1)由原子序数推导位置①原子序数较小的,先画出原子的结构示意图,然后根据对应关系进行确定。
如:15号元素的原子核外电子排布为2、8、5,则它位于第3周期第ⅠA族。
②原子序数较大的,根据附近的稀有气体元素的原子序数(2、10、18、36、54、86、118)定出周期,然后根据元素周期表中列和族的对应关系进行推断。
如:85号元素,因为86号元素是第6周期的稀有气体元素,则85号元素位于第6周期第ⅠA族。
(2)由位置推导原子序数①同周期(ⅠA和ⅠA原子序数差值)a.对第2、3周期,差值为1。
b.对第4、5周期,差值为11。
c.对第6周期,差值为25。
②同族a.对ⅠA或ⅡA,相邻周期原子序数之差为前者周期元素种数。
如:第3、4周期第ⅠA元素的原子序数差值为8b.对ⅢB—0族,相邻周期原子序数之差为后者周期元素种数。
如:第3、4周期第ⅢA元素的原子序数差值为18二、精讲精练1.下列元素中,不属于短周期元素的是()A.氮B.钠C.钙D.磷2.下列元素属于第ⅠA族的是()A.氟B.铍C.氢D.铝3.元素周期表中位于第2纵列的元素在第_______族;元素周期表中位于第8纵列的元素在第_______族;元素周期表中第ⅠA族的元素在______纵列;元素周期表中第ⅥB族的元素在______纵列;元素周期表中0族元素在______纵列。
4.下列关于元素周期表的叙述正确的是()A.元素周期表中有7个周期,18个族B.由短周期元素和长周期元素共同构成的族一定是主族C.元素周期表共7个周期,其中1~4为短周期D.元素周期表中零族元素的单质全部是气体5.下列关于元素周期表的叙述正确的是()A.短周期元素是指1~20号元素B.元素周期表中,最长的周期含有18种元素C.所有族中,第ⅠB族元素最多,共有32种元素D.元素周期表共16个族,包含7个主族、8个副族和0族6.某元素的原子序数为16,则它在元素周期表中位于()A.第2周期,第ⅣA族B.第2周期,第ⅤA族C.第3周期,第ⅣA族D.第3周期,第ⅥA族7.X+的核外每层的电子排布为2、8、8,则X元素在周期表中的位置是()A.第3周期,0族B.第3周期,第ⅠA族C.第4周期,第ⅠA族D.第4周期,第ⅠB族8.请判断下列元素在元素周期表中的位置。
初中化学元素周期表经典综合大题练习卷

初中化学元素周期表经典综合大题练习卷
1. 下面关于元素周期表的说法正确的是什么?
A. 元素周期表是元素按一定规律排列形成的表格
B. 元素周期表纵向的列称为族,横向的行称为周期
C. 元素周期表的第1行是1个元素,第2行是2个元素,以此类推
D. 元素周期表中元素按照原子量从小到大排列
()
2. 元素周期表中,下列元素符号和名称匹配正确的是()
A. C:氢
B. H:氧
C. O:碳
D. Ca:钙
3. 下列属于金属元素的是()
A. 钠
B. 铁
C. 硫
D. 氯
4. 没有稳定同位素的元素是()
A. U
B. C
C. Cl
D. P
5. 根据元素周期表中元素位置及其化学性质,下列元素中,最容易发生化学变化的是()
A. 冠状病毒
B. 氧气
C. 蔗糖
D. 金属铝
6. 铜是一种常见的金属,铜最外层电子的排布情况是()
A. 1个S电子,1个D电子,1个P电子
B. 1个S电子,1个P 电子,2个D电子
C. 1个S电子,2个P电子,1个D电子
D. 1个S电子,2个D电子
7. 下列物质中能导通电的是()
A. 纯净水
B. 纯净酒精
C. 食盐水
D. 纯净石蜡
答案:
1. A
2. C
3. A、B
4. C
5. B
6. B
7. C。
第九节 元素周期表和元素周期律(打印)

第九节元素周期表和元素周期律一.原子结构原子序数= = =在阳离子中:数 > 数;在阴离子中:数 > 数二.元素周期表的结构1.元素周期表的编排原则按的顺序从左到右排列;将的元素排成一个横行;把的元素(个别例外)按的顺序从上到下排成纵行。
2.元素周期表的结构(1)横行:每一横行称为一个。
其中第周期中包含的元素数目较少,叫做;第周期中包含的元素数目较多,叫做。
(2)纵行:个纵行构成个族。
三.质量数1.质量数()= ( )+ ( )2.符号:表示1个为Z,为A的原子,中子数为.四.同位素相同而不同的同一元素的不同原子互称为同位素,即同一元素的不同互称为同位素.如.和三种核素都是的同位素。
【巩固练习】1.19世纪中叶,门捷列夫的突出贡献是 ( )A.提出原子学说B.发现元素周期律C.提出分子学说D.发现氧气2.关于Hf18572说法正确的是()A.该元素的原子序数是72 B.该元素的原子序数是113C.该元素是一种新原子D.该元素是一种新元素3.据报导,1994年12月科学家发现了一种新元素,它的原子核内有161个中子,质量数272该元素的原子序数为() A.111 B.161 C.272 D.433五、元素周期律:1.元素的金属性:在同一周期,由左到右,元素的金属性___________;在同一主族,元素的金属性。
可以通过:和比较元素金属性强弱。
2.元素的非金属性:在同一周期,由左到右,元素的非金属性____________。
可以通过:和比较元素非金属性强弱。
3.原子半径,同一周期______________________,同一主族_______________________。
4.以上变化的根本原因是______________________________ 。
【巩固练习】1.从原子序数11依次增加到17,下列所叙递变关系错误的是( )A.电子层数逐渐增多 B.原子半径逐渐增大C.最高正价数值逐渐增大 D.从硅到氯负价从-4-12.原子序数从3~10的元素,随着核电荷数的递增而逐渐增大的是( ) A..电子层数B..电子数 C..原子半径D..化合价3.某元素气态氢化物的化学式为H2X,则此元素最高氧化物水化物的化学式应是 ( ) A.H2XO3 B.H2XO4 C.H3XO4 D.H6XO64.下列各含氧酸中,酸性最强的是 ( )A.H3PO4 B.H2SO4 C.HClO4 D.HBrO45.下列各组按碱性依次减弱顺序排列的是:( )A.LiOH、NaOH、CsOH B.Ba(OH)2、Ca(OH)2、Mg(OH)2C.Ca(OH)2、KOH、Ba(OH)2 D.Al(OH)3、Mg(OH)2、NaOH6.用元素符号回答原子序数11~18号的元素的有关问题(1)除稀有气体外,原子半径最大的是。
元素周期表讲义和习题.doc

元素周期表一、元素周期表1.原子序数:(1).含义:O(2).原子序数== =2.元素周期表的编排原则(1)将的元素按的顺序从左到右排成横行(2 )把的元素按的顺序从上到下排成纵行3.周期表的结构(1)周期:元素周期表共有个横行,每一横行称为一个,故元素周期表共有—个周期周期序数与电子层数的关系: _____________________________________________周期的分类:元素周期表中,我们把1、2、3周期称为短周期,其他周期称为长周期,完成下表内容。
类别周期序数起止元素包括元素种数核外电子层数短周期123长周期456不完全周期7[思考]:如果第七周期排满后,应有几种元素?(2)族:元素周期表共有—个纵行,除了二个纵行称为例外,其余的每一个纵行称为一个,故元素周期表共有个族。
族的序号一般用罗马数字表示。
①族的分类元素周期表中,我们把18个纵行共分为16个族,其中7个主族,7个副族,一个零族,一个第伽族。
a、主族:由元素和元素共同构成的族,用A表示:如:I A、IIA、IIIA、IVA、VA> VIA> VUAb、副族:完全山长周期元素构成的族,用B表示:IB、IIB、IIIB、IVB、VB、VIB、VDBc、第MH族:三个纵行(注意:第Vffl族既不是主族也不是副族)d、零族:第纵行,即稀有气体元素主族序数与最外层电子数的关系:____________________________________________________ 族的别称如I A称为元素VDA称为元素零族称为元素[随堂练习]1.画出具有下列原子序数的元素原子结构示意图,并指出其在周期表中的位置。
9、16、14、5、18二、元素的性质和原了结构1、碱金属元素(1)结构从锂一锚:相同点:最外层电子数均为不同点:随着核电荷数的增多,电子层数,, 原子半径(2)化学性质通过实验:对比钠、钾与氧气和水的反应钾钠与氧气反应现象化学方程式与水反应现象化学方程式结论相似性:都能与 _________ 、__________ 等发生反应递变性:随着核电荷数的增加,元素的_____________ 性逐渐增强注意:比较元素金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度,以及它们的最高价氧化物的水化物的碱性强弱来比较(3)物理性质相似性:除Cs略带金属光泽外,其余的都是____________ 色,它们都比较,有性.密度都比较,熔点也都比较,导电性和导热性也都.递变性:随核电荷数的增多,碱金属的密度逐渐,熔、沸点逐渐.思考:锂和钾的保存方法?______________________________________________________随堂练习:1.下列金属与水反应最剧烈的是A. LiB. KC. RbD. Cs2.钠和锚都是碱金属元素,下列关于锚及其化合物的叙述中不正确的是A.硫酸锚的化学式为Cs2SO4B.氢氧化锚是一种强碱C.锚的熔沸点比钠的低D.碳酸锚受热易分解成氧化锚和二氧化碳2.卤族元素(1)卤素的原子结构特点从氟至碘:相同点:最外层电子数.不同点:随着核电荷数的递增,电子层数逐渐(2)卤素单质的物理性质:从F2-I2颜色逐渐,密度逐渐,熔沸点逐渐.(3)化学性质:表(_)卤素单质与玦反应F2C12Br2I2相似性递变条件剧烈程度逐渐 ___________________________ 产物的稳定性逐渐 ___________________________表(二)卤素单质间的置换反应总结:从F-L原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱,因此,氏、%、Br2. I2的氧化性依次减弱。
元素周期表 练习+习题课 附答案

高一第一章第1节《元素周期表》达标演练(分值:100分;时间:30分钟。
)一、选择题(本题共6小题,每题6分,共36分)1.无机化学命名委员会(国际组织)在1989年作出决定:把周期表原先的主、副族号取消,由左到右按原顺序编为18列,如碱金属为第1列,稀有气体为第18列。
按这个规定,下列说法正确的是A.第3列元素种类最多,第14列的化合物种类最多B.每1列都有非金属元素C.从上到下第1列元素的单质熔点逐渐升高,而第17列元素的单质熔点逐渐降低D.只有第2列元素的原子最外层有2个电子2.主族元素在周期表中的位置取决于该元素原子的A.相对原子质量和核外电子数 B.电子层数和最外层电子数C.相对原子质量和最外层电子数 D.电子层数和次外层电子数3.下列4种元素中,其单质氧化性最强的是A.最外电子层上有5个电子的第二周期元素B.位于周期表中第三周期ⅢA族的元素C.原子序数为10的元素D.原子序数为17的元素4.下列各组微粒属同位素的是①1602和1802,②H2和D2,③168O和1880,④1H2180和2H216O,⑤3517Cl和3717ClA.①②B.③⑤C.④D.②③5.某元素一种同位素原子的质量数为m,中子数为n,则下列说法正确的是A.不能由此确定该元素的相对原子质量B.这种元素的相对原子质量为mC.(m + n)可写在该元素符号的左上角D.核内中子的总质量小于质子的总质量6.重水a与普通水b分别跟足量的金属钠反应,下列叙述正确的是A. a、b的质量相等时,产生气体的体积在同温、同压下相等B. a、b的质量相等时,产生气体的质量相等C. a、b的物质的量相等时,产生气体的体积在同温、同压下相等D. a、b的物质的量相等时,产生气体的质量相等二、填空题(本题共4小题,每空3分,共64分)1、元素周期表中有个周期,短周期指周期;有个族。
氯元素位于元素周期表中的周期,族。
2、在同一主族中,从上到下,原子序数逐渐,原子半径逐渐,失电子能力逐渐,得电子能力逐渐,金属性逐渐,非金属性逐渐。
元素周期表及元素周期律习题课共26页文档

元素周期表及元素周期律习题课
36、“不可能”这个字(法语是一个字 ),只 在愚人 的字典 中找得 到。--拿 破仑。 37、不要生气要争气,不要看破要突 破,不 要嫉妒 要欣赏 ,不要 托延要 积极, 不要心 动要行 动。 38、勤奋,机会,乐观是成功的三要 素。(注 意:传 统观念 认为勤 奋和机 会是成 功的要 素,但 是经过 统计学 和成功 人士的 分析得 出,乐 观是成 功的第 三要素 。
39、没有不老的誓言,没有不变的承 诺,踏 上旅途 ,义无 反顾。 40、对时间的价值没有没有深切认识 的人, 决不会 坚韧自命不凡。——邓拓 12、越是无能的人,越喜欢挑剔别人的错儿。——爱尔兰 13、知人者智,自知者明。胜人者有力,自胜者强。——老子 14、意志坚强的人能把世界放在手中像泥块一样任意揉捏。——歌德 15、最具挑战性的挑战莫过于提升自我。——迈克尔·F·斯特利
(完整版)元素周期表及元素周期律练习题答案
元素周期表及元素周期律1. 元素X、丫、Z原子序数之和为36, X、丫在同一周期,X+与Z2—具有相同的核外电子层结构。
下列推测不正确的是()。
A. 同周期元素中X的金属性最强B. 原子半径X>丫离子半径X+ >Z2—C. 同族元素中Z的氢化物稳定性最高D. 同周期元素中丫的最高价含氧酸的酸性最强【解析】井析题给条件可推知:X是钠觸、¥是轨口)、£是氧⑹。
原子半徑但F■血J与芒W)电子层结枸相同』寓子半g 曲乙【答和B【点评】在周期表中,元素的原子序数差因周期表结构出现以下两种情况:(1)同主族,相邻周期元素原子序数之差的判断。
①第I A、n A族元素,相差上一周期元素所在周期所含元素的种数。
②第川A〜%A族元素,相差下一周期元素所在周期含有的元素的种数。
(2)同周期相邻主族元素原子序数之差的判断。
①I A、n A元素或M A〜%A相邻元素相差1。
②n A、川A元素:若为第二或第三周期则相差1,若为第四或第五周期相差11,若为第六或第七周期则相差25。
2. A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2—和C—, B2+和C—具有相同的电子层结构。
下列说法正确的是()。
A. 原子序数:A<B<CB. 原子半径:A>B>CC. 离子半径:A2 —>C— >B2+D. 原子核外最外层电子数:A>C>B【解析】严和L具有相同电子层結村说明R的原子序数大于®而具有相同电子层结构的粒子』都杲随橈电荷如博子序数)的增扣而粒子半径减小所以由于□在C的下一周期,且A的最低价离子为A二所以原子序数:直孑半胫:原子半轻;3>A>C,原子的最外层电子数不可能为直【答案肮3. 在以离子键为主的化学键中常含有共价键的成分。
下列各对原子形成化学键时共价键成分最少的是()A. Li, FB. Na,FC. Na,ClD. Mg,Or【解折】越活泼的金属与越活泼的非金属化合^越易形成离子键,所形成的代学键中合有鎭裕锥越少。
元素周期表
河北考源书业有限公司
第23页
返回导航
第 1章 第 2节
第2课时
名师一号 · 高中同步学习方略 · 鲁科版 · 化学 · 必修2
位置:副族、Ⅷ族 原子最外层电子数为1~2,能失电子, 3.过渡 是金属元素 元素 单质性质:导电,多数比较稳定,坚硬, 有光泽
(2)周期
现在的长式元素周期表共有七个横行,一个横行
就是一个周期,从上到下依次命名为第1周期、第2周期„„第 7周期。
河北考源书业有限公司
第18页
返回导航
第 1章 第 2节
第2课时
名师一号 · 高中同步学习方略 · 鲁科版 · 化学 · 必修2
河北考源书业有限公司
第 1章 第 2节
第2课时
名师一号 · 高中同步学习方略 · 鲁科版 · 化学 · 必修2
二、常见几类重要元素的特点 位置:ⅡA族,2~7周期 所含元素:铍Be、镁Mg、钙Ca、 锶Sr、钡Ba、镭Ra 原子最外层电子数为2,易失2个电子, 1.碱土 显+2价 金属 存在状态:化合态 元素 单质物理性质:亮白色、导电 用途:Mg制造合金Mg有“国防金属” 美誉;含钙、锶、钡的化合物用于 制造焰火
河北考源书业有限公司
第26页
返回导航
第 1章 第 2节
第2课时
名师一号 · 高中同步学习方略 · 鲁科版 · 化学 · 必修2
2.如果原子序数较大可利用0族元素的原子序数进行推 断,其方法是: 首先,明确各周期0族元素的原子序数。 周期数 0族元素的 原子序数 1 2 3 4 5 6 7
河北考源书业有限公司
第24页
返回导航
第 1章 第 2节
第2课时
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第 1 页 共 25 页 元素周期表 A组 1.在下列元素中,不属于主族元素的是 A 磷 B 铁 C 钙 D 碘 2.在短周期元素中,原子最外电子层只有1个或2个电子的元素是 A 金属元素 B 稀有气体元素 C 非金属元素 D 无法确定为哪一类元素 3.下列说法中,正确的是 A 周期表中的主族都有非金属元素 B 周期表中的主族都有金属元素 C 周期表中的非金属元素都位于短周期 D 周期表中的非金属元素都位于主族和0族 4.推测第八周期的最终未了元素的原子序数是 A 168 B 176 C 170 D 169 5.从元素周期表中每一周期最后一个元素的原子序数为2、10、18、36、54……,推测第十周期最后一个元素的原子序数为 A 200 B 770 C 290 D 292 6.同一主族的两种元素的原子序数之差不可能是 A 16 B 26 C 36 D 46 7.在周期表中,已知:①第n周期最多可容纳的元素种数为(n+1)2/2或(n+2)2/2,n=1、2、3,②各周期中元素的种数都是偶数。若科学上发现或合成出质子数为175的元素,则该元素在周期表中可能存在的位置是 A ⅡB族 B 第八周期 C ⅥA族 D 第九周期 8.第二周期的元素与氢元素所形成的常见的分子和阳离子中,电子总数为10的共有 A 7种 B 6种 C 5种 D 4种 9.周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是 A 电子数 B 最外层电子数 C 电子层数 D 次外层电子数 10.在周期表的前20号元素中,某两种元素的原子序数相差3、周期数相差1,它们形成化合物时原子个数之比为1︰2,则这两种元素不可能 A 钠和氧 B 钙和氯 C 镁和氟 D 硫和氧 11.同主族两种元素原子核外电子数差值可能为 A 6 B 12 C 26 D 30 12.在元素周期表中的短周期元素中,原子最外层电子数与其电子层数之比为1:1,2︰1,3︰1的元素共有 A 4种 B 5种 C 6种 D 7种 13.在短周期元素中,若某元素最外层电子数与电子层数相等,则下列有关叙述正确的是 A 符合条件的元素只有一种 B 符合条件的元素有两种 C 符合条件的元素有三种 D 符合条件的元素有六种 第 2 页 共 25 页
14.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是 A 半导体材料砷化镓 B 吸氢材料镧镍合金 C 透明陶瓷材料硒化锌 D 超导材料K3C60 15.有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是 A HF B H3O+ C NaH D H2O2 16.X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是 A X原子的电子层数比Y原子的电子层数多 B X的氢化物的沸点比Y的氢化物的沸点低 C X的气态氢化物比Y的气态氢化物稳定 D Y的单质能将X从NaX的溶液中置换出来 17.某主族元素R的最高正化合价与负化合价的代数和为4,下列有关叙述正确的是 A R一定是第四周期元素 B R的气态氢化物分子式为H2R C R的气态氢化物比同周期其他元素的气态氢化物稳定 D R的气态氢化物的水溶液显碱性 18.A、B是周期表中相邻两主族的两种元素,若A的原子序数为a,以下不可能是B的原子序数是 A a-17 B a-7 C a+18 D a+19 19.X和Y是短周期元素,两者能组成化合物X2Y3,已知X原子序数为n,则Y的原子序数不可能是 A n+11 B n+3 C n-5 D n-6 20.短周期元素X和Y能形成XY4,若X的原子序数为m,Y的原子序数为n,则m和n不可能的关系 A m-13=n B n+5=m C n-11=m D m+8=n 21.有A、B两种主族元素,A的原子序数为n,A2+比B2-少8个电子,则B的原子序数是 A n+4 B n+6 C n+12 D n-4 22.短周期元素x和y可以相互形成化合物x2y,那么x和y所在族的族数之差可能是 A 1 B 3 C 4 D 5 23.有两种短周期元素X 和Y可组成化合物XY3,当Y的原子序数为m时,X的原子序数可能为:①m-4 ②m+4 ③m+8 ④m-2 ⑤m+6 A ①②③④⑤ B ①②④⑤ C ①②⑤ D ①③④ 24.有两种短周期元素X和Y可组成化合物XY3,当Y的原子序数为m时,X的原子序数可能为:①m-4;②m+4;③m+8;④m-2;⑤m+6 A ①②③④⑤ B ①②④⑤ C ①②⑤ D ①③④ 25.二种短周期元素组成的化合物中,原子个数比为1︰3,若二种元素的原子序数分别为a和b,则a、b的关系可能是 第 3 页 共 25 页
①a=b+5 ②a+b=8 ③a+b=30 ④a=b+8 26.某周期的IA族元素的原子序数为x,和它同周期的ⅢA族元素的原子序数可能是 ①x+2 ②x+19 ③x+12 ④x+18 ⑤x+26 ⑥x+11 A 只有②④⑥ B 只有①③⑤ C 只有①② D 全部 27.在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是 A XY3晶体一定是离子晶体 B 若Y的原子序数为m,X的原子序数一定是m±4 C X和Y一定不属于同一主族 D X和Y可用于同一周期,也可用于两个不同周期 28.X、Y是短周期元素,它们可组成化合物XY,则下列说法正确的是 A XY晶体一定是离子晶体 B 若Y的原子序数为m,X的原子序数一定是m±6 C X、Y可以属于同一周期,也可居于两个不同周期 D X与Y一定不属于同一主族 29.下列对各种元素的叙述中,可肯定是主族元素的是 A 最高正价为+7价的一种元素 B 除了最外层,原子核外其他各电子层都达到饱和的一种元素 C 原子核外N层比M层少8个电子的一种元素 D 原子核外L层比M层多3个电子的一种元素 30.短周期元素X、Y的原子序数相差2。下列有关叙述正确的是
A X与Y不可能位于同一主族 B X与Y一定位于同一周期 C X与Y可能形成共价化合物XY D X与Y可能形成离子化合物XY 31.甲、乙两元素原子的L层电子数都是其它层电子总数的2倍。下列推断正确的是
A 甲与乙处于同一周期 B 甲与乙处于同一主族 C 甲与乙的单质都是原子晶体 D 甲与乙的原子序数之和为偶数 32.根据中学化学教材所附元素周期表判断,下列叙述不正确的是 A K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 B L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 C L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 D M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等 33.主族元素A的最高氧化物分子式为A2O5,B元素比A元素核电荷数多2个正电荷,B元素的最高价氧化物水化物的溶液能使石蕊试液 A 变红色 B 变蓝色 C 不变色 D 变红色或不变色 34.X、Y两元素原子的L层电子数都等于它们的其它层电子数之和。下列推断正确的是 A X与Y可能处于同一周期 B X与Y可能处于同一主族 C X与Y的单质不是分子晶体就是原子晶体 D 若X的原子序数大于Y的原子序数,则X可形成不同价态的氧化物 第 4 页 共 25 页
35.能形成A2B化合物的一组元素是 A 原子序数分别是3和17的元素 B 原子序数分别是12和8的元素 C 核电荷数分别为11和16的元素 D 核电荷数分别为13和17的元素 36.根据硼元素在元素周期表中的位置,推测硼的最高价的含氧酸分子式不可能的是 A H2BO4 B H3BO3 C HBO3 D H2B4O7 37.下列有关元素周期表的叙述正确的是 A 原子半径最小的是F B 所含元素种类最多的族为第Ⅷ族 C 金属元素的种类多于非金属元素 D 第n周期第n主族的元素均为金属 38.下列有关推断中符合实际的是 A 第n周期中有2n2种元素 B 第n周期第n族(n>1)的元素一定是金属元素 C 第n周期中有(8-n)种非金属元素(n>1包括稀有气体元素) D 第n周期第n族的元素一定是非金属元素 39.下列叙述正确的是 A 同一主族的元素,原子半径越大,其单质的熔点一定越高 B 同一周期元素的原子,半径越小越容易失去电子 C 同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高 D 稀有气体元素的原子序数越大,其单质的沸点一定越高 40.有关元素周期表的说法不正确的是 A 0族元素形成的晶体都是分子晶体 B 过渡元素全部是金属元素 C 同周期元素(不含稀有气体)随着原子序数递增,原子半径依次减小 D 周期表中ⅠA族所含元素最多 41.下列有关短周期元素的叙述中,肯定正确的是 A 原子最外层电子只有1个或2个的元素是金属元素 B 16号元素原子的最外层电子数是4号元素原子最外层电子数的四倍 C 11号元素与17号元素能形成XY2型化合物 D 136C表示碳的原子核内有6个质子、7个中子 42.下列说法中,正确的是 A 元素的原子序数越大,其原子半径也越大 B 最外层电子数为8的粒子是稀有气体元素的原子 C 在周期表里,主族元素所在的组序数等于原子核外电子数 D 在周期表里,元素所在的同期数等于族元素原子核外电子层数 43.下列说法正确的是 A 非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价 B 只有非金属能形成含氧酸或含氧酸盐 C 除稀有气体外的非金属元素都能生成不同价态的含氧酸 D 非金属的最高价含氧酸都具有强氧化性 44.根据门捷列夫长式元素周期表的规律回答: (1)如有第八周期并排满,则此周期将有 种元素。
