第3章 立体化学.1
配合物的空间结构表1配位数和配合...

存在形式:气相(离子对)Ti(I), In(I), Ga(I), Cu(I), Ag(I) 配体:体积庞大Ga[C(SiMe 3)3], 2,4,6-三苯基苯基合铜(I)(2,4,6-triphenylphenylcopper 三苯基苯基合银(I)(2,4,6-triphenylphenylsilver )[(2,6-trip 2C 6HCu(I), Ag(I), Au(I), Hg(II), Mo(IV), U(IV), AgCN, AgSCN, AuI, [UO 2] 2+, [PuO 2]2+, Mn[N(SiMePh2.1 配合物的空间结构3. 配位数3构型:平面三角形金属:d 10组态离子,Cu(I), Au(I), Hg(II), Pt(0)示例:K[Cu(CN)2], [Cu 2Cl 2(Ph 3P)2], [Cu(tu)]Cl, [Cu(SPPh 3)3]ClO 4, [Cu(Me 3PS)Cl]3, [Au(PPh 3)3]+, [AuCl(PPh 3)2], [HgI 3]-, [Pt(PPh 3)3] 注意:MX 3型化合物不一定都是三配位,如:CuCl 3,链状结构-Cl-CuCl 2-Cl-CuCl 2-;AuCl 3,实为Au 2Cl 6,Au Cl AuCl Cl Cl Cl Cl2.1 配合物的空间结构4. 配位数4构型:四面体、平面正方形、畸变四面体四面体:第一过渡系金属[尤其是Fe 3+、Co 2+以及具有球对称d 0、d 5(高自旋)或d 10电子构型的金属离子];碱性较弱或体积较大的配体——价层电子对互斥理论。
如:[Be(OH 2)4]-、[SnCl 4]、[Zn(NH 3)4]2+、Ni(CO)4、[FeCl 4]-等平面正方形:d 8电子组态的Ni 2+(强场)、第二、三过渡系的Rh +、Ir +、Pd 2+、Pt 2+、Au 3+等——晶体场理论。
如:[Ni(CN)4]2-、[AuCl 4]-、[Pt(NH 3)4]2+、[PdCl 4]2-、[Rh(PPh 3)3Cl]等畸变四面体:[CuCl 4]2-、Co(CO)4四面体平面正方形R=异丙基,磁矩=1.8∼2.3B.M.,四面体30 ∼50%R=叔丁基,磁矩=3.2B.M.,四面体95%电子排布:e 4t 24d yz 2d xz 2d z22d xy 2未成对电子数:2 0磁矩(B.M.):3.3 0:ThI2二硫醇根)合铼]dbm=二苯甲酰甲烷单帽八面体2.1 配合物的空间结构7. 配位数7构型:五角双锥(D 5h )、单帽三棱柱(C 2v )、单帽八面体(C 3v );结构互变五角双锥:Na 3[ZrF 7]、[Fe II (H 2O)(H 2edta)]⋅2H 2O 、K 5[Mo(CN)7]⋅H 2O 单帽三棱柱:(NH 4)3[ZrF 7]、Li[Mn(H 2O)(edta)]⋅4H 2O 、[MoI(CNR)6]I 单帽八面体:[MoCl 2(CO)3(PEt 3)2]、(NEt 4)[WBr 3(CO)4]金属:大多数过渡金属,d 0∼d 4畸变五角双锥2(Ac)3]4)4[VO 2(C 2O 4)3]2.1 配合物的空间结构三角十二面体四方反棱柱体dbm=二苯甲酰甲烷[Sm III (H 2O)(dmb )3],七配位[Sm II I 2(dme )3],八配位离子半径:Sm II (1.27Å) > Sm (0.958Å)配体体积:dmb > dmedme = 二甲氧基乙烷dbm=二苯甲酰甲烷单帽八面体畸变六角双锥畸变三角十二面体中心金属半径&配体体积对配位数的影响比较:2.1 配合物的空间结构10. 配位数10构型:双帽四方反棱柱(D 4d )、双帽十二面体(D 2)、十四面体(C 2v )配位数2-12的最重要配位多面体的构型配位数2-12的最重要配位多面体的构型2.2 配合物的异构现象2.2.1 化学结构异构1. 配位异构2. 键合异构——两可配体CoCl BAA CoClCl BBACoClBBA A能垒低可互变[Cr(en)3][Ni(CN)5]⋅1.5H 2O :三角双锥& 四方锥[NiBr 2(EtPPh 2)2]:四面体(顺磁性)& 平面型(抗磁性)H 2H 2H 配体异构)配体的构象异构)配合物的多元异构)手性配合物绝对构型的命名(IUPAC)ΔΛΛΔ选取八面体一对相互平行的合适的三角形平面,以M为中心画投影图,按配合物的确定构型联结双齿配体的螯合物位置。
2-1配合物的立体化学

[Co(en)3]3+
2、旋光异构
四配位 Td点群: MABCD
乳酸
OH
COOH C H CH3
六配位Oh点群: M(L-L)3, cis-M(L-L)2A2, MA2B2C2, MABCDEF eg. [Co(en)3]3+
N N Co N N N N
N N Co N N N N
D (+) Co(en)33+
配合物的异构类型
1、几何异构(geometric isomerism) 2、旋光异构(chiral isomerism)
异构类型
3、键合异构(linkage isomerism) 4、电离异构(ionization isomerism) 5、溶剂合异构(solvate isomerism)
6、配位异构(coordination isomerism)
空间斥力:配体间静电排斥, 与配体大小有关。
立方体场
Oh
四面体场
Td
球形场
八面体场 四方畸变
Oh D4h
平面四方场
D4h
中心离子的电子组态为:d0
d5
d10 d1
d6
通常与弱场配体形成 Td构型配合物。 例如: TiBr4 (d0),
FeCl4- (d5),
ZnCl42- (d10),
VCl4 (d1),
③ 同类配体(同为阴离子或同为中性分子)以配 位原子元素符号英文字母的先后排序。
配位化合物的命名原则:
① 阴离子名称在前,阳离子名称在后,阴、阳离子名称 之间用“化”字或“酸”字相连。此时,配阴离子一 律当含氧酸根看待; ② 配位个体中:配体名称在前,中心原子名称在后;
不同配体名称的顺序同书写顺序,相互之间以中圆点 “”分开,最后一种配体名称之后缀以“合”字;
1,2,3,4,5-戊醇的所有立体异构体

1. 戊醇的定义和性质戊醇是一种有机化合物,化学式为C5H12O,它是戊烷和羟基的衍生物。
戊醇在室温下呈无色液体,具有刺激性气味。
它是一种常用的溶剂,广泛应用于化工、制药、香料等领域。
2. 戊醇的立体异构体根据化学构造的不同,戊醇存在多种立体异构体。
在有机化学中,立体异构体是指分子结构相同但空间构型不同的化合物。
对戊醇来说,它的主要立体异构体有以下几种:3. 顺-戊醇(cis-戊醇)顺-戊醇的化学结构中,羟基(-OH)与戊烷的相邻碳原子上。
它的分子中羟基与有机基的排列方式相对规整,因此它具有独特的物理化学性质。
顺-戊醇在溶剂、表面活性剂等方面有广泛的应用。
4. 反-戊醇(trans-戊醇)反-戊醇的化学结构中,羟基(-OH)与戊烷的相邻碳原子上。
与顺-戊醇不同的是,反-戊醇的羟基与有机基的排列方式相对杂乱,这也导致其物理化学性质与顺-戊醇有所不同。
反-戊醇在一些特定的有机合成反应中有重要的应用。
5. 其他立体异构体除了顺-戊醇和反-戊醇外,戊醇还存在其他一些立体异构体,如环状异构体和手性异构体等。
这些立体异构体在不同领域都具有独特的应用价值,受到化学科研人员的广泛关注。
6. 戊醇立体异构体的性质和应用不同的戊醇立体异构体具有不同的物理化学性质和应用价值。
研究者们通过对戊醇立体异构体的研究,不仅可以深入了解有机化合物的立体构象特征,还可以为其在工业生产、生物医药等领域的应用提供重要的参考。
7. 结语在有机化学中,立体异构体是一个重要而复杂的研究课题。
戊醇作为一种重要的有机化合物,其立体异构体的研究不仅具有理论意义,还具有广泛的实际应用前景。
希望未来能有更多的科学家和研究者投入到戊醇立体异构体的研究中,为化学领域的发展做出更大的贡献。
戊醇作为一种重要的有机化合物,在化工、医药等领域具有广泛的应用。
在这些领域,研究人员对戊醇的立体异构体进行深入的研究,旨在深入了解其物理化学性质,并探索其在实际应用中的潜力。
SN1和SN2反应机制

单分子亲核取代 (SN1反应)
反应速率= k [(CH3)3CBr]
简介
SN2立体化学
SN1立体化学
课堂总结
练习
第三页,编辑于星期五:十点 六分。
sp3
四面体结构
E
Ea
甲基溴
CH3Br + OH-
过渡态
sp3
四面体结构
反应一步完成;
只sp经2 过一个过渡态;
平面结反构应中无中甲间醇体形成。
CH3OH + Br-
外消旋化
简介 SN2立体化学 SN1立体化学
课堂总结
练习
第十一页,编辑于星期五:十点 六分。
知识拓展
问:SN1反应的立体化学特征:产物外消旋化,
? 最后得到的产物会是外消旋体
请查阅相关资料,以小论文的形式对上述问题进行 阐述。
(可参考:《March 高等有机化学》)
简介
SN2立体化学
SN1立体化学
SN1立体化学
课堂总结
练习
第十七页,编辑于星期五:十点 六分。
课堂练习
问:根据下列现象,判断卤代烷与NaCN的乙醇溶液
的反应,指出它们分别属于那种SN反应?
SN2
SN1
SN1
SN2
简介 SN2立体化学
SN1立体化学
课堂总结
练习
第十八页,编辑于星期五:十点 六分。
SN1和SN2反应机制
第一页,编辑于星期五:十点 六分。
分子型亲核试剂 Nu: H2O;ROH;NH3 … OH-;RO-;CN-;X- …
简介 SN2立体化学 SN1立体化学
课堂总结
练习
第二页,编辑于星期五:十点 六分。
立体化学基础1指出下列各对化合物属于哪一种类型的异构2
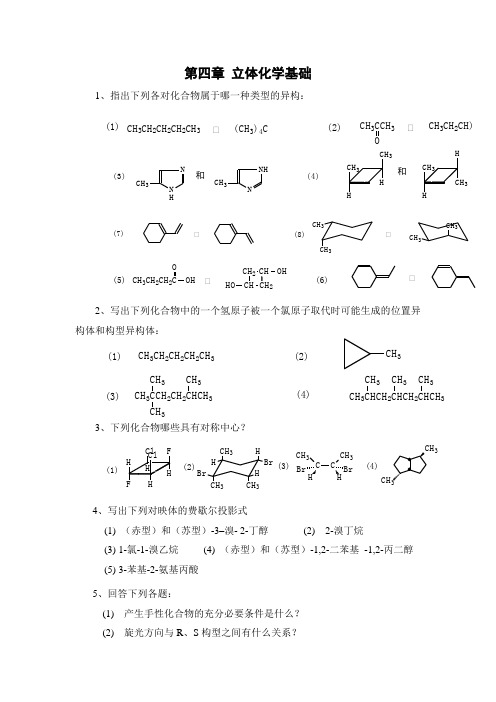
第四章 立体化学基础1、指出下列各对化合物属于哪一种类型的异构:2、写出下列化合物中的一个氢原子被一个氯原子取代时可能生成的位置异构体和构型异构体:3、下列化合物哪些具有对称中心?4、写出下列对映体的费歇尔投影式(1) (赤型)和(苏型)-3–溴- 2-丁醇 (2) 2-溴丁烷(3) 1-氯-1-溴乙烷 (4) (赤型)和(苏型)-1,2-二苯基 -1,2-丙二醇(5) 3-苯基-2-氨基丙酸 5、回答下列各题:(1) 产生手性化合物的充分必要条件是什么? (2) 旋光方向与R 、S 构型之间有什么关系?CH 3CH 2CH 2CH 2CH 3(CH 3)4CºÍ(1)(2)CH 3CCH 3CH 3CH 2CH)ºÍ(7)(8)ºÍºÍCH 3CH 33CH 3(5)(6)ºÍºÍCH 3CH 2CH 2OHOCH 22CH OHHO(3)(1)(4)(2)CH 3CH 2CH 2CH 2CH 3CH 3CH 3CCH 2CH 2CHCH 3CH 33CH 3CH 3223CH 3CH 3CH 33H BrBrH H CH 33CH3CH 3CH 3(1)(2)(3)(4)33和和HNHNCH 3NNCH 3(4)(3)HCH3H3CH3H33H (3) 内消旋体和外消旋体之间有什么本质区别? (4) 手性(旋光)异构体是否一定有旋光性? 6、将下列纽曼投影式改写成费歇尔投影式:(1) (2)(3) (4)7、指出下列各组构型式间的相互关系(对映体、非对映体或相同):8、下列各化合物中有无手性碳原子(用*表示手性碳):(4)(2)(3)(1)(6)(5)(7)ClBr3C BrCH3CH 3Br A. B.C.HOH 2CHCHOOH HOCH 2OHCHOHOH CHOCH 2OH HCHO OHCH 2OH A. B.C.D.D.C.B.A. B.A.H OH CHO2OH H NH 2H OH CHO CH 2OHH 2N HB.A.3B.A.B.A.CH 3Br 3HCH 3CHCH3CH 3C 2H 53C 2H 5CH 3H 5C CH 3C 2H 5(1)(2)(3)(4)CH 3CHDC 2H 5BrCH 2CHDCH 2Br CH 2BrCH 2CH 2ClCH 3CHCH 2CH 2CH 3CH 3CHClCHClCHClCH 3(5)(6)OH Br (7)(8)(9)(10)(11)(12)H 5C 2CH C 2H 533CH 3COOHHOCH 3O9、写出下列化合物的立体结构式或费歇尔投影式:(1) (R)-3-甲基-1-戊炔 (2) (S)-3-乙基-1-己烯-5-炔(3) (2R,3S)-2,3-二甲氧基丁烷 (4) (2R,3R)-2-甲基-3-羟基戊醛(5) S-2-氘代丙酸 (6) (2E,4S)-2-氯-4-溴-2-戊烯(7) (1R,2R)-1-苯基-2-氨基-1,3-丙二醇 (8) r-meso-1,2,3-三羟基环戊烷(9) 苏型-3,4-二甲基己烷 (10) ( R)-2, 3-戊二烯 10、用系统命名法命名下列化合物,立体异构体用R-S 或Z-E 标明其构型:11、已知某一对对映体混合物的比旋光度为+8.5°,并知其纯的右旋对映异构体的比旋光度为+42.5°(相同条件下测定),指出此混合物中右旋异构体的百分光学纯度%o.p 及混合物中两种异构体的摩尔比。
一 手性---立体(三维)异构 - 分子识别与功能重点实验室 …
“ELN脯氨酰 4-氢化酶”的活性,导致“缺氧诱导 因子”水平下降。
黄皮中分离出来的,(Байду номын сангаас)-黄皮酰胺具有抗衰老,抗缺氧及 促智等作用,(+)-黄皮酰胺不仅无正作用,还有一定抑制 作用。
手性药物的药理作用
通过药物分子与体内的大分子之间严格的手性识别和匹配 而实现的。生物体的酶和细胞表面受体是手性的,两个对 映体在体内以不同的途径被吸收、活化或降解。 多 为例 以DOPA(多巴)为例:
这三位科学家获奖的意义还在于: “他们的发明帮助人们在认识和改造世界中
L-多巴生产工艺
不对称合成中最大的工业化例子 (Novatis, 1996):
(S)-异丙甲草胺除草剂(>10,000 >10 000 吨/年)
还有,如: 硫醚的不对称氧化:生产抗胃溃疡药,奥美拉唑,的新工艺 应用不对称异构化反应生产薄荷醇---日本高砂公司
5
B)化合物带有三价的杂原子, 如:N, S, P 等
具有角锥形结构,三个基团和孤对电子形成假四面体排列,可能 带有不对称性,即形成中心手性。
Cl N H CH3 N Cl H CH3 N H3C O Ph Ph
在溶液中稳定存在的三元杂环体系,不易翻转。 可分离到稳定的对映体。
Troger碱
两个N原子被环内亚甲 在室温下,N原子中心翻转很快,使对映体无法分离。 在室温下,与磷相邻的键翻转较慢,有可能得到手性膦, 即含磷的手性化合物。 基的固定,三级胺的翻 转受阻,两个对映体可 被拆分。
3.1 手性分子的命名(构型)规则
Fisher命名法则: 相对构型:将尽可能多的手性化合物与标准化合物的构型 相关联,用以推导这些化合物的构型。
SN1反应立体化学特征的探讨
SN1反应立体化学特征的探讨1999年第6期高等函授学报(自然科学版)35SN1反应立体化学特征的探讨’陈迪炎(武汉教育学院化学系)关于对S1反应立体化学特征的描述,大多数教材[,]都是列举具有光活性的反应物在s1反应中得到外消旋化产物(或部分消旋化产物)予以说明;有的教材[则以叔丁基溴为例, 叙述其水解产物按理是外消旋体,无旋光性.于是得出结论,按SN1历程进行的反应,无论是光活性反应物,还是非光活性反应物,立体化学特征是外消旋的,得到外消旋化或部分消旋加构型转化产物.然而S1反应的立体化学特征究竟如何呢?ss1反应中是否都发生外消旋化(或部分消旋化)呢?下面予以详细地讨论.1构型转化和构型保持过程反应物的反应速度与亲核试剂(非溶剂的亲核试剂)的浓度无关,那么可以证实该反应是按S1历程进行的.例如,二苯基氯甲烷在含有0.02M或0.06MNaN3的含水丙酮中几乎以相同的速度进行反应.这种结果说明亲核试剂是在二苯基氯甲烷离解成二苯甲基碳正离子后再进行反应生成产物的.4(C6Hs)2CHC1亩(C6Hs)2eH+C1一N(C6Hs)2CHN3(C6H5)2~HH20\(c6H5)2CHOHH20,(C6)上述反应说明S1反应中生成碳正离子的一步是控制反应速度的步骤.碳正离子具有平面构型或近于平面构型,亲核试剂可以从平面的两侧进攻,相对于离去基团而言,同时发生构型保持和构型转化两个过程.对于理想的sN1反应来说,构型转化和构型黧主蓑c一,般认为,在离去基团完全离开之前,亲核试剂就开始进/R\…攻碳正离子,这样离去基团在一定程度上阻碍了亲核试—,,+I一剂从离去基团一侧的进攻,而从离去基团的背面方向进:,—”攻没有阻碍,因而构型转化占了优势.RR2外消旋化(1)/具有光学活性化合物转变为外消旋体的过程称作外消旋化.例如Lewis酸如SbC15,HgC12,A1C13等可使N一C.(+)一或(一)一a一氯乙苯进行消旋化.一般认为a一’R氯乙苯在Lewis酸作用下离解成碳正离子.碳正离子R中的碳为SP杂化,呈平面构型.在氯离子与它重新结掬型转化合时,氯从平面两侧进攻的几率相等,故发生消旋化_5J.收稿日期:1999—02—17R\C—NuR掬型保持361999年第6期高等函授学报(自然科学版)(+)一C6HsCHCH3+SbC15Cl+SbC16(一)一C6H5CHCt—I3(l在SN1反应中,如果反应物是光活性物质,其离解生成的碳正离子被亲核试剂在两侧进攻的几率相等时,构型转化和构型保持势均力敌,则最终生成外消旋混合物.例如:[C6H5,OOHC6H5,C6H5,/==芋一+一/f”H.c水HrP但在大多数情况下,结果并不那么简单.往往在外消旋化的同时,还出现部分构型的转化,即构型转化产物多于构型保持的产物.因而使产物具有不同程度的旋光性.例如,光活性的1一氯一1一蓑基乙烷水解形成51%构型转化产物和49%构型保持产物.即98%外消旋化,2%构型CllcH,+H’oCHCH,+HalOH构型转化产物愈多,消旋化愈不完全.一般来说,碳正离子愈不稳定,溶剂化及亲核试剂的亲核性愈强,亲核试剂从离去基团的背面进攻碳正离子的几率愈大,也愈容易,因而构型转化的BIrOICH3IcHOHIphCHCH3phCHCH3光学活性27%转化,73%外消旋B.rOHIIn--C6H13H3—n--C6H13HcH3光学活性66%转化,34%外消旋QcH3OHl丫…j.n--C~H11HcH3—C—H—aOH-—H~O一~CsH11占Hc H3+n-—c5H11占Hc H3光学活性74%转化.26%外消旋68%转化,32%外消旋3非光学活性反应物的产物对于中心碳原子为非手性碳的化合物在进行sN1反应时,同样应有”构型转化产物,,和”构型保持产物”.但由于形成的产物分子中有对称面存在,’’构型转化产物’’和”构型保持产物”其实是同一化合物,且无旋光性因而非光学活性反应物发生SNl反应只产生一种产物,并无外消1999年第6期高等函授学报(自然科学版)37旋化可言.例如,下述反应是按SN1历程进行的,都只生成一种无光活性的产物[81.2C1+HCOOphCHC一旦phCH2-CHH2一二’2—-()_~H8oCH,cH2Cl+oH一CH,cH20H这是由于生成的”构型转化产物”和”构型保持产物”分子中存在着一个对称面,无旋光性,它们本质上是同一产物.类似地,苯甲酸二苯基甲酯在乙醇中反应生成乙基二苯基甲基醚的反应是按S1历程进行,也只产生一种无光活性的产物.[91O(C6H5)2CH--O---C6H5(C6H5)2+一W一(C6H5)2CH——<=}一C2H5(C6H5)2CH—O—C2H5IH4结论综上所述,反应物进行SN1反应时,限速步骤产生的碳正离子由于具有平面构型或近于平面构型,亲核试剂可以从平面的两侧进攻,发生构型转化和构型保持过程.对于反应物来说, 如果是非光学活性的,则只生成一种无光活性的产物;如果是光学活性的,则生成旋光性相反的两种产物,产物的比例由碳正离子的稳定性,溶剂对碳正离子的溶剂化程度及试剂亲核性的强弱决定,因而表现出外消旋化(或部分消旋化).应该指出,sN1反应立体化学的特征应该是构型转化与构型保持同时发生的过程;而光学活性反应物在sN1反应中导致产物的外消旋化或部分消旋化则是对S1历程的一种证实.参考文献1东北师大等校编.有机化学(上册)(第二版).高等教育出版社,1986:262—2632Morfimn.R.T.,Boyd,R.N.,OnganicChemstry,(4ed.).1983:229—2303谷亨杰等.有机化学,高等教育出版社,1990:233—2344[美]J.密尔顿.哈利斯等着.王建华等译.有机反应机理的基本原理,上海科学技术出版社.1984:171—1725冯海嶷有机立体化学.高等教育出版社,1983:416A.SWingrove,R.L.Caret.ONanicChemistry.1981:380—3817何九龄.高等有机化学.化学工业出版社,1987:1018井本稔.仲矢忠雄着.有机反应论(上).东京化学同人,1982:118—1199恽魁宏等.高等有机化学.高等教育出版社,1988:158’。
大学有机化学期末复习1
第一章链烃一、命名1、烷烃的命名系统命名法要点:ⅰ选主链(C数最多的链)ⅱ编号(靠近取代基的一端)ⅲ命名(将复杂基团后列出)注:1、用汉字的数字表示取代基的个数,用阿拉伯数字表示取代基的位置(如2,3—二甲基)2、不要忘记短线连接2、烯烃的命名1、系统命名法同烷烃(离双键最近的位置开始编号)2、顺反命名分别连接在双键碳原子上的两个相同的原子和原子团位于双键的同一侧称为顺式(或cis-);在双键的两侧称为反式(或trans-)3、Z/E命名法1)取代基与双键碳直接连接的原子按其原子序数大小排列,大者为“较优”基团;如为同位素,则质量高的定为“较优”基团I > Br > Cl > S > O > C > D > H2)如果两个取代基团的第一个原子相同,则比较与第一个原子相连的几个原子。
比较时,按原子序数排列,先比较各组中最大者:若仍相同,再依次比较第二、第三个……3)含有双键和三键基团,可以认为连有两个或三个相同原子注:1、当两个优先基团位于双键的同一侧时,记为Z-构型(Zusammen);位于双键异侧,记为E-构型(Entgegen)2、写法(例如E-3-乙基-2-己烯),对于烯烃的命名,一定要首先看是否为Z/E构型3、炔烃的命名1、系统命名(同烷烃,靠近三键的一段开始编号)2、分子中同时含有双键和三键时(1)选同时含双键和三键的最长碳链为主链(2)编号从靠近三键或双键最近的一端开始,同等位置时选离双键最近端开始(3)名称均为某(位次加主链碳数)烯某(位次)炔(如1-庚烯-6-炔)二、化学性质烯烃1)加成反应1、加氢(空间位阻)2、加卤素(电子效应)3、加卤代烃(1)无氧化物时:遵循马氏规则(H 加在含H 较多的双键C 上) (2)有氧化物时:与HBr 反应遵循反马氏规则 4、加水(生成醇) 2)氧化1、高锰酸钾氧化 (区分酸碱性)RCH = CHR + KMnO4RCH = CH2 + KMnO4 RCOOH + CO2 + H2O + Mn2 + 注: 碳原子上连接一个氢,则氧化生成羧酸 连接两个氢则生成二氧化碳和水未连接氢则生成酮2、臭氧氧化炔烃1、加成同烯烃2、特征反应(必须一端有H)HC ≡C-R + Cu(NH3) 2+ —→ CuC ≡CCu ↓乙炔亚铜(红棕色) HC ≡C-R + Ag(NH3)2+ —→ AgC ≡CAg ↓乙炔银(白色)第二章 环烃3.1 环烷烃1环烷烃的命名 ①环的命名 ②顺反命名C(CH 3)3HCH 3H2化学反应+ Br 2 300℃Br+ HBrRCH CHROH OH+ MnO 2中性或碱性H RC CHR RO 3R R C C OOOR H RR C CO OR H+22) 加成反应Addition (1)加氢Hydrogenation (2)加卤素、卤化氢BrCH 2CH CH 2+ HBr CH 3CHCH 2 CH 3CH 3加热CH 3CH 2CH 2 + HBr CH 2CH 2CH 2BrCH 2CH 2CH 2 + Br 2 CH 2CH 2CH 2BrBrCH 2 CH 2 CH 2 CH 2+ H 2 CH 3CH 2CH 2CH 3Ni200℃CH 2CH 2 CH 2+ H 2 Ni80℃CH 3CH 2CH 3碳环开环发生在连接氢原子最多和最少的两个碳原子之间,氢原子加在连接氢原子较多的碳原子上.3.2 芳香烃(Aromatic hydrocarbon ) 重难点重点 命名、亲电取代、氧化反应 难点 亲电取代反应的机理具有“芳香性”的化合物称为芳香化合物 结构上:1.具有平面或接近平面的环状结构;2.键长平均化。
高等有机化学-第1章-基本理论
杂化轨道的类型与分子构型
sp,sp2,sp3杂化等 化合物 键长/nm 0.154 0.110 键角 109.5° 杂化轨道 sp3 s成分 1/4 C-H键能(kJ· mol-1) 406
H3C
CH2
H
H2C
CH
H
HC
C
H
0.134 0.109 120° sp2 1/3 435
2015-1-15
20
键与键的性质比较
键 键
可以单独存在,存在于任何共 不能单独存在,必须与单键共存, 价键中 形成双键或三键 沿轨道轴线的方向相互重叠 电子云重叠程度较大 相互平行的侧向重叠 电子云重叠程度较小
形成圆柱形对称轴轨道,对称 分布成轴线的上下两块,中间有 轴处电子云密度最大 一对称的节面,电子云较分散, 在节面处电子云密度几乎为零 键能较大
可以绕轴线旋转(内旋转) 键的极化度较小
键能较小
较难旋转 键的极化度较大
2015-1-15
21
3、共价键与分子的立体结构
典型分子的空间构象
价层电子对互斥理论
杂化轨道理论
键的极性与分子的极性 分子的构型与分子的性质
2015-1-15
22
典型分子的空间构型
典型三原子分子、四原子分子、五原子分子的空间构型
2015-1-15 7
②有机合成仍然占有独特的核心地位。 1973年Woodward等完成维生素B12的全合成。 1989年kishi等完成海葵毒素的全合成,被誉为有机合 成的珠穆朗玛峰。
选择性反应,尤其是不对称合成,已成为有机化学的热
点和前沿领域。 从20世纪下半叶起,化学的主要任务不再是发现新元 素,而是合成新分子,特别是人们感兴趣的明星分子。 ——徐光宪
立体化学一异构体的分类
COOH
H
OH
H
COOH
H
OH
CH 2OH D-(+)-甘油醛
CH 2 OH
a
CH 3 D-(-)-乳酸
20
2. R / S标记法
OH
OH
H
CHO H OH
C2HO H
R
C2H5 H
C H3
R
CHO
H
OH
C2HO H
a
C H3 C2H5
S
H HO
CHO
C2HO H
21
D,L标记的是相对构型,R,S标记的是绝对构型
旋光方向,还是依靠测定。
a
22
五、含两个手性碳原子化合物的对映异构 1. 含两个不同手性碳原子化合物的对映异构
1
-
COOH
1
COOH
HO
HO 2 H
H2
Cl 3 H
H 3 Cl
4COOH
(2R,3R)
4COOH (2S,3S)
1
2
1
COOH HO 2 H
H 3 Cl 4COOH
(2R,3S)
3
-
1
COOH
COOH
(1)
(2)
(3) (+)-酒石酸
mp
(+)-酒石酸 170oc
(-)-酒石酸
170oc
()-酒石酸 (dl) 206oc
meso-酒石酸 140oc
[]D(水) +12.0 -12.0 0 0
溶解度(g/100ml) 139 139 20.6
a 125
COOH HO H (S)
H OH (S)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一 外消旋化 一个纯的光活性物质,如果体系中 的一半量发生构型转化,就得外消旋体, 这种由纯的光活性物质转变为外消旋体 的过程称为外消旋化。如果构型转化未 达到半量,就叫部分外消旋化。
经烯醇化发生外 消旋化。
含手性碳的化合物,若手性碳上的氢 在酸或碱的催化作用下,易发生烯醇化, 在烯醇化的过程中常会发生外消旋化。
结论:用平面式分析,化合物是内消旋体。 用构象式分析,化合物是外消旋体。 是非手性分子。
例二:(1R,2R)反-1,2-二甲基环己烷
R R
例三: (1S,2S)反-1,2-二甲基环己烷
S
S
结论:用平面式分析,(1R,2R)-1,2-二甲基环己烷或(1S,2S)-1,2-二甲基
环己烷是一种有旋光的化合物。
四. 含手性碳原子的单环化合物 ——判别单环化合物旋光性的方法
实验证明:单环化合物有否旋光性可以通过其 平面式的对称性来判别,凡是有对称中心和对称平 面的单环化合物无旋光性,反之则有旋光性。
A A
A A
A A
无旋光(对称面)
有旋光
顺式和反式互为非对映异构体
1 奇数环
A A
A A
无旋光(对称面)
有旋光
一对对映体已拆分
未拆分出光活异构体
(未分电子对起不到一 个键的作用。)
C 6H 5N
R R' R"
"R
除C外,N、S、P、As 等也能作 手性中心
2. 有手性轴的旋光异构体
(1)丙二烯型的旋光异构体
(2)联苯型的旋光异构体 (3)把手化合物
(1)丙二烯型的旋光异构体
(2)联苯型的旋光异构体
X1 X2
C原子与X1(或X3)的中心 距离和C原子与X2 (或X4) 的中心距离之和超过 290pm,那么在室温 (25oC)以下,这个化合 物就有可能拆分成旋光异 构体。
NO2 COOH
X3 X4
HOOC
NO2
NO2 COOH
HOOC NO2
NO 2 NO 2
C-NO2 与 C-NO2 384pm C-NO2 与 C-CH3 365pm
例:化学析解法—形成和分离非对映体异构体的析解法
成盐 (+) — RCOOH + (-)-RNH 2 (+)-RCOO-(-)-RNH2 (-)-RCOO-(-)-RNH
分级结晶
+
HCl (+)-RCOOH + (-)-RNH3 Cl HCl (-)-RCOOH + (-)-RNH3 Cl +
[R] + [S]
当S构型的产物大于R构型的产物时,%ee 为
%ee = [S] - [R] 100% [R] + [S]
不对称合成常采用的方法
反应物 +试剂
催化剂 溶剂
产物
*1.手性反应物
*2.手性试剂
*3.手性溶剂
*4.手性催化剂 *5.在反应物中引入手性
CH3CHO + HCN
CH3CHCN OH
(A)两个双键相连
a C b
SP
C
2
a C
SP
SP
2
b
实例:a=苯基,b=萘基,1935年拆分。
Vont Hoff(荷兰)Bel(法)
(1901年诺贝尔奖)
(B)一个双键与一个环相连(1909年拆分)
H H3C
25
COOH H
[]D = 81.4o ( 乙醇 )
(C)螺环形
H H3C
H COOH
HO C H
O OH CH3 H
+
HO C H OH-
+ OH OH CH3 -H
+
HO C H3C
OH OH
H+
D-(-)-乳酸
HO -H H+ + C HO H CH3 + OH -H+ H
+
烯醇化 HO C HO H CH3 O
L-(+)-乳酸
经形成正碳离子、负 碳离子、自由基等中 间体发生外消旋化。
2
接种结晶析解法
1g R氨基醇 5g S +5g R 氨基`醇饱和液 (80℃,100ml) 2g S 氨基 醇析出
冷却至 20℃
析出2g R 氨基醇 (余下4g R,5g S)
冷却至 加水至100ml 分去晶体,剩下母液 20℃ 80℃ 加2g消旋 体
过 滤
三 不对称合成
对称的反应(选向率为0)
反应物1+反应物2
若(R) > (S)
产物1(R)+产物2(S) 若 (R) < (S)
实测 %O.P 纯R
实测 %O.P 纯S
(2)对映体过量百分率(%ee); 简称ee值
若产物是一对对映体,当R构型的产物大于S构型
的产物时,%ee 为 %ee = [R] - [S] 100%
不对称合成
不对称 的反应
立体选向性反应 0<选向率<100%
立体专一性反应 选向率≈100%
通过反应把分子中的一个对称的结构单元转化为不 对称的结构单元,称之为不对称合成。 选向率 0 用拆分法提纯
选向率
100%
几乎只有一种产物;要用 重结晶法来提纯。
关于不对称合成的几个基本概念
(1)光学纯度百分率(%O.P)
用构象式分析, (1R,2R)-1,2-二甲基环己烷或(1S,2S)-1,2-二甲基 环己烷是无数种有旋光的构象式 组合而成的混
合物。
五 不含手性碳原子的手性分子
1.有手性中心的旋光异构体 2.有手性轴的旋光异构体 3.有手性面的旋光异构体
1.有手性中心的旋光异构体
H 3C + N C H2 C H CH 2
CH3 H NHCH3 H OH C6H5 H+ H2O
含有手性碳原子的化合物,若手性 碳很容易形成正碳离子、负碳离子、自 由基等中间体时,常会发生外消旋化。
CH3 H NHCH3 C6H5 H
H2O H+
CH3 H NHCH3 HO H C6H5
D-(-)-麻黄素 有生理活性,易结晶
L-(+)-假麻黄素
CH3
由于位阻太大引起的旋光异构体称为位
阻异构体。
(3)把手化合物
HOOC (CH2)n
n=8,可析解,光活体稳定。 n=9,可析解, 95.5oC时,半衰期为444分。
n=10,不可析解。
3. 有手性面的旋光异构体
蒄(无手性)
六螺并苯(有手性)
H3C CH3
CH3
CH2COOH
第五节 消旋、拆分和不对称合成 一 外消旋化 二外消旋体的拆分 三 不对称合成
COOH H OH CH3 HO
COOH H CH3
非手性分子
有一个手 性中心
外消旋体
CHO H3C H + C2H5 HCN
CN HO H3C H H C2H5 H H3C
CN OH H C2H5
反应物有一个 手性中心
(少)
H2O COOH HO H3C H H C2H5 H H3C
(多)
COOH OH H C2H5
(3)选择吸附拆分法: 用某种旋光性物质作为吸附剂, 使之选择性地吸附外消旋体中的一种异构体(形成两个非 对映的吸附物)。 (4)诱导结晶拆分法(晶种结晶法):在外消旋体的过饱 和溶液中,加入一定量的一种旋光体的纯晶体作为晶种, 于是溶液中该旋光体含量多,在晶种的诱导下优先结晶析 出。 (5) 化学拆分法: 将外消旋体与旋光性物质作用,得到 非对映体的混合物,根据非对映体不同的物理性质,用一 般的分离方法将它们分离。如酸:
A
A
A
A
无旋光(对称面) 有旋光
当AB不同时,顺式和反式都有手性。
2 偶数环
A A
无旋光(对称中心)
A A
有旋光
A
A A
A
无旋光(对称面)
无旋光(对称面)
思考:当AB相同和不同时有什么区别?
取代环己烷旋光性的情况分析
例一:顺-1,2-二甲基环己烷
旋转120o
(1)
(1)的构象转换体
(2)
(1)和(2)既是构 象转换体,又 是对映体。能 量相等,所以 构象分布为 (1):(2)=1:1。
碳正离子
生理活性只有麻黄素的1/5。
二 外消旋的拆分
• 外消旋体是由一对对映体等量混合而成,对映体除旋光方向
外,其它物理性质均相同。 • 用一般的物理方法(分馏、分步结晶等)不能把一对对映体 分离开来。必须用特殊方法。 • 拆分—将外消旋体分离成旋光体的过程叫“拆分”。 拆分的方法一般有以下几种: (1)机械拆分法: 利用外消旋体中对映体的结晶形态上的差异, 借肉眼直接辨认,或通过放大镜进行辨认,而把两种结晶体挑 捡分开。(目前很少用) (2)微生物拆分法: 利用某些微生物或它们所产生的酶,对对 映体中的一种异构体有选择的分解作用。
产物有二个手性中心,非对映体。
大量的实验事实证明:
一个非手性分子在反应过程中产生一个手性 中心时,产物为外消旋体;但一个手性分子 在反应过程中产生第二个手性中心时,将会 产生二个不等量的非对映体。
本章小结
1 基本概念 立体异构、对映异构、对映异构体、手性、 对称因素、比旋光度、手性中心、不对称碳原子 2 构型的表示方法 透视式、Fischer投影式 3 对映体的命名 RS、D L 相对构型、绝对构型的判断 4 判断化合物的手性★
