化学电负性计算公式(经验公式)

总结人徐茂渊
电负性计算公式,自己总结了一晚上出来的
D(A-B)= [D(A-A)*D(B-B)]^1/2 + (109+3.2*(PA-PB))*{(XA-XB)^2)
式中D是键能,D(A-B)即物质AB之间的键能(注意不管是两种元素的
哪种化合物,一律按照两元素的单键键能来算),XA和XB是元素A和B的电负性,PAPB为两元素的原子序数差,并指定氢的电负性为 2.20,依次计算出其它元素的电
负性。电负性计算公式,自己总结的。
因为是自己总结的多少会有些错误希望大家指出来
这个方法计算时需规定H的电负性为 2.20 计算出F的电负性为 3.72与鲍林算出的有差别(只有F的差别最大)其余元素的差值与鲍林计算的大约相差在0.1—0.2左右基本可以吻合以下是鲍林标度
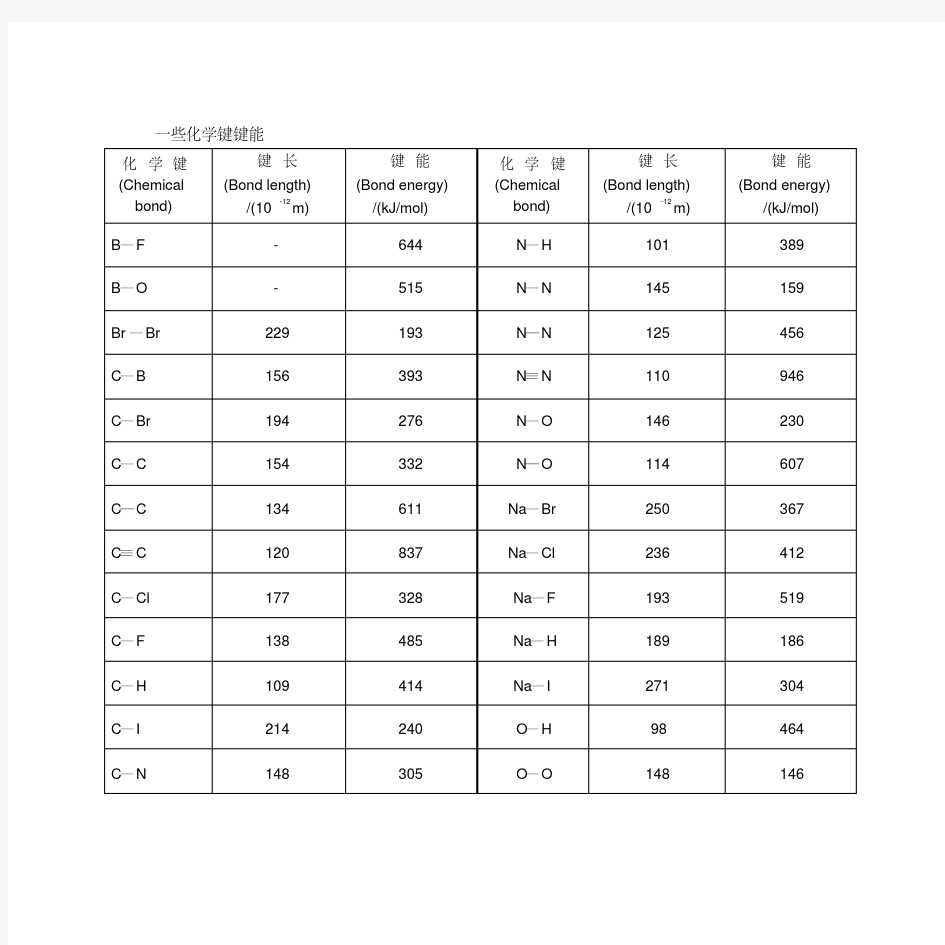
一些化学键键能
化学键(Chemical bond)
键长
(Bond length)
/(10-12m)
键能
(Bond energy)
/(kJ/mol)
化学键
(Chemical
bond)
键长
(Bond length)
/(10-12m)
键能
(Bond energy)
/(kJ/mol)
B—F - 644 N—H 101 389 B—O - 515 N—N 145 159 Br—Br 229 193 N═N 125 456 C—B 156 393 N≡N 110 946 C—Br 194 276 N—O 146 230 C—C 154 332 N═O 114 607 C═C 134 611 Na—Br 250 367 C≡C 120 837 Na—Cl 236 412 C—Cl 177 328 Na—F 193 519 C—F 138 485 Na—H 189 186 C—H 109 414 Na—I 271 304 C—I 214 240 O—H 98 464 C—N 148 305 O—O 148 146
C═N 135 615 O═O 120 498 C≡N 116 891 P—Br 220 272 C—O 143 326 P—Cl 203 331 C═O 120 728 P—H 142 322 C═O(CO2) - 803 P—O 163 410 C—P 187 305 P═O 138 - C—S 182 272 P—P - 213 C═S 156 536 Pb—O 192 382 C═S(CS2) - 577 Pb—S 239 346 C—Si 186 347 Rb—Br 294 381 Cl—Cl 199 243 Rb—Cl 279 428 Cs—I 337 337 Rb—F 227 494 F—F 140 153 Rb—I 318 319 H—H 75 436 S—H 135 339 H—Br 142 366 S—O - 364 H—Cl 127 431 S═O 143 -
H—F 92 565 S—S 207 268 H—I 161 298 S═S 189 - I—I 266 151 Se—H 147 314 K—Br 282 380 Se—Se 232 - K—Cl 267 433 Se═Se 215 - K—F 217 498 Si—Cl - 360 K—I 305 325 Si—F - 552 Li—Cl 202 469 Si—H - 377 Li—H 239 238 Si—O - 460 Li—I 238 345 Si—Si - 176
初中化学常用计算公式和方程式
初中化学 一. 常用计算公式: (1)相对原子质量 (2)设某化合物化学式为 ①它的相对分子质量=A的相对原子质量×m+B的相对原子质量×n ②A元素与B元素的质量比=A的相对原子质量×m:B的相对原子质量×n ③A元素的质量分数 (3)混合物中含某物质的质量分数(纯度) (4)标准状况下气体密度(g/L) (5)纯度
(6)溶质的质量分数 (7)溶液的稀释与浓缩 (8)相对溶质不同质量分数的两种溶液混合 (9)溶液中溶质的质量 =溶液的质量×溶液中溶质的质量分数 =溶液的体积×溶液的密度 二. 化学方程式: (1)镁带在空气中燃烧 (2)碱式碳酸铜受热分解 (3)磷在空气中燃烧 (4)木炭在氧气中充分燃烧
(5)硫在氧气中燃烧 (6)铁在氧气中燃烧 (7)氯酸钾与二氧化锰共热 (8)高锰酸钾受热分解 (9)氧化汞受热分解 (10)电解水 (11)锌与稀硫酸反应 (12)镁与稀硫酸反应 (13)铁与稀硫酸反应 (14)锌与盐酸反应
(15)镁与盐酸反应 (16)铁与盐酸反应 (17)氢气在空气中燃烧 (18)氢气还原氧化铜 (19)木炭在空气不足时不充分燃烧 (20)木炭还原氧化铜 (21)木炭与二氧化碳反应 (22)二氧化碳与水反应 (23)二氧化碳与石灰水反应
(24)碳酸分解的反应 (25)煅烧石灰石的反应 (26)实验室制取二氧化碳的反应 (27)泡沫灭火器的原理 (28)一氧化碳在空气中燃烧 (29)一氧化碳还原氧化铜 (30)一氧化碳还原氧化铁 (31)甲烷在空气中燃烧 (32)乙醇在空气中燃烧
(33)甲醇在空气中燃烧 (34)铁与硫酸铜反应 (35)氧化铁与盐酸反应 (36)氢氧化铜与盐酸反应 (37)硝酸银与盐酸反应 (38)氧化铁与硫酸反应 (39)氢氧化铜与硫酸反应 (40)氯化钡与硫酸反应 (41)氧化锌与硝酸反应
切削加工常用计算公式
附录3:切削加工常用计算公式 1. 切削速度Vc (m/min) 1000n D Vc ?π?= 主轴转速n (r/min) D 1000 Vc n ?π?= 金属切除率Q (cm 3/min) Q = V c ×a p ×f 净功率P (KW) 3p 1060Kc f a Vc P ????= 每次纵走刀时间t (min) n f l t w ?= 以上公式中符号说明 D — 工件直径 (mm) ap — 背吃刀量(切削深度) (mm) f — 每转进给量 (mm/r ) lw — 工件长度 (mm)
铣削速度Vc (m/min) 1000n D Vc ?π?= 主轴转速n (r/min) D 1000 Vc n ?π?= 每齿进给量fz (mm) z n Vf fz ?= 工作台进给速度Vf (mm/min) z n fz Vf ??= 金属去除率Q (cm 3/min) 1000Vf ae ap Q ??= 净功率P (KW) 61060Kc Vf ae ap P ????= 扭矩M (Nm) n 10 30P M 3 ?π??= 以上公式中符号说明 D — 实际切削深度处的铣刀直径 (mm ) Z — 铣刀齿数 a p — 轴向切深 (mm) a e — 径向切深 (mm)
切削速度Vc (m/min) 1000n d Vc ?π?= 主轴转速n (r/min) d 1000 Vc n ?π?= 每转进给量f (mm/r) n Vf f = 进给速度Vf (mm/min) n f Vf ?= 金属切除率Q (cm 3/min) 4Vc f d Q ??= 净功率P (KW) 310240kc d Vc f P ????= 扭矩M (Nm) n 10 30P M 3?π??= 以上公式中符号说明: d — 钻头直径 (mm) kc1 — 为前角γo=0、切削厚度hm=1mm 、切削面积为1mm 2时所需的切 削力。 (N/mm 2) mc — 为切削厚度指数,表示切削厚度对切削力的影响程度,mc 值越 大表示切削厚度的变化对切削力的影响越大,反之,则越小 γo — 前角 (度)
大学精选化学公式(通用版)
大学精选化学公式(通用版) 一、化平衡学 化学反应亲和势:A =-r m B B B G γμ?∑=- 化学反应等温式:r m r m a G G RT ln Q Φ??=+ 平衡常数的表达式:()B B g h G H f p d e D E p p K K p p p γΦ ΦΦ∑-== ()B B p p K K p γΦΦ∑-= () B B f p K K K p γγΦΦ ∑- = B B B B x p p p K K K p p γγΦΦ∑∑?? ? ?? - - == ()B B B B c p p RT K K K RT p γγΦΦ∑?? ∑ ? ?? - -== 温度,压力及惰性气体对化学平衡的影响: r m 2 d ln K H dT RT Φ Φ ?= C r m 2 d ln K U dT RT ΦΦ?= B B p C c RT K K p γΦ ΦΦΦ ∑?? ??? = 二、电解质溶液 法拉第定律:Q =nzF m =M zF Q dE r U dl ++ = dE r U dl --= t +=- + I I =- + +r r r += - +U U U ++ = ∞ ∞+ Λ m ,m λ= ( ) F U U F U ∞ ∞+∞+-+ r +为离子移动速率,U +( U -)为正(负)离子的电迁移率(亦称淌度)。
近似:+∞+≈,m ,m λλ +∞ +≈,m ,m U U m m Λ≈Λ∞ (浓度不太大的强电解质溶液) 离子迁移数:t B =I I B =Q Q B ∑B t =∑+t +∑-t =1 电导:G =1/R =I/U =kA/l 电导率:k =1/ρ 单位:S ·m -1 莫尔电导率:Λm =kV m =k/c 单位S ·m 2 ·mol -1 cell l R K A ρ ρ== cell 1K R kR ρ== 科尔劳乌施经验式:Λm =()c 1m β-∞Λ 离子独立移动定律:∞Λm =()m,m,+U U F λλ∞∞∞∞ +-- +=+ m U F λ∞∞+,+= 奥斯特瓦儿德稀释定律:Φc K =() m m m 2 m c c ΛΛΛΛ∞∞Φ- 平均质量摩尔浓度:±m =()v 1v v m m - - ++ 平均活度系数:±γ=()v 1v v - - +γγ+ 平均活度:± a =()1v v a a -- ++ = m m γ±± Φ 电解质B 的活度:a B =v a ± =v m m ? ? ? ??Φ±±γ +v v v B +a a a a ±--== m +=v +m B m -=v -m B () 1 v v v B m v v m +±+- -= 离子强度:I =∑i 2i i z m 2 1 德拜-休克尔公式:lg ±γ=-A|z +z --|I 三、可逆电池的电动势及其应用 (Δr G )T,p =-W f,max (Δr G m )T,p =zEF
机械加工时间定额的计算公式和方法
机械加工时间定额的计算公式和方法 2、刨削、插削 所用符号机加工工时定额,机械加工定额,机加工工时,定额计算方法,加工中心定额,工时 tj——机动时间(min) L——切刀或工作台行程长度(mm) 1——被加工工件长度(mm) 11——切入长度(mm) 12——切出长度(mm) 13——附加长度(mm) 14——行程开始超出长度(mm) 15——行程结束时超出长度(mm) B——刨或插工件宽度(mm) h——被加工槽的深度或台阶高度(mm) U——机床平均切削速度(m/min) f——每双行程进给量(mm) i——走刀次数 n——每分钟双行程次数 n=(1000×VC)/L×(1+K) 注: 龙门刨:K=0.4-0.75 插床:K=0.65-0.93 牛头刨:K=0.7-0.9 单件生产时上面各机床K=1 ①插或刨平面 tj=(B+12+13)×i/(f×n)=2×(B×11+12+13)×i/(f×Um×1000)(min) ②刨或插槽 tj=(h+1)×i/(f×n)=(h+1)×i×L/(f×Um×1000)(min) 注: 龙门刨:14+15=350mm 牛头刨:14+15=60mm(各取平均值) ③刨、插台阶 tj=(B+3)×i/(f×n)(横向走刀刨或插)(min) tj=(h+1)×i/(f×n)(垂直走刀刨或纵向走刀插)(min) 3、钻削或铰削 所用符号机加工工时定额,机械加工定额,机加工工时,定额计算方法,加工中心定额,工时 tj——机动时间(min)1——加工长度(mm) 11——切入长度(mm)11——切出长度(mm) f——每转进给量(mm/r)n——刀具或工件每分钟转数(r/min) Φ——顶角(度)D——刀具直径(mm) L——刀具总行程=1+11+12(mm) 钻削时:11=1+D/[2×tg(Φ/2)]或11≈0.3P(mm)
中央空调冷量计算方法
中央空调冷量计算方法 实际受冷面积=房屋建筑面积×房屋实用率×65%(除去厨房、洗手间等非制冷面积) 实际所需冷量=实际受冷面积×单位面积制冷量 注意:单位面积制冷量根据具体情况有所变化,家用通常为100 ——150瓦/平方米。如果房间朝南、楼层较高,或者有大面积玻璃墙,可适当提高到170 ——200瓦/平方米左右。 第二步:确定室内机与风口 根据实际所需冷量大小决定型号,每个房间或厅只需要一台室内机或者风口,如果客厅的面积较大,或者呈长方形,可以多加一台室内机或风口。以每12平方米需要一匹左右为准。 第三步:确定空调布局: 1、主机的位置要讲究通风散热良好,便于检修维护,同时位置要尽量隐蔽,避免影响房子外观和噪音影响室内; 2、室内机的位置要和室内装修布局配合,一般是暗藏在吊顶内,也可以隐藏在高柜的顶部。一般室内机都是超薄型的,只需要大约25厘米的高度就可以放置。安装时要注意回风良好,使室内空气形成循环,以保证空调效果和空气质量; 3、管路的布置:冷水机组的冷媒管路都比较细,即使外面包上保温层,也可以方便地暗藏起来;管路需要全程保温,管件、阀件以及与管路接触的金属配件都要保温包裹起来,以防冷凝水滴漏;管路材料一般选用PP R管、PVC U管或铝塑复合管,可以保证50年不损坏;全部的冷凝水集中或就近隐蔽排放; 4、室内机可根据用户要求增加负离子发生器、净化除尘装置,以进一步提高室内空气质量。 第四步:选择适合价格的产品 家用中央空调的价格大约在300 ——350元/平方米左右。品牌、机型、用户自己的需求,如选择变频与非变频空调,冷暖或单冷,都会导致价格差异。 第五步:选择服务 同普通分体空调相比,家用中央空调实际上是一个“半成品”,因为它要同室内装修相配合。家用中央空调的服务,不仅包括售后服务,还包括销售前的咨询、方案设计、安装施工。可以说,要使一套家用中央空调系统能够正常运行,设计、安装、施工的重要性不亚于主机设备。 所以用户在购买家用中央空调的时候,一定要选择服务佳、信誉好的企业,以保障自己的利益。 空调好坏的三项指标 制冷(热)量、能效比和噪音的大小是衡量空调优劣的三个最为关键的指标。 制冷(热)量
大学有机化学反应方程式总结(较全)
大学有机化学反应方程式总 结(较全) -标准化文件发布号:(9556-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII
有机化学 一、烯烃 1、卤化氢加成 (1) CH CH 2 R HX CH 3R X 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】 CH 2 C H 3+ CH 3 C H 3X + CH 3 C H 3 +H + CH 2 +C 3X + C H 3X 主 次 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2) CH CH 2 R CH 2CH 2 R Br HBr ROOR 【特点】反马氏规则 【机理】 自由基机理(略) 【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。 【本质】不对称烯烃加成时生成稳定的自由基中间体。 【例】 CH 2 C H 3Br CH CH 2Br C H 3CH + CH 3 C H 3HBr Br CH 3CH 2CH 2Br CH CH 3 C H 3 2、硼氢化—氧化 CH CH 2 R CH 2CH 2R OH 1)B 2H 62)H 2O 2/OH -
【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。 【机理】 2 C H 33H 32 3H 32 CH CH 2C H 3H BH 2 CH CH=CH (CH 3CH 2CH 2)3 - H 3CH 2CH 2C 22CH 3 CH 2O CH 2CH 2CH 3 H 3CH 2CH 2C 2CH 2CH 3 + O H - O H B - OC H 2CH 2CH 3CH 2CH 2CH 3 H 3CH 2CH 2B OC H 2CH 2CH 3 CH 2CH 2CH 3H 2CH 2CH 3 HOO -B(OCH 2CH 2CH 3)3 B(OCH 2CH 2CH 3)3 + 3NaOH 3NaOH 3HOC H 2CH 2CH 33 + Na 3BO 3 2 【例】 CH 3 1)BH 32)H 2O 2/OH -CH 3H H OH 3、X 2加成 C C Br /CCl C C Br Br 【机理】
机械加工时间计算
工业生产中机械加工时间定额与其组成-切削用量的计算与选择原则-车削-刨削、插削-钻削或铰削-齿轮加工-铣削-用板牙或丝锥加工螺纹-拉削磨削加工生产供应技术 机械加工时间定额与其组成-切削用量的计算与选择原则-车削-刨削、插削-钻削或铰削-齿 轮加工-铣削-用板牙或丝锥加工螺纹-拉削磨削加工生产供应技术 机械加工时间定额与其组成 1、什么是机械加工时间定额?它是指完成一个零件或零件某一工序加工所规定的时间。 2、时间定额的组成: (1) 、机动时间(也称基本时间)(Tj) ——是指直接改变工件尺寸、形状和表面质量所需要的时间。它包括刀具趋近、切入、切削和切出的时间。 (2) 、辅助时间(Tf) ——用于某工序加工每个工件时,进行各种辅助动作所消耗的时间。包括装卸工件和有关工步的时问。如启动与停止机床、改变切削用量、对刀、试切、测量等有关工步辅助动作所消耗的时间。 (3) 、布置工作地、休息和生理需要的时间(Tbx) ——指工人在工作时间内清理工作地点以及 保证正常工作时所消耗的时间。其中包括阅读交接等,检查工件,机床,对机床进行润滑和空运转,更换与修磨刀具,检具和刃具,清理切屑,工作前取出和工作后归还工具,交班前擦拭机床,清理工作场地,填交接班纪录及工作时间内允许必要的休息和生理需要的时问。为了计算方便,根据加工复杂程度的难易,按操作时间的百分比来表示。 (4) 、准备终结时间(Tzz) ——是指工人在加工一批工件的开始和结束时间所做准备工作和结束时所消耗的时间。包括熟悉图纸,工艺文件,进行尺寸换算,借还工具、夹具、量具、刃具,领取毛坯,安装刀杆、刀具、夹具,转动刀架,修整砂轮,点收零件,调整机床,首件检查,加工结束时清理机床,发送成品等。 一般情况,准备与终结时间分固定部分和另加部分。固定部分是指一批零件加工前必须发生的时间。另加部分是根据实际工作需要做某些准备与结束工作所需时间。加工一批零件只给一次准备与终结时间。 3、机械加工时间定额的计算 (1) 、中批以上 td=(tj+tf) X (1+K % )+tzz/N (2) 、单件小批 td=tj X (1+K%)+tbx+tzz 式中,td ——单件加工时间定额(min) tj ——机动时间(min) tbx ——布置场地与休息和生理需要时间(min) tzz ----- 准嵛与终结时间(mi n) K ——tbx 和tzz 占tj 的百分比 N ——生产纲领——相同一批零件数 辅助时间的确定 1 、确定原则 (1) 、辅助时问的长短和工件与机床规格大小、复杂程度成正比。 (2) 、单件小批生产类型的其他时问,包括tf、tbx、tzz 时间占tj 的百分比(K% )及装卸时间。 tzz时间按N=10考虑,直接计入单件时间定额中。 2、确定 ( 1 ) 、卧车:
大学有机化学反应方程式总结(较全)
有机化学 一、烯烃 1、卤化氢加成 (1) CH CH 2 R HX CH CH 3R X 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】 CH 2 C H 3+ CH 3 C H 3X + CH 3 C H 3 +H + CH 2 +C 3X + C H 3X 主 次 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2) CH CH 2 R CH 2CH 2 R Br HBr ROOR 【特点】反马氏规则 【机理】 自由基机理(略) 【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。 【本质】不对称烯烃加成时生成稳定的自由基中间体。 【例】 CH 2 C H 3Br CH CH 2Br C H 3CH + CH 3 C H 3HBr Br CH 3CH 2CH 2Br CH CH 3 C H 3 2、硼氢化—氧化 CH CH 2 R CH 2CH 2R OH 1)B 2H 62)H 2O 2/OH - 【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。 【机理】
2 C H3 3 H3 2 3 H3 2 CH CH2 C H3 2 CH CH=CH (CH3CH2CH2)3 - H3CH2CH2C 22 CH3 CH2 B O CH2CH2CH3 3 CH2CH2C 2 CH2CH3 +O H- O H B-OCH2CH2CH3 CH2CH2CH3 H3CH2CH2 B OCH2CH2CH3 CH2CH2CH3 2 CH2CH3 HOO- B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO3 2 【例】 CH3 1)BH 3 2)H 2 O 2 /OH- CH3 H H OH 3、X2加成 C C Br 2 /CCl 4 C C Br Br 【机理】 C C C C Br Br C Br +C C Br O H2+ -H+ C C Br O H
中考化学常用计算公式大全(整理)教案资料
中考化学常用计算公式大全(整理)
中考化学常用计算公式 相对分子质量=(化学式中各原子的相对原子质量×化学式中该元素原子个数)之和 如设某化合物化学式为AmBn ①它的相对分子质量=A的相对原子质量×m+B的相对原子质量×n ②A元素与B元素的质量比=A的相对原子质量×m:B的相对原子质量×n ③A元素的质量分数ω=A的相对原子质量×m /AmBn的相对分子质量 ④A的化合价×m + B的化合价×n = 0 ⑤原子个数比:A : B = m : n (3)混合物中含某物质的质量分数(纯度)=纯物质的质量/混合物的总质量× 100% (4)标准状况下气体密度(g/L)=气体质量(g)/气体体积(L) (5)纯度=纯物质的质量/混合物的总质量× 100% =纯物质的质量/(纯物质的质量+杂质的质量) × 100%= 1- 杂质的质量分数 (6)溶质的质量分数=溶质质量/溶液质量× 100% =溶质质量/(溶质质量+溶剂质量) × 100% (饱和溶液溶质的质量分数=溶质质量/(溶质质量+100) × 100%)、 含有晶体溶质的质量分数=溶质所有质量-晶体质量/(溶质所有质量-晶体质量+溶剂质量) × 100%)(7)溶液的稀释与浓缩 M浓× a%浓=M稀× b%稀=(M浓+增加的溶剂质量) × b%稀 (8)相对溶质不同质量分数的两种溶液混合 M浓× a%浓+M稀× b%稀=(M浓+M稀) × c% (9)溶液中溶质的质量=溶液的质量×溶液中溶质的质量分数=溶液的体积×溶液的密度 (1)化合物中某元素百分含量的计算式 (2)化合物质量与所含元素质量的关系式 仅供学习与交流,如有侵权请联系网站删除谢谢2
加工中心常用计算公式
三角函数计算 1.tanθ=b/a θ=tan-1b/a 2.Sinθ=b/c Cos=a/c 二、切削速度的计算 Vc=(π*D*S)/1000 Vc:线速度(m/min) π:圆周率(3.14159) D:刀具直径(mm) S:转速(rpm) 例题. 使用Φ25的铣刀Vc为(m/min)25求S=?rpm Vc=πds/1000 25=π*25*S/1000 S=1000*25/ π*25 S=320rpm 三、进给量(F值)的计算 F=S*Z*Fz F:进给量(mm/min) S:转速(rpm) Z:刃数 Fz:(实际每刃进给) 例题.一标准2刃立铣刀以2000rpm)速度切削工件,求进给量(F 值)为多少?(Fz=0.25mm) F=S*Z*Fz F=2000*2*0.25 F=1000(mm/min) 四、残料高的计算 Scallop=(ae*ae)/8R Scallop:残料高(mm) ae:XYpitch(mm) R刀具半径(mm)
例题.Φ20R10精修2枚刃,预残料高0.002mm,求Pitch为多 少?mm Scallop=ae2/8R 0.002=ae2/8*10 ae=0.4mm 五、逃料孔的计算 Φ=√2R2 X、Y=D/4 Φ:逃料孔直径(mm) R刀具半径(mm) D:刀具直径(mm) 例题. 已知一模穴须逃角加工(如图), 所用铣刀为ψ10;请问逃角孔最小 为多少?圆心坐标多少? Φ=√2R2 Φ=√2*52 Φ=7.1(mm) X、Y=D/4 X、Y=10/4 X、Y=2.5 mm 圆心坐标为(2.5,-2.5) 六、取料量的计算 Q=(ae*ap*F)/1000 Q:取料量(cm3/min) ae:XYpitch(mm)ap:Zpitch(mm) 例题. 已知一模仁须cavity等高加工,Φ35R5的刀XYpitch是刀具的60%,每层切1.5mm,进给量为2000mm/min,求此刀具的取料量为多少? Q=(ae*ap*F)/1000 Q=35*0.6*1.5*2000/1000 Q=63 cm3/min
大学无机化学方程式整理
第一章氢及稀有气体 1.氢气的制备 实验室:Zn+2HCl=ZnCl2+H2↑ 军事上:CaH2 +2H2O → Ca(OH)2 + 2H2↑ 2.稀有气体化合物 ①第一个稀有气体化合物:Xe + PtF6 → Xe+[ PtF6] (无色)(红色)(橙黄色) ②氙的氟化物水解: 2XeF2+2H2O →2Xe↑+4HF+ O2↑ 6XeF4 + 12H2O == 2XeO3 + 4Xe↑+3O2↑ +24HF XeF6+3H2O →XeO3+6HF ③氙的氟化物为强氧化剂: XeF2 + H2─→ Xe + 2HF XeF2 + H2O2─→ Xe + 2HF + O2↑ 第二章碱金属与碱土金属元素 一、碱金属与碱土金属(铍、镁除外)元素溶于液氨,生成溶剂合电子和阳离子成具有导电性的深蓝色溶液。 碱金属M(S) + (x+y)NH3 M+(NH3)x + e-(NH3)y 碱土金属M(S) + (x+2y)NH3 M2+(NH3)x +2e-(NH3)y 二、氢化物
氢化物共分为离子型、共价型、过渡型 离子型氢化物是极强的还原剂:TiCl 4+4NaH Ti +4NaCl +2H 2↑ LiH 能在乙醚中同B 3+ Al 3+ Ga 3+ 等的无水氯化物结合成复合氢化物,如氢化铝锂的生成。 4LiH + AlCl 3 乙醚 Li[AlH 4] + 3LiCl 氢化铝锂遇水发生猛烈反应Li[AlH 4]+4H 2O=LiOH↓+Al(OH)3↓+4H 2↑ 三、 氧化物 1、正常氧化物 碱金属中的锂和所有碱土金属在空气中燃烧时,分别生成正常氧化物Li 2O 和MO 。其他碱金属正常的氧化物是用金属与他们的过氧化物或硝酸盐相作用制得。 Na 2O 2+2Na=2Na 2O 2KNO 3+10K=6K 20+N 2↑ 碱土金属氧化物也可以由他们的碳酸盐或硝酸盐加热分解得到。 CaCO 3 CaO +CO 2↑ 2Sr(NO 3)2 2SrO +4NO 2+O 2↑ 1、 过氧化物与超氧化物 过氧化物是含有过氧基(—O —O —)的化合物,可看作是H 2O 2的衍生物。除铍外,所有碱金属和碱土金属都能形成离子型过氧化物。 2Na +O 2 Na 2O 2 除锂、铍、镁外,碱金属和碱土金属都能形成超氧化物。 K +O 2=KO 2 2、 臭氧化物 300℃~500℃ 高温 △
化工原理化工计算所有公式总结
化工原理化工计算所有 公式总结 Document serial number【KK89K-LLS98YT-SS8CB-SSUT-SST108】
化工原理化工计算所有公式总结 第一章 流体流动与输送机械 1. 流体静力学基本方程:gh p p ρ+=02 2. 双液位U 型压差计的指示: )21(21ρρ-=-Rg p p ) 3. 伯努力方程:ρ ρ2 22212112121p u g z p u g z ++=++ 4. 实际流体机械能衡算方程:f W p u g z p u g z ∑+++=++ρ ρ2 22 212112121+ 5. 雷诺数:μ ρ du = Re 6. 范宁公式:ρρμλf p d lu u d l Wf ?= =??=22322 7. 哈根-泊谡叶方程:2 32d lu p f μ= ? 8. 局部阻力计算:流道突然扩大:2 211??? ? ? -=A A ξ流产突然缩小:??? ??- =2115.0A A ξ 第二章 非均相物系分离 1. 恒压过滤方程:t KA V V V e 222=+ 令A V q /=,A Ve q e /=则此方程为:kt q q q e =+22 第三章 传热 1. 傅立叶定律:n t dA dQ ??λ-=,dx dt A Q λ-= 2. 热导率与温度的线性关系:)1(0t αλλ+=
3. 单层壁的定态热导率:b t t A Q 21-=λ,或m A b t Q λ?= 4. 单层圆筒壁的定态热传导方程: )ln 1(21 2 21r r t t l Q λπ-= 或m A b t t Q λ21-= 5. 单层圆筒壁内的温度分布方程:C r l Q t +-=ln 2λ π(由公式4推导) 6. 三层圆筒壁定态热传导方程:3 4 12321214 1ln 1ln 1ln 1(2r r r r r r t t l Q λλλπ++-= 7. 牛顿冷却定律:)(t t A Q w -=α,)(T T A Q w -=α 8. 努塞尔数λαl Nu =普朗克数λμ Cp =Pr 格拉晓夫数223μρβtl g Gr ?= 9. 流体在圆形管内做强制对流: 10000Re >,1600Pr 6.0<<,50/>d l k Nu Pr Re 023.08.0=,或k Cp du d ??? ?????? ??=λμμρλα8 .0023.0,其中当加热时,k=,冷却时k= 10. 热平衡方程:)()]([1222211t t c q T T c r q Q p m s p m -=-+= 无相变时:)()(12222111t t c q T T c q Q p m p m -=-=,若为饱和蒸气冷凝: )(12221t t c q r q Q p m m -== 11. 总传热系数: 2 1 211111d d d d b K m ?+?+=αλα 12. 考虑热阻的总传热系数方程:2 12121 211111d d R R d d d d b K s s m ?++?+?+=αλα 13. 总传热速率方程:t KA Q ?= 14. 两流体在换热器中逆流不发生相变的计算方程:??? ? ??-=--22111112211ln p m p m p m c q c q c q KA t T t T
加工中心常用计算公式
CNC常用计算公式 一、三角函数计算 1.tanθ=b/aθ=tan-1b/a 2.Sinθ=b/c Cos=a/c 二、切削速度的计算 Vc=(π*D*S)/1000 Vc:线速度(m/min) π:圆周率(3.14159) D:刀具直径(mm) S:转速(rpm) 例题. 使用Φ25的铣刀Vc为(m/min)25 求S=?rpm Vc=πds/1000 25=π*25*S/1000 S=1000*25/ π*25 S=320rpm 三、进给量(F值)的计算 F=S*Z*Fz F:进给量(mm/min) S:转速(rpm) Z:刃数 Fz:(实际每刃进给) 例题.一标准2刃立铣刀以2000rpm)速度切削工件,求进给量(F 值)为多少?(Fz=0.25mm) F=S*Z*Fz F=2000*2*0.25 F=1000(mm/min) 四、残料高的计算 Scallop=(ae*ae)/8R Scallop:残料高(mm) ae:XY pitch(mm) R刀具半径(mm) 例题. Φ20R10精修2枚刃,预残料高0.002mm,求Pitch为多 少?mm Scallop=ae2/8R 0.002=ae2/8*10 ae=0.4mm 五、逃料孔的计算 Φ=√2R2X、Y=D/4 Φ:逃料孔直径(mm) R刀具半径(mm) D:刀具直径(mm) 例题. 已知一模穴须逃角加工(如图), 所用铣刀为ψ10;请问逃角孔最小 为多少?圆心坐标多少? Φ=√2R2 Φ=√2*52 Φ=7.1(mm) X、Y=D/4 X、Y=10/4 X、Y=2.5 mm 圆心坐标为(2.5,-2.5) 六、取料量的计算 Q=(ae*ap*F)/1000 Q:取料量(cm3/min)ae:XY pitch(mm) ap:Z pitch(mm) 例题. 已知一模仁须cavity等高加工,Φ35R5的刀XY pitch是刀具的60%,每层切1.5mm,进给量为2000mm/min,求此刀具的取料量为多少? Q=(ae*ap*F)/1000
大学无机化学所有公式
所有公式: 1、注意单位,如焦耳,千焦。 2、加入溶液时注意体积变化引起的浓度的变化 3、能斯特方程注意正负号。 4、单质的标准绝对熵不等于零,?f G m ?(稳定态单质,T)=0 ?f G m ?(H + ,aq,T)=0 Chap 1 1、热力学温度:T= t + T0 (T0=273.15K) 2、理想气体状态方程:pV=nRT 用于温度不太低,压力不太高的真实气体 在SI 制中,p 的单位是Pa ,V 的单位是m 3,T 的单位是K ,n 的单位是mol ;R 是摩尔气体常数,R 的数值和单位与p,V,T 的单位有关,在SI 制中,R = 8.314 J·K -1·mol -1。 3、 4、分压 5、分体积定律 6、溶液的浓度 质量百分比浓度 B = mB/m = mB/(mB+mA) 以溶质(B)的质量在全部溶液的质量中占有的 百分比 质量摩尔浓度 bB = nB/mA 溶质(B)的物质的量与溶剂(A)的质量的比值物质的量分数(摩尔分数) ?= nB/(nB+nA) 溶质(B)的物质的量占全部溶液的物质的量的分数 物质的量浓度 cB = nB/V 溶质的物质的量除以溶液的总体积(与温度相关), 单位:mol?m-3, mol?dm-3, mol?L-1 Chap 2 1、体积功:气体发生膨胀或压缩做的功,一般条件下进行的化学反应,只作体积功 W= -p ?V = -p (V 终-V 始) 2、热和功不是状态函数 3、热力学第一定律:封闭体系中:?U = U 2 – U 1 = Q + W 4、焓:H = U + pV 等压时:Q p =H 2 – H 1 = ?H 若为理想气体,H = U + pV = U + nRT ?H = ?U + ?nRT 5、等容热效应Q V : ?U = Q V 等压反应热Qp :W= -p?V 则U = Qp + W = Qp -p ?V Qp = Qv + ??nRT 6、标准摩尔反应焓变:?r H m ? =??i ?f H m ?(生成物)? ??i ?f H m ?(反应物) =[y ?f H m ?(Y)+z ?f H m ?(Z)] – [a ?f H m ?(A)+b ?f H m ?(B)] 7、S m ?(B,相态,T) ,单位是J·mol -1·K -1 任一化学反应的标准摩尔熵变: ?rSm ? =??B Sm ?(生成物,T)-??B Sm ?(反应物,T)
初中常见化学方程式及常用计算公式
初中常见化学方程式及 常用计算公式 Company Document number:WTUT-WT88Y-W8BBGB-BWYTT-19998
初中常见化学方程式及常用计算公式 一.化合反应 二.分解反应 三.置换反应 四.复分解反应 1.盐酸和氢氧化钠反应:NaOH+HCl=NaCl+H 2O 2.中和胃酸的反应:Al (OH )3+3HCl=AlCl 3+3H 2O 3.熟石灰和硫酸反应:Ca(OH)2+H 2SO 4=CaSO 4+2H 2O 4.盐酸和硝酸银反应:AgNO 3+HCl=AgCl ↓+HNO 3 5.硫酸和氯化钡反应:BaCl 2+H 2SO 4=BaSO 4↓+2HCl 6.碳酸钙和过量盐酸反应:CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑ 7.碳酸氢钠和盐酸反应:NaHCO 3+HCl=NaCl+H 2O+CO 2↑ 8.碳酸钠和过量盐酸反应:Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑ 9.氢氧化钠和硫酸铜反应:2NaOH+CuSO 4=Na 2SO 4+Cu(OH)2↓ 10.氢氧化钙和碳酸钠反应:Ca(OH)2+Na 2CO 3=CaCO 3↓+2NaOH 11.氯化钙和碳酸钠反应:CaCl 2+Na 2CO 3=CaCO 3↓+2NaCl 12.硝酸银和氯化钠反应:AgNO 3+NaCl=AgCl ↓+NaNO 3 13.硫酸钠和氯化钡反应:BaCl 2+Na 2SO 4=BaSO 4↓+2NaCl 14.盐酸除铁锈:Fe 2O 3+6HCl=2FeCl 3+3H 2O 15.硫酸除铁锈:Fe 2O 3+3H 2SO 4=Fe 2(SO 4)3+3H 2O 16.氧化铜和硫酸反应:CuO +H 2SO 4=CuSO 4+H 2O 五.其他反应 1.二氧化碳和过量澄清石灰水反应:CO 2+Ca(OH)2=CaCO 3↓+H 2O 2.二氧化碳和过量氢氧化钠反应:CO 2+2NaOH=Na 2CO 3+H 2O 3.氢氧化钠吸收二氧化硫:SO 2+2NaOH=Na 2SO 3+H 2O 4.一氧化碳还原氧化铜:CO+CuO ?=Cu+CO 2 5.一氧化碳还原氧化铁:3CO+Fe 2O 3高温=2Fe+3CO 2 6.甲烷燃烧:CH 4+2O 2点燃=2H 2O+CO 2 7.酒精燃烧:C 2H 5OH+3O 2点燃 =3H 2O+2CO 2 8.葡萄糖在酶的作用下与氧气反应:C6H12O6+6O2酶=6H2O+6CO2
数控加工常用计算公式
国际标准一、挤牙丝攻内孔径计算公式: 公式:牙外径-1/2×牙距 例1:公式:M3×0.5=3-(1/2×0.5)=2.75mm M6×1.0=6-(1/2×1.0)=5.5mm 例2:公式:M3×0.5=3-(0.5÷2)=2.75mm M6×1.0=6-(1.0÷2)=5.5mm 二、一般英制丝攻之换算公式: 1英寸=25.4mm(代码) 例1:(1/4-30) 1/4×25.4=6.35(牙径) 25.4÷30=0.846(牙距) 则1/4-30换算成公制牙应为:M6.35×0.846 例2:(3/16-32) 3/16×25.4=4.76(牙径) 25.4÷32=0.79(牙距) 则3/16-32换算成公制牙应为:M4.76×0.79 三、一般英制牙换算成公制牙的公式: 分子÷分母×25.4=牙外径(同上) 例1:(3/8-24) 3÷8×25.4=9.525(牙外径) 25.4÷24=1.058(公制牙距)
则3/8-24换算成公制牙应为:M9.525×1.058 四、美制牙换算公制牙公式: 例:6-32 6-32 (0.06+0.013)/代码×6=0.138 0.138×25.4=3.505(牙外径) 25.4÷32=0.635(牙距) 那么6-32换算成公制牙应为:M3.505×0.635 1、孔内径计算公式: 牙外径-1/2×牙距则应为: M3.505-1/2×0.635=3.19 那么6-32他内孔径应为3.19 2、挤压丝攻内孔算法: 下孔径简易计算公式1: 牙外径-(牙距)/代码=下孔径 例1:M6×1.0 M6-(1.0×0.425)=5.575(最大下孔径) M6-(1.0×0.475)=5.525(最小) 例2:切削丝攻下孔内径简易计算公式: M6-(1.0×0.85)=5.15(最大) M6-(1.0×0.95)=5.05(最小) M6-(牙距)/代码=下孔径 例3:M6×1.0=6-1.0=5.0+0.05=5.05 五、压牙外径计算简易公式:
(完整word版)大学物理化学公式大全,推荐文档
热力学第一定律 功:δW =δW e +δW f (1)膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。 (2)非膨胀功δW f =xdy 非膨胀功为广义力乘以广义位移。如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。 热 Q :体系吸热为正,放热为负。 热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。 热容 C =δQ/dT (1)等压热容:C p =δQ p /dT = (?H/?T )p (2)等容热容:C v =δQ v /dT = (?U/?T )v 常温下单原子分子:C v ,m =C v ,m t =3R/2 常温下双原子分子:C v ,m =C v ,m t +C v ,m r =5R/2 等压热容与等容热容之差: (1)任意体系 C p —C v =[p +(?U/?V )T ](?V/?T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程: pV γ=常数 TV γ-1=常数 p 1-γT γ=常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=1 1 -γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1 nR -δ(T 1—T 2) 热机效率:η= 2 1 2T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β= 1 21 T T T - 焦汤系数: μJ -T =H p T ???? ????=-()p T C p H ?? 实际气体的ΔH 和ΔU : ΔU =dT T U V ??? ????+dV V U T ??? ???? ΔH =dT T H P ??? ????+dp p H T ???? ???? 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑B B γRT 化学反应热效应与温度的关系:()()()dT B C T H T H 2 1 T T m p B 1m r 2m r ? ∑??,+=γ 热力学第二定律
脱硫系统常用计算公式
1) 由于烟气设计资料,常常会以不同的基准重复出现多次,(如:干基湿基,标态实际态,实际O2 等),开始计算前一定要核 算统一,如出现矛盾,必须找出正确的一组数据,避免原始数据代错。 常用折算公式如下: 烟气量(dry)=烟气量(wet) >(1-烟气含水量%) 实际态烟气量=标态烟气量>气压修正系数x温度修正系数 烟气量(6%02) = ( 21-烟气含氧量)/ ( 21 -6%) S02 浓度(6%02 ) = ( 21 - 6%) / (21 -烟气含氧量) S02 浓度( mg/Nm3 ) =S02 浓度( ppm) x2.857 物料平衡计算 1 )吸收塔出口烟气量G2 G2= (G1 x (1 - mw1) X(P2/(P2-Pw2)) (X —mw2 )+ G3X (1- 0.21/K) ) >(P2/(P2-Pw2)) G1: 吸收塔入口烟气流量 mw1: 入口烟气含湿率 P2:烟气压力 Pw2 :饱和烟气的水蒸气分压 说明: Pw2 为绝热饱和温度下的水蒸气分压,该值是根据热平衡计算的反应温度,由烟气湿度表查得。(计算步骤见热平衡计 算) 2) 氧化空气量的计算 根据经验,当烟气中含氧量为6%以上时,在吸收塔喷淋区域的氧化率为50 - 60 %。采用氧枪式氧化分布技术,在浆池中氧化 空气利用率n 02=25-30%,因此,浆池内的需要的理论氧气量为: S=(G1 x q1-G2 x q2) x(1-0.6)/2/22.41 所需空气流量Qreq Qreq=S x22.4/(0.21 0.x3) G3= Qreq >K G3:实际空气供应量 K :根据浆液溶解盐的多少根据经验来确定,一般在 2.0-3左右。 3) 石灰石消耗量计算 W1=100x qs xns W1: 石灰石消耗量 qs: :入口S02 流量 n S兑硫效率 4) 吸收塔排出的石膏浆液量计算 W2=172xx qs xn s/Ss W2:石膏浆液量 Ss石膏浆液固含量 5) 脱水石膏产量的计算 W3=172xx qs xn s/Sg W3: 石膏浆液量 Sg:脱水石膏固含量(1-石膏含水量) 6) 滤液水量的计算 W4=W3-W2 W3: 滤液水量 7) 工艺水消耗量的计算 W5=18x (G4-G1-G3 x(1-0.21/K))+W3 (1x-Sg)+36x qs x n+W s WT
大学有机化学反应方程式总结较全完整版
大学有机化学反应方程 式总结较全 Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】
有 机化学 一、烯烃 1、卤化氢加成 (1) CH CH 2 R HX CH CH 3R X 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】 CH 2 C H 3CH + CH 3 C H 3X + CH 3 C H 3 +H + CH 2 +C 3X + C H 3X 主 次 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2) CH CH 2 R CH 2CH 2 R Br HBr ROOR 【特点】反马氏规则 【机理】 自由基机理(略) 【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。 【本质】不对称烯烃加成时生成稳定的自由基中间体。 【例】 CH 2 C H 3Br CH CH 2Br C H 3CH + CH 3 C H 3HBr Br CH 3CH 2CH 2Br CH CH 3 C H 3 2、硼氢化—氧化 CH CH 2 R CH 2CH 2R OH 1)B 2H 62)H 2O 2/OH - 【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】 2 C H3 3 H3 2 3 H3 2 CH CH2 C H3 2 CH CH=CH (CH3CH2CH2)3 - H3CH2CH2C 22 CH3 CH2 O CH 2 CH2CH3 H3CH2CH2C 2 CH2CH3 +O H- O H B-OCH2CH2CH3 CH2CH2CH3 H3CH2CH2C B OCH2CH2CH3 CH2CH2CH3 2 CH2CH3 HOO- B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO3 2 【例】 CH3 1)BH 3 2)H 2 O 2 /OH- CH3 H H OH 3、X 2 加成 C C Br/CCl C C Br Br 【机理】 C C C C Br Br C Br +C C Br O H2+ -H+ C C Br O H
