2013化学一轮复习课件:第五章 第2讲 元素周期律
高考化学(新课标)大一轮复习配套课件第5章-第2节 元素周期表和元素周期律(共83张PPT)

【答案】 (1)Na>Mg>Al>S>Cl (2)Na、Mg、Al (3)Cl2、S NaOH、Mg(OH)2、Al(OH)3 HClO4、H2SO4
HCl、H2S
元素周期表中三个七,二个一: 即 7 个周期,7 个主族,7 个副族;二个特殊的族:1 个Ⅷ族和 1 个零族。 , 周期表中各族的排列顺序: Ⅰ A、Ⅱ A、ⅢB、ⅣB、Ⅴ B、ⅥB、Ⅶ B、Ⅷ、 ⅠB、ⅡB、Ⅲ A、Ⅳ A、Ⅴ A、Ⅵ A、Ⅶ A、 0。 原子结构与周期表关系的 4 个关系式: ( 1)质子数=原子序数; ( 2)电子层数=周期序数; ( 3)最外层电子数=主族序数; ( 4)最低负价=主族序数- 8。
(3)元素周期表中主族元素性质的递变规律 同周期主族元素自左而右:原子半径逐渐 减小 ①原子半径 _____ 增大 同主族元素自上而下:原子半径逐渐_____
+1―→+7 最高正价:______________ 同周期 最高正价=主族序数(O、F除外) ②主要化合价:自左而右负价_______________ -4―→-1 非金属最低负价=-(8-族序数) 逐渐减弱 同周期自左而右__________ ③元素的金属性 逐渐增强 同主族自上而下__________
(6)同一主族元素的单质随着原子序数的增大, 熔沸点均 增大 ( )
(7)第 3 周期元素的最高化合价等于它所处的主族序数 ( ) (8)酸性: H3PO4> H2SO4> HClO4( (9)氢化物的稳定性: H2S> HF> H2O( ) )
(10)元素的性质随相对原子质量的递增呈现周期性的变 化( )
元素周期表 1.编排原则
原子序数 最外层电子数 层数
电子
2.结构 (1)周期(7 个横行,7 个周期) 短周期 序号 元素种数 1 2 2 3 4 长周期 5 6 7 32
高三化学高考备考一轮复习专题:元素周期表 元素周期律课件

题组二 微粒半径及元素金属性或非金属性强弱的比较 4.比较下列微粒半径的大小(用“>”或“<”填空):
(1)Na________Mg________Cl (2)Li________Na________K (3)Na+________Mg2+________Al3+ (4)F-________Cl-________Br- (5)Cl-________O2-________Na+________Mg2+ (6)Fe2+________Fe3+ 答案 (1)> > (2)< < (3)> > (4)< < (5)> > > (6)>
4.电负性 (1)含义:元素的原子在化合物中__吸__引__键__合__电__子__能力的标度。元素的电负性 越大,表示其原子在化合物中_吸__引__键__合__电__子___的能力越_强___。 (2)标准:以最活泼的非金属元素氟的电负性为___4_._0___作为相对标准,计算 得出其他元素的电负性(稀有气体未计)。 (3)变化规律 金属元素的电负性一般__小__于__1.8,非金属元素的电负性一般__大__于__1.8,而位 于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右。 在元素周期表中,同周期从左至右,元素的电负性逐渐__增__大__,同主族从上 至下,元素的电负性逐渐_减__小___。
(2)按价层电子排布分区 ①元素周期表分区简图
②各区元素化学性质及价层电子的排布特点
分区
元素分布
价层电子排布
元素性质特点
s区
ⅠA、ⅡA族
ns1~2
除氢外都是活泼金属元素;通常 是最外层电子参与反应
ⅢA族~ⅦA族、 p区
0族
ns2np1~6 (除He外)
通常是最外层电子参与反应(0族 除外)
2013版高考化学一轮复习课件第5单元-物质结构 元素周期律-山东科技版

考点
2009年
2010年
第五单元 │ 高考纵览 2010年 2011年 江苏13(选择); 全国新课标 11(选择); 全国 Ⅱ12(选择); 广东22(选 浙江8(选 择);全国 福建23(解答); 择);福建 新课标 23(解答); 13(选择); 元素推断 全国 Ⅰ29(解答) 天津7(解 浙江9(选 答);安徽 择);安徽 25(解答); 25(解答); 四川26(解 四川26(解 答) 答) 山东11(选择); 浙江 7 、 9( 选 10 海南11(选 本资料由书利华教育网(又名数理 择 ) ;天津 海南19— 化网)为您整理 择);安徽 考点 2009年
第五单元 │ 使用建议
2.总结归纳、形成体系、建成网络。要学 会精读教材,总结归纳,寻找有关物质结构 与物质性质的内在联系,将各类知识列成图 表,形成系统,建成知识网络,以达到优化 学习的目的。 3.运用图表数据,综合分析推理,寻找一 般规律。充分利用教材中的相关图表和数据, 通过综合分析推理,寻找或总结出规律性的 知识,以便灵活运用,如可以通过各种图表 和数据,总结出如下规律:核外电子排布规 13 本资料由书利华教育网(又名数理 化网)为您整理 律;微粒半径 高考纵览
2011年 安徽11(选择); 海南2、 重庆7(选 10(选择); 江苏13(选择); 择);浙江 山东11(选 全国Ⅰ6(选 8( 选择 ) ; 择);山东 择);北京 天津2(选 元素周期 7(选择); 11(选择); 择);福建 律 江苏8(选 上海20(选 7( 选择 ) ; 择);北京 择);四川 天津7(解 10(选择); 27(解答) 答);北京 9 本资料由书利华教育网(又名数理 天津7( 解答 ) 化网 )为您整理 25(解答)
2013届高三一轮复习化学教案第5章元素周期律
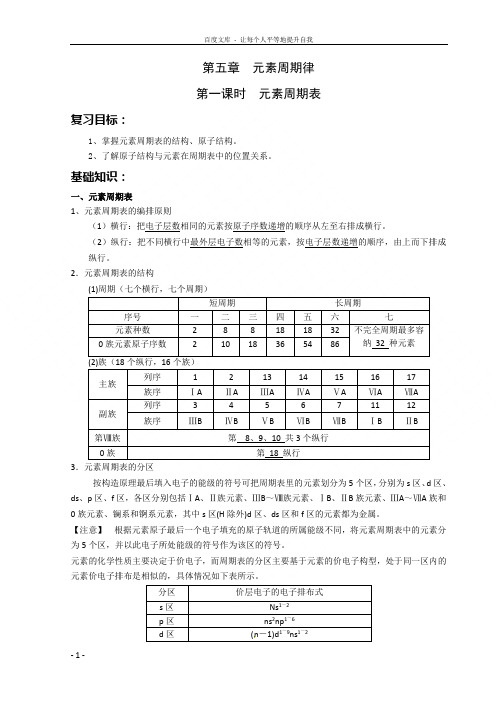
第五章元素周期律第一课时元素周期表复习目标:1、掌握元素周期表的结构、原子结构。
2、了解原子结构与元素在周期表中的位置关系。
基础知识:一、元素周期表1、元素周期表的编排原则(1)横行:把电子层数相同的元素按原子序数递增的顺序从左至右排成横行。
(2)纵行:把不同横行中最外层电子数相等的元素,按电子层数递增的顺序,由上而下排成纵行。
2.元素周期表的结构(1)周期(七个横行,七个周期)短周期长周期序号一二三四五六七元素种数 2 8 8 18 18 32 不完全周期最多容纳32 种元素0族元素原子序数 2 10 18 36 54 86主族列序 1 2 13 14 15 16 17 族序ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA副族列序 3 4 5 6 7 11 12 族序ⅢB ⅣB ⅤB ⅥB ⅦB ⅠB ⅡB第Ⅷ族第8、9、10 共3个纵行0族第18 纵行3.元素周期表的分区按构造原理最后填入电子的能级的符号可把周期表里的元素划分为5个区,分别为s区、d区、ds、p区、f区,各区分别包括ⅠA、Ⅱ族元素、ⅢB~Ⅷ族元素、ⅠB、ⅡB族元素、ⅢA~ⅦA族和0族元素、镧系和锕系元素,其中s区(H除外)d区、ds区和f区的元素都为金属。
【注意】根据元素原子最后一个电子填充的原子轨道的所属能级不同,将元素周期表中的元素分为5个区,并以此电子所处能级的符号作为该区的符号。
元素的化学性质主要决定于价电子,而周期表的分区主要基于元素的价电子构型,处于同一区内的元素价电子排布是相似的,具体情况如下表所示。
分区价层电子的电子排布式s区Ns1~2p区ns2np1~6d区(n-1)d1~9ns1~2ds区(n-1)d10ns1~2f区(n-2)f1~14(n-1)d0~2ns2★☆元素周期表1.元素周期表结构的记忆(1)七个横行七周期,三短三长一不全。
即一、二、三周期为短周期,长周期为四、五、六、七,其中第七周期还未填满。
(2)18纵行16族,7主7副0和Ⅷ。
2013年高考化学复习专题 元素周期律和元素周期表专题5课件

4.(2008·海南,14)根据元素周期表1~20号元素的
性质和递变规律,回答下列问题。
(1)属于金属元素的有
种,金属性最强的
元素与氧反应生成的化合物有
(填两种化
合物的化学式);
(2)属于稀有气体的是
(填元素符号,下
同);
(3)形成化合物种类最多的两种元素是 ;
(4)第三周期中,原子半径最大的是
(稀
一、元素推断题的一般思路
二、有关推断必备知识与题型分析 题型一由主族元素在周期表中的位置推断 解题指导 1.牢记元素周期表的结构(能区分长短周期、主 副族、每周期的元素数目等)是求解的基础,一定要 “心中有表”。 2.熟悉主族元素在周期表中的特殊位置 ①族序数等于周期数的元素:H、Be、Al。 ②族序数等于周期数2倍的元素: C、S。 ③族序数等于周期数3倍的元素:O。 ④周期数是族序数2倍的元素:Li。
【例2】 A、B、C、D、E都是元素周期表中前20号
元素,原子序数依次增大,A是地壳中含量最高的
元素,B、C、D同周期,E和其他元素既不在同周
期也不在同主族,D的氢化物和最高价氧化物的水
化物均为强酸,且B、C、D的最高价氧化物的水
化物两两混合均能发生反应生成盐和水。据此回答
下列问题:
(1)A和D的氢化物中,沸点较低的是 (选
(3)次氯酸钙 ClO-+2H++Cl-
Cl2↑+H2O
题型三 综合利用“位”、“构”、“性”的关
系推断
解题指导 这类题目综合性强,难度较大,但若
对元素周期律的实质和元素周期表的结构知识熟练掌
握,这一类问题便能顺利求解。
【典例3】 根据下表中有关短周期元素性质的数据,
高考化学一轮复习学案课件(人教版)第5章物质结构元素周期律第2节元素周期律(1)

答案:
一、1. K L M N O P Q 由近到远 由低到高 2.(1)能量低 (2)2n2 (3)8 2 (4)18 2 32 二、1. 性质 原子序数 周期性 2. 核外电子排布 3. 减小 增大 相同 逐渐增多 逐渐增多 相同 减弱 增强 增强 减弱 减弱 增强
增强 减弱 主族序数 主族序数 增强 减弱 减弱 容易 增强 难 减弱
其他
分子 Ar F2、HCl
离子
K+、Ca2+、Cl-、 S2-
O22-、HS-
H2S
PH3、H2O2
SiH4、CH3F
N2H4、CH3OH
C2H6、CH3NH2等
【温馨提示】上表中有些18电子粒子符合“9+9”规律,如 C2H6、H2O2、N2H4、F2、CH3F、CH3OH等(-CH3、-OH、 -NH2、-F为9电子基团)。
三、2. (1)金属与非金属的分界线 (2)过渡元素 (3)右上角
原子核外电子的排布
【自主解答】
C 解析:K层电子数为奇数的元素只有H,A正确;L层或M层电 子数为奇数时,此层为最外层,族序数等于最外层电子数,B、D 均正确;第二周期以后元素的L层中电子数均为8个,但族序数与L 层电子数无关,C错误。
非金属元素气态氢化物 的形成与稳定性
最高正价=______最 低负价=主族序数-8
酸性逐渐________碱 性逐渐________
气态氢化物的形成越来 越______,其稳定性 逐渐______
最高正价数= ________(O、F除外)
酸性逐渐________碱 性逐渐________
气态氢化物的形成越来 越______,其稳定性 逐渐______
②最高价氧化物性也就越强。
