中国药典 药品包装规格
药包材通用要求指导原则

药包材通用要求指导原则《中国药典》2015年版四部通则9621药包材即直接与药品接触的包装材料与容器,是指药品生产企业生产药品与医疗机构配制的制剂所使用的直接与药品接触的包装材料与容器。
作为药品的一部分,药包材本身的质量、安全性、使用性能与药包材与药物之间的相容性对药品质量有着十分重要的影响。
药包材是由一种或者多种材料制成的包装组件组合而成,应具有良好的安全性、习惯性、稳固性、功能性、保护性与便利性,在药品的包装、贮藏、运输与使用过程中起到保护药品质量、安全、有效、实现给药目的(如气雾剂)的作用。
药包材能够按材质、形制与用途进行分类。
按材质分类可分为塑料类、金属类、玻璃类、陶瓷类、橡胶类与其他类(如纸、干燥剂)等,也能够由两种或者两种以上的材料复合或者组合而成(如复合膜、铝塑组合盖等)。
常用的塑料类药包材如药用低密度聚乙烯滴眼剂瓶、口服固体药用高密度聚乙烯瓶、聚丙烯输液瓶等;常用的玻璃类药包材有钠钙玻璃输液瓶、低硼硅玻璃安瓿、中硼硅管制注射剂瓶等;常用的橡胶类药包材有注射液用氯化丁基橡胶塞、药用合成聚异戊二烯垫片、口服液体药用硅橡胶垫片等;常用的金属类药包材如药用铝箔、铁制的清凉油盒。
按用途与形制分类可分为输液瓶(袋、膜及配件)、安瓿、药用(注射剂、口服或者者外用剂型)瓶(管、盖)、药用胶塞、药用预灌封注射器、药用滴眼(鼻、耳)剂瓶、药用硬片(膜)、药用铝箔、药用软膏管(盒)、药用喷(气)雾剂泵(阀门、罐、筒)、药用干燥剂等。
药包材的命名应按照用途、材质与形制的顺序编制,文字简洁,不使用夸大修饰语言,尽量不使用外文缩写。
如口服液体药用聚丙烯瓶。
药包材在生产与应用中应符合下列要求。
药包材的原料应通过物理、化学性能与生物安全评估,应具有一定的机械强度、化学性质稳固、对人体无生物学意义上的毒害。
药包材的生产条件应与所包装制剂的生产条件相习惯;药包材生产环境与工艺流程应按照所要求的空气洁净度级别进行合理布局,生产不洗即用药包材,从产品成型及以后各工序其洁净度要求应与所包装的药品生产洁净度相同。
《中国药典》2020年版格式质量标准撰写专题一之一般要求

《中国药典》2020年版格式质量标准撰写专题一
之一般要求
《中国药典》是我国法定的药物质量标准参考书,对于确保药品质量和安全具有重要意义。
以下是《中国药典》2020年版中关于质量标准撰写的一般要求:
1.目的与适用范围:每个质量标准应明确阐述其目的,并确定适用范围,包括适用的药品种类、规格和剂型。
2.引用文献:质量标准应引用相关的国内外法规、标准、药典及其他公开的技术文献,以确保标准的科学性和权威性。
3.命名与编号:每个质量标准应具有唯一的名称和编号,便于标识和查找。
4.结构与组织:质量标准应按照一定的结构和组织方式进行撰写,通常包括通则、检查项目、分析方法、标识、包装和贮存要求等内容。
5.术语定义:质量标准中应对其中涉及的术语进行定义,确保各方理解的一致性。
6.检查项目:质量标准应明确规定药品的各项检查项目,包括理化性质、含量测定、杂质检查等。
7.分析方法:质量标准应详细描述用于检验药品的分析方法,包括仪器设备、试剂、操作步骤、计算公式等。
8.限度要求:质量标准中应规定药品各项指标的限度要求,以判断是否符合质量标准。
9.标识要求:质量标准应包括药品的标识要求,如产品名称、生产厂商、批号等。
10.包装和贮存要求:质量标准中应规定药品的包装和贮存要求,以确保药品在使用过程中的稳定性和安全性。
以上是《中国药典》2020年版格式质量标准撰写的一般要求。
质量标准的撰写
应严格遵循这些要求,以确保药品质量的科学性和可靠性。
药品包装用铝箔(YBB00152002)

精心整理国家药品监督管理局国家药品包装容器(材料)标准(试行)YBB00152002药品包装用铝箔囊剂等)检查台0.1—的规定0.5g/(m 2的向PVC 度155±进行180°角方向剥离,不得低于7.0N/15mm(PVC);不得低于6.0N/15mm(PVDC)。
【保护层粘合性】取一张纵向长90mm ,宽为全幅的试样(注意试样不应有皱折)。
将试样平放在玻璃板上,保护层向上,取聚酯胶粘带(与铝箔的剥离力不小于2.94N/20mm)一片,横向均匀地贴压试样表面,以160°~180°方向迅速剥离(见图1),保护层表面应无明显脱落。
图1【保护层耐热性】取100mm×100mm 试样三片,分别将试样的保护层与铝箔原材叠合,置于热封仪中,进行热封(热封条件:温度200℃,压力0.2Mpa ,时间1s),取出放冷,将试样与铝箔原材分开,观察保护层表面应无明显粘落。
【粘合剂涂布量差异】取100mm×100mm试样五片,分别精密称定(质量m1),用乙酸乙酯或其他溶剂擦去粘合剂,再精密称定(质量m2)。
m1与m2之差即为粘合剂的涂布量,同时计算五片涂布量的平均值,各片涂布量与平均值之间的差异均应在±10.0%以内。
【开卷性能】取100mm×100mm试样四片,将试样粘合层与保护层叠合,置于一块大小适宜的平板上,依次在试样上放置20mm×20mm的小平板与1.0kg砝码(见图2),于40℃烘箱中,保温2h后,取出,观察,粘合层面与保护层面不得粘合。
图2【破裂强度】取40mm×40mm试样三片,分置破裂强度仪上,测定,均不得低于98Kpa。
【荧光物质】取100mm×100mm试样五片,分别置于紫外灯下,在254nm和365nm波长4mg。
500ml)℃维持30min1ml,煮沸3)滴国药典0.9%21分钟,J)测定。
变更国内生产药品包装规格申报指南
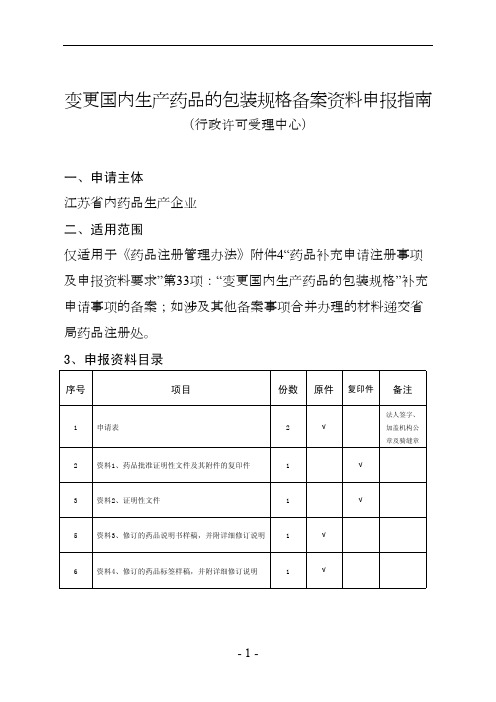
不得比通用名称更突出和显著,其字体以单字面积计不得大于 通用名称所用字体的二分之一。
16 药品说明书和标签中禁止使用未经注册的商标以及其他 未经国家食品药品监督管理局批准的药品名称。 药品标签使用注册商标的,应当印刷在药品标签的边角,含文 字的,其字体以单字面积计不得大于通用名称所用字体的四分 之一。
-7-
8 资料6、临床试验资料
1
√
资料7、药品说明书和标签备案情况承诺书及修订后
9
1
√
说明书标签样稿
用于说明书 标签备案
资料8、行政许可(行政确认)申请材料真实性保证
11
1
√
声明
省局网站下 载固定格式
四、申报资料要求
1、申报资料应按照目录顺序用A4纸打印装订成册并放入档
案袋,张贴封面后递交到受理窗口;
2、申请表由国家总局报盘系统生成(2016年12月2日公布版
7、第14项包装: 直接接触药品的药包材:系指直接接触药品的包装材料或 容器,如有多个包装材质要分别填写,中间用句号分开,例如“ 玻璃瓶。塑料瓶”(注意:结尾不加句号); 包装规格:是指基本包装单元的规格,药品的基本包装单 元,是药品生产企业生产供上市的药品最小包装,如:每瓶×片 ,每瓶×毫升,每盒×支,对于按含量或浓度标示其规格的液体 、半固体制剂或颗粒剂,其装量按包装规格填写。配用注射器 、输液器或者专用溶媒的,也应在此处填写。每一份申请表可 填写多个包装规格,不同包装规格中间用句号分开,书写方式 为“包装材质:包装规格”,例如:“玻璃瓶:每瓶30片。塑料瓶 :每瓶100片”(注意:结尾不加句号),多个规格的按上述顺
本)其中申请表纸质版2份,本表打印表格各页边缘应当骑缝加
盖负责办理申请事宜机构的公章。电子申请表RVT格式1份;
2020版《中国药典》药包材—药用塑料材料和容器通则公示稿(1)

药用塑料材料和容器通则药用塑料材料是以高分子聚合物或合成树脂粒料为主要组分,并添加增塑剂、稳定剂等助剂制成的。
塑料粒料有均聚物和共聚物两种类型,常用的塑料粒料有聚乙烯、聚丙烯、聚对苯二甲酸乙二醇酯、聚碳酸酯、乙烯-醋酸乙烯共聚物等。
药用塑料容器一般由热塑性塑料粒料或材料成型加工而成的中空容器,成型工艺包括挤出吹塑成型、注射注吹、注拉吹成型、多层共挤吹塑成型等。
药用塑料材料和容器单独或与其他材料组合成包装系统后可用于包装所适用的药品。
也可以采用吹灌封(BFS)工艺直接生产药品。
药用塑料材料和容器在生产和使用中应符合下列规定。
一、药用塑料材料和容器使用的塑料粒料的选择和使用应与生产容器的种类和给药途径相匹配,并确保药品的安全性。
药品包装用塑料材料和容器的生产不得使用再生塑料。
塑料添加剂及用量应符合安全性要求,其中每种粒料所含抗氧剂的种类一般不超过 3 种,总量不超过 0.3%。
二、药品包装用塑料材料和容器的配方,应确定原辅材料的化学名称、粒料牌号(型号)、质量标准、来源(生产商名称)、在配方中的功能、用量范围以及比例,并应进行相应的安全性评估,保证使用安全。
三、药用塑料容器的生产工艺应稳定,应采用确定的起始原辅材料、生产条件和工艺步骤。
并控制原辅材料、中间产品、最终产品的主要理化性质。
如产品涉及印刷,应确定印刷工艺及采用的印刷介质等相关信息,不得使用含苯及苯类溶剂的油墨。
对于塑料输液瓶产品,在确定封口方式后,应开展清洗工艺和密封完整性验证研究。
四、药用塑料材料和容器应有化学稳定性,药品生产企业应根据相容性研究结果选择适宜的塑料容器。
五、药用塑料容器因其有半透过的特性,在用于包装液体制剂时,应选择适宜的实验条件进行药物稳定性和相容性研究。
口服和外用液体制剂不宜选用阻隔性能较差的低密度聚乙烯容器,聚氯乙烯材料可用于口服固体制剂泡罩包装,不得用于输液用软袋(腹膜透析液、冲洗液除外)及其他液体制剂等的包装。
中药材及饮片包装贮藏运输技术规范指导原则

中药材及饮片包装贮藏运输技术规范指导原则一、前言中药材及饮片包装贮藏运输过程是一个极其重要的环节,包材的选择、包装的方式以及贮藏运输过程的保管与养护,均直接影响中药材及饮片的质量稳定和患者的用药安全。
保证中药材及饮片包装贮藏运输过程的规范性、合理性,是保证中药材及饮片质量稳定的重要途径。
为促进产业健康发展,保障临床用药安全有效,根据《中华人民共和国药品管理法》、《中华人民共和国中医药法》、《中药材质量生产规范》、《中共中央国务院关于促进中医药传承创新发展的意见》、《中药材保护和发展规划(2015—2020年)》(国办发〔2015〕27号)、《四川省中药材产业发展规划(2018-2025年)》(川中医药强省办发〔2019〕6号)、《国家中医药管理局中药饮片包装管理办法(试行)》(国中医药生〔1998〕11号)、《中药材包装技术规范》(SB/T 11182-2017)、《中药材仓储管理规范》(SB/T 11094-2014)、《药品生产质量管理规范(2010年修订)》等制定本技术指导原则。
本指导原则适用于中药材及中药饮片的包装贮藏运输技术研究,包括制定新的中药材及饮片包装贮藏运输规范,以及已有中药材及饮片包装贮藏运输规范的修订。
本指导原则供中药材及饮片生产者和销售者、科研院校等参照执行,随着先进技术的发展和科学研究的进展,本指导原则中的相关内容将不断完善。
二、基本要求1.中药材及饮片包装贮藏运输技术规范的制定必须在总结传统经验的基础上,结合《中国药典》、《部颁标准》、《四川省中药饮片炮制规范》(2015年版)、《四川省中药材标准》(2010年版)、《四川省藏药材标准》(2014年版)、《国家中医药管理局中药饮片包装管理办法(试行)》等国家、地方标准,通过科学的研究评价,并在实践中应用证实是切实可行的。
2.除另有规定外,中药材及饮片包装贮藏运输规范的研究所用术语、符号、计量单位、检验方法及相关要求等,均执行有关规定。
药品质量标准

药品标准——局颁标准
未列入药典的其他药品标准,由国家药品监 督管理部门另行成册颁布,成为局颁标准。药 品局颁标准的收载范围是:
1.国家药品监督管理部门批准的新药; 2.疗效肯定,但质量标准仍需要进一步改进的药品; 3.上版药典收载,而新版药典未收入。疗效肯定,国内仍然生产使 用,需要统一标准的品种; 4.原来地方标准收载,医疗常用,但生产地较多,需要统一标准的 品种。
药品标准
2001年以前:
药品标准 国家药品标准 地方标准 《中国药典》 注册标准 部颁标准 局颁标准 《中国药典》 注册标准 部颁标准 局颁标准
2001年以后:
药品标准
国家药品标准
药品标准——药典标准
药典是记载国家药品标准 的法典,由国家组织药典委员会 编纂,并由国务院药品监督管理 部门批准颁布实施,具有法律约 束力。
5 项 目 与 要 求 制法项下主要记载药品的重要工艺要求和质量管理要求; 所有药品的生产工艺应经验证,并经国务院药品监督管理 部门批准,生产过程均应符合《药品生产质量管理规范》 (GMP)的要求; 来源于动物组织提取的药品,其所属动物种属要明确,所 用脏器均应来自经检疫的健康动物,涉及牛源的应取自无牛 海绵状脑病地区的健康牛群;来源于人尿提取的药品,均应 取自健康人群。上述药品均应有明确的病毒灭活工艺要求以 及质量管理要求;
第四章
药品质量标准
Contents
1
2
药品质量标准 药典概况
药品标准
药品标准(drug standard):是国家对
药品质量规格及检验方法所作的技术规定,是 药品生产、供应、使用、检验和管理部门共同 遵循的法定依据。
目前药品所有执行标准均为国家注册标准包括
1.药典标准 2.卫生部中药成方制剂一至二十一册 3.卫生部化学、生化、抗生素药品第一分册 4.卫生部药品标准(二部)一册至六册; 5.卫生部药品标准藏药第一册、蒙药分册、维吾尔药分册; 6.新药转正标准1至76册(正不断更新) 7.国家药品标准化学药品地标升国标一至十六册; 8.国家中成药标准汇编内科心系分册、内科肝胆分册、内科 脾胃分册、内科气血津液分册、内科肺系(一)、(二)分册、 内科肾系分册、外科妇科分册、骨伤科分册、口腔肿瘤儿科分册 、眼科耳鼻喉皮肤科分册、经络肢体脑系分册; 9.国家注册标准(针对某一企业的标准,但同样是国家药品 标准) 10.进口药品标准
药品包装用铝箔(YBB00152002)

国家药品监督管理局国家药品包装容器(材料)标准(试行)YBB00152002药品包装用铝箔Aluminium foils packaging for medicine本标准适用于与聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC)等硬片粘合,用于固体药品(片剂、胶囊剂等)包装用的铝箔。
本品涂有保护层和粘合层。
【外观】取本品适量,在自然光线明亮处,正视目测。
表面应洁净、平整、涂层均匀。
文字、图案印刷应正确、清晰、牢固。
【针孔度】取长400mm,宽250mm(当宽小于250mm时,取卷幅宽)试样十片,逐张置于针孔检查台(800mm×600mm×300mm或适当体积的木箱,木箱内安装30W日光灯,木箱上面放一块玻璃板,玻璃板衬黑纸并留有400mm×250mm空间以检查试样的针孔)上,在暗处检查其针孔。
不应有密集的、连续性的、周期性的针孔;每一平方米中,直径大于0.3mm的针孔不允许有;直径为0.1—0.3mm的针数不得过1个。
【阻隔性能】水蒸气透过量照塑料薄膜和片材透水蒸气性试验方法杯式法(GB1037-88)的规定进行。
试验时热封面向湿度低的一侧,试验温度(38±2)℃,相对湿度(90±5)℃,不得过0.5g/(m2·24h) 。
【粘合层热合强度】除另有规定外,取100 mm×100mm的本品二片,另取100 mm×100mm 的标准聚乙烯固体药用硬片(或聚氯乙烯/聚偏二氯乙烯固体药用复合硬片)二片。
将试样的粘合层面,向PVC面(或PVC/PVDC复合硬片的PVDC面)进行叠合。
置于热封仪进行热合,热合条件为:温度155℃±5℃,压力0.2Mpa,时间1s,热合后取出放冷,用标准裁切器切成15mm宽的试样,取中间三条供试验,试样应在温度23℃±2℃以,相对湿度50%±5%的环境中,放置4小时以上,并在上述条件下进行试验。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国药典药品包装规格
中国药典是中国国家药典委员会编制的药典,药品包装规
格是其中的一部分。
药品包装规格主要包括以下内容:
1. 药品名称:药品的通用名称或商品名称。
2. 药品规格:药品的规格,通常以含量单位表示,如mg、
g、ml等。
3. 药品剂型:药品的剂型,如片剂、胶囊剂、注射剂、口
服液等。
4. 药品包装材料:药品包装所使用的材料,如塑料瓶、玻
璃瓶、铝塑包装等。
5. 药品包装容量:药品包装所容纳的药品数量,通常以单
位数量和含量单位表示,如片剂每瓶100片、胶囊剂每瓶
30粒等。
6. 药品包装形式:药品包装的形式,如瓶装、袋装、盒装等。
7. 药品包装标志:药品包装上的标志,包括药品名称、规格、剂型、生产厂家等信息。
8. 药品包装要求:药品包装的要求,包括密封性、防潮性、防光性、防震性等。
需要注意的是,具体的药品包装规格可能因药品的特殊性质而有所差异,以上仅为一般药品包装规格的参考。
在实际使用药品时,应根据药品包装上的具体规格进行使用。
