高考化学配位化合物题
高考化学复习考点题型讲解与练习51配位键、配合物、螯合物

高考化学复习考点题型讲解与练习1.(2022·全国高三专题练习)关于化学式为[TiCl(H2O)5]Cl2·H2O的配合物,下列说法中正确的是()A.配体是Cl-和H2O,配位数是9B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+C.内界和外界中Cl-的数目比是1∶2D.加入足量AgNO3溶液,所有Cl-均被完全沉淀2.(2022·成都高三期中)下列关于化学键的说法正确的是()A.配位键只存在于配合物中B.任何两原子形成的共价键均有方向性C.形成共价键的电子云优先以头碰头形式重叠D.H2O能和H+结合生成H3O+,说明共价键没有饱和性3.(2022·泰安高三模拟)胆矾CuSO4·5H2O可写为[Cu(H2O)4]SO4·H2O,其结构示意图如下:下列有关胆矾的说法正确的是()A.Cu2+的价电子排布式为3d84s1B.所有氧原子都采取sp3杂化C.胆矾中含有的粒子间作用力有离子键、极性键、配位键和氢键D.胆矾所含元素中,H、O、S的半径及电负性依次增大4.(2022·山东济宁一中高三月考)镍能形成多种配合物如正四面体形的Ni(CO)4和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。
下列说法正确的是()A.Ni(CO)4和[Ni(CN)4]2-中,镍元素均是sp3杂化B.NH3的立体结构为平面三角形C.CO分子内σ键和π键个数之比为1∶2D.Ni2+在形成配合物时,其配位数只能为45.向盛有硫酸铜溶液的试管中滴加氨水,先生成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色透明溶液。
下列对此现象的说法正确的是()A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+C.配位化合物中只有配位键D.在[Cu(NH3)4]2+配离子中,Cu2+给出孤电子对,NH3提供空轨道6.下列关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是()A.配体为H2O,配位原子为O,外界为Br-B.中心离子的配位数为6C.在水溶液中,所有的Br-都能完全电离D.Cr的化合价为+27.镍及其化合物是重要的合金材料和催化剂。
高中化学如何解决配位化合物问题

高中化学如何解决配位化合物问题高中化学中,配位化合物是一个重要的概念,涉及到配位键、配位数、配位体等多个知识点。
解决配位化合物问题需要理解相关概念,并掌握一些解题技巧。
本文将从配位键、配位数和配位体三个方面,介绍如何解决配位化合物问题。
一、配位键配位键是配位化合物中金属离子和配位体之间的化学键。
在解决配位化合物问题时,我们需要确定配位键的类型和数量。
常见的配位键有配位键和离子键两种。
例如,对于[Co(NH3)6]Cl3这个化合物,配位键的类型为配位键。
其中,Co与NH3形成配位键,Cl与Co形成离子键。
配位键的数量等于配位体的数量,即6个。
二、配位数配位数是指一个金属离子周围配位体的数量。
在解决配位化合物问题时,我们需要确定金属离子的配位数。
配位数的大小与金属离子的电子排布有关。
例如,对于[Fe(CN)6]4-这个化合物,Fe的配位数为6。
这是因为Fe离子的电子排布为3d6,4s2,其中3d6电子构成了配位键,配位键的数量为6,所以配位数为6。
三、配位体配位体是指与金属离子形成配位键的化合物或离子。
在解决配位化合物问题时,我们需要确定配位体的类型和数量。
不同的配位体会影响到配位化合物的性质。
例如,对于[Co(NH3)6]Cl3这个化合物,配位体的类型为氨。
其中,Co与6个氨分子形成配位键。
配位体的数量等于配位键的数量,即6个。
通过以上的例子,我们可以总结出解决配位化合物问题的一些技巧和方法:1. 确定配位键的类型和数量:根据化合物中金属离子和配位体之间的化学键类型,确定配位键的类型;根据配位体的数量,确定配位键的数量。
2. 确定金属离子的配位数:根据金属离子的电子排布,确定其配位数。
一般来说,d轨道上的电子参与配位键的形成,所以配位数通常与d电子的数量有关。
3. 确定配位体的类型和数量:根据与金属离子形成配位键的化合物或离子,确定配位体的类型;根据配位键的数量,确定配位体的数量。
除了以上的基本技巧,我们还可以通过一些练习题来加深对配位化合物问题的理解。
微专题33配位键的形成及配合物的组成与性质

高考总复习第1轮 化学
返回导航
第十一章 物质结构与性质 (选修3)
(3)(2020·江苏卷,21-A(1))[Fe(H2O)6]2+中与 Fe2+配位的原子是O__(填元素符 号)。
高考总复习第1轮 化学
返回导航
第十一章 物质结构与性质 (选修3)
解析:(1)图中虚线代表氢键,从氢键处断裂,可得[Cu(H2O)4]2+、H2O、SO24- , 故用配合物的形式表示胆矾的化学式为[Cu(H2O)4]SO4·H2O。SO24- 离子的中心 原子价层电子对数为 4,不含孤电子对,则 S 原子采取 sp3 杂化,SO24- 的空间构 型为正四面体形。
高考总复习第1轮 化学
返回导航
第十一章 物质结构与性质 (选修3)
解析:(1)[Cr(NH3)3(H2O)2Cl]2+中心离子是 Cr3+,配位体为 NH3、H2O 和 Cl-, 故中心离子的配位数为 3+2+1=6;提供电子对形成配位键的原子是 N、O、Cl。
(2)NH3BH3 分子中,N 原子提供孤电子对,B 原子提供空轨道,形成配位键 (N→B)。
高考总复习第1轮 化学
返回导航
第十一章 物质结构与性质 (选修3)
(2)Cu 能与(SCN)2 反应生成 Cu(SCN)2。1 mol (SCN)2 中含有的 π 键数目为 __4_N_A__ ; (SCN)2 对 应 的 酸 有 两 种 , 分 别 为 硫 氰 酸 (H—S—C≡N) 和 异 硫 氰 酸 (H—N===C===S),其中异硫氰酸的沸点较高,原因是_异__硫__氰__酸__分__子__之__间__能__形___ _成__氢__键__。
高中化学配位化合物几何结构解题技巧

高中化学配位化合物几何结构解题技巧高中化学中,配位化合物是一个重要的概念,涉及到化学键的形成和分子的空间结构。
在解题过程中,正确理解和应用配位化合物的几何结构是至关重要的。
本文将介绍一些解题技巧,帮助高中学生和他们的父母更好地理解和应用配位化合物的几何结构。
首先,我们需要了解配位化合物中的配位数。
配位数是指一个中心金属离子周围配位体的数目。
常见的配位数有2、4、6等。
在解题中,如果题目中给出了配位数,我们可以根据配位数来确定配位化合物的几何结构。
以配位数为4为例,当配位数为4时,配位化合物的几何结构可以是四面体结构或平面方形结构。
四面体结构是指中心金属离子与四个配位体形成四个键,形成一个四面体的结构。
而平面方形结构则是指中心金属离子与四个配位体形成四个键,形成一个平面方形的结构。
在解题过程中,我们可以通过一些特定的情况来判断配位化合物的几何结构。
例如,如果配位体是相同的,且中心金属离子的电子排布是d2sp3杂化的,那么配位化合物的几何结构很可能是四面体结构。
又如,如果配位体是相同的,且中心金属离子的电子排布是dsp2杂化的,那么配位化合物的几何结构很可能是平面方形结构。
除了配位数为4的情况,对于其他配位数,我们也可以通过一些规律来判断配位化合物的几何结构。
例如,当配位数为6时,配位化合物的几何结构往往是八面体结构或六面体结构。
八面体结构是指中心金属离子与六个配位体形成六个键,形成一个八面体的结构。
而六面体结构则是指中心金属离子与六个配位体形成六个键,形成一个六面体的结构。
在解题中,我们可以通过一些特定的情况来判断配位化合物的几何结构。
例如,如果配位体是相同的,且中心金属离子的电子排布是d2sp3杂化的,那么配位化合物的几何结构很可能是八面体结构。
又如,如果配位体是相同的,且中心金属离子的电子排布是dsp2杂化的,那么配位化合物的几何结构很可能是六面体结构。
此外,在解题过程中,我们还需要注意一些特殊情况。
人教版选修三物质结构和性质——配位键疑难释疑

人教版选修三物质结构与性质——配位键高考题汇编1. 气态氯化铝(Al2Cl6) 是具有配位键的化合物,分子中原子间成键的关系如下图所示,请将图中,你认为是配位键的斜线上加上箭头。
2.①AICl3在NaCl、KCI融熔盐中能形成Al2CI7-,其结构如图所示。
其中AI原子的杂化轨道类型为____ , 配位键数目为____.3.在CrCI3的水溶液中,一定条件下存在组成为[CrCI n(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H) ,可发生离子交换反应:[CrCI n(H2O)6-n]x++xR-H→R x[CrCI n(H2O)6-n]+xH+交换出来的H经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015mol[CrCI n(H2O)6-n]x+的溶液,与R-H 完全交换后,中和生成的H+需浓度为0.1200 mol/LNaOH溶液25.00ml可知该配离子的化学式为.[答案][CrCI(H2O)5]2+[解析](3)根据提供数据,该配离子通过离子交换树脂后生成的n(H+)=0.1200mol/Lx0.025L=0.003mol,则1:X=0.0015:0.003,解得x=2。
则该配离子的化学式为[CrCI(H2O)5]2+.4.元素W(Cu)的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是________,它可与浓盐酸发生非氧化还原反应,生成配合物H n WCl3,反应的化学方程式为________________________,[答案]CuCI CuCI+2HCI===H2CuCI3(或CuCI+2HCI===H2[CuCl3])5.金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是,反应的化学方应程式为[答案]H2O2为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行。
Cu+H2O2+4NH3===[Cu(NH3)4]2++20H-6.向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。
全国高中生化学竞赛试题3 配位化合物(答案)
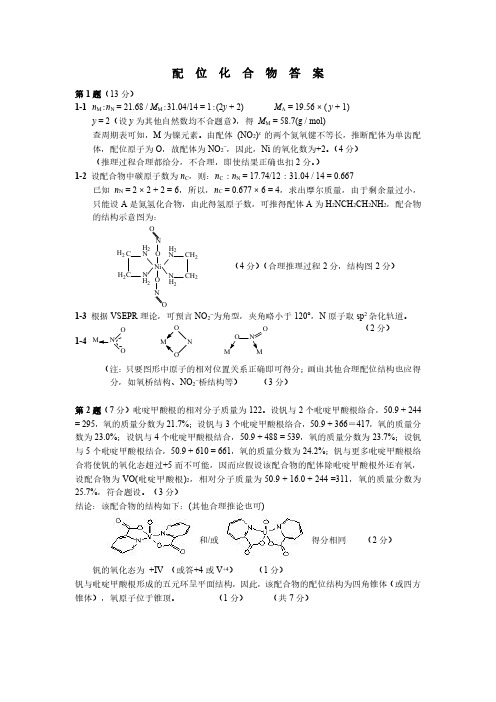
配位化合物答案第1题(13分)1-1n M :n N =21.68/M M :31.04/14=1:(2y +2)M A =19.56×(y +1)y =2(设y 为其他自然数均不合题意),得M M =58.7(g /mol)查周期表可知,M 为镍元素。
由配体(NO 2)x 的两个氮氧键不等长,推断配体为单齿配体,配位原子为O ,故配体为NO 2-,因此,Ni 的氧化数为+2。
(4分)(推理过程合理都给分,不合理,即使结果正确也扣2分。
)1-2设配合物中碳原子数为n C ,则:n C :n N =17.74/12:31.04/14=0.667已知n N =2×2+2=6,所以,n C =0.677×6=4,求出摩尔质量,由于剩余量过小,只能设A 是氮氢化合物,由此得氢原子数,可推得配体A 为H 2NCH 2CH 2NH 2,配合物的结构示意图为:N C CN NC C N H 2H 2H 2H 2H 2H 2H 2H 2Ni NNOO OO(4分)(合理推理过程2分,结构图2分)1-3根据VSEPR 理论,可预言NO 2-为角型,夹角略小于120°,N 原子取sp 2杂化轨道。
1-4O NONOOON O (2分)(注:只要图形中原子的相对位置关系正确即可得分;画出其他合理配位结构也应得分,如氧桥结构、NO 2-桥结构等)(3分)第2题(7分)吡啶甲酸根的相对分子质量为122。
设钒与2个吡啶甲酸根络合,50.9+244=295,氧的质量分数为21.7%;设钒与3个吡啶甲酸根络合,50.9+366=417,氧的质量分数为23.0%;设钒与4个吡啶甲酸根结合,50.9+488=539,氧的质量分数为23.7%;设钒与5个吡啶甲酸根结合,50.9+610=661,氧的质量分数为24.2%;钒与更多吡啶甲酸根络合将使钒的氧化态超过+5而不可能,因而应假设该配合物的配体除吡啶甲酸根外还有氧,设配合物为VO(吡啶甲酸根)2,相对分子质量为50.9+16.0+244=311,氧的质量分数为25.7%,符合题设。
全国高中生化学竞赛试题3 配位化合物

配位化合物(全国初赛)第1题(13分)六配位(八面体)单核配合物MA 2(NO 2)2呈电中性;组成分析显示:M 21.68%,N 31.04%,C 17.74%;配体A 含氮不含氧;配体(NO 2)x 的两个氮氧键不等长。
1-1该配合物中心原子M 是什么元素?氧化态多大?给出推论过程。
(2002年第5题)1-2画出该配合物的结构示意图,给出推理过程。
13指出配体(NO 2)x 在“自由”状态下的几何构型和氮原子的杂化轨道类型。
1-4除本例外,上述无机配体还可能以什么方式和中心原子配位?画出三种。
第2题(7分)研究发现,钒与吡啶-2-甲酸根形成的单核配合物可增强胰岛素降糖作用,它是电中性分子,实验测得其氧的质量分数为25.7%,画出它的立体结构,指出中心原子的氧化态。
要给出推理过程。
(2004年第5题)第3题(8分)今有化学式为Co(NH 3)4BrCO 3的配合物。
(2004年第8题)3-1画出全部异构体的立体结构。
3-2指出区分它们的实验方法。
第4题(6分)本题涉及3种组成不同的铂配合物,它们都是八面体的单核配合物,配体为OH -和/或Cl -。
(2005年第4题)4-1PtCl 4·5H 2O 的水溶液与等摩尔NH 3反应,生成两种铂配合物,反应式为:。
4-2BaCl 2·PtCl 4和Ba(OH)2反应(摩尔比2:5),生成两种产物,其中一种为配合物,该反应的化学方程式为:。
第5题(11分)化合物A 是近十年开始采用的锅炉水添加剂。
A 的相对分子质量90.10,可形成无色晶体,能除去锅炉水中溶解氧,并可使锅炉壁钝化。
(2006年第7题)5-1A 是用碳酸二甲酯和一水合肼在70℃下合成,收率80%。
画出A 的结构式。
5-2写出合成A 的反应方程式。
5-3低于135℃时,A 直接与溶解氧反应,生成三种产物。
写出化学方程式。
5-4高于135℃时,A 先发生水解,水解产物再与氧反应。
高中化学配位化合物的解题方法与题目解析

高中化学配位化合物的解题方法与题目解析化学是一门需要理论知识和实践技能相结合的学科,而配位化合物作为其中的重要内容之一,经常出现在高中化学考试中。
掌握解题方法和技巧,能够帮助学生更好地理解和应用相关知识,提高解题的准确性和效率。
本文将介绍一些常见的配位化合物解题方法,并通过具体的题目分析,帮助读者更好地理解和应用这些方法。
一、确定配位数和配位方式在解题过程中,首先需要确定配位化合物的配位数和配位方式。
配位数是指配位中心周围配体的数量,常见的配位数有2、4、6等。
配位方式是指配位中心与配体之间的键的类型,常见的配位方式有配位键、离子键等。
确定配位数和配位方式有助于理解化合物的结构和性质,从而更好地解答相关题目。
例如,下面是一道关于配位数和配位方式的题目:题目:已知某配合物的化学式为[Co(NH3)4Cl2],请回答以下问题:(1)该配合物的配位数是多少?(2)该配合物的配位方式是什么?解析:根据配合物的化学式,可以看出其中含有一个配位中心Co和六个配体(四个氨和两个氯)。
由于配体的数量为6个,所以该配合物的配位数为6。
而配位中心Co与配体之间的键为配位键,因此该配合物的配位方式为配位键。
二、确定配位化合物的离化度和价态离化度是指配位化合物在溶液中的解离程度,常用来表示配位化合物的溶解性和电解质性质。
价态是指配位中心的氧化态,常用来表示配位中心的电子状态和化学性质。
确定离化度和价态有助于理解化合物的溶解和反应过程,从而更好地解答相关题目。
例如,下面是一道关于离化度和价态的题目:题目:已知某配合物的化学式为[Fe(H2O)6]Cl3,请回答以下问题:(1)该配合物的离化度是多少?(2)该配合物中Fe的价态是多少?解析:根据配合物的化学式,可以看出其中含有一个配位中心Fe和六个配体(六个水分子)。
由于配位中心Fe与六个水分子之间的键为离子键,所以该配合物的离化度为3。
而Fe的价态可以通过配位化合物的总电荷和配体的电荷来确定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学配位化合物题
配位化合物是化学领域中的一个重要研究领域。
它研究的是由一个或多个中心原子或离子和一个或多个配位子以化学键连接而成的化合物。
在高考化学中,配位化合物是一个重要的考点,下面将为您介绍一道高考化学配位化合物题。
题目:已知某配位化合物的分子式为[A2B2C2],其中A为2价金属离子,B为1价金属离子,C为一种十二面体配位子。
该配位化合物的电荷为-2。
请回答以下问题:
1. A、B、C在配位化合物中的配位数分别是多少?
2. 根据所给配位化合物的分子式,推测A、B、C在该配位化合物中的排列方式,并给出理由。
3. 该配位化合物的几何构型是什么?
4. 请画出所给配位化合物的结构式。
解析:
1. A、B、C在配位化合物中的配位数分别是多少?
A、B、C在配位化合物中的配位数分别为6、6、12。
其中,A为2价金属离子,配位数为6;B为1价金属离子,配位数也为6;C为一种十二面体配位子,配位数为12。
2. 根据所给配位化合物的分子式,推测A、B、C在该配位化合物中的排列方式,并给出理由。
根据[A2B2C2]的分子式,我们可以推测A、B、C在该配位化合物中的排列方式为A2B2C2。
这是因为,根据电荷平衡原则,2个2价金属离子A需要与1个1价金属离子B形成化学键,而1个1价金属离子需要与2个十二面体配位子C形成化学键,因此,配位化合物的分子式应该为A2B2C2。
3. 该配位化合物的几何构型是什么?
根据配位数的规则,A的配位数为6,B的配位数为6,则A和B 所形成的配位构型应该为八面体。
C的配位数为12,则C所形成的配位构型应该为十二面体。
因此,该配位化合物的几何构型是八面体和十二面体。
4. 请画出所给配位化合物的结构式。
A A
/ \ |
C—B—C C—B—C
\ / |
A A
上述化合物的结构式可以简化为一个八面体和一个十二面体相连接的结构。
其中,A代表2价金属离子,B代表1价金属离子,C代表十二面体配位子。
以上是对一道高考化学配位化合物题的解析。
希望能对您的学习有所帮助。
配位化合物是化学领域中的一个重要研究领域,深入理解和
掌握配位化合物的性质和特点对于化学学科的学习是至关重要的。
加油!。
