Protein SRP68 of human signal recognition particle
细胞生物学名词解释

123细胞生物学名词解释1.细胞(cell)是组成包括人类在内的所有生物体的基本单位,这一基本单位的含义即包括结构上的,也包括功能上的。
2.细胞生物学(cell biology)是在细胞水平上研究生物体的生长、运动、遗传、变异、分化、衰老、死亡等生命现象的学科。
3.医学细胞生物学(medical cell biology)以人体或医学为对象的细胞生物学研究或学科。
4.原核细胞(prokaryotic cell)是组成原核生物的细胞,这类细胞主要特征是细胞内没有分化为以膜为基础的具有专门结构与功能的细胞器和细胞核膜,且遗传信息量小,因此进化地位较低。
5.真核细胞(eukaryotic cell)指含有真核(被核膜包围的核)的细胞,主要特征是有细胞膜、发达的内膜系统和细胞骨架体系。
6.生物大分子(biological macromolecules)也称多聚体,由许多小分子单体通过共价键连接而成,相对分子质量比较大,包括蛋白质、核酸和多糖等。
7.多肽链(polypeptide chain)多个氨基酸通过肽键组成的肽称为多肽链。
8.细胞蛋白质组(proteome)将细胞内基因活动和表达后所产生的全部蛋白质作为一个整体,研究在个体发育的不同阶段,在正常或异常情况下,某种细胞内所有蛋白质的种类、数量、结构和功能状态,从而阐明基因的功能。
9.拟核(nucleoid)原核细胞没有核膜包被的细胞核,也没有核仁,DNA位于细胞中央的核区就称为拟核。
10.质粒(plasmid)很多细菌除了基因组DNA外,还有一些小的双链环形DNA分子,称为质粒。
11.细胞膜(cell membrane)又称质膜,是指围绕在细胞最外层,由脂质、蛋白质和糖类所组成的生物膜。
12.生物膜(biological membrane)人们把生物膜和细胞内各种模性结构统称为生物膜。
13.单位膜(unit membrane)生物膜在电镜下呈现出较为一致的3层结构,即电子致密度高的内、外两层之间夹着电子密度较低的中间层。
肽链合成后的加工和运输
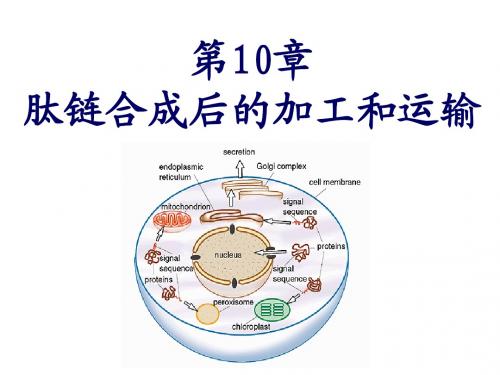
• ①通过线粒体膜的蛋白质在运转之前大多数以前体形 式存在,它由成熟蛋白质和N端延伸出的一段20-80个 氨基酸的导肽(leader peptide)共同组成。 • ②蛋白质通过线粒体内膜的运转是一种需能过程;
• ③蛋白质通过线粒体膜运转时,首先由外膜上的Tom
受体复合蛋白识别,再与Hsp70或MSF等分子伴侣相结
2) 信号序列的切除
需要靶项运输到各细胞器及细胞外的蛋白 质N-端一般有一段信号序列,用于指导蛋白质 的运输,这一信号序列会在完成任务后被相应 的蛋白水解酶切除。
3)切除新生肽链中非功能片段 如新合成的胰岛素前体是前胰岛素原,必须先 切去信号肽变成胰岛素原,再切去C-肽,才变成有 活性的胰岛素。 有些动物病毒如脊髓灰质炎病毒的mRNA可翻译成 很长的多肽链,含多种病毒蛋白,经蛋白酶在特定 位置上水解后得到几个有功能的蛋白质分子。 不少多肽类激素和酶的前体也要经过加工才能变 为活性分子,如血纤维蛋白原、胰蛋白酶原经过加 工切去部分肽段才能成为有活性的血纤维蛋白、胰 蛋白酶。
核孔复合物,NPC, 是一个多蛋白复合 体,由胞质环、核 质环、转运环、轮 辐等组成一个 120nm的篮网装结 构,其中心为亲水 通道。 NPC具有分 子筛功能,可以允 许小分子自由通过, 大分子在运转蛋白 介导下,以主动运 输的方式进入细胞 核。
核孔复合物(Nuclear
pore complex,NPC)
• SRP与DP的结合很可能导致受体聚集而形成膜孔道, 使信号肽及与其相连的新生肽得以通过。整个蛋白 跨膜以后,信号肽被水解,形成高级结构和成熟型 蛋白质,被送入高尔基体或形成运转小泡,运送到 细胞膜。
通过分泌小泡输送到目的地
降解
正确的折叠
不正确的折叠
分子生物学习题

分子生物学复习习题名词解释:1.功能基因组学:是依附于对DNA序列的了解,应用基因组学的知识和工具去了解影响发育和整个生物体的特定序列表达谱。
2.分子生物学:指分子水平上理解生命活动,主要指遗传信息的传递(复制)、保持(损伤和修复)、基因的表达与调控。
强调以上活动是什么,以及所涉及的生物大分子是如何相互作用而使之发生的。
3.epigenetics(发育遗传学)4.C值矛盾:指生物体细胞所含有的基因组大小和复杂性在生物等级进化中不呈现一致的矛盾,表现在等级进化中基因组大小变化趋势的矛盾和同类生物基因组大小不一致的矛盾。
5.基因簇:基因簇是指一组相同或相关的比邻基因,即基因家族的成员紧密排列在一起形成的,如组蛋白H1的基因、rRNA基因等。
6.间隔基因7.基因芯片8.基序(Motifs):指一组存在于彼此相关的蛋白家族成员中的次级结构元件或氨基酸序列,相似的结构基序也常发现于那些没有相似序列的蛋白中,如βαβ基序等。
9.CpG岛:是指在某些基因上游的转录调控区及其附近,存在着成串的CpG二核苷酸序列,长度可达1—2kb,这段序列往往被称为CpG岛。
其上的大部分CpG不被甲基化。
10.染色体重建11.Telomerase12.足迹分析实验13.RNA editing:转录后的RNA在编码区发生碱基的突变、加入或丢失等现象。
14.RNA干涉(RNA interference)15.反义RNA16.启动子(Promoter):是DNA转录起始信号的一段序列,它能指导全酶与模板正确的结合,并活化酶使之具有起始特异性转录形式。
17.SD序列(SD sequence):原核生物起始密码子AUG上游7-12个核苷酸处有一被称为SD序列(Shine –Dalgarno sequence)的保守区,因为该序列与16S-rRNA 3’端反向互补,所以被认为在核糖体-mRNA的结合过程中起作用。
18.碳末端结构域(carboxyl terminal domain,CTD)19.single nucleotide polymorphism,SNP20.切口平移(Nick translation):指大肠杆菌的DNA聚合酶I能够在DNA双链所产生的切口处延5`-3`方向进行切割和合成DNA连。
蛋白质分选与膜泡运输

COPⅠ有被小泡的形成 Ⅰ
LOGO
① 一种胞质溶胶中的 小分子GTP结合蛋白, GTP结合蛋白 小分子GTP结合蛋白,即 ARF,释放 释放GDP, GTP结 ARF,释放GDP, 同GTP结 形成ARF GTP复合物 ARF复合物, 合,形成ARF-GTP复合物, 并整合在高尔基体膜中。 并整合在高尔基体膜中。 COPⅠ同ARF以及高 ② COPⅠ同ARF以及高 尔基体膜蛋白的细胞质 部分结合; 部分结合; ③在脂酰CoA的帮助下 在脂酰CoA的帮助下 CoA 形成COPⅠ被膜小泡, COPⅠ被膜小泡 形成COPⅠ被膜小泡, 一旦COPⅠ COPⅠ小泡形成就 一旦COPⅠ小泡形成就 立即从供体膜释放出来, 立即从供体膜释放出来, COPⅠ包被去聚合 包被去聚合, COPⅠ包被去聚合, 并 与膜脱离, 与膜脱离, 这一过程是 由与ARF结合的GTP ARF结合的GTP水解 由与ARF结合的GTP水解 所触发。 所触发。
COPII有被小泡的组装与运输 COPII有被小泡的组装与运输
过程:
LOGO
• ER腔中可溶性货物蛋白 可溶性货物蛋白通过与选择性跨膜蛋白腔面一端 可溶性货物蛋白 结合而被募集 • 选择性跨膜蛋白胞质面一端的信号序列以及ER膜上整合 蛋白v-SNARE被COPII蛋白识别,形成有货物蛋白和 货物蛋白和v货物蛋白和 SNARE的有被小泡。 • 小分子GTP结合蛋白(Sar1蛋白,对包被组装和去组装起 调控作用)参与下脱被并定位到高尔基体的cis面。 • 暴露的v-SNARE与高尔基体cis面膜上的同类蛋白 t-SNARE配对,介导膜泡与靶膜融合,内含物进入高尔 基体。 • 被脱去的包被蛋白再循环利用。 11
网格蛋白有被小泡的形成 网格蛋白有被小泡的形成
a.配体同膜表面特异 受体结合, 网格蛋白 装配的亚基结合上去, 使膜凹陷成小窝状。 。 b.通过出芽的 方式形成小泡, 在发动蛋白 发动蛋白的 发动蛋白 作用下与质膜 割离。
交大细胞名词解释

1.细胞拆合(Cells down):把细胞核与细胞质分离开来,然后把不同来源的细胞质和细胞核相互结合,形成核质杂交细胞。
2.血影(blood ghost):当细胞经低渗处理后,质膜破裂,同时释放出血红蛋白和胞内其他可溶性蛋白,这时红细胞仍然保持原来的基本形状和大小,这种结构称为血影。
3.泛素依耐性降解途径(ubiquitin-dependent pathway):在E1、E2、E3三种酶的催化下,通过一系列级联反应将泛素连接到靶蛋白上,最后由26S蛋白酶特异性识别被泛素化的底物并将其降解,同时释放出泛素单体以备循环利用。
4.协同运输(cotransport):两种溶质协同跨膜运输的过程。
两种溶质运输方向相同称为同向协同运输,反之则为反向协同运输,是一种间接消耗ATP的主动运输过程。
5.Caspase蛋白酶:一组结构类似、与细胞凋亡有关的蛋白酶家族,其活性位点包括半胱氨酸,特异的裂解靶蛋白天冬氨酸残基后的肽键,负责选择性地裂解蛋白质,使靶蛋白失活或活化。
6.信号识别颗粒(signal recognition particle,SRP):由6条不同多肽和一个小RNA分子构成的RNP颗粒。
识别并结合从核糖体中合成出来的内质网信号序列,指导新生多肽及核糖体和mRNA附着到内质网膜上。
7.胞吞作用(endocvtosis):通过质膜内陷形成膜泡,将细胞外或细胞质膜表面的物质包裹到膜泡内并转运到细胞内。
8.细胞信号通路(Cell signaling pathway):是指细胞接受外界信号,通过一整套特定的机制,将胞外信号转导为胞内信号,最终调节特定基因表达,所引起的一系列细胞的应答反应。
9.核小体(nucleosome):由DNA和组蛋白形成的染色质基本结构单位。
每个核小体由147bp的DNA缠绕组蛋白八聚体近两圈形成。
核小体核心颗粒之间通过60bp左右的连接DNA 相连。
10.G蛋白偶联的受体(G protein-coupled receptor):一类在质膜上7次跨膜的受体。
蛋白质的加工

protein through.
翻译后易位
氨基酸侧链修饰作用包括磷酸化(如核糖体蛋白质)、糖基化(如各种糖蛋白)、甲基化(如组蛋白、肌肉蛋白质)、乙基化(如组蛋白)、羟
基化(如胶原蛋白)和羧基化等。
2 二硫键形成
1.
3 信号肽与蛋白质转运的关系
蛋白质插入或穿过生物膜的过程称为蛋白质易位(protein translocation)。
点最近那个氨基酸常带很短侧链(Ala或Gly )
An N-terminal signal sequence is hydrophobic
The signal sequence of bovine growth hormone consists of the N-terminal amino acids and has a central highly hydrophobic region, preceded or flanked by regions containing polar amino acids.
3 特定氨基酸化学修饰
1.
Proteins enter the nucleus by passage through very large nuclear pores.
The leader sequence of yeast cytochrome c ⑩蛋白质有序降解机理。
Proteins can enter the ER-Golgi pathway only by associating with the endoplasmic reticulum while they are being
2 蛋白质易位
2.1 概 述 2.2 共翻译易位 2.3 翻译ck
2.1 概 述
内质网
多聚核糖体模式图
游离核糖体
主要合成细胞本身的 固有蛋白:胞质溶质 蛋白、核蛋白、线粒 体蛋白、质体蛋白
附着核糖体?
主要合成分泌蛋 白、溶酶体蛋白、 穿膜蛋白和驻留 蛋白
细胞中所有蛋白质的合成,皆起始
于细胞质基质中游离的核糖体上。
分泌性蛋白多肽链在其合成起始后 不久,随核糖体一起附着于糙面内质网 上,不断延伸的多肽链穿过内质网膜直 至肽链合成完成。
高尔基复合体
修饰加工 分泌泡 细胞外
高尔基复合体
分泌泡 接收信号
细胞外
普遍和常见(?)
分泌细胞(?)
共同特点: 在糙面内质网合成并经加工修
饰后的各种外输性蛋白质最终被内
质网膜包裹,以膜泡形式完全隔离
于细胞质溶质进行转运 。
2.信号肽指导的穿膜蛋白插入转移的机制
单次穿膜蛋白
多次穿膜蛋白
⑴ 单次穿膜蛋白插入转移的机制
②在完成蛋白质的分拣、转运引导作用 后通常不被切除而得以保留; ③信号斑可识别以特异性糖残基为标志 的酶蛋白,并指导它们的定向转运。
(二)光面内质网的功能
1.脂类的合成与转运
⑴ 合成过程
⑴ 合成过程
※ 脂酰转移酶催化脂酰辅酶A与甘油-3-
磷酸反应形成磷脂酸;
※ 在磷酸酶的作用下,磷脂酸去磷酸化生 成双酰甘油;
信号识别颗粒 (SRP) :
signal recognition particle
存在于细胞质基质中,由6条多 肽链和一个7sRNA分子组成。能够识 别信号肽,并与核糖体结合,形成 SRP-核糖体复合体。
转运体与核糖体大亚基中央管形成肽链转运通道
转运体(translocon):
位于内质网膜,是新生的分泌 蛋白质多肽链合成时进入内质网腔 的通道。
中山大学生科院 细胞生物学试卷 (9)
中山大学生科院细胞生物学期末试卷(生物科学、生物技术专业、进修教师、交换生,140人)姓名∶专业∶一、填空题(每空1分,共10分)1. 人细胞中DNA总长度为米2. 一个既含有输入细胞核又含有输出细胞核信号的蛋白质分子合成后将会。
3. 如果在一个正处于缩短状态的微管溶液中加入不能被水解的GTP类似物, 微管将。
4. 细胞分裂的最后一步, 即产生两个子细胞的过程称为。
5. 2003年的诺贝尔生理学或医学奖奖给了英国科学家曼斯菲尔德和美国科学家劳特布尔, 表彰他们在方面作出的杰出贡献。
6.同源染色体配对和联会的部位形成,进而发生重组。
7.染色体上有主缢痕和次缢痕,着丝粒位于。
8.内质网中BiP蛋白的功能是,以阻止它们的输出。
9. AP1和AP2都是披网格蛋白小泡外被装配必需的辅助蛋白, 但是二者的作用部位不同:AP1 的披网格蛋白小泡的装配。
10. 通过起动子交换重组实验, 证明了U1 snRNA输出细胞核的信号与相关。
二、判断以下各题是否正确, 若正确, 用T表示, 不正确用F表示, 不需说明。
(每题1分,共10分)1. 一个含有输入过氧化物酶体和输入ER两种信号的蛋白质将定位于ER。
( )2. 在多次跨膜蛋白中,奇数跨膜片段(从N-端起始)只能作为起始跨膜信号,而偶数片段只能作为停止跨膜信号。
( )3. 细胞质膜将细胞分割成功能各异、不通透的区室。
( )4. “在多数真核细胞中质膜的含量最少、功能最大”, 此话正确吗? ( )5. Ras基因是一种癌基因。
( )6. 虽然细胞周期各时相的长短都有不同程度的变化,但变化最大的是G1期。
( )7. 一个同时含有输入线粒体信号和ER驻留信号的蛋白质最终定位于线粒体而不能驻留ER。
( )8. 脊椎动物和芽殖酵母都是使用一种 Cdk控制细胞周期的时相转换。
( )9. 核纤层是由核纤层蛋白A、核纤层蛋白B和核纤层蛋白C构成的,其中只有核纤层蛋白A与内核膜相连,核纤层蛋白B和C则与染色质相连。
11-12-1内膜系统 ER GC
• 蛋白合成及穿膜转移机制
新生多肽链转移至内质网腔的主要过程:
1)胞质游离核糖体合成信号肽;
2)信号识别颗粒(SRP)与信号肽结合;
3)SRP+核糖体复合体与受体结合附着到内质网膜上的移
位子通道蛋白处; 4) SRP解离,进入再循环;移位子通道蛋白孔道打开; 5)蛋白质协同翻译转运(co-translational translocation); 6)信号肽酶切除信号肽;
如神经原胞体或树突中的尼氏体(Nissl body) ,位于脊髓运 动神经元等大神经元的尼氏体呈粗大的斑块状,即虎斑小体 ; 位于如神经节内神经元等小神经元的尼氏体则呈细颗粒状。
粗面内质网 核糖体
尼氏体溶解: 神经细胞基本病变,脊髓灰质炎、维生素B缺乏、神 经元胞体与轴突断离等时发生。此时,尼氏体溶解从核周开始崩解 为细尘状颗粒,并渐渐向外扩展,进而完全溶解消失。因尼氏体消 失,胞浆着色浅,胞体肿胀,细胞由多极形状变为圆形,胞核移至 位于轴突起始部对侧边缘部。病变一般为可逆性,去除病因,可恢 复正常。如发展,可导致细胞萎缩或坏死。 此外,当脑震荡、脑 病变症状等出现会伴随着尼氏体的变化。
表面是否具有核糖体附着。
a ribosome (blue) with mRNA (brown) and a polypeptide (red)
是核糖体与内质网共同构成的复合结构,又称 RER 颗粒内质网( granular endoplasmic reticulum, GER),多为板层状排列的扁囊状,少数为管状 和泡状,多分布在分泌活动旺盛或分化较完善 的细胞内,参与嗜碱性颗粒(嗜碱质)的形成。
特殊类型的内质网
• Microsome 微粒体
• 微粒体:是通过人工分离得到的、非生理性的、由 破碎的内质网自我融合形成的、近似球形的膜泡性结 构,被分离的微粒体,特别是粗面微粒体仍具备蛋白质 合成、糖基化和脂类合成等各种基本功能,可用于体 外研究观察胞内各种生理功能实验。
真核生物蛋白质生物合成的起始
真核生物蛋白质生物合成的肇端自八十年月以来,人们对真核细胞蛋白质生物合成及其肇端因子的研讨有了进一步深刻. elF的感化或真核细胞蛋白质合成的肇端进程与原核细胞的肇端进程大体相似,不合之处重要有以下几点:(1)特异的肇端型tRNA为Met-tRNAMet,不须要N末尾的甲酰化.(2)Met-tRNAMet和GTP与eIF2形成一个可分别的复合物,不依附于小亚基.而在原核细胞IF1与tRNAMet联合在30S 小亚基上.(3)tRNA Met与40S小亚基的联合先于与mRNA的联合.相反,在原核细胞tRNAMet与30S小亚基的联合后于mRNA与3 0S小亚基的联合.(4)ATP水解为ADP供给能量,对于mRNA的联合是必须的.(5)在真核细胞,不但elF的种类多,并且很多elF本身是多亚基的蛋白质.最显著的是elF3(涉及mRNA联合,相似于原核细胞IF3的感化),含有大约10个亚基,分子量达106KD,其重量相当于40S亚基重量的1/3.(6)mRNA5'端帽的消失对于肇端是须要的(除外某些病毒mRNA,一些病毒mRNA的5'末尾有共价联合的蛋白质).(7)真核细胞在肇端进程中消失的一种蛋白质合成调节方法是最后一个症结不同.elF,每个轮回周期阅历一次GTP-GDP 交流,介入该交流进程的另一蛋白质称为elF2B(也称为GEF,即GTP-GDP exchange factor).从酶催化上讲,进程相似于原核细胞肽链延伸中的EF-Tu/Ts轮回(见第二节).当elF2将Met-tRNAMet定位于核糖体后它即改变成无活性情势的elF2 -GDP.只有当elF2与elF2B形成复合物(elF2-elF2B)后,elF 2中的GDP才干被代替.在elF2-elF2B复合物中.elF2与GTP 有很高的亲和力,是以能再进入活性状况并再与Met-tRNAMet 联合.在这个轮回进程中,elF2的三个亚基之一elF2α对磷酸化迟钝.磷酸化的elF2与elF2B形成的复合物甚稳固,不轻易解离,从而下降了elF2的可应用性.真核细胞蛋白质生物合成的肇端步调可归纳综合为:(1)形成43S核糖体复合物;由40S小亚基与elF3和elF4c构成.(2)形成43S前肇端复合物:即在43S核糖体复合物上,衔接elF2-GTP-Met-tRNAMet复合物.(3)形成43S前肇端复合物:由mRNA及帽联合蛋白1(CBP 1).elF4A.elF4B和elF4F配合构成一个mRNA复合物.mRNA 复合物与43S前肇端复合物感化,形成48S前肇端复合物.(4)形成80S肇端复合物:在elF5的感化下,48S前肇端复合物中的所有elF释放出,并与60S大亚基联合,最终形成80S 肇端复合物,即40S亚基-mRNA-Met-tRNAMet-60S亚基.在真核生物蛋白质生物合成的肇端阶段,值得一提的是40S核糖体亚基几乎老是选择第一个肇端暗码子AUG,开端对mR NA翻译,这种选择比原核细胞对肇端暗码子的选择方法更简略些.起首,AUG是独一的肇端暗码子,而在原核细胞(E.coli)可作为肇端暗码子的三联体除AUG外,还有GUG,UUG,甚至AU U也可被应用.其次,定位在mRNA5'末尾的AUG(平日距5'末尾10-100个核苷酸)总被选择.其最简略的模式是:40S亚基与带帽的mRNA5'末尾接触,并沿着mRNA"扫描"一向到抵达第一个AUG处再开端翻译.该进程需消费ATP.这主如果因为Met-tRN AMet的反暗码子与肇端暗码子AUG互补的成果.是以正如前述,真核细胞蛋白质生物合成的特色之一是:tRNAMet先与40S 亚基联合,然后再与mRNA联合.由此看来,"扫描"进程其实是以43S前肇端复合物的情势进行的.在真核细胞tRNAMet中,邻接它的反暗码子3'端的核苷酸是被一个大团体润饰的A(t6 A:N-[9-β-D-呋喃核糖)嘌呤-6-氨基甲酰]苏氨酸),t6A能经由过程增强成摞反响(Stacking interaction),稳固反暗码子3'端核苷酸,不许可在暗码子与反暗码子的反响中暗码子第一位碱基摆动.原核细胞tRNAMet缺少该润饰碱基,是以在反响进程中许可暗码子有更多可摆动性.这个构造的消失也有助于说明43S前肇端复合物对肇端暗码子AUG的选择的简略的方法.所以,在真核mRNA中,附加的上游旌旗灯号是须要的,例如象原核mRNA的SD次序那样的旌旗灯号.但是,经由过程深刻研讨40S亚基对肇端部位的选择机制.发明亦有某些破例情形,即一些mRNA的翻译不是从肇端AUG开端,而是从下流A UG处开端凋谢读框.研讨标明,事实A+1NNAUGG次序对于40S 亚基进行肇端是幻想的序列.假如该次序-3位的A或G和G+1位的G被代替的话,该肇端暗码子可能就被漏读,或者40S亚基经由AUG持续"扫描"下去.肽链的延伸和终止与真核细胞蛋白质生物合成的肇端因子比拟较,在延伸和终止步调中所涉及的因子就十分简略.真核细胞肽链延伸和终止进程所涉及的因子延伸因子(EF)α,分子量约50KD.EF1α可与GTP和aa-t RNA形成复合物,并把aa-tRNA供应核糖体.对EF1βγ的研讨不象对原核细胞EF-Ts那么清晰,但已证实EF1βγ能催化GDP-GTP交流,有助于EF1α再轮回应用,EF2分子量约100KD,相当于原核细胞的EF-G,催化GTP水解和使aa-tRNA从A位转移至P位.肽链合成的终止仅涉及到一种释放因子(RF),分子量约115KD.它可以辨认所有的三种终止暗码子UAA,UAG和UGA.RF在活化了肽链酰转移酶释放新生的肽链后,即从核糖体解离,解离进程涉及GTP水解,故终止肽链合成是耗能的.真核生物蛋白质生物合成的特异克制剂真核细胞蛋白质生物合成的特异克制剂的感化环节.毫不惊异,一些可以或许克制原核细胞蛋白质生物合成的克制剂同样也能克制真核细胞的蛋白质生物合成.如aa-tRNA的相似物嘌呤霉素可提前终止肽链翻译.又如梭孢酸(fusidica cid)不但可阻拦完成功效后的原核细胞EF-G从核糖体释放,也能阻拦真核细胞EF2的释放.有一些克制剂对真核细胞的翻译进程是特异的,这主如果因为真核细胞翻译体系装配的特别性.如7-甲基鸟苷酸(m7Gp)在体外克制真核细胞的翻译肇端,就是因为m7Gp与帽联合蛋白质竞争性地与mRNA5'端帽联合.同样,其它多半真核细胞蛋白质生物合成的特异性克制剂亦可与不合的翻译装配(成份)联合.上述这些特异性克制剂大多半是小分子,有的是多肽,如蓖麻蛋白(ricin).蓖麻蛋白是一种特异的核酸酶,可以或许经由过程使60S亚基水解掉活而中断延伸步调.由白喉杆菌(Cor yne bacterium diptheriae)所产生的致逝世性毒素是研讨得较为清晰的真核细胞蛋白质合成克制剂.白喉毒素是一种65 KD的蛋白质,它不是由细菌基因组编码的,而是由一种寄生于白喉杆菌体内的溶源性噬菌体β(phageβ)编码的.该毒素只是经白喉杆菌转运排泄出来,然落后入组织细胞内.一旦进入真核内,白喉毒素就催化ADP-核糖与EF2衔接.ADP-核糖由NA D+供给,它与EF2分子中润饰的组氨酸残基联合.在体外,这种联合很轻易被参加尼克酰胺而逆转.一旦EF2被ADP-核糖化, EF2就完整掉活.因为白喉毒素是起催化感化,是以只需微量(也许少至一个分子)就能有用地克制细胞的全部蛋白质合成,而导致细胞逝世亡.EF2中润饰的组氨酸残基亦称为白喉酰胺(diphthamide).假如在EF2中不消失白喉酰胺,白喉毒素就不会杀逝世哺乳动物细胞.蛋白质合成后的排泄不管原核核照样真核生物,在细胞浆内合成的蛋白质需定位于细胞的特异区域,或者排泄出细胞.将蛋白质排泄出细胞,在真核细胞比原核细胞更艰苦,因为真核细胞胞体大,并且还有大量的膜性距离.一些蛋白质被合成后排泄到细胞外,这些蛋白质统称排泄蛋白.人们发明,将某些排泄蛋白质mRNA在体外进行翻译时,其翻译产品的分子量比估计的要大的多.例如胰岛素由51个氨酸残基构成,但胰岛素mRNA的翻译产品在兔网织红细胞无细胞翻译体系中为86个氨基酸残基,称为胰岛素原(proins ulin).在麦胚无细胞翻译体系中为110个氨基酸残基构成的前胰岛素原.后来证实,在前胰岛素原的M-末尾有一段富含疏水氨基酸的肽段作为旌旗灯号肽(signalpeptide),使前胰岛素原已成为胰岛素原.然后胰岛素原被运到高尔基复合体,切去C肽成熟的胰岛素,最终排出胞外.后来发明,几乎各类排泄蛋白质(如真核细胞的前清蛋白,免疫球蛋白轻链,催乳素等,原核细胞的脂蛋白.青霉素酶等)均含有旌旗灯号肽,约由15-30个疏水氨基酸残基构成.近年来,人们才提出了旌旗灯号肽假说去说明排泄蛋白质的排泄.其机理是:当新生肽链正在跨越膜时,旌旗灯号序列和厥后段折成两个短的螺旋段,并曲成一个反向平行的螺旋发夹,该发夹构造可拔出到疏水的脂质双层中.一旦排泄蛋白质的N端锚在膜内,后续合成的其它肽链段部分将顺遂经由过程膜.疏水性旌旗灯号肽对于新生肽链跨越膜及把它固定在膜上起了一个拐棍感化.旌旗灯号肽在完成功效后,随即被一种特异的旌旗灯号肽酶水解.哺乳类动物的旌旗灯号辨认颗粒(SRP)可见蛋白质与折叠的RNA的二个构造域缔合,Alu暗示7SLRNA的序列(7SLRNA的序列与脊椎动物基因的Alu反复序列家族的的序列同源).S 代表特别的中间区.真核细胞蛋白质生物合成的特异克制剂的感化环节.杆形颗粒的长度约相当于核糖体直径.在80年月中期,Walter等人已提出了确定的证据标明:在启动排泄和掌握排泄方面,有一小分子RNA-蛋白质反复合物起症结感化.因为该复合物能与新生的旌旗灯号肽特异性反响,故被定名为旌旗灯号辨认颗粒(Signal Recognition Parti cle,简写为SRP).SRP由7SLRNA(约300个碱基)和6种不合的蛋白质慎密联合构成.蛋白质的分子量从9-72KD不等.SRP的感化是能与核糖体结归并停滞蛋白质联合,阻拦翻译产生在肽链延伸至约70个氨基酸残基长时.这个长度正好是旌旗灯号肽完整从核糖体出来时的长度(随旌旗灯号肽后的30-40个氨基酸残基此时被埋在核糖体内).当SRP)与内质网膜上的船坞蛋白(docking protein)接触后,翻译阻滞逆转,SRP集中开再去启动另一蛋白质转运.上述SRP对翻译起负调节作器具有极重要的生物学意义. SRP在胞浆内含量很高,约有106个拷贝(约占哺乳动物细胞核糖体数目的1/10).哺乳动物排泄蛋白质中的很多种都是降解酶类(如核酸酶.蛋白酶等),即使它们有时出如今胞浆内也会造成细胞内的大灾害.经由过程用SRP临时中断这些蛋白质的翻译,确保这些蛋白质未到达内质网膜之前不克不及完成翻译.如许,在旌旗灯号肽和SRP的配合感化下,使得这些排泄蛋白能实时进入膜性腔内,完成转运和排泄.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
10.1110/ps.051861406Access the most recent version at doi: 2006 15: 1290-1302; originally published online May 2, 2006; Protein Sci.
Elena Iakhiaeva, Shakhawat Hossain Bhuiyan, Jiaming Yin and Christian Zwieb
of the RNA and SRP72 binding domainsProtein SRP68 of human signal recognition particle: Identification dataSupplementary http://www.proteinscience.org/cgi/content/full/ps.051861406/DC1 "Supplemental Research Data"
References
http://www.proteinscience.org/cgi/content/full/15/6/1290#ReferencesThis article cites 36 articles, 13 of which can be accessed free at:
serviceEmail alerting click heretop right corner of the article or Receive free email alerts when new articles cite this article - sign up in the box at the
Notes
http://www.proteinscience.org/subscriptions/ go to: Protein ScienceTo subscribe to © 2006 Cold Spring Harbor Laboratory Press
Cold Spring Harbor Laboratory Press on February 6, 2008 - Published by www.proteinscience.orgDownloaded from ProteinSRP68ofhumansignalrecognitionparticle:IdentificationoftheRNAandSRP72bindingdomains
ELENAIAKHIAEVA,SHAKHAWATHOSSAINBHUIYAN,JIAMINGYIN,ANDCHRISTIANZWIEBDepartmentofMolecularBiology,UniversityofTexasHealthScienceCenteratTyler,Tyler,Texas75708,USA(RECEIVEDSeptember23,2005;FINALREVISIONFebruary8,2006;ACCEPTEDFebruary27,2006)
AbstractThesignalrecognitionparticle(SRP)playsanimportantroleinthedeliveryofsecretoryproteinstocellularmembranes.MammalianSRPiscomposedofsixpolypeptidesamongwhichSRP68andSRP72formaheterodimerthathasbeennotoriouslydifficulttoinvestigate.HumanSRP68waspurifiedfromoverexpressingEscherichiacolicellsandwasfoundtobindtorecombinantSRP72aswellasinvitro-transcribedhumanSRPRNA.PolypeptidefragmentscoveringessentiallytheentireSRP68moleculeweregeneratedrecombinantlyorbyproteolyticdigestion.TheRNAbindingdomainofSRP68includedresiduesfrompositions52to252.Ninety-fouraminoacidsneartheCterminusofSRP68mediatedthebindingtoSRP72.TheSRP68–SRP72interactionremainedstableatelevatedsaltconcentrationsandengaged;150aminoacidsfromtheN-terminalregionofSRP72.ThisportionofSRP72waslocatedwithinapredictedtandemarrayoffourtetratricopeptide(TPR)-likemotifssuggestedtoformasuperhelicalstructurewithagroovetoaccommodatetheC-terminalregionofSRP68.
Keywords:signalrecognitionparticle;SRP;proteinsecretion;RNAbindingdomain;protein–proteininteraction
Supplementalmaterial:seewww.proteinscience.org
Thesignalrecognitionparticle(SRP)ribonucleoproteincomplexbindstoribosomesthatengageinthesynthesisandtranslocationofproteinswithsecretorysignalsequences.SRPdirectstheemergingpolypeptidetothelipidbilayerbyfirstpausingtranslationfollowedbythebindingoftheribosome/nascentchain-complextothemembrane-associatedSRPreceptor.UpondissociationoftheSRPfromthemembraneandtheribosome,translationcontinuesandleadstothedeliveryofthesecretoryproteinintothetranslocationchannel(forreview,seeKeenanetal.2001;Wildetal.2002;ZwiebandEichler2002;Zwieb2003;DoudnaandBatey2004;Halicetal.2004;LuirinkandSinning2004;ShanandWalter2005).ThefundamentalrequirementofeverycelltoremaincompartmentalizedprovidesarationaleforthepresenceofanSRPinallorganisms(Rosenbladetal.2003).ThemammalianSRPiscomposedofan;300-nucleotideSRPRNAmoleculeboundtosixproteinsnamedSRP9,SRP14,SRP19,SRP54,SRP68,andSRP72accordingtotheirapproximatemolecularweightsinkDa(WalterandBlobel1983).DuringSRPassembly,SRP9/14bindstothesmall(Alu)domainoftheSRPRNAandtherebyshortenstheelongatedparticle(Andrewsetal.1987;Weichenriederetal.2000).Thesmalldomainisresponsibleforpausingthe
Reprintrequeststo:ChristianZwieb,DepartmentofMolecularBiology,TheUniversityofTexasHealthScienceCenteratTyler,11937USHighway271,Tyler,TX75708-3154,USA;e-mail:zwieb@uthct.edu;fax:(903)877-5731.Abbreviations:DTT,dithiothreitol;EDTA,ethylenediaminetetra-aceticacid;EST,expressedsequencetag;ER,endoplasmicreticulum;IPTG,isopropyl-b-D-thiogalactopyranoside;LB,Luria-Bertanime-dium;MALDI-TOF,matrixassistedlaserdesorption/ionizationtimeofflight;PAGE,polyacrylamidegelelectrophoresis;PCR,polymerasechainreaction;SDS,sodiumdodecylsulfate;SLS,sodiumlaurylsarcosinate;SRP,signalrecognitionparticle;TCA,trichloroaceticacid;TEV,tobaccoetchvirus;TFA,trifluoroaceticacid;TPR,tetratricopeptiderepeat;Tricine,N-tris(hydroxymethyl)methylglycine.Articlepublishedonlineaheadofprint.Articleandpublicationdateareathttp://www.proteinscience.org/cgi/doi/10.1110/ps.051861406.
1290ProteinScience(2006),15:1290–1302.PublishedbyColdSpringHarborLaboratoryPress.CopyrightÓ2006TheProteinSociety
