标准溶液配制标定记录
edta标准溶液的标定实验报告

edta标准溶液的标定实验报告 EDTA 标准溶液的标定实验报告一、实验目的1、掌握 EDTA 标准溶液的配制和标定方法。
2、学会用络合滴定法测定金属离子的含量。
3、熟悉酸式滴定管、移液管和容量瓶的正确使用方法。
二、实验原理EDTA(乙二胺四乙酸)是一种很强的络合剂,能与许多金属离子形成稳定的 1:1 络合物。
在一定条件下,以二甲酚橙为指示剂,用锌标准溶液标定 EDTA 溶液的浓度。
锌离子与 EDTA 反应的化学方程式为:\Zn^{2+}+ H_{2}Y^{2-}= ZnY^{2-}+ 2H^{+}\二甲酚橙在 pH < 60 时呈紫红色,在 pH > 63 时呈黄色。
在滴定过程中,当溶液由紫红色变为亮黄色时,即为滴定终点。
三、实验仪器与试剂1、仪器酸式滴定管(50 mL)、移液管(25 mL)、容量瓶(250 mL)、锥形瓶(250 mL)、烧杯(250 mL)、玻璃棒、电子天平。
2、试剂(1)乙二胺四乙酸二钠盐(EDTA):分析纯。
(2)氧化锌(基准试剂):在 800℃灼烧至恒重。
(3)盐酸(1:1):浓盐酸与水等体积混合。
(4)氨水溶液(1:1):浓氨水与水等体积混合。
(5)氯化铵氨水溶液:将 20 g 氯化铵溶于水,加 100 mL 氨水,用水稀释至 1 L。
(6)二甲酚橙指示剂(02%):称取 02 g 二甲酚橙,溶于 100 mL 水中。
四、实验步骤1、配制 002 mol/L EDTA 标准溶液(1)称取约 4 g EDTA 二钠盐于小烧杯中,加入约 200 mL 水,温热溶解后,转入容量瓶中,用水稀释至刻度,摇匀。
(2)将配制好的 EDTA 溶液转移至试剂瓶中,贴上标签。
2、配制锌标准溶液(1)准确称取 042 g 左右已在 800℃灼烧至恒重的基准氧化锌于小烧杯中。
(2)用少量水湿润,盖上表面皿,从杯嘴边逐滴加入 1:1 盐酸,至氧化锌完全溶解。
(3)将溶液转入 250 mL 容量瓶中,用水冲洗表面皿和烧杯内壁数次,一并转入容量瓶中,用水稀释至刻度,摇匀。
0.07盐酸标定记录

20
C 2
HCL V C NaOH ⨯=
标准溶液配制与标定记录
标准溶液名称: 配制及标定执行标准: 室温:
配置
标准溶液方法:
移取5.85 毫升盐酸至1升塑料容器中,加入1升去离子水充分混匀。
此溶液有效期2 个月。
标准溶液的标定
滴定方法根据SOP-CL-001 0.07molL 盐酸标定操作程序
溶液
个人标定结果(mol/L )
个人标定允许差(极限相对值≤
0.15%)
标准溶液浓度
平均值(mol/L )
双人标定允许差(极限相对值≤
0.18%)
氢氧化钠
氢氧化钠
盐酸
盐酸 配置时间 配置人 根据下式计算氢氧化钠的浓度
其中:
C NaoH = 氢氧化钠物质的量浓度 (mol/L) W =称取的邻苯二甲酸氢钾质量 (g)
V 1 = 滴定消耗氢氧化钠溶液体积的平均值 (ml)
根据下式,计算盐酸溶液的浓度:
其中:
C HCl = 盐酸溶液浓度 (mol/L)
C NaOH = 氢氧化钠物质的量浓度 (mol/L) V 2 =滴定消耗氢氧化钠溶液体积的平均值 (ml)
1
NaOH 2041001000
02w C V ⨯⨯⨯⨯=。
标准滴定溶液标定原始记录
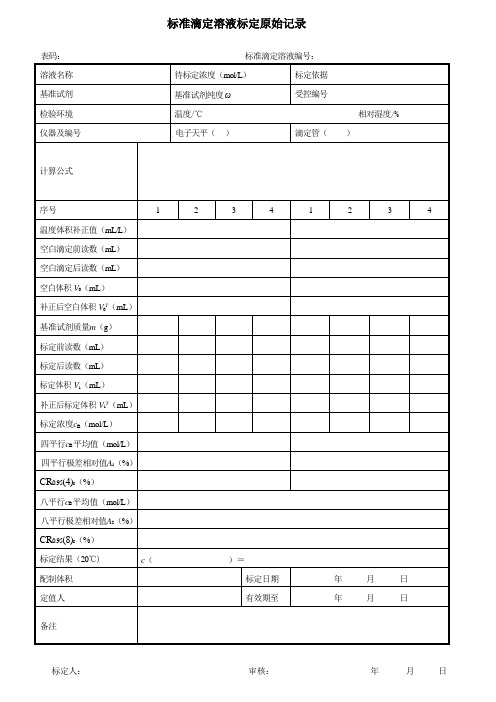
标定前读数(mL)
标定后读数(mL)
标定体积V1(mL)
补正后标定体积V1T(mL)
标定浓度cB(mol/L)
四平行cB平均值(mol/L)
四平行极差相对值A1(%)
CR0.95(4)r(%)
八平行cB平均值(mol/L)
八平行极差相对值A2(%)
CR0.95(8)r(%)
标定结果(20℃)
c()=
配制体积
标定日期
年月日
定值人
有效期至
年月日
备注
表码:标准滴定溶液编号:
溶液名称
待标定浓度(mol/L)
标定依据
基准试剂
基准试剂纯度ω
受控编号
检验环境
温度/℃ 相对湿度/%
仪器及编号
电子天平()
滴定管()
计算公式
序号
1
2
3
4
1
2
3
4
温度体积补正值(mL/L)
空白ห้องสมุดไป่ตู้定前读数(mL)
空白滴定后读数(mL)
空白体积V0(mL)
补正后空白体积V0T(mL)
标准溶液配制标定及复标记录

滴定液标定记录标准溶液名称亚硝酸钠滴定液配制浓度 mol/L 基准物名称基准对氨基苯磺酸配制时间年月日配制温度℃配制人标定时间年月日标定温度℃标定人复标时间年月日复标温度℃复标人配制方法取亚硝酸钠 g,加无水碳酸钠(Na2CO3) g,加水适量使溶解成ml,摇匀。
标定方法取在120℃干燥至恒重的基准对氨基苯磺酸约0.5g,精密称定,加水30ml与浓氨试液3ml,溶解后,加盐酸(1→2)20ml,搅拌,在30℃以下用本液迅速滴定,滴定时将滴定管尖端插入液面下约2/3处,随滴随搅拌,至近终点时,将滴定管尖端提出液面,用少量水洗涤尖端,洗液并入溶液中,继续缓缓滴定,用永停法指示终点。
每1ml亚硝酸钠滴定液(0.1mol/L)相当于17.32mg的对氨基苯磺酸。
根据本夜的消耗量与对氨基苯磺酸的取用量,计算:F=W样×1000V×17.32×100%称量与标定计算结果 W样1 V1 F1 =××=W样2 V2 F2 =××=W样3 V3 F3 =××=RD = % 0.1%标定平均F值相对偏差是否符合规定是否称量与标定计算结果W样1 V1 F1 =××=W样2 V2 F2 =××=W样3 V3 F3 =××=RD = % 0.1%复标平均F值相对偏差是否符合规定是否二次相对偏差是否符合规定是否标准溶液F值有效期至年月日。
标准溶液‘配制’及‘标定’原始重点学习的记录.docx
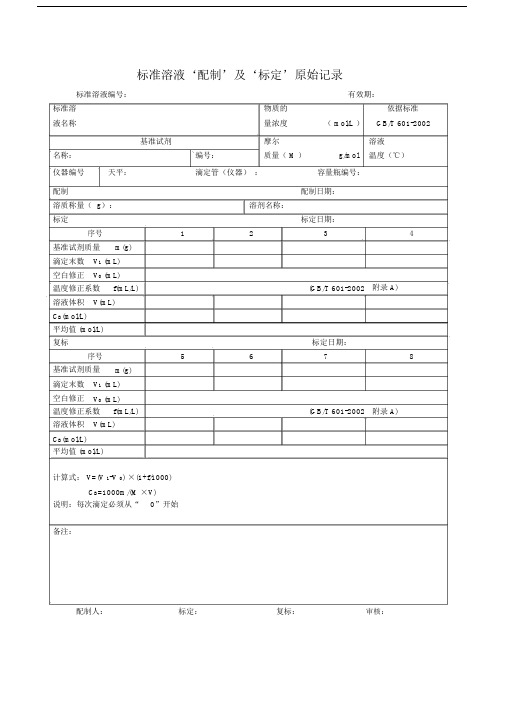
标准溶液‘配制’及‘标定’原始记录标准溶液编号:有效期:标准溶物质的依据标准液名称量浓度( mol/L )GB/T 601-2002基准试剂摩尔溶液名称:编号:质量( M )g/mol温度(℃)仪器编号天平:滴定管(仪器):容量瓶编号:配制配制日期:溶质称量( g):溶剂名称:标定标定日期:序号1234基准试剂质量m(g)滴定末数V1 (mL)空白修正V0 (mL)温度修正系数f(mL/L)(GB/T 601-2002附录 A)溶液体积V(mL)C B(mol/L)平均值 (mol/L)复标标定日期:序号5678基准试剂质量m(g)滴定末数V1 (mL)空白修正V0 (mL)温度修正系数f(mL/L)(GB/T 601-2002附录 A)溶液体积V(mL)C B(mol/L)平均值 (mol/L)计算式: V=(V 1-V 0) ×(1+f/1000)C B=1000m/(M ×V)说明:每次滴定必须从“0”开始备注:配制人:标定:复标:审核:标准物质配制(标定)记录编号: CHEC/ QBG-075名称:、配制方法:使用天平型号编号室温℃、湿度%RH配制:取定溶mL标定:取份:⑴⑵⑶⑷用溶液滴定,滴定消耗量( mL)V1=、 V2=、 V3=、V4=、V0=。
标准溶液浓度计算公式: C=计算结果():C1=C2=C3=C4= C =相对偏差( %):S1=S2=S3=S4=备注:。
配制人:复核人:配制日期:年月日有效期年月日标准溶液配制记录编号: CHEC/QBG-147标准溶液名称:规格:配制方法:仪器名称:溯源标准:温度:℃、湿度:%RH标准溶液拟配浓度:配制或稀释过程:配制日期:年月日有效期:年月日配制人:复核人:0.1mol/L盐酸标准滴定溶液的标定编号: JL/LJ-001-01一、标定方法: GB/T5009.1-2003二、使用仪器: AEL-200 电子天平(仪器编号: JYB001)马弗炉 (仪器编号:JYC009)三、操作1、量取 9ml 盐酸,加适量水并稀释至 1000ml 。
edta标准溶液的配制与标定数据处理

edta标准溶液的配制与标定数据处理以EDTA标准溶液的配制与标定数据处理为主题,本文将介绍EDTA标准溶液的配制方法和标定数据处理过程。
一、EDTA标准溶液的配制EDTA(乙二胺四乙酸)是一种常用的配位试剂,可用于金属离子的定量分析。
EDTA标准溶液的配制需要以下试剂:1. EDTA二钠盐(Na2EDTA):粉末状,纯度≥99.0%。
2. 氢氧化钠(NaOH):固体或液体,纯度≥98.0%。
3. 硝酸银(AgNO3):固体,纯度≥99.0%。
4. 蒸馏水:纯度≥99.0%。
EDTA标准溶液的配制步骤如下:1. 称取约4g的Na2EDTA,加入1000mL容量瓶中。
2. 加入约500mL蒸馏水,摇匀溶解。
3. 加入10mL 1mol/L NaOH溶液,调节pH至8.0-8.2。
4. 加入约50mg AgNO3,用蒸馏水定容至1000mL。
5. 摇匀混合,即得到EDTA标准溶液。
二、EDTA标准溶液的标定数据处理EDTA标准溶液的标定需要使用标准铜离子溶液,标定步骤如下:1. 取一定量的标准铜离子溶液,加入适量的NH3-NH4Cl缓冲液,使pH约为9.5。
2. 加入适量的Eriochrome Black T指示剂,溶液变为蓝色。
3. 用EDTA标准溶液滴定至溶液变为红色,记录所用EDTA标准溶液的体积V1。
4. 重复上述步骤,至少进行三次滴定,计算平均值。
5. 根据反应方程式,计算出标准铜离子溶液的浓度C1。
Cu2+ + EDTA4- + 2H2O → CuEDTA•2H2O + 2H+6. 根据滴定结果和反应方程式,计算出EDTA标准溶液的浓度C2。
C1V1 = C2V2其中,V2为EDTA标准溶液的体积,单位为mL。
7. 计算出EDTA标准溶液的摩尔浓度C3。
C3 = C2 / M其中,M为EDTA二钠盐的摩尔质量,约为372.24g/mol。
8. 计算出EDTA标准溶液的质量浓度C4。
C4 = C3 × M其中,M为EDTA二钠盐的摩尔质量,单位为g/L。
硝酸银滴定液配制、标定记录

第二次称量
称量瓶
g
g
称量瓶+样
g
g
用减重法分取四分:ag;bg;cg;dg.各加水ml使溶解,再加糊精溶液(1→50)ml,碳酸钙g与荧光黄指示液滴,用本液滴定至浑浊液由色变为色。消耗本液体积分别为aml;bml;cml;dml.〔每1ml硝酸银滴定液(0.1mol/L)相当于5.844mg的氯化钠〕
Ca=---------------------------------------=mol/L
Cb=---------------------------------------=mol/L
Cc=---------------------------------------=mol/L
Cd=---------------------------------------=mol/L
=---------------------------------------=mol/L
相对平均偏差(%)=-------------------------------×100%= %
F=-----------=
相对偏差%
标定浓度
配制人:
标定人:
复核人:
标准液(滴定液)配制、标定记录
配液名称
硝酸银滴定液
浓度
mol/L
配制日期
年月日
标定日期
年月日
配制总量
ml
使用截止日期
年月日
所用试剂
碳酸钙、荧光黄指示液等
基准试剂
基准氯化钠
【配制】称取硝酸银g,置烧杯中,加水适量使溶解,移至1ห้องสมุดไป่ตู้00ml容量瓶中,加水至刻度,摇匀,即得。
标准溶液配制记录

定
直接 滴定
反滴定
I
II
I
II
称 样 量
溶 剂
定容体积
待标定溶液 取用量
被滴定标液 (II)加 入量
标液 (I)消 耗量 (ml)
始点
终点 用量
标 定
配制浓度
是否标定 是 配制温度
(℃)
否复 核
配制人 配制日期 标定人
复核人
标定温度(℃) 标定后浓度 标定日期 复核日期
备注
校正标定消耗标准溶液的体积(ml) 标准溶液的浓度(mol/L) A、B 均值相对偏差(%) A B 相对偏差(%)
比对记录
容器编号
A1 A2 A3 A4 B1 B2 B3 B4
移取比较溶液的体积(ml)
校正移取比较溶液的体积(ml)
标定消耗标准溶液的体积(ml)
校正标定消耗标准溶液的体积(ml)
标准溶液的浓度(mol/L)
A、B 均值相对偏差(%)
A B 相对偏差(%)
标定溶液浓度与比较溶液浓度相对偏差
%
标示溶液浓度与标定溶液浓度相对偏差
%
配制标准液的浓度:
配制者:甲(A)
乙(B)
审核者:
配制时间:
年 月 日 时至
年
月
日
时
标准溶液配制与标定原始记录表
标准溶液名称:
配
制
标物名称
质量等级
化学式 及式量
标 滴定方式
标定用 标液名称
标准溶液配制记录
配制标准液的名称:
实验室条件: 温度 ℃ 相对湿度
配制标准液的浓度: 比对标准液的名称和浓度: 基准物质名称:
容器编号 称量瓶质量(g)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
标准溶液配制标定记录
一、实验目的。
本实验旨在记录标准溶液的配制和标定过程,确保实验数据的准确性和可靠性。
二、实验原理。
1. 标准溶液,是已知浓度的溶液,用于分析化学中的定量分析和质量分析。
2. 配制标准溶液的步骤:
a. 确定所需配制的标准溶液的浓度和体积。
b. 准备所需的溶质和溶剂。
c. 按照一定的比例将溶质溶解于溶剂中,配制出标准溶液。
3. 标定标准溶液的步骤:
a. 使用已知浓度的标准溶液进行定量分析,得到实验数据。
b. 根据实验数据计算出待标定标准溶液的浓度。
三、实验仪器和试剂。
1. 电子天平。
2. 称量瓶、烧杯。
3. 蒸馏水。
4. 已知浓度的标准溶液。
5. 待标定的溶质。
四、实验步骤。
1. 配制标准溶液:
a. 根据所需配制的标准溶液的浓度和体积,准备好溶质和溶剂。
b. 使用电子天平称量所需的溶质,转移至称量瓶中。
c. 加入适量的溶剂,摇匀使溶质完全溶解,配制出标准溶液。
d. 使用称量瓶和烧杯进行操作,注意操作规范,避免溶液的挥发和外界杂质的污染。
2. 标定标准溶液:
a. 取一定体积的待标定标准溶液,转移至烧杯中。
b. 使用已知浓度的标准溶液进行定量分析,记录实验数据。
c. 根据实验数据计算出待标定标准溶液的浓度。
五、实验数据记录。
1. 配制标准溶液的记录:
a. 配制日期,XXXX年XX月XX日。
b. 配制人,XXX。
c. 标准溶液的浓度,XXXXmol/L。
d. 配制过程中所用的溶质和溶剂的质量和体积。
e. 配制后的标准溶液的外观和溶解情况。
2. 标定标准溶液的记录:
a. 标定日期,XXXX年XX月XX日。
b. 标定人,XXX。
c. 待标定标准溶液的浓度,XXXXmol/L。
d. 使用已知浓度的标准溶液进行定量分析的实验数据。
e. 计算出的待标定标准溶液的浓度。
六、实验结果分析。
根据实验数据记录和计算结果,验证标准溶液的浓度是否符合预期要求,评估
实验数据的准确性和可靠性。
七、实验结论。
总结实验过程中的操作规范和注意事项,总结实验结果并得出结论,指出实验
中存在的问题和改进的方向。
八、实验注意事项。
1. 操作过程中要注意称量精度和配制溶液的溶解情况。
2. 配制和标定过程中要注意实验数据的准确记录和计算。
3. 实验结束后要及时清洗和归还实验器材,保持实验环境的整洁。
以上就是标准溶液配制标定记录的实验内容,希望能对您的实验工作有所帮助。
