方程式复习有机
高中有机化学方程式总结

高中有机化学方程式总结高中有机化学方程式综述一、碳氢化合物甲烷烷烃通式:CnH2n-2 (1)氧化反应燃烧甲烷燃烧:CH4+2O2 CO2+2H2O甲烷不能使酸性高锰酸钾溶液和溴水变色。
(2)取代反应光线氯甲烷:CH4+Cl2 CH3Cl+HCl2.乙烯乙烯的制备:烯烃通式:(1)乙烯的氧化反应燃烧:乙烯会使酸性高锰酸钾溶液褪色并引起氧化反应。
(2)加成反应丙烯和溴水加成:丙烯和氢加成:丙烯和氯化氢加成:丙烯和水加成:(3)聚合反应丙烯加成聚合,3.1,3丁二烯向溴中加入1,3丁二烯:1:1加入1,3丁二烯:4。
乙炔乙炔的制备:(1)乙炔在氧化反应中的燃烧;乙炔会使酸性高锰酸钾溶液变色并引起氧化反应。
(2)加成反应和溴水添加:加入氢气;加入氯化氢;图2乙炔(3)聚合反应的制备丙烯加聚:5。
苯苯的同系物具有以下通式:(1)氧化反应苯的燃烧:(苯不能淡化溴水和酸性高锰酸钾溶液。
(2)取代反应①苯和溴反应(2)硝化反应高中化学方程式概述(第二部分),第2-1页,共6页(3)加成反应甲苯(1)氧化甲苯的燃烧:甲苯不能使溴水褪色,但能使酸性高锰酸钾溶液褪色。
(2)取代反应:与溴的反应甲苯硝化反应产生2,4,6-三硝基甲苯,简称三硝基甲苯,也称为三硝基甲苯,是一种淡黄色晶体,不溶于水。
它是一种烈性炸药,广泛用于国防、采矿等。
二。
碳氢化合物衍生物烃类衍生物的重要类别及主要化学性质:卤代烃类醇酚醛羧酸酯代表物质通式为R-X R-羟基溴乙烷C2H5Br乙醇C2H5OH苯酚-羟基乙醛O | | CH3-C-H分子结构特征C-X键具有极性,易断裂的C-O键和O-H 键具有极性;-羟基直接与链烃基相连-羟基直接与苯环相连。
碳氧双键具有极性,并具有不饱和的主要化学性质。
1.取代反应:用氢氧化钠溶液进行取代反应生成乙醇;2.消除反应:与强碱醇溶液共同加热生成烯烃。
1.与钠反应生成醇钠并释放氢气;2.氧化反应:O2:产生CO2和H2O;;氧化剂:产生乙醛;3.脱水反应:140℃;乙醚;170℃:乙烯;4.酯化反应。
化学有机物方程式总结

化学有机物方程式总结有机物是指碳元素为主要组成元素的物质,其构成的化学键主要是碳碳键和碳氢键。
有机物方程式是描述有机物反应和转化的化学方程式,它们对研究有机化学的基本原理和应用具有重要意义。
下面将对一些常见的有机物方程式进行总结。
1.烷烃的燃烧反应:烷烃是由碳氢键构成的最简单的有机物,其分子式为CnH2n+2、烷烃的燃烧反应是指烷烃与氧气反应生成二氧化碳和水。
反应方程式通常表示为:烷烃+氧气→二氧化碳+水。
2.烯烃的加成反应:烯烃是由碳碳双键构成的有机物,其分子式为CnH2n。
烯烃具有较高的反应活性,可以与其他化合物发生加成反应。
例如,乙烯(C2H4)与溴(Br2)反应生成1,2-二溴乙烷,反应方程式为:乙烯+溴→1,2-二溴乙烷。
3.炔烃的加成反应:炔烃是由碳碳三键构成的有机物,其分子式为CnH2n-2、炔烃的加成反应是指炔烃与其他化合物发生加成反应。
例如,乙炔(C2H2)与氢气(H2)反应生成乙烯,反应方程式为:乙炔+氢气→乙烯。
4.醇的酸碱中和反应:醇是一类带有羟基(-OH)官能团的有机物,其分子式为ROH。
醇可以与酸反应生成酯,也可以与碱反应生成醇盐。
例如,乙醇(C2H5OH)与硫酸反应生成乙酯(C2H5OC2H5),反应方程式为:乙醇+硫酸→乙酯+水。
5.醛的氧化反应:醛是由羰基(C=O)官能团连接一个氢原子的有机物,其分子式为RCHO。
醛可以发生氧化反应,生成相应的羧酸。
例如,乙醛(CH3CHO)经过氧化反应生成乙酸(CH3COOH),反应方程式为:乙醛+氧气→乙酸。
6.酮的加氢还原反应:酮是由羰基连接两个碳基团的有机物,其分子式为RCOR'。
酮可以通过加氢还原反应转化为相应的醇。
例如,丙酮(CH3COCH3)经过加氢还原反应生成异丙醇(CH3CHOHCH3),反应方程式为:丙酮+氢气→异丙醇。
以上只是对一些常见有机物方程式进行了简要总结,实际上有机化学领域有着丰富且复杂的方程式。
(完美版)高中有机化学方程式总结

高中有机化学方程式总结一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl4+HCl乙烯的制取:CH 3CH 2OHH 2C=CH 2↑+H 2O 与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH3与氯化氢加成: H 2C=CH 2+HClCH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n H 2C=CHn乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2与溴水加成:HC ≡CH+Br 2 HC=CHCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应 氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯 ①苯与溴反应(溴苯)②硝化反应+HO —NO 2 +H 2O(硝基苯)(3)加成反应(环己烷)。
(2)取代反应光 光光催化剂 △2-CH 2催化剂 △ Br 2—CHClCH=CH +Br +HBr Br浓H 2SO 4 60℃ —NO2+3H CH 3 | +3HNO 3 浓硫酸 O2N — CH 3|—NO 2 |NO 2+3H 2O6.溴乙烷:(1)取代反应溴乙烷的水解:C 2H 5—Br+H 2O C 2H 5—OH+HBr(2)消去反应 溴乙烷与NaOH 溶液反应:CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O7.乙醇(1)与钠反应乙醇与钠反应:2CH 3CH 2OH+2Na 2CH3CH 2ONa+H 2↑(乙醇钠)(2)氧化反应 乙醇的燃烧:2CH 3CH 2OH+O 2 2CH3CHO+2H 2O (乙醛) (3)消去反应 乙醇在浓硫酸做催化剂的条件下,加热到170℃生成乙烯。
大学有机化学反应方程式总结(较全)
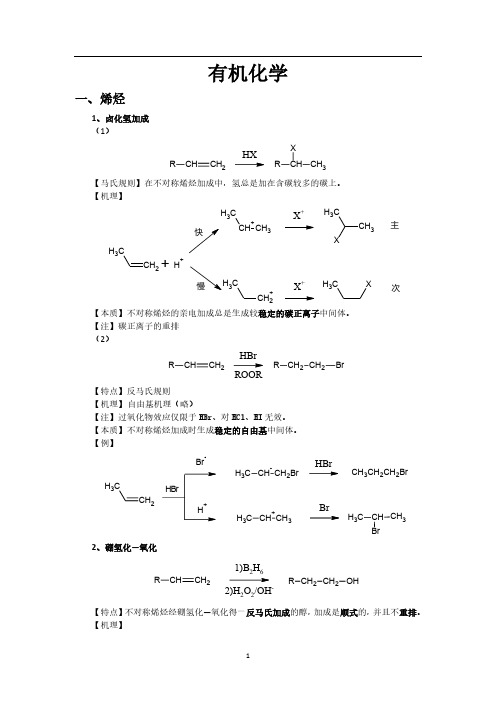
有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCH CH 3RX 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3CH +CH 3CH 3X +CH 3CH 3X+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH BrCH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】CH2CH 33H 323H 32CH CH 2CH 3HBH 2CH CH=CH (CH 3CH 2CH 2)3-B-H 3CH 2CH 2C22CH 3CH 2B OCH2CH 2CH 3H 3CH 2CH 2CCH 2CH 2CH 3+OH -OHB-OCH 2CH 2CH 3CH 2CH 2CH 3H 3CH 2CH 2OBOCH 2CH 2CH 3CH 2CH 2CH 3OCH 2CH 2CH 3HOO -B(OCH 2CH 2CH 3)3B(OCH 2CH 2CH 3)3+3NaOH3NaOH3HOCH 2CH 2CH 33+Na 3BO 32【例】CH 31)BH 32)H 2O 2/OH-CH 3HH OH 3、X 2加成C CBr/CCl CC BrBr 【机理】CC CC Br BrC CBr +CC Br OH 2+-H +CC Br OH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
有机化学常用反应方程式汇总

光照 光照 光照 光照 高温 CaO△ 催化剂加热、加压 催化剂催化剂△催化剂 △ 催化剂 催化剂有机化学方程式汇总1. CH 4 + Cl 2CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2 + H 2O CH 3CH 2OH10. CH 2 = CH 2 + HBr CH 3—CH 2Br11. CH 2 = CH 2CH 312. nCH 2 = CH 13. nCH 22] n14. 2CH 2 = CH 3CHO15. CH ≡CH + Br 2 CHBr = CHBr16. CHBr = CHBr+ Br 2CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl18. nCH 2 = CH [ CH 2-CH ] nCl Cl19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2NaOHH 2O醇△催化剂△ 浓硫酸170℃浓硫酸140℃催化剂△21. + Br 2 22. + HO -2 +H 2O23. + HO -SO 33H+H 2O24. + 3H 2 -NO 2 2O26. 3CH ≡CH →27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O34. 2O35. 2O -+H 3O +2O+CO 337催化剂 △ △ △ 催化剂催化剂催化剂催化剂催化剂△ 催化剂 加热、加压 38. CH 3CHO + H 2 CH 3CH 2OH39. 2CH 3CHO + O 2 2CH 3COOH40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O41CH 3CHO+2Cu(OH)2CH 3COOH+Cu 2O ↓+2H 2O42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑45. CH 3COOH + NaOH CH 3COONa + H 2O46. 2CH 3COOH + Cu(OH) (CH COO)2Cu + 2H 2O47.CH 3COOH+CH 3CH 23COOCH 2CH 3 +H 2O48. CH 3COOCH 2CH 3+NaOH 3COONa+CH 3CH 2OH49. nOHCH 2CH 2COOH → [ OCH 2CH 2C ] n +H 2O50. C 6H 12O 6 (s) + 6O 2 (g) 6CO 2 (g) + 6H 2O (l)51. C 6H 12O 6 2CH 3CH 2OH + 2CO 252. C 12H 22O 11+H 2OC 6H 12O 6+ C 6H 12O 6蔗糖 葡萄糖 果糖53. C 12H 22O 11 + H 2O2C 6H 12O 6麦芽唐葡萄糖54. (C 6H 10O 5)n + nH 2O n C 6H 12O 6淀粉葡萄糖55. (C 6H 10O 5)n + nH 2O n C 6H 12O 6纤维素葡萄糖56.C 17H 33COO-CH 2 C 17H 35COO-CH 2C 17H 33COO-CH +3H 2 C 17H 35COO-CHC 17H 33COO-CH 2 C 17H 35COO-CH 2+ 浓硫酸 △+ 2H 2OO O C — CO OCH 2-CH 257. C 17H 35COO-CH 2 CH 2-OHC 17H 35COO-CH +3NaOH3C 17H 35COONa+ CH-OHC 17H 35COO-CH 2 CH 2-OH58. CH 2OH COOH CH 2OH COOH 1.HCl Cl CH Cl CH +−→−+324光HCl Cl CH Cl Cl CH +−→−+2223光2.3.4.5.6.7.8. 222Br CH CH CH CH +=-=9.10.11.12. 13.14.15.16.17. OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+−→−∆18.19.20.21.高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
高中有机化学方程式总结

高中有机化学方程式总结一、烃1.甲烷:烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl 2.乙烯:烯烃通式:C n H 2n乙烯的实验室制取:CH 3CH 2OH H 2C=CH 2↑+H 2O (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH (3)聚合反应点燃光 光光光浓硫酸 170℃点燃催化剂 △催化剂 加热加压催化剂CH 2-CH 2图1 乙烯的制取图2 乙炔的制取催化剂 △乙烯加聚,生成聚乙烯:n H 2C=CH 2 n 3.乙炔:炔烃通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2 (1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CH BrCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl n 乙炔加聚,得到聚乙炔:n HC≡CH n 4.苯:苯的同系物通式:C n H 2n-6 (1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
有机方程式书写(有答案)
高三化学二轮复习——有机方程式书写【训练一】写出下列反应的化学方程式(要标注反应条件和配平!):1、由甲苯制2-溴甲苯:2、由甲苯制一溴苯基甲烷():3、由甲苯制TNT(2,4,6-三硝基甲苯):4、由苯甲醛制苯甲醇:5、与Br2按1:1发生加成::6、氯乙烷与NaOH水溶液反应:7、一氯乙酸与足量NaOH水溶液混合加热反应:8、与NaOH醇溶液反应:9、的催化氧化反应:10、发生消去反应:11、乙二醇与乙二酸酯化成环反应:12、乙二醇与乙二酸酯化成高分子化合物:13、苯酚溶液滴入浓溴水:14、与溴水反应:15、乙醛发生银镜反应:16、与新制氢氧化铜反应:17、二乙酸乙二酯发生完全水解:18、一氯乙酸乙酯与足量的NaOH溶液加热反应:19、2-甲基-1,3-丁二烯发生加聚反应:20、丙烯酸甲酯发生加聚反应:【训练二】读懂信息,正确迁移:根据题给信息进行信息迁移是有机综合题的热点。
题给信息理解错了,就无法正确运用信息进行迁移。
平时多做信息题可以提高信息的理解和迁移能力!1、已知:则苯甲醛与丙醛发生上述反应的方程式为:__________________________________________________.2、已知:则两分子乙醛在上述条件下反应的化学方程式:_ 。
3、已知:请写出实现由(CH3)2CHCH=CH2分两步转变为(CH3)2CHCH2CH2OH的方程式:_________________________________________________________________________________________________________________________________________________ 4、已知:已知环氧氯丙烷可与乙二醇发生如下聚合反应:则:环氧氯丙烷与发生类似反应生成高聚物,该高聚物的结构式是:5、已知:则:+6、已知:则:+7、已知:则8、已知:①②则:⑴⑵+→9、已知:碱存在下,卤代烃与醇反应生成醚(R—O—R‘):R—X + R‘OH R—O—R ’ +HX 则:B的结构简式为:10、已知:通常情况下,多个羟基连在同一个碳原子上的分子结构是不稳定的,容易自动失水,生成碳氧双键的结构:下面是9个化合物的转变关系:(1)化合物①的名称是它跟氯气发生反应的条件A是(2)化合物⑤跟⑦可在酸的催化下去水生成化合物⑨, ⑨的结构简式是:______________ ,名称是(3)化合物⑨是重要的定香剂,香料工业上常用化合物⑧和②直接合成它。
(完整版)有机化学方程式汇总
有机化学反应方程式汇总1. 甲烷与氯气CH 4+Cl 2CH 3Cl+HCl CH 3Cl+Cl 2CH 2Cl 2+HClCH 2Cl 2+Cl 2CHCl 3+HCl CHCl 3+Cl 2CCl 4+HCl (分步取代)2. 甲烷的燃烧3. 烷烃的燃烧通式4. 甲烷的热分解 CH 4−−→−高温C+2H 25. 烷烃的热分解6. 乙烯实验室制法 CH 3CH 2OH H 2O + CH 2=CH 2 ↑(浓硫酸:催化剂,脱水剂)7. 乙烯的燃烧8. 乙烯通入溴水中9. 乙烯和氢气加成10. 乙烯和HCl 的反应 11. 乙烯水化制乙醇 12. 乙烯催化氧化制备乙醛13. 乙烯的加聚反应 14. 制取聚丙烯 CH 4 + 2O CO 2 + 2H 2O燃烧C n H 2n+2 + O n CO 2 + (n + 1)H 2O 3n+1 2燃烧△C 4H C 2H 4+C 2H 6△C 4H CH 4 + C 3H 6CH 2=CH 2 + 3O 2 2CO 2 + 2H 2O点燃2CH 2=CH 2 + O 2CH 3CHO催化剂加热加压CH 3CH=CH 2 + H CH 3CH 2CH 3催化剂CH 2=CH 2 + Br 2 CH 2BrCH 2BrCH 2=CH 2 + HCl CH3CH 2Cl 催化剂CH 2=CH 2 + H 2O CH 3CH 2OH催化剂―CH 2―CH 2―nn CH 2=CH 2催化剂―CH 2――nn CH 2=CH ―CH 催化剂15. 1,3-丁二烯的加成反应 1,2加成1,4加成完全加成16. 1,3-丁二烯的加成反应 17. 乙炔的制取 CaC 2+2H 2O →C 2H 2↑+Ca(OH)218. 乙炔的燃烧19. 乙炔通入溴水中20. 乙炔与氢气的加成反应21. 乙炔水化制备乙醛22. 聚氯乙烯的制备23. 苯的燃烧 24. 苯与液溴反应(FeBr 3作催化剂)25. 苯的硝化反应Cl+ Cl 2催化剂+ Cl 2催化剂Cl+ 2Cl 2催化剂Cl ClCl―CH 2―C=CH ―CH 2―nn CH 2=C ―CH=CH 2催化剂CH 3CH 32 C 2H 2 + 5 O 4 CO 2 + 2 H 2O (l) + 2600 kJ点燃1, 2 - 二溴乙烷HC CH +Br BrC C Br Br H H 1, 1 , 2 , 2 - 四溴乙烷+Br BrC C Br BrH H C C Br Br H Br Br H 催化剂HC CH+H 2H 2C CH 2CH ≡CH + HCl CH 2=CHCl 催化剂氯乙烯CH ≡CH + H 2O乙醛3C C OH 催化剂聚氯乙烯H 2C CHCln -CH 2-CH --Cln 点燃+ 15 O 12 CO 2 + 6 H 2O2+ Br 溴苯NO 226. 苯的磺化反应27. 苯与氢气加成生成环己烷28. 苯与氯气的加成反应29. 苯的同系物被高锰酸钾酸性溶液氧化30.甲苯和氯气的取代反应31. 甲苯的硝化反应32. 甲苯和氢气的加成反应33. 溴乙烷水解 CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr34. 溴乙烷消去反应 CH 3CH 2Br +NaOH CH 2=CH 2↑ + NaBr + H 2O35. 乙醇与钠反应 2CH 3CH 2OH + 2Na 2CH 3CH 2ONa + H 2↑36. 乙醇催化氧化 2CH 3CH 2OH + O 2 2CH 3CHO + 2H 2O37. 乙醇的燃烧 CH 3CH 2OH +3O 2→2CO 2 + 3H 2OH 2O,△ Cu △醇 △HO SO 3+△+ H 2O3H 苯磺酸催化剂2△ClCl Cl ClClCl + 3 Cl 2光照C H KMnO 4 (H +)CH 3HO NO 2+ 3浓硫酸+ 3 H 2OCH 3NO 2NO 2O 2N2,4,6-三硝基甲苯 (TNT)+ 3 H CH 3CH 3CH 3CH 3Cl+ Cl + HClFeCH 3ClCH 3+ Cl + HClFe38. 乙醇与浓氢溴酸的反应 CH 3CH 2OH +HBr →CH 3CH 2Br + H 2O39. 乙醇脱水(分子内、分子间) CH 3CH 2OH CH 2=CH 2 ↑+H 2O (消去反应)2CH 3CH 2OH CH 3CH 2—O —CH 2CH 3+ H 2O (取代反应)40. 苯酚的电离方程式 41. 苯酚与NaOH 溶液反应42. 苯酚与金属钠反应 43. 苯酚和碳酸钠溶液反应44. 苯酚钠和盐酸反应 45. 苯酚钠溶液中通入CO 2气体46. 苯酚和浓溴水反应(苯酚的定性检验和定量测定方法)47. 苯酚的硝化反应48. 苯酚与FeCl 3溶液49. 苯酚的加成反应浓H 2SO 4 140℃OH电离O -+ H+OH + NaOHONa + H 2OOH 2 + 2Na ONa 2 + H OH + Na 2CO ONa + NaHCO 3+ HCl OH + NaClONa + CO 2 + H 2OH + NaHCO 3ONa OH+ 3 HNO + 3 H 2OOHNO 2O 2NNO 2浓硫酸苦味酸OHFeCl 3溶液紫色,易溶于水的物质OHOH+ 3 H 2Ni环己醇OH+ 3 Br OHBr BrBr+ 3 HBr50. 苯酚的缩聚反应n + n + n H 2O2OHH C OH n51.苯酚的酯化反应52. 乙醛的加成反应(还原反应) 53. 乙醛的氧化反应—燃烧反应54. 乙醛的催化氧化反应 55. 乙醛与银氨溶液的反应 ③ CH 3CHO + 2 [Ag(NH 3)2]+3COO - + NH 4+3 + H 2O56. 乙醛与Cu(OH)2悬浊液反应57. 乙醛的制备方法乙醇氧化法乙烯氧化法乙炔水化法58. 醛的加成反应(还原反应)59. 醛的催化氧化反应OH+ CH 3COOH + H 2OOOCCH3乙酸酐CH 3CHO + H 23CH 2OH 2CH 3CHO + 5O 4CO 2 + 4H 2O点燃2 CH 3CHO + O 3COOH① Ag + + NH 3·H 2O AgOH + NH 4+② AgOH + 2 NH ·H 2O [Ag(NH3)2]+ + OH - + 2 H 2O2 CH 3CH 2OH + O 3CHO + 2 H 2O + H 23CHOHC CH 2 + O 22 CH 3CHO 加热 加压H 2C CH 2催化剂2R―CHO + O 2―COOHR ―CHO + H 2―CH 2OHCH 3CHO + 2 Cu(OH)23COOH + Cu 2O + 2 H 2OCu 2+ + 2 OH - Cu(OH)260. 醛与银氨溶液的反应 61. 醛与Cu(OH)2悬浊液反应 62. 甲醛的银镜反应 63. 甲醛与Cu(OH)2悬浊液反应 64. 乙酸与氢氧化铜悬浊液 2CH 3COOH + Cu(OH)2 = (CH 3COO)2Cu + 2H 2O65. 乙酸乙酯制取(用饱和碳酸钠溶液收集)CH 3COOH + CH 3CH 2OHCH 3COOC 2H 5 + H 2O66. 乙二酸和乙二醇反应C ―OH ∣C ―OH OOHO ―CH 2∣HO ―CH 2+ + 2H 2O 浓硫酸C C O CH 2CH 2O O OnHOOC ―COOH + nHOCH 2―CH 2OH + 2nH 2O ―C ―C ―OCH 2―CH 2O ―O On浓硫酸67. 乙醇和硝酸酯化CH 3CH 2OH + HNO 3 CH 3CH 2ONO 2 + H 2O浓硫酸68. 乙酸乙酯的水解CH 3COOC 2H 5 + H 2O CH 3COOH + CH 3CH 2OH 稀硫酸CH 3COOC 2H 5 + NaOH ==== CH 3COONa + CH 3CH 2OH69. 甲酸钠与银氨溶液反应HCOONa +2Ag(NH 3)2OH NH 4OCOONa +2Ag ↓+3NH 3↑+H2O浓硫酸△R ―CHO + 2Cu(OH)2 R ―COOH + Cu 2O ↓ + 2H 2OR ―CHO + 2Ag(NH 3)2OH R ―COONH 4 + 2Ag ↓ + 3NH 3 + H 2O HCHO + 4 Cu(OH)2 CO 2 + 2 Cu 2O + 5 H 2O HCHO + 4 [Ag(NH 3)2]+ + 4 OH - (NH 4)2CO 3 + 4 Ag + 6 NH 3 + 2 H 2O70.甲酸钠与新制氢氧化铜反应HCOONa+2Cu(OH)2+ NaOH Na2CO3+Cu2O↓+3H2O71.葡萄糖的银镜反应CH2OH(CHOH)4CHO+2Ag(NH3)2OHCH2OH(CHOH)4COONH4+2Ag↓+3NH3↑+H2O72.葡萄糖与新制氢氧化铜反应CH2OH(CHOH)4CHO+2Cu(OH)2 +NaOH CH2OH(CHOH)4COONa+Cu2O↓+3H2O 73. 蔗糖水解C12H22O11 + H2O 催化剂C 6H 12O6 + C6H12O6蔗糖葡萄糖果糖74. 麦芽糖水解C12H22O11 + H2O 催化剂2C6H12O6麦芽糖葡萄糖75. 淀粉水解(C6H10O5)n + nH2O 催化剂nC6H12O6淀粉葡萄糖76. 纤维素水解(C6H10O5)n + nH2O 催化剂nC6H12O6纤维素葡萄糖77. 工业制取肥皂(皂化反应)C17H35COO―CH2∣C17H35COO―CH∣C17H35COO―CH2+ 3NaOH 3 C17H35COONa +HO―CH2∣HO―CH∣HO―CH278.油酸甘油酯硬化79.工业制造乙苯 + CH2=CH280.制造硝酸纤维的反应81.甲苯与高锰酸钾酸性溶液反应5 +6KMnO4+9H2SO4→ 5 +3K2SO4+ 6MnSO4+ 14H2O82.甘油制取炸药83.甲醛与苯酚反应制取酚醛树脂代表物之间的转化关系:CH3CH3CH2=CH2 CH=CH CH2=CHCl CH3CH 2OHCH 2BrCH2BrCH2OHCH2OHCHOCHOCOOHCOOH[ CH2—CH ]nClCH3CHO CH3COOHCH3COOC2H5CH3CH2BrO=CO=CCH2CH2OO。
高中有机化学方程式汇总
高中有机化学方程式汇总一、取代反应1、CH 4 + Cl 2 HCl + CH 3Cl ( 气态) 一氯甲烷CH 3Cl + Cl 2HCl + CH 2Cl2 ( 液态 ) 二氯甲烷CH 2Cl + Cl 2HCl + CHCl 3 ( 液态 ) 三氯甲烷或氯仿 CHCl 3+ Cl 2HCl +CCl 4 ( 液态 )四氯甲烷或四氯化碳 2、C 2H 6 + Cl 2 HCl + CH 3CH 2Cl3 + Br 2Br + HBr (真正催化剂是FeBr3)3 + Cl 22Cl + HCl3 + 3Cl 2 + 3HCl4 + HONO 2 2 + H 2O+ HOSO 3H 3H + H 2O5 + 3Br 2 + 3HBr+ 3HONO 2 + H 2O6、C 2H 5OH + HBr C 2H 5Br + H 2O C 2H 5Br C 2H 5OH + HBrC 2H 5Br CH 2 CH 2 + HBr7、CH 3COOC 2H 5 + H 2O CH 3COOH + C 2H 5 OH光照光照光照 光照光照Fe 光照无水AlCl 3Cl LNaOHH 2O NaOHC 2H 5OHBr L3H 2SO 4浓50-60℃2NO NO 2 LH 2SO 4浓50-60℃ H 2SO 4浓70-80℃ 无机酸或碱8、 + 3 NaOH + 3C 17H 35 COONa二、加成反应1、CH 2 CH 2 + H 2CH 3 CH 32、CH 2 CH 2 + HCl CH 3 CH 2Cl3、CH 3CH CH 2+ HClCH 3 CHClCH3(马氏加成)CH 3 CHCH 2 + HCl CH 3 CH 2 CH 2Cl (反马氏加成)4、CH CH + H 2 CH 2 CH 2 CH CH + 2 H 2 CH 3 CH 35、CH CH + 2HCl CH 3 CHCl 26、CH 3 CHO + 2 H 2 CH 3 CH 2OH 7+ 3 H 2 + H 2 CH 3 CH 2 CH 3+ H 2 CH 3 CH 2 CH 2 CH 3 ㊣ Pt 比Ni 催化效率高 8+ 3Cl 2 C 6H 6 Cl 69、 CH 2 CH 2 + H 2O CH 3 CH 2OHCH CH + H 2O 2CH 2 CH 2 + O 22 1、CH3 CH 2OH CH 2 2 + H 2O2、2CH 3 CH 2OH+ H 2O (分子间脱水) 3、C 2H 5 Cl CH 2 CH 2 + H ClOOOCH 2 O C C 17H 35 CH O C C 17H 35 CH 2 O C 17H 35CH 2CH OH CH 2 无水AlCl 3/HgCl 2/ZnCl 2150-160℃ 无过氧酸有过氧酸如CH 3COOOH 催化剂加热 HHC CH Cl +--+ H Cl无水AlCl 3 H 2SO 4 或 H 3PO 4 加热 加压HgSO 4(H +)OCH 3 C H高温、高压PdCl 2 或CuCl 2OCH 3 C H三、消去反应H 2SO 4浓170℃ H 2SO 4浓 140℃CH 3 CH 2 O CH 2 CH 3 NaOH C 2H 5OH四、酯化反应 (酯化反应也是取代反应)1、CH 3 COOH + CH 3 CH 2OH CH 3 COOCH 2 CH 3 + H 2O2、 + 3HONO 2+ H 2O3、[C 6H 7 O 2(OH) 3 ]n + 3n HONO 2 [C 6H 7 O 2(NO 2) 3 ]n + 3nH 2O 五、水解反应(卤代烃、酯、油脂的水解见上,也是取代反应)1、CH 3 COONa + H 2O 3 COOH + NaOH2、C 17H 35 COONa + H 2 C 17H 35 COOH + NaOH3、(C 6H 10O 5)n + nH 2O n C 6H 12O 64、C 12H 22O11 + H 2OC 6H 12O 6 + C 6H 12O 6C 12H 22O 11 + H 2O 2C 6H 12O 6麦芽唐 葡萄糖5、CH 3 COOCH 2 CH 3 + H 2O CH 3 COOH + CH 3 CH 2OH六、氧化反应①被强氧化剂氧化 1、2 CH 3 CH 2OH + O 2 2 + H 2O 2、2 + O 2 2 CH 3 COOH 3、2 CH 2 CH 2 + O 2 2 ②被弱氧化剂缓慢氧化1、CH 3 CHO + 2[Ag(NH 3)2] OH CH 3 COOH + 4 NH 3 + 2Ag + H 2O2、CH 3 CHO + 2 Cu(OH)2 CH 3 COOH + 2 Cu 2O + H 2O3、CH 2 OH(CHOH)4 CHO + 2[Ag(NH 3)2] OH CH 2 OH(CHOH)4 COOH + 4 NH 3 + 2Ag + H 2O4、CH 2 OH(CHOH)4 CHO +2 Cu(OH)2 OH(CHOH)4 COOH + 2 Cu 2O + H 2O5、HCOOH + 2[Ag(NH 3)2] OH CO 2 + 4 NH 3 + 2Ag + H 2OH 2SO 4浓 加热CH 2 OH CH OHCH 2 OHCH 2 O NO 2 CH O NO 2 CH 2 O NO 2 H 2SO 4浓 H 2SO 4浓H 2SO 4稀加热淀粉/纤维素 葡萄糖H 2SO 4稀加热蔗糖 葡萄糖 果糖H 2SO 4稀加热无机酸 或碱Cu 或Ag OCH3 C H OCH 3 C H Mn(AC)2 Mn(AC)2 OCH 3 C H 水浴加热 水浴加热 水浴加热6、HCOOH + 2 Cu(OH)2CO 2 + 2 Cu 2O + 2H 2O③有化合机物的燃烧 C x H y + (x+y /4) O 2xCO 2 + y /4 H 2O七、还原反应1、+ H 22、 + H 2 CH 3 CH 2OH3、 八、加聚反应1、n CH 2 CH 22、n CH CH3、 九、缩聚反应1、n+ nH 2O2、+ nH 2O 1、CH 4 C + 2H 2 C 16H 34 C 8H 16 + C 8H 18C 8H 18 C 4H 8 + C 4H 10 C 8H 16 CH 4 + C 7H 12十一、其它有机反应12 + H 2O 3 2、2CH 3 CH 2OH + 2Na 2CH 3 CH 2O Na + H 2 3、OH + 2Na 24、C 12H 22O 11 12C + 11 H 2O C + 2H 2SO 4(浓) CO 2 +2 SO 2 + 2H 2O5、氨基酸的两性点燃 O CH 3 C CH 3 CH 3 C CH 3 OCH 3 C H 2 CH 2 + H 2 2 CH 3nCH 2 CH CH 2 CH 2催化剂[ CH 2 CH CH 2 CH 2]nH N CH 2 C OH H O [N CH 2 C ]n H O催化剂COOH + nHO CH 2 CH 2 OH 催化剂O O CH 2 CH 2 O C C]n [ O 十、裂化反应高温 高温 高温 高温 H 2SO 4浓 + HClCH 2 COOH NH 2 CH 2 COOHNH 3Cl+ NaOHCH 2 COOH NH 2CH 2 COONa + NH 2H 2O。
高中有机方程式大全
nHOOC—
—COOH+ nHOCH2CH2OH
催化剂
HO—[ OC—
—CO OCH2CH2O—]n H +(2n-1)H2O
6、1,6—己二酸与 1,6—己二胺的缩聚: nHOOC(CH2)6COOH+nH2N(CH2)6NH2
催化剂
HO—[ OC(CH2)6CONH(CH2)6NH—]nH+(2n-1)H2O 七、酯类
加热
(三)乙二醛 1、乙二醛与银氨溶液反应:
OHC—CHO+4[Ag(NH3)2]OH 水浴加热 H4NOOC—COONH4+2H2O+4Ag↓+6NH3↑
2、乙二醛与新制的氢氧化铜反应:
加热
OHC—CHO+4Cu(OH)2 +2NaOH
NaOOC—COONa+2Cu2O↓ +6H2O
3、乙二醛的催化氧化:OHC—CHO+O2 催化剂 HOOC—COOH
COOH +2CH3CH2OH
COOH
浓 H2SO4 加热
COOCH2、乙二醇与足量的乙酸和浓硫酸共热:
CH2OH +2CH3COOH
CH2OH
浓 H2SO4 加热
CH2OOCCH3 CH2OOCCH3
+2H2O
二乙酸乙二酯
3、乙二酸与乙二醇和浓硫酸共热:
(一)乙酸乙酯
1、乙酸乙酯的燃烧:CH3COOCH2CH3+5O2 点燃 4CO2+4H2O
2、乙酸乙酯在酸性条件下的水解反应:
CH3COOCH2CH3+H2O 稀硫酸 CH3COOH+CH3CH2OH
加热
3、乙酸乙酯与氢氧化钠溶液共热: CH3COOCH2CH3+NaOH 加热 CH3COONa+CH3CH2OH
加热
12、2—丙醇的催化氧:2(CH3)2CHOH+O2 催化剂 2CH3COCH3+2H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机性质和方程式书写
一、有机物物理性质总结:
1、一般碳原子数越多熔沸点越高,碳原子数相同,支链越多熔沸点越低。
2、一般烃(CxHy)、酯类均难溶于水且比水的密度小;一般卤代烃均难溶于水且比水的密度大。
二、烷烃
1、通式: ;2、结构特点:碳碳单键,饱和;
3、空间构型:碳原子SP3杂化,以每个碳原子为中心空间伸展为四面体结构;甲烷空间结构:
;
4、同分异构和命名:(1)试写出符合C6H14的所有结构简式并命名
;
;
(2)符合C4H9Cl的同分异构体有 种;符合C4H8Cl2的同分异构体有 种;
5、性质:
(1)取代反应:甲烷和氯气: ; ; ;
;
(2)氧化反应:常温下烷烃均不能被酸性高锰酸钾氧化,紫色不褪色。
燃烧:CxHy和O2反应: 。
(3)分解反应:甲烷隔绝氧气高温: ;
C16H34催化分解(裂化): ;
三、烯烃
1、通式: (同碳数烯烃和环烷烃是同分异构);2、结构特点:碳碳双键,不饱和;
3、官能团: ;
4、空间结构:双键碳原子SP2杂化,以每个双键碳原子为中心空间伸展为平面结构;
5、同分异构和命名:写出符合C5H10且能使酸性高锰酸钾溶液褪色的所有结构简式并命名:
;
;
6、性质:
(1)加成反应:乙烯通入溴的四氯化碳: ;乙烯和水: ;
乙烯和盐酸反应: ;乙烯和氢气: 。
(2)氧化反应:常温下烯烃均能被酸性高锰酸钾氧化,紫色褪色。
(3)加聚反应:乙烯的加聚反应: ;苯乙烯的加聚: 。
四、炔烃
1、通式: (同碳数炔烃和二烯烃是同分异构;2、官能团: ;
3、结构特点:碳碳叁键,不饱和;
4、空间结构:双键碳原子SP杂化,以每个叁键碳原子为中心空间伸展为直线结构;
5、性质(类似烯烃):加成反应;氧化反应;加聚反应。
乙炔和氢气生成氯乙炔: ;氯乙炔的加聚反应: 。
五、苯及苯的同系物
1、通式: ;2、结构特点:含一个苯环,侧链均为饱和结构;
3、苯的结构:碳原子SP2杂化;六个碳原子形成平面正六边形,碳原子之间既不是单键也不是双
键,是一种独特的键;
4、同分异构和命名:试写出符合C8H10的所有结构简式并命名
;
5、性质:
(1)取代反应:苯和液溴: ;
(2)加成反应(一般只能和氢气加成): ;
(3)氧化反应:常温下不能被酸性高锰酸钾氧化,紫色不褪色。
苯环直接相连的碳上有氢原子时可被酸性高锰酸钾溶液氧化而褪色。(如甲苯等)
六、醇
1、饱和一元醇通式: ;(同碳数醇和醚是同分异构)2、官能团: ;
3、同分异构和命名:试写出符合C4H10 O且能够和钠反应的所有结构简式并命名:
;
4、性质:(1)乙醇和钠: ;
(2)乙醇催化氧化(去氢): ;乙醇也可被酸性高锰酸钾溶液氧化而褪色;
(3)乙醇消去反应: ;
(4)乙醇和乙酸的酯化反应(属于取代反应: ;
(5)乙醇和溴化氢取代反应: 。
七、醛
1、饱和一元醛通式: ;(同碳数醛、酮、烯醇是同分异构)2、官能团: ;
3、性质:(1)氧化反应:乙醛的催化氧化(加氧): ;
乙醛发生银镜反应: ;
乙醛和新制的氢氧化铜悬浊液的反应: ;
(2)乙醛的催化还原(加氢): ;
(有机中氧化反应:去氢或加氧,还原反应为加氢或去氧)
八、羧酸
1、饱和一元酸的通式:
