★碳族元素基础知识点
高中化学关于碳的知识点

高中化学关于碳的知识点碳是一种非金属元素,位于元素周期表的第二周期IVA族。
你知道多少关于碳的化学知识点呢?接下来店铺为你整理了高中化学关于碳的知识点,一起来看看吧。
高中化学关于碳的知识点:一氧化碳1、物理性质:无色,无味的气体,密度比空气略小,难溶于水2、有毒:吸进肺里与血液中的血红蛋白结合,使人体缺少氧气而中毒。
3、化学性质:(H2、CO、C具有相似的化学性质:①可燃性②还原性)1)可燃性:2CO+O2点燃 2CO2 (可燃性气体点燃前一定要检验纯度)H2和O2的燃烧火焰是:发出淡蓝色的火焰。
CO和O2的燃烧火焰是:发出蓝色的火焰。
CH4和O2的燃烧火焰是:发出明亮的蓝色火焰。
鉴别:H2、CO、CH4可燃性的气体:看燃烧产物(不可根据火焰颜色)(水煤气:H2与CO 的混合气体 C + H2O高温 H2 + CO)2)还原性:CO+CuO △ Cu+CO2 (非置换反应) 应用:冶金工业现象:黑色的氧化铜逐渐变成光亮红色,石灰水变浑浊。
Fe2O3+3CO高温 2Fe+3CO2(现象:红棕色粉末逐渐变成黑色,石灰水变浑浊。
)除杂:CO[CO2] 通入石灰水或氢氧化钠溶液:CO2+2NaOH==Na2CO3+H2OCO2[CO] 通过灼热的氧化铜CO+CuO △ Cu+CO2CaO[CaCO3]只能煅烧(不可加盐酸) CaCO3高温CaO+CO2↑注意:检验CaO是否含CaCO3加盐酸:CaCO3+2HCl==CaCl2+H2O+CO2↑(CO32-的检验:先加盐酸,然后将产生的气体通入澄清石灰水。
)高中化学关于碳的知识点:二氧化碳1、物理性质:无色,无味的气体,密度比空气大,能溶于水,高压低温下可得固体——干冰2、化学性质:1)一般情况下不能燃烧,也不支持燃烧,不能供给呼吸2)与水反应生成碳酸:CO2+H2O==H2CO3 生成的碳酸能使紫色的石蕊试液变红,H2CO3 == H2O+ CO2↑ 碳酸不稳定,易分解3)能使澄清的石灰水变浑浊:CO2+Ca(OH)2==CaCO3↓+H2O 本反应用于检验二氧化碳。
高一上册化学碳族元素实验知识点总结

高一上册化学碳族元素实验知识点总结化学中存在着化学变化和物理变化两种变化形式。
以下是查字典化学网为大家整理的高一上册化学碳族元素实验知识点,希望可以解决您所遇到的相关问题,加油,查字典化学网一直陪伴您。
碳族元素实验1:把石墨电极或铅笔芯和导线连在一起,接通电源后,灯泡是否发亮?现象与解释:灯泡发亮,说明石墨能导电。
实验2:参考左图所示装置,制一个净水器,并完成实验。
现象与解释:混有红墨水的水变为无色,说明木炭(活性炭)具有吸附性。
实验3:把木炭加热到发红,伸进盛有氧气的集气瓶里,注意木炭在空气里和在氧气里燃烧有什么不同。
燃烧停止后,立即向瓶内倒入一些澄清的石灰水,振荡,观察现象。
现象与解释:木炭在氧气里燃烧比在空气里燃烧更旺,发出白光,并放出热量。
燃烧后生成的无色气体能使澄清的石灰水变浑浊,说明碳与氧气反应生成了二氧化碳。
实验4:把经过烘干的木炭和黑色的氧化铜共同研磨均匀,小心地铺放进试管里,把试管固定在铁架台上。
试管口装有通入澄清石灰水的导管,用酒精灯(可加网罩使火焰集中并提高温度)加热试管几分钟。
观察现象。
现象与解释:黑色固体变为有红色固体,说明有金属铜生成;澄清石灰水变浑浊,说明有二氧化碳生成。
实验5:在一根细木棍的两端各系上一个大小相同的小纸袋(或一次性水杯),在木棍的中间部位系上一根细绳,使两端平衡,并把它系在铁架台上。
取预先收集好的二氧化碳(注意观察颜色、状态),迅速倒入其中一个小纸袋中,观察两端的小纸袋是否继续保持平衡。
现象与解释:二氧化碳是一种没有颜色的气体;倒入二氧化碳的小纸袋一端向下倾斜,说明二氧化碳的密度比空气大。
实验6:点燃两支短蜡烛,分别放在白铁皮架的两个阶梯上,把白铁皮架放在烧杯里,沿烧杯壁倾倒二氧化碳。
观察现象。
现象与解释:二氧化碳使下层阶梯上的蜡烛先熄灭,上层的后熄灭。
这个实验可以说明两点:第一,二氧化碳既不能燃烧,也不能支持燃烧;第二,二氧化碳的密度比空气大。
实验7:向盛有紫色试液的试管里通入二氧化碳,观察石蕊试液颜色的变化。
碳族元素知识点归纳

碳在氧气不足的情况下,生成 CO:
2 C(s)+ O2(g)—— 2 CO(g)(b)
一氧化碳可以与氧气进一步反应,
生成二氧化碳:
2 CO + O2 —— 2 CO2
(c)
焦炭是冶金工业的重要还原剂, 被用来还原金属氧化物矿物以冶炼 金属。如:
ZnO + C —12—00 —K Zn + CO
该反应可看作是反应
每个 C 原子以近似于 sp2 的杂化轨 道与相邻 3 个碳原子相连,未参加杂化 的 p 轨道在 C60 的球面形成大 键。
用纯石墨作电极,在氦气氛围中放 电,令电弧中产生的碳烟沉积在水冷反 应器的内壁上,这种碳烟中存在着数量 可观的 C60、C70 等碳原子簇。
2. 碳单质的还原性 碳单质最重要的性质是它的还原性。 碳在空气中充分燃烧,生成 CO2: C(s)+ O2(g)—— CO2 (g) (a)
CaCO3
有机化合物 动植物体, 煤,石油,天然气
碳在地壳中的质量分数 为 0.048 % 列第 15 位
硅 Si (曾用矽)
以 Si-O-Si 键的化合态存在: 水晶、石英、SiO2 其他硅酸盐矿物
硅在地壳中的质量分数 为 27.7 % 列第 2 位
1823 年,瑞典人贝采里乌斯 (Berz-elius)用金属钾还原四氟化 硅首次制得单质硅。
图中(d),(b)两线交点所对 应的温度为 T1,这时反应:
△rGm /(kJ·mol-1) -200 -400 -600 -800
(a) (b)
(c)
273
1273
T/K
(a) 2 CO(g)+ O2(g)—— 2 CO2(g)
反应的 △rSm 为负,其斜率为正。
高中化学碳和硅的知识点介绍

高中化学碳和硅的知识点介绍(一)碳族元素1、组成和结构特点(1)碳族元素包括碳、硅、锗、锡、铅五种元素,位于元素周期表的IVA族。
(2)碳族元素原子最外层有4个电子,在化学反应中不易得到或失去电子,易形成共价键。
主要化合价有+2和+4价,其中碳和硅有负价。
碳族元素在化合物中多以+4价稳定,而铅在化合物中则以+2价稳定。
碳族元素中碳元素形成的单质(金刚石)硬度最大;碳元素形成的化合物种类最多;在所有非金属形成的气态氢化物中,CH4中氢元素的质量分数最大;12C是元素相对原子质量的标准原子;硅在地壳中的含量仅次于氧,其单质晶体是一种良好的半导体材料。
2、性质的递变规律随着原子序数的增大,碳族元素的原子半径依次增大,由非金属元素逐渐转变为金属元素,即金属性逐渐增强,非金属性逐渐减弱;最高价氧化物对应水化物的酸性逐渐减弱,碱性逐渐增强;气态氢化物的稳定性逐渐减弱,还原性逐渐增强。
(二)碳及其化合物1、碳单质(1)碳的同素异形体金刚石石墨足球烯晶体类型原子晶体过渡性晶体分子晶体微粒间作用力共价键层内共价键,层间范德华力范德华力熔沸点很高很高低溶解性一般不溶难溶易溶于有机溶剂硬度最大质软很小导电性不导电导电不导电(2)碳的化学性质常温下碳的性质稳定,在加热、高温或点燃时常表现出还原性,做还原剂,温度越高,还原性越强,高温时的氧化产物一般为一氧化碳。
溶解性不同:一般情况下,所有的钾盐、钠盐和铵盐是可溶的,所有的酸式盐是可溶的,正盐的溶解度小于酸式盐的溶解度,但碳酸钠的溶解度大于碳酸氢钠的溶解度。
热稳定性不同:一般情况下,难溶的正盐和酸式盐受热易分解,可溶性碳酸盐稳定不易分解。
与酸反应的剧烈程度不同:两者都能与强酸(H+)反应产生CO2,但反应的剧烈程度不同,根据反应的剧烈程度可鉴别两者。
可溶性盐的水解程度不同:相同浓度的正盐溶液的pH值大于酸式盐溶液的pH值。
与碱反应不同:弱酸的酸式盐可与碱反应生成正盐。
与盐反应不同:碳酸钠可与氯化钙或氯化钡反应生成难溶性碳酸盐,但碳酸氢钠不反应。
碳族元素知识小结

碳族元素知识归纳二. 教学目标:1. 通过对比归纳C 和Si ;2CO 和2SiO 等主要单质和化合物的性质。
2. 归纳酸式盐的有关反应。
3. 连续反应的讨论题。
三. 知识体系: 1. 碳族元素(1)概述① 结构:最外层都是4个电子 ② 位置:ⅣA 族 (2)性质① 相似性:化合价4,2,4-++,易形成共价化合物,难形成简单离子 ② 递变性:从Pb C →,非金属性逐渐减弱,金属性逐渐增强 2. Si(1)物理性质:熔沸点高,硬度大,半导体 (2)化学性质:① 常温:只与HF F 、2、强碱溶液反应 ② 加热:与22Cl O 、等反应 (3)制备:↑++CO Si C SiO 222高温3. 2SiO(1)物理性质:硬度大,熔沸点高 (2)化学性质:① 酸性氧化物,具有酸性氧化物的通性 ② 不与水反应(不溶于水) ③ 不与酸反应(HF 除外)④ 高温下与32,CO Na CaO 等反应生成相应的硅酸盐 ⑤ 与强碱反应:O H SiO Na NaOH SiO 23222+=+ 4. 硅酸盐工业及新型无机非金属材料四. 专题总结:专题二碳与硅单质的性质比较1. 金刚石和晶体硅都是原子晶体,都不溶于水和任何有机溶剂,它们的熔、沸点、硬度均高,但前者比后者更高。
2. 碳、硅在常温下稳定,高温时活泼性增强,主要表现还原性。
碳、硅的化学性质(见下表)。
碳和硅的性质比较专题三 二氧化碳和二氧化硅的结构、性质比较(见下表)专题四 酸式盐性质的一般规律 1. 酸式盐的性质(1)在水中的溶解性:一般来说,在相同温度下,酸式盐的溶解度比正盐大,如3CaCO 难溶于水,23)(HCO Ca 易溶于水。
但也有例外,如3NaHCO 的溶解度比32CO Na 小。
(2)与酸或碱反应:强酸的酸式盐只跟碱反应,不跟酸反应;弱酸的酸式盐既能跟碱反应又能跟酸反应。
如:将少量4NaHSO 溶液滴入2)(OH Ba 溶液中:O H BaSO OH Ba SO H 24224+↓=+++-+-+O H CO OH HCO 2233+=+---O H S OH HS 22+=+---↑+=++-223CO O H H HCO 4342PO H H PO H =++-等(3)对热的稳定性:一般来说,热稳定性大小顺序为:正盐>酸式盐>多元酸盐(盐的阳离子相同,成盐的酸相同)。
12.3.1 碳族元素
8 8 1098 1277
•碱金属碳酸盐稳定,难分解 电荷少,半径大,8电子构型,极化力小,反极化作用 小,碳酸盐稳定。 •同周期,碱土金属碳酸盐比碱金属稳定性差。 •碱土金属碳酸盐从Mg到Ba稳定性增强 Mn+ r(Mn+)/pm Mn+电子构型 分解温度/℃ Mn+ r(Mn+)/pm Mn+电子构型 分解温度/℃ Li+ Na+ 60 95 2 8 1100 1800 Fe2+ 74 9∼17 282 Mg2+ Ca2+ Sr2+ Ba2+ 65 99 113 135 8 8 8 8 402 814 1098 1277 Cd2+ 97 18 360 Pb2+ 120 18+2 315 Ag+ 126 18 218
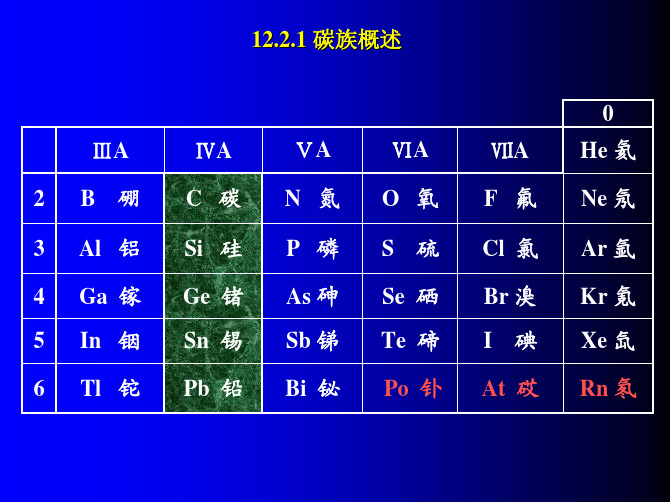
12.2.1 碳族概述 0 ⅢA 2 3 4 5 6 B 硼 ⅣA C 碳 Si 硅 Ge 锗 Sn 锡 Pb 铅 ⅤA N 氮 P 磷 As 砷 Sb 锑 Bi 铋 ⅥA O 氧 S 硫 Se 硒 Te 碲 Po 钋 ⅦA F 氟 Cl 氯 Br 溴 I 碘 He 氦 Ne 氖 Ar 氩 Kr 氪 Xe 氙 Rn 氡
生成物 氢氧化物 碱式碳酸盐 碳酸盐
2 2 Mg 2 2CO3 H 2O Mg 2 ( OH )2 CO3 ( s ) CO2 ( g ) 2 2Cu 2 2CO3 H 2O Cu2 ( OH )2 CO3 ( s ) CO2 ( g )
2 Ca 2 CO3 CaCO3 ( s ) 2 Ba 2 CO3 BaCO3 ( s )
•CO2用于制冷剂、灭火剂,是生产小苏打、纯碱、肥料和 铅白的原料。 •在生产和科研中, CO2常用作惰性介质。
高一化学碳的知识点总结
高一化学碳的知识点总结化学是一门既基础又重要的学科,而对于高中生来说,学习化学是非常重要的。
其中,碳是化学中一个极为重要的元素。
本文将介绍高一化学中与碳相关的一些知识点。
1. 碳的基本性质碳是自然界中广泛存在的元素之一。
它是一种非金属元素,在常温常压下,纯碳呈固体状态,没有颜色和气味。
碳具有良好的化学稳定性,不容易与其他元素发生反应,因此被认为是一种稳定的元素。
2. 碳的同素异形体碳的同素异形体是指具有相同的化学组成,但结构不同的化合物。
最常见的碳同素异形体是钻石和石墨。
钻石由坚硬的晶体结构组成,是一种透明且具有光泽的宝石。
而石墨由层状结构组成,是一种具有黑色、柔软、导电性能的物质。
3. 碳的化合物碳在自然界中与许多元素能够形成化合物。
最常见的化合物是碳氢化合物,即由碳和氢组成的化合物。
其中,烷烃是最简单的一类碳氢化合物,由碳原子构成直链或支链结构,并与氢原子相连。
另外,碳还能与氧、氮、硫等元素形成多种化合物,如醇、醚、酮、酸等。
4. 碳的电子结构碳的原子结构中,有6个电子,排布在两个能级上。
其中,主能级1上有2个电子,主能级2上有4个电子。
碳的电子结构决定了其在化学反应中的活性。
碳有4个价电子,可以与其他元素共享电子形成化学键。
5. 碳的共价键碳与其他元素形成的化学键通常为共价键。
共价键指的是通过共享电子对来连接化合物中的原子。
碳原子通常形成4个共价键,其中最常见的是与其他碳原子形成的碳-碳共价键。
6. 碳的重要化合物碳的化合物有很多,在生活中有广泛应用。
其中,最重要的是有机化合物。
有机化合物是由碳和氢组成的化合物,有时也包含其他元素,如氧、氮、硫等。
有机化合物在生活和工业中起着重要的作用,如燃料、药物、塑料、橡胶等。
总结:高一化学中学习碳的知识点是非常重要的。
了解碳的基本性质、同素异形体以及与其他元素形成的化合物,可以帮助我们更好地理解化学反应和化学变化。
同时,深入了解碳的电子结构和共价键的形成,可以为我们学习有机化学打下坚实的基础。
化学辅导之碳的知识点有哪些
化学辅导之碳的知识点有哪些碳单质很早就被人认识和利用,碳的一系列化合物——有机物更是生命的根本。
碳是生铁、熟铁和钢的成分之一。
下面是小编给大家带来的化学辅导之碳的知识点,欢迎大家阅读参考,我们一起来看看吧!初中化学知识点:碳的性质概述:碳是一种非金属元素,位于元素周期表的第二周期IVA族。
拉丁语为Carbonium,意为“煤,木炭”。
汉字“碳”字由木炭的“炭”字加石字旁构成,从“炭”字音。
碳是一种很常见的元素,它以多种形式广泛存在于大气和地壳之中。
碳能在化学上自我结合而形成大量化合物,在生物上和商业上是重要的分子。
生物体内大多数分子都含有碳元素。
a)稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应b)可燃性:碳的存在形式是多种多样的,有晶态单质碳如金刚石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。
单质碳的物理和化学性质取决于它的晶体结构。
高硬度的金刚石和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。
碳的化学性质:1.稳定性:在常温下碳的化学性质稳定,点燃或高温的条件下能发生化学反应2.可燃性:氧气充足的条件下:C+O2CO2 氧气不充分的条件下: 2C+O23.还原性:木炭还原氧化铜:C+2CuO2Cu+CO2↑ 焦炭还原氧化铁:3C+2Fe2O34Fe+3CO2↑ 焦炭还原四氧化三铁:2C+Fe3O43Fe+2CO2↑ 木炭与二氧化碳的反应:C+CO2CO◎ 碳的性质的知识点拨碳”与“炭”的区别:“碳”是一种核电荷数为6的非金属元素,而“炭” 一般是指由石墨的微小晶体和少量杂质组成的混合物,如木炭、焦炭、活性炭、炭黑等。
在说明碳元素时,用“碳”表示,如碳单质、二氧化碳、碳酸等;在说明含石墨的无定形碳时,用“炭”表示,如木炭、焦炭等。
碳燃烧生成物的判断:氧气量充足时,碳充分燃烧:C+O2CO2 氧气量不充足时,碳不充分燃烧:2C+O22CO初中化学知识点:活性炭和木炭的结构和用途定义:木炭、活性炭、炭黑、焦炭是由石墨的微小晶体和少址杂质构成的,均属混合物。
高二化学碳族元素知识精讲 人教版
高二化学碳族元素知识精讲人教版一. 本周教学内容:碳族元素[学习过程]四. 碳族元素的物质的氧化还原性小结:1. 碳族元素的单质以还原性为主,如C 、Si 都能被O 2氧化,高温时C 可还原CuO ;Sn 、Pb 都能与酸反应置换出H 2等。
2. +2价的化合物有还原性。
如CO 高温时可还原某些金属氧化物。
3. +4价的化合物有氧化性。
如CO 2和C 高温时反应生成CO ;PbO 2是强氧化性等。
【疑难解析】在密闭容器中充入CO 2和CO 的混合气体,测其密度是同条件下氦气密度的8倍,这时容器内压强为P 1。
若控制容器的体积不变时,加入足量的Na 2O 2,充分振荡并不断用电火花点燃至反应完全。
恢复容器到开始时的温度,再次测得容器内压强为P 2。
则P 1和P 2的关系是( )A. P 1=2P 2B. P 1=4P 2C. P 1=6P 2D. P 1=8P 2解析:本题的难点在于反应的循环,处理类似问题最有效的途径是综合分析。
232222222O CO Na CO O Na +→+ 2222CO CO O →+因为Na 2O 2足量,故剩余气体中一定不存在CO 2;据此将两个方程式作变形得: *3222CO Na CO O Na →+ 3248=⨯=平因M311243228442=COCO 设混合气体中CO 2为1mol ,CO 为3mol由*知,反应的结果无论原混合气体中含多少CO 都不影响最终剩余气体的组成及量。
所以,剩余为0.5mol 的O 2185.042121===mol mol n n P P 选D【典型例题】1. 怎样用化学方法检验生石灰里混有的石英和石灰石等杂质?解析:物质检验方法选择的依据是物质之间性质的差异,结构决定性质,故首先应从组成结构入手。
CaO (SiO 2、CaCO 3)的检验,CaO 是碱性氧化物,SiO 2是酸性氧化物且不溶于水,CaCO 3是碳酸盐,故加入过量盐酸可使CaCO 3释放出CO 2气体,可使CaO 溶解而SiO 2以固体形式保留。
考点21碳族元素碳及其化合物
考点21碳族元素碳及其化合物碳(Carbon)是第14号元素,在元素周期表中位于第2周期、14族。
碳是一种非金属元素,原子序数为6,是自然界中最丰富的元素之一,也是生命体中存在最多的元素之一、碳具有丰富的化学性质和形成化合物的能力,因此具有广泛的应用。
碳的基本性质:1.原子结构:碳原子的原子核周围有6个电子,分布在两个能级上,第一能级上有2个电子,第二能级上有4个电子。
碳原子的电子排布为1s22s22p2,其中2p2的两个电子构成了碳原子的共有电子对。
2. 原子半径:碳原子的共有电子对可以与其他原子的电子对进行共价结合,形成化学键。
碳原子的共价半径为77 pm。
3.化合价:碳原子的化合价为4,即一个碳原子可以形成4个共价键。
这使得碳原子能够与其他元素形成多种多样的化合物。
碳的化合物:碳的化合物非常多样,其中最简单的是与碳原子形成单一共价键的化合物。
例如,甲烷(CH4)是由一个碳原子和四个氢原子形成的化合物。
甲烷是天然气的主要成分之一,也是一种重要的燃料和化学原料。
除了甲烷,碳还能形成许多其他的化合物,如乙烷(C2H6)、乙炔(C2H2)等。
这些化合物在能源、化工、材料等领域有着广泛的应用。
碳族元素的共同性质:除了碳,碳族元素还包括硅(Silicon)、锗(Germanium)、锡(Tin)、铅(Lead)等元素。
这些元素都具有相似的电子结构和化学性质:1.四个共价键:碳族元素的原子外层都有四个电子,因此它们都能够形成四个共价键。
2.价态变化:由于碳族元素具有4个共价键的能力,在不同的化合物中它们的价态可能有所不同。
例如,碳可以形成-4价的甲烷,也可以形成+4价的二氧化碳。
3.相似的化学性质:碳族元素都具有相似的化学性质,例如对氧化剂的反应性较弱,容易与氧化还原反应中电子亲和力较低的元素结合。
碳族元素及其化合物的应用:1.碳的应用:碳是材料工程领域最重要的元素之一,它能够形成多种多样的材料,如金刚石和石墨。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 ★碳族元素基础知识点 一、知识网络 1.碳及其化合物的知识网络
2.硅及其化合物的知识网络 二、基础知识 1.碳族元素 ①特征:碳族元素原子最外层电子数为4,既不容易失去电子,又不容易得到电子,易形成共价键,难形成离子键。碳族元素形成的单质在同周期中硬度最大,熔沸点最高(如金刚石、晶体硅)。 ②化合价:碳族元素的主要化合价有+2,+4,其中Pb+2价稳定,其余元素+4价稳定。 ③递变规律:从上到下电子层数增多,原子半径增大,原子核对最外层电子的吸引能力减弱,
Ca(HCO3)2 C CO2 CaCO3
CaC2 C2H2
CO 有机物 NH4HCO3 CH4
H2CO3 Na2CO3 NaHCO3 O2 SiC 、CCl4
不完全燃烧 O2(不足) O2 (
不
足)
①O2 ②CuO 炽 热的碳 NH3·H2O
O2 (
点
燃)
△
H2O CaO
△
Si、Cl2 (△)
Mg (点燃) ①O2 (点) ②CuO (△)
C、CO Na2O2
NaOH H2O
NaOH H+
Ca(OH)2 ①高温②H+ Ca2+ CO2 、H2O △
Ca(OH)2
CO2 (水) ①OH― ②加热
Na2SiO3 CO2,H2O NaOH H2SiO3 SiH4 Si SiO2 CaSiO3 SiF4 H4SiO4 SiC SiCl4 O2 (自燃) H2 ①O2(△) ②FeO (高温)
F2 HF Cl2 (高温) H2
(高温)
C(高温)
C(高温)足量
Na2CO3 (高温) NaOH(溶液)
①CaO(△) ②CaCO3 (△)
Ca2+ -H2O
C(适量) 2
失电子的能力增强,从上到下由非金属递变为金属的变化非常典型。其中碳是非金属,Sn、Pb是金属,Si、锗Ge是半导体材料。 ④自然界的存在:自然界里碳有游离态和化合态两种;硅在地壳里无游离态,主要以含氧化合物的形式存在 ⑤几种同素异形体:碳:金刚石、石墨、C60、C70等;硅:晶体硅,无定形硅 2.碳 在常温下碳很稳定,只在高温下能发生反应,通常表现为还原性。 ①燃烧反应 ②与某些氧化物的反应:CuCOCuOCCOCOC22;222高温 OHCOOHC22高温(CO、H2的混合气体叫水煤气);
2COSiSiO2C2电炉
③与氧化性酸反应:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O; C+4HNO3(浓)CO2↑+4NO2↑+2H2O 3.CO 不溶于水,有毒(CO和血红蛋白结合,使血红蛋白无法和O2结合,而使细胞缺氧引起中毒),但由于CO无色无味因此具有更大的危险性。 ①可燃性 ②还原性:CO+CuOCO2+Cu,CO+H2O(g)CO2+H2O 4.CO2 直线型(O=C=O)非极性分子,无色能溶于水,密度大于空气,可倾倒,易液化。固态CO2俗称干冰,能升华,常用于人工降雨。实验室制法:CaCO3+2HCl=CaCl2+CO2↑+H2O。 ①酸性氧化物一—酸酐 Ca(OH)2+CO2=CaCO3↓+H2O(用于检验CO2) ②氧化性:CO2+C高温2CO;2Mg+CO2点燃2MgO+C 5.碳酸盐 ①溶解性:Ca(HCO3)2>CaCO3;Na2CO3>NaHCO3。 ②热稳定性:Na2CO3>CaCO3;碱金属正盐>碱金属酸式盐: Na2CO3>NaHCO3。 ③相互转化:碳酸正盐碳酸酸式盐(除杂用) 6.硅 ①硅在地壳中只有化合态,没有游离态。其含量在地壳中居第二,仅次于氧,是构成矿物和岩石的主要成分。 ②晶体硅是灰黑色,有金属光泽,硬而脆的固体,是半导体,具有较高的硬度和熔点。 ③硅的化学性质不活泼,常温下,只能与氟气、氢氟酸及强碱溶液反应:Si+2F2→SiF4、Si+4HF 3
→SiF4+2H2↑、Si+2NaOH+H2O→Na2SiO3+2H2↑;在加热条件下,能与氧气、氯气等少数非金属单质化合:Si+O2SiO2。 ④制备:在电炉里用碳还原二氧化硅先制得粗硅:SiO2+2C高温Si+2CO↑,将制得的粗硅,再与C12反应后,蒸馏出SiCl4,然后用H2还原SiCl4可得到纯硅。有关的反应为:Si十2C12高温SiCl4、 SiCl4+2H2高温Si+4HCl。 ⑤硅在高新技术中的应用:高纯硅可作半导体材料 7.SiO2 ①SiO2为原子晶体,是一种坚硬难熔的固体,硬度、熔点都很高。而CO2通常状况下是气体,固体熔点很低。其差别在于晶体类型不同。CO2是分子晶体,故熔点很低。 ②二氧化硅的化学性质很稳定,不能跟酸(氢氟酸除外)发生反应。由于它是一种酸性氧化物,所以能跟碱性氧化物或强碱反应 SiO2+CaO高温CaSiO3 SiO2+2NaOH→Na2SiO3+H2O(碱溶液不能在使用磨口玻璃塞的试剂瓶中) ③二氧化硅是一种特殊的酸性氧化物 a.酸性氧化物大都能直接跟水化合生成酸,但二氧化硅却不能直接跟水化合,它的对应水化物(硅酸)只能用相应的可溶性硅酸盐跟盐酸作用制得:首先让SiO2和NaOH(或Na2CO3)在熔化条件下反应生成相应的硅酸钠:SiO2+2NaOH熔化Na2SiO3+H2O, SiO2+Na2CO3熔化Na2SiO3+CO2,然后用酸与硅酸钠作用制得硅酸:Na2SiO3+2HCl →H2SiO3+2NaCl。 b.酸性氧化物一般不跟酸作用,但二氧化硅却能跟氢氟酸起反应:SiO2+4HF→SiF4+2H2O(氢氟酸不能盛放在玻璃容器中)。 ④光导纤维 ⑤石英、水晶 石英的主要成分是SiO2,可用来制造石英玻璃。石英晶体中有时含有其他元素的化合物,它们以溶解状态存在于石英中,呈各种颜色。纯 净的SiO2晶体叫做水晶,它是六方柱状的透明晶体,是较贵重的宝石。 8.硅酸和硅胶 ①硅酸:硅酸有多种形式,如H4SiO4、H2SiO3、H2Si2O5等。一般用通式xSiO2·yH2O表示,由于“H2SiO3”分子式最简单,习惯采用H2SiO3作为硅酸的代表。 ②硅酸酸性比碳酸还弱,由下列反应可证明:Na2SiO3+CO2+H2O→H2SiO3↓+Na2CO3 ③硅胶:刚制得的硅酸是单个小分子,能溶于水,在存放过程中,它会逐渐失水聚合,形成各种多硅酸,接着就形成不溶于水,但又暂不从水中沉淀出来的“硅溶胶”。如果向硅溶胶中加入电解质,则它会失水转为“硅凝胶”。把硅凝胶烘干可得到“硅胶”。烘干的硅胶是一种多孔性物质,具有良好的吸水性。而且吸水后还能烘干重复使用,所以在实验室中常把硅胶作为作为干燥剂。 4
9.硅及其化合物的“反常” ①Si的还原性大于C,但C却能在高温下还原出Si:SiO2+2C高温Si+2CO↑ ②非金属单质跟碱液作用一般无H2放出,但Si却放出H2:Si+2NaOH+H2O→Na2SiO3+2H2↑ ③非金属单质一般不跟非氧化性酸作用,但Si能与HF作用:Si+4HF→SiF4+2H2↑ ④非金属单质大多为非导体,但Si为半导体。 ⑤SiO2是H2SiO3的酸酐,但它不溶于水,不能直接将它与水作用制备H2SiO3。 ⑥酸性氧化物一般不与酸作用,但SiO2能跟HF作用:SiO2+4HF→SiF4+2H2O ⑦无机酸一般易溶于水,但H2SiO3难溶于水。 ⑧因H2CO3的酸性大于H2SiO3,所以在Na2SiO3溶液中通人CO2能发生下列反应:Na2SiO3+CO2+H2O→H2SiO3↓+Na2CO3,但在高温下SiO2+Na2CO3高温Na2SiO3+CO2↑也能发生。 ⑨Na2SiO3的水溶液称水玻璃,但它与玻璃的成分大不相同,硅酸钠水溶液(即水玻璃)称泡花碱,但它却是盐的溶液,并不是碱溶液 10.硅酸盐 ①硅酸盐是构成地壳岩石的主要成分,其结构复杂,组成可用氧化物的形式表示。例如:硅酸钠Na2SiO3(Na2O·SiO2);镁橄榄石Mg2SiO4(2MgO·SiO2);高岭石Al2(Si2O5)(OH)4(A12O3·2SiO2·2H2O) ②云母、滑石、石棉、高岭石等,它们都属于天然的硅酸盐。 ③人造硅酸盐:主要有玻璃、水泥、各种陶瓷、砖瓦、耐火砖、水玻璃以及某些分子筛等。 ④硅酸盐制品性质稳定,熔点较高,难溶于水,有很广泛的用途。最简单硅酸盐是硅酸钠,其水溶液俗称水玻璃,是一种矿物胶,可作粘合剂,防腐剂。 11.水泥、玻璃、陶瓷 ①普通水泥的主要成分是硅酸三钙(3CaO·SiO2)、硅酸二钙(2CaO·SiO2)和铝酸三钙(3CaO·Al2O3),水泥具有水硬性,水泥、沙子和碎石的混合物叫混凝土。 ②制玻璃的主要原料是纯碱、石灰石和石英,主要反应是:SiO2+Na2CO3高温Na2SiO3+CO2↑、SiO2+CaCO3高温CaSiO3+CO2↑,玻璃是无固定熔点的混合物。加入氧化钴后的玻璃呈蓝色,加入氧化亚铜后的玻璃呈红色,普通玻璃一般呈淡绿色,这是因为原料中混有二价铁的缘故。 ③制造陶瓷的主要原料是黏土,黏土的主要成分:Al2O3·2SiO2·2H2O。 12.无机非金属材料 无机非金属材料包含除传统陶瓷外的各种性能优异的精细陶瓷:耐高温的二氧化锆(ZrO2)陶瓷、高熔点的氮化硅(Si3N4)和碳化硅(SiC)陶瓷;透明的氧化铝、砷化镓(GaAs)、硫化锌(ZnS)、硒化锌(ZnSe)、氟化镁(MgF2)、氟化钙(CaF2)等氧化物或非氧化物陶瓷;生物陶瓷;超细微粉体粒子制造的纳米陶瓷等。
