2-1-1-1元素周期表1
化学元素周期表超清可打印
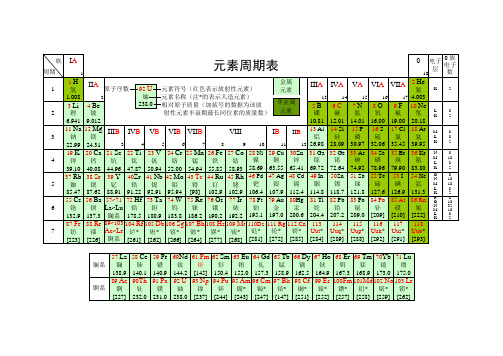
[222]
P
O
N
M
L
K
8
18
32
18
8
2
7
87Fr
钫
[223]
88Rr
镭
[226]
89~103
Ac~Lr
锕系
104Rf
钅卢*
[261]
105Db
钅杜*
[262]
106Sg
钅喜*
[266]
107Bh
钅波*
[264]
108Hs
钅黑*
[277]
109Mt
钅麦*
[268]
110Ds
钅达*
[281]
111 Rg
4.003
K
2
2
3Li
锂
6.941
4Be
铍
9.012
5B
硼
10.81
6C
碳
12.01
7N
氮
14.01
8O
氧
16.00
9F
氟
19.00
10Ne
氖
20.18
L
K
8
2
3
11Na
钠
22.99
12Mg
镁
24.31
IIIB
3
IVB
4
VB
5
VIB
6
VIIB
7
VIII
89 10
IB
11
IIB
12
13Al
铝
26.98
29Cu
铜
63.55
30Zn
锌
65.41
31Ga
镓
69.72
化学元素周期表的规律总结

化学元素周期表规律化学元素周期表的规律总结1、同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减,其中0族元素除外。
2、同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子半径增大,原子序数也会随之递增,元素金属性递增,非金属性则递减。
元素周期表规律1、原子半径的规律(1)除了第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随着电子层数增多,原子的半径也会随之增大。
2、元素化合价的规律(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同。
3、单质的熔点规律(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。
4、元素的金属性与非金属性规律(1)同一周期的元素从左到右金属性递减,非金属性递增;(2)同一主族元素从上到下金属性递增,非金属性递减。
5、最高价氧化物和水化物的酸碱性规律元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
6、非金属气态氢化物规律元素非金属性越强,气态氢化物越稳定。
同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。
7、单质的氧化性、还原性规律一般元素的金属性越强,其单质的还原性越强,其氧化物的氧离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。
8、热稳定性规律同一周期自左向右依次增加,同一族自上而下减少,与非金属元素电负性变化规律一样。
高中化学-元素周期表-1

+88 2 8183218 82
已知某主族元素的原子结构示意图如下,判断 其位于第几周期,第几族?
电子层数 决定
决定
最外层电子数
周期序数 主族序数
那么12号元素Mg,35号元素Br在周期表 中的位置在哪?
主族与副族的对比
定义 表示 个数
主族 长短周期共同组成
IA、IIA、… 7
副族 仅由长周期组成
练习
1、下列各组中的元素用原子序数表示,其 中都属于主族的一组元素是( C)
(A)14、24、34 (C)5、15、20
(B)26、31、35 (D)11、17、18
2、下列各表为周期表的一部分(表中为
原子序数),其中正确的是( D )
(A) 2 3 4(B)
2
11
10 11
19
18 19
(C)
(X为Cl、Br)
3I2+6OH- =5I- +IO3- +3H2O
在氧化还原反应中,氧化剂 > 氧化产物 的氧化能力
E、卤素单质间的置换反应
(1) Cl2 + 2NaBr = 2NaCl + Br2 Cl2 > Br2
(2) Br2 + 2NaI = 2NaBr + I2
Br2 > I2
(3) Cl2 + 2NaI = 2NaCl + I2
元元 素素 名符 称号
失去最 外层电 子的能
力
还原性
与水反 应的剧 烈程度
氢氧化 物的碱
性
锂 Li
钠 Na
逐 渐
钾K 铷 Rb
增 强
铯 Cs
逐
逐
逐
化学元素周期表(内容+记忆方法)

第一周期元素:1 氢(qīng) 2 氦(hài)元素周期表正确金属汉字写法第二周期元素:3 锂(lǐ) 4 铍(pí) 5 硼(péng) 6 碳(tàn) 7 氮(dàn)8 氧(yǎng) 9 氟(fú) 10 氖(nǎi)第三周期元素:11 钠(nà) 12 镁(měi)13 铝(lǚ) 14 硅(guī) 15 磷(lín)16 硫(liú) 17 氯(lǜ) 18 氩(yà)第四周期元素:19 钾(jiǎ)20 钙(gài)21 钪(kàng) 22 钛(tài) 23 钒(fán) 24 铬(gè)25 锰(měng) 26 铁(tiě) 27 钴(gǔ) 28 镍(niè)29 铜(tóng)30 锌(xīn)31 镓(jiā) 32 锗(zhě) 33 砷(shēn)34 硒(xī)35 溴(xiù) 36 氪(kè)第五周期元素:37 铷(rú)38 锶(sī)39 钇(yǐ)40 锆(gào)41 铌(ní)42 钼(mù) 43 锝(dé) 44 钌(liǎo)45 铑(lǎo) 46 钯(bǎ) 47 银(yín)48 镉(gé) 49 铟(yīn)50 锡(xī) 51 锑(tī) 52 碲(dì) 53 碘(diǎn) 54 氙(xiān)第六周期元素:55 铯(sè) 56 钡(bèi)57 镧(lán) 58 铈(shì)59 镨(pǔ)60 钕(nǚ) 61 钷(pǒ)62 钐(shān) 63 铕(yǒu) 64 钆(gá)65 铽(tè) 66 镝(dī) 67 钬(huǒ) 68 铒(ěr)69 铥(diū) 70 镱(yì) 71 镥(lǔ) 72 铪(hā) 73 钽(tǎn) 74 钨(wū)75 铼(lái)76 锇(é)77 铱(yī) 78 铂(bó) 79 金(jīn) 80 汞(gǒng)81 铊(tā) 82 铅(qiān)83 铋(bì) 84 钋(pō)85 砹(ài) 86 氡(dōng)第七周期元素:87 钫(fāng)88 镭(léi) 89 锕(ā)90 钍(tǔ)91 镤(pú) 92 铀(yóu) 93 镎(ná) 94 钚(bù)95 镅(méi)96 锔(jú) 97 锫(péi) 98 锎(kāi)99 锿(āi)100 镄(fèi)101 钔(mén)102 锘(nuò)103 铹(láo) 104 鑪(lú)105 (dù) 106 (xǐ) 107 (bō) 108 (hēi)109 䥑(mài)110 鐽(dá)111 錀(lún)112 (仍未有中文名)学习技巧化合价一价氢氯钾钠银,二价氧钙钡镁锌.三铝四硅五价磷,二三铁二四碳,莫丢二三四五氮,铜汞二价最常见,单质零价记心间。
1-1元素周期表

元素周期表的结构
主族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
共七个主族
副族:ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB
族
共七个副族
(纵向) 第VIII 族:三个纵行,位于Ⅶ B 与ⅠB中间
4)熔、沸点低,随着核电荷数的递增,碱金属的熔、 沸点依次降低。 K、Na常温下为固态,而K、Na的合金常温下为 液态,它是原子反应堆的导热剂。
5)导电、导热
4.比较元素金属性强弱的方法
(1)根据金属活动性顺序表判断。自左至右金属性减 弱,即失电子能力减弱,如:Zn>Cu。
(2)根据元素周期表判断。同周期,从左至右金属性 减弱。同主族,自上而下金属性增强。如: Na>Mg>Al,Na<K。
71
7 87 88 89103
104
105
106
107
108
109
110
111
112
②族: 元素周期表中有18个纵行,分为16个族,其中
7个主族、7个副族、1个第Ⅷ族和1个0族。 (用罗马数字) 除短周期外,从左到右各族的排列顺序为 ⅠA ⅡA ⅢB … ⅦB Ⅷ ⅠB ⅡB
ⅢA … ⅦA 0族。
71
89
7
87
88
10
10 410 510 6来自10 710 8
10 9
11 0
11 1
11 2
3
不完全 周期
元素周期表的结构
短周期
第1周期:2 种元素 第2周期:8 种元素 第3周期:8 种元素
27个化学元素周期表

27个化学元素周期表小编在此整理了27个化学元素周期表,希望能帮助到您。
元素读音第一周期元素:1 氢(qīng)2 氦(hài)元素周期表正确金属汉字写法第二周期元素:3 锂(lǐ)4 铍(pí)5 硼(péng)6 碳(tàn)7 氮(dàn)8 氧(yǎng)9 氟(fú) 10 氖(nǎi)第三周期元素:11 钠(nà) 12 镁(měi) 13 铝(lǚ) 14 硅(guī) 15 磷(lín) 16 硫(liú) 17 氯(lǜ) 18 氩(yà)第四周期元素:19 钾(jiǎ) 20 钙(gài) 21 钪(kàng) 22 钛(tài) 23 钒(fán) 24 铬(gè) 25锰(měng) 26 铁(tiě) 27 钴(gǔ) 28 镍(niè) 29 铜(tóng) 30 锌(xīn) 31 镓(jiā) 32锗(zhě) 33 砷(shēn) 34 硒(xī) 35 溴(xiù) 36 氪(kè)第五周期元素:37 铷(rú) 38锶(sī) 39 钇(yǐ) 40 锆(gào) 41 铌(ní) 42 钼(mù) 43 锝(dé) 44 钌(liǎo) 45 铑(lǎo)46 钯(bǎ) 47 银(yín) 48 镉(gé) 49 铟(yīn) 50 锡(xī) 51 锑(tī) 52 碲(dì) 53碘(diǎn) 54 氙(xiān)第六周期元素:55 铯(sè) 56 钡(bèi) 57 镧(lán) 58 铈(shì) 59镨(pǔ) 60 钕(nǚ) 61 钷(pǒ) 62 钐(shān) 63 铕(yǒu) 64 钆(gá) 65 铽(tè) 66 镝(dī)67 钬(huǒ) 68 铒(ěr) 69 铥(diū) 70 镱(yì) 71 镥(lǔ) 72 铪(hā) 73钽(tǎn) 74钨(wū) 75 铼(lái) 76 锇(é) 77 铱(yī) 78 铂(bó) 79 金(jīn) 80 汞(gǒng) 81 铊(tā)82 铅(qiān) 83 铋(bì) 84 钋(pō) 85 砹(ài) 86 氡(dōng)第七周期元素:87 钫(fāng) 88镭(léi) 89 锕(ā) 90 钍(tǔ) 91 镤(pú) 92 铀(yóu) 93 镎(ná) 94 钚(bù) 95 镅(méi)96 锔(jú) 97 锫(péi) 98 锎(kāi) 99 锿(āi) 100 镄(fèi) 101 钔(mén) 102 锘(nuò)103 铹(láo) 104 炉(lú) 105 (dù) 106 (xǐ) 107 (bō) 108 (hēi) 109䥑(mài) 110 鐽(dá) 111 錀(lún) 112 鎶(gē)其中常用的27个:1氢 H 2氦 He3锂 Li 4 铍 Be 5 硼 b 6 碳 C 7 氮 N 8 氧 O 9 氟 F 10 氖Ne11 钠 Na 12镁 Mg 13铝 Al 14硅Si 15磷P 16硫S 17氯Cl18 氩 Ar19 钾 K 20 钙 Ca 22钛 Ti 25锰Mn 26铁Fe 28镍Ni 29铜Cu 30锌Zn 33砷As35 溴 Br47银Ag 50锡 Sn 53碘I56钡Be 78铂 Pt 79金Au 80汞Hg 82铅Pb相关知识:元素周期表的规律按照电子排布,可把周期表的元素划分为5个区:s区、p区、d 区、ds区、f区。
1-1元素周期表

二.元素周期表 7 16 1、周期表的结构( __个周期、___个族 )
横的方向: 七个周期(三短、三长、一不完全)
(7个横行)
周 期 表
纵的方向:
(18个纵行)
七个主族
七个副族
零族 Ⅷ族
稀有气体
(三个纵行)
2、元素的种类及稀有气体元素的原子序数 周期序数 元素种类 稀有气体 原子序数 1 2 2 8 3 8 18 4 18 36 5 18 54 6 32 86 7 (32) (118)
碱金属的物理性质的比较
Li 相 似 点 颜色 硬度 密度 熔沸点 Na K 柔软 较小 较低 Rb Cs 均为银白色(Cs略带金色)
导电导热性
递 变 性 密度变化
强
逐渐增大(K特殊)
熔沸点变化
单质的熔沸点逐渐降低
[阅读归纳] 1、碱金属颜色、状态、硬度相似性: _____________________________________。 2、碱金属密度、熔点、沸点的递变性: _____________________________________。 3、夏天30℃时呈液态的碱金属单质是______ ,浮在水面的碱金属单质有:_____________。 4、由于密度小于煤油,不能保存在煤油中, 需要封存在石蜡中的碱金属单质是 。
一.元素周期律
3、实质: 元素性质随原子序数递增呈现出 周期性变化,其本质原因是元素的原子 核外电子排布周期性变化的必然结果。
4.金属性强弱的实验依据 (1)与水或酸反应置换氢的难易: 越易者金属性越强。 (2)最高价氧化物的水化物碱性强弱: 碱性强者金属性越强。 (3)与盐溶液的置换反应: 一般金属性强的能置换金属性弱的金属 (但K、Ca、Na等极活泼金属例外)。 (4)原电池的正负极: 一般作负极的金属较活泼。 (5) 电解池阴极析出金属的顺序: 后析出的金属比先析出的金属金属性强 (6)金属活动性顺序表: 一般在金属活动性顺序表中越靠前,金属性越强
原子物理学-元素周期表(一)

? 各种元素性质为什么呈
周期性变主量子数n=1,2,3,4,5,6,7, 分别对应K、L、M、N、O、
P、Q 等主壳层。
轨道角量子数 l =0,1,2,3,4, 5, n-1分别对应n主壳层的 s、p、d、f、g、h 等支壳 层。
(2)壳层中电子的数目
§27 元素周期表
(1) 元素性质的周期性
114种元素,一行为一个周期,一 列为一族,a为主族,b为副族;
同一族中,元素的化学性质相似; 不同元素的化学和物理性质呈现周
期性变化。
元素的电离能
当原子序数 Z =2、10、18、 36、54和86时,元素最稳定,这 些数称为
幻数(magic number)
泡利不相容原理 能量最小原理
按照泡利不相容原理:
每一个支壳层中最多可能容纳 多少个电子?
Nl 2(2l 1)
每个主壳层中最多可能容纳 多少个电子?
Nn 2n2
角动量 01
l
符
号
sp
状态数 26
2(2 l +1)
2
3
4
d
f
g
10 14 18
主 壳
名称
K
L
M
N
层n 1 2
3
4
支 名称 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 壳
原 子 能 级 的 填 充 顺 序
等电子体系: K Ca Sc2 Ti 3 V4 Cr 5 Mn 6
光谱项:T
RZ *2 n2
T 1 Z
Rn
32D 42S
等电子体系 KI 等的莫塞莱图解
层 l 00 1 0 1 2 0 1 2 3
Nl
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
57 89
58 90
59 91
60 92
61 93
62 94
63 95
64 96
65 97
练习:
√
1、同周期元素,其原子结构相同之处是: A、最外层电子数 B、核电荷数 C、电子层数 D、核外电子数
2、原子序数为17的元素的符号是 Cl , 位于 第三 周期, 第ⅦA 族。
练习3
推算原子序数为6, 13, 34, 81的元素在
长周期
2、族:
不同横行中 最外层电子数相同 的 元素按电子层数递增的顺序由上 到下排成纵行。
主族序数= 最外层电子数
18个纵行,16个族
主族: , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA ⅠA
共七个主族
族
副族:ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB ,ⅠB , ⅡB
共七个副族
第VIII 族: 包含3个纵行 零族: 稀有气体元素
104
2 3 4 1 7 3
105
24 25 26 42 43 44
2 7 4 5 7 7
109
2 9 4 7 7 9
111
3 0 4 8 8 0
112
74 75 76
10 8
7
8 7
8 8
镧 系 锕 系
106
107
过渡元素
66 98 67 99 68 10 0 69 10 1 70 10 2 71 10 3
6 1 4 3 2 5 0 8 2
7 1 5 3 3 5 1 8 3
8 1 6 3 4 5 2 8 4
9 1 7 3 5 5 3 8 5
L K
M L k
8 2
18 8 2
B
IB 2 8 4 6 7 8
110
II B
1 3 3 1 4 9 8 1
2 1 3 9
57 71
89103
2 2 4 0 7 2
七主七副 一Ⅷ一零
周 期 1 2 3 4 5 6
I A
主 族
II A
元素周期表
III A IV A
V A
0
VI A VI IA
1 3 11 1 9 3 7 5 5
2
1 0 1 8 3 6 5 4 8 6
K
2
4 1 2 2 0 3 8 5 6
III B IV B V B VI B
副 族
VII
5
VIII
实践与交流:
请你根据以上原则将前18号元素 编排成一个周期表。
(二)、元素周期表的结构
1、周期:
具有 相同电子层数 而又按照原 子序数递增顺序由左往右排列 的一系列元素。
周期序数 = 电子层数
三 短 四 长
建议:记住稀有 气体原子序数
短周期
周期
(横向)
第1周期: 2 种元素 2He 第2周期: 8 种元素 10Ne 第3周期: 8 种元素 18Ar 第4周期:18 种元素 36Kr 第5周期: 18 种元素 54Xe 第6周期: 32 种元素 86Rn 第7周期:26种元素(至112号)
Байду номын сангаас
第一章 第一节
物质结构 元素周期律 (1)
动手练习:
查周期表,写出下列元素的原 子序数, 并画出原子结构示意图
H
C
O Al
S
Cl
一、元素周期表
(一)、元素周期表编排原则
1、将电子层数相同的元素按原子序 数递增的顺序从左到右排列成横行。 2、把最外电子数相同的元素,按电子层 数递增的顺序从上而下排成纵行。
周期表中的位置。
第6号元素: 6 - 2=4 第13号元素:13-10=3 第二周期第ⅣA 族。 第三周期第ⅢA 族。
第34号元素:36 -34 = 2 第四周期第ⅥA 族。
第81号元素:86 -81 =5 第六周期第Ⅲ A 族。
练习4、下列各表为周期表的一部分 (表中为原子序数),其中正确的是 D
(A) 2
3 4 11 19
(B)
2 10 11 18 19 6 7 14 31 32
(C)
6 11 12 13 24
(D)
作业布置:
1、课本 P11:习题2、7、10(1); 2、《学海导航》 P1-3:6题不做,9题(2)不做
必修2
第一章
物质结构 元素周期律
教学目标: 1、能描述元素周期表的结构,知道金属、非 金属在元素周期表中的位置。 2、通过有关数据和实验事实,了解原子结构 与元素性质之间的关系;认识原子结构相似的一族 元素在化学性质上表现出的相似性和递变性。 3、知道核素和同位素的涵义。 教学重点:元素周期表的结构,元素在元素周 期表中的位置及其性质的递变规律。 教学难点:元素在元素周期表中的位置及其性 质的递变规律。
