α-葡萄糖苷酶(α-Glucosidase)使用说明
α-葡萄糖苷酶酶活定义

α-葡萄糖苷酶酶活定义葡萄糖是一种常见的单糖,它在生物体内起着重要的能量供应和代谢调节作用。
而α-葡萄糖苷酶则是一种在生物体内广泛存在的酶,它在糖的代谢过程中发挥着重要的催化作用。
α-葡萄糖苷酶(α-glucosidase)是一种能够水解α-葡萄糖苷键的酶类。
它主要存在于许多生物体中,包括人类、动物和微生物等。
α-葡萄糖苷酶能够将α-葡萄糖苷与水分子作用,将其水解为葡萄糖和其他成分。
α-葡萄糖苷酶在生物体内的作用非常重要。
首先,它参与了食物中碳水化合物的消化过程。
当我们食用含有淀粉和糖类的食物时,α-葡萄糖苷酶能够水解食物中的α-葡萄糖苷键,将其分解为葡萄糖,从而提供能量给身体使用。
α-葡萄糖苷酶还参与了糖的代谢调节过程。
在体内,糖的代谢过程需要受到严格的调控,以维持血糖水平的稳定。
当血糖浓度升高时,胰岛素会促使α-葡萄糖苷酶的活性降低,从而减少葡萄糖的合成和释放,维持血糖水平的平衡。
α-葡萄糖苷酶还在医学上具有重要的意义。
糖尿病是一种常见的代谢性疾病,患者的胰岛素分泌或作用异常,导致血糖浓度升高。
研究发现,通过抑制α-葡萄糖苷酶的活性,可以减缓食物中糖类的吸收和降低血糖浓度,从而用于糖尿病的治疗。
对于研究α-葡萄糖苷酶酶活的方法,科学家们进行了大量的探索。
一种常用的方法是通过测定酶的催化反应速率来评估其活性。
在实验中,可以选择合适的底物,如pNPG(对硝基苯基-α-D-葡萄糖苷)或PNPG(对硝基苯基-β-D-葡萄糖苷),并测定在一定时间内反应生成产物的数量,从而计算出酶的活性。
还可以利用荧光标记等技术来研究α-葡萄糖苷酶的酶活。
例如,可以将底物与荧光染料结合,当底物被酶水解时,荧光信号会发生变化,从而可以通过检测荧光强度来评估酶的活性。
α-葡萄糖苷酶酶活的研究在生物医学领域具有广泛的应用前景。
通过深入理解α-葡萄糖苷酶的结构和功能,可以为疾病的治疗和预防提供重要的依据。
此外,对于某些产业,如食品加工、酿酒和乳制品生产等,了解α-葡萄糖苷酶的活性也具有重要的意义。
α 葡萄糖苷酶抑制实验原理

α 葡萄糖苷酶抑制实验原理
α-葡萄糖苷酶抑制实验的原理主要基于酶的抑制作用。
在适宜的温度和酸碱环境中,α-葡糖苷酶能够催化水解4-硝基苯基-D-吡喃葡萄糖苷,生成对硝基苯酚。
这个过程可以通过酶标仪在420nm处检测到对硝基苯酚的吸光度,从而计算出产物量的变化。
当多酚与α-葡糖苷酶结合生成多酚α--葡糖苷酶络合物时,该络合物引起
α-葡糖苷酶的构象发生改变,改变构象的α-葡糖苷酶对4-硝基苯基-D-吡
喃葡萄糖苷的催化水解作用减弱或消失,从而减少了对硝基苯酚的生成。
通过酶标仪检测吸光度的变化,可以计算出多酚对α-葡糖苷酶的抑制率。
以上信息仅供参考,如需了解更多信息,建议查阅相关文献或咨询专业人士。
用于治疗糖病的α葡萄糖苷酶抑制剂及用法指南

用于治疗糖病的α葡萄糖苷酶抑制剂及用法指南α葡萄糖苷酶抑制剂是一种用于治疗糖尿病的药物,其通过抑制α葡萄糖苷酶的活性,减少肠道对碳水化合物的吸收,从而降低血糖水平。
本文将介绍α葡萄糖苷酶抑制剂的作用机制、常见的药物种类以及用法指南。
一、作用机制α葡萄糖苷酶是一种存在于肠道上皮细胞中的酶,在消化过程中起到将复杂的碳水化合物分解为简单的葡萄糖分子的作用。
糖尿病患者存在胰岛素功能异常,无法足够利用血液中的葡萄糖,导致血糖升高。
而α葡萄糖苷酶抑制剂能够抑制该酶的活性,减少葡萄糖的吸收,从而降低血糖水平。
二、常见的药物种类目前市场上常见的α葡萄糖苷酶抑制剂包括:阿卡波糖、伏格列波糖、米格列糖等。
这些药物的作用机制相似,但有些差异。
例如,阿卡波糖主要作用于小肠,其在肠道中形成可逆的酶药物复合物,从而延缓酶的活性,减少葡萄糖的吸收。
而伏格列波糖作用于小肠和肾小管,不仅抑制肠道葡萄糖的吸收,还可以增加尿液中葡萄糖的排泄。
米格列糖主要作用于小肠,通过竞争性地与肠道上α葡萄糖苷酶结合,从而减少碳水化合物的降解和吸收。
三、用法指南1. 用药时间:通常在餐前服用α葡萄糖苷酶抑制剂,以确保药物在进食前就生效。
具体用药时间应遵循医生的指导。
2. 用量:α葡萄糖苷酶抑制剂的用量应根据病情和体重等因素调整,一般起始剂量较低,随后逐渐增加,直到达到适当的控制血糖水平的剂量。
务必严格按照医生的指导用药。
3. 注意事项:a. 药物与饮食的配合:α葡萄糖苷酶抑制剂需要与饮食相结合,特别是高淀粉和高糖饮食。
在用药期间,尽量避免大量摄入含简单糖和复杂碳水化合物的食物,以免增加血糖升高的风险。
b. 药物与其他药物的相互作用:与其它药物相比,α葡萄糖苷酶抑制剂的药物相互作用较少。
但仍需在使用其他药物时告知医生,包括处方药、非处方药和补品等。
c. 不良反应:α葡萄糖苷酶抑制剂的常见不良反应包括腹胀、腹泻和恶心等消化系统反应。
如果出现严重的不良反应,应立即咨询医生。
人α葡萄糖苷酶α
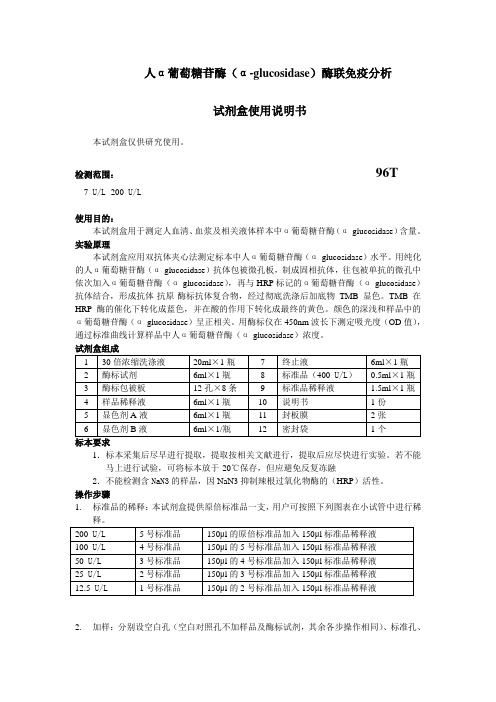
人α葡萄糖苷酶(α-glucosidase)酶联免疫分析试剂盒使用说明书本试剂盒仅供研究使用。
检测范围:96T7 U/L -200 U/L使用目的:本试剂盒用于测定人血清、血浆及相关液体样本中α葡萄糖苷酶(α-glucosidase)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中人α葡萄糖苷酶(α-glucosidase)水平。
用纯化的人α葡萄糖苷酶(α-glucosidase)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入α葡萄糖苷酶(α-glucosidase),再与HRP标记的α葡萄糖苷酶(α-glucosidase)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的α葡萄糖苷酶(α-glucosidase)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人α葡萄糖苷酶(α-glucosidase)浓度。
1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤1.标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀释。
2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
在酶标包被板上标准品准确加样50μl,待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。
加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3.温育:用封板膜封板后置37℃温育30分钟。
4.配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干。
α-葡萄糖苷酶在凝胶珠和纸基上的固定化及其酶抑制剂筛选

α-葡萄糖苷酶在凝胶珠和纸基上的固定化及其酶抑制剂筛选α-葡萄糖苷酶是一种重要的酶类,参与了糖代谢和消化系统中的一系列生化反应。
酶的固定化(enzymes immobilization)是一种将酶固定在某种载体上的方法,以提高酶的稳定性和重复使用性。
本文将介绍α-葡萄糖苷酶在凝胶珠和纸基上的固定化方法,并探究了其在酶抑制剂筛选中的应用。
α-葡萄糖苷酶的固定化是一种常用的生物技术手段,通过限制酶的运动,提高其在特定条件下的稳定性和催化活性。
凝胶珠是一种常用的酶固定化载体,其具有较大的表面积和很强的化学稳定性。
凝胶珠表面的活性基团可以与酶分子上的氨基酸残基或羧基发生共价键结合,从而实现酶的固定化。
同时,凝胶珠还可以在酶固定化后充当保护层,避免酶在极端环境条件下发生变性。
另外,凝胶珠在反应体系中起到了“支架”的作用,增加了底物与酶结合的机会,进一步提高了酶催化的效率。
与凝胶珠不同,纸基是一种较为简单和廉价的酶固定化载体。
纸基表面往往带有一定的孔隙结构,这为酶的固定化提供了空间。
一种常见的纸基酶固定化方法是将酶溶液滴在纸基上,然后通过干燥将酶固定在纸基的孔隙中。
与凝胶珠不同,纸基的固定化方式更为简单,但纸基的载体能力较弱,因此固定化后的酶活性可能会受到限制。
在酶抑制剂筛选方面,固定化的α-葡萄糖苷酶在底物中添加潜在的酶抑制剂,观察酶催化反应的变化,从而筛选出具有酶抑制活性的化合物。
通过固定化的酶,我们可以有效地筛选出具有高抑制活性和选择性的化合物。
这种方法在药物开发和生物医学领域具有重要应用,可以发现新的疾病治疗药物或药物作用机制。
综上所述,α-葡萄糖苷酶在凝胶珠和纸基上的固定化可以提高酶的稳定性和活性,为酶的重复使用和底物转化提供了新的途径。
同时,在酶抑制剂筛选中,固定化的酶可以有效地筛选出具有潜在药物活性的化合物。
这些方法在生物医学研究和药物开发中具有重要的意义,对于探索新的治疗方法和药物作用机制具有重要的帮助综合来看,通过凝胶珠和纸基的固定化,α-葡萄糖苷酶的稳定性和活性得到了提高,为酶的重复使用和底物转化提供了新的途径。
α-葡萄糖苷酶(α-Glucosidase, α-GC)试剂盒说明书

货号:QS2612 规格:50管/24样α-葡萄糖苷酶(α-Glucosidase,α-GC)试剂盒说明书可见分光光度法正式测定前务必取2-3个预期差异较大的样本做预测定测定意义:α-GC(EC 3.2.1.20)广泛存在于动物、植物、微生物和培养细胞中,催化水解芳基或烃基与糖基之间的α-糖苷键生成葡萄糖,不仅与细胞壁的松弛或加固有关,而且与细胞识别和一些信号分子产生密切相关。
测定原理:α-GC分解对-硝基苯-α-D吡喃葡萄糖苷生成对-硝基苯酚,后者在400nm有最大吸收峰,通过测定吸光值升高速率来计算α-GC活性。
自备实验用品及仪器:可见分光光度计、台式离心机、水浴锅、可调式移液器、1mL玻璃比色皿、研钵、冰和蒸馏水。
试剂组成和配制:提取液:液体50mL×1瓶,4℃保存。
试剂一:粉剂×2瓶,-20℃保存;临用前每瓶加入10mL蒸馏水,充分溶解备用;用不完的试剂仍-20℃保存。
试剂二:液体25mL×1瓶,4℃保存。
试剂三:液体50mL×1瓶,4℃保存。
粗酶液提取:1、细菌或培养细胞:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细菌或细胞加入1mL提取液),超声波破碎细菌或细胞(冰浴,功率20%或200W,超声3s,间隔10s,重复30次);15000g 4℃离心10min,取上清,置冰上待测。
2、组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液),进行冰浴匀浆。
15000g 4℃离心10min,取上清,置冰上待测。
测定步骤:1、分光光度计预热30min以上,调节波长至400nm,蒸馏水调零。
,第1页,共2页测定管需设一个对照管。
α-GC活力计算:标准条件下测定的回归方程为y =0.00543x -0.0027;x为标准品浓度(nmol/mL),y为吸光值。
人α葡萄糖苷酶α-glucosidase试剂盒使用方法
人α葡萄糖苷酶(α-glucosidase)试剂盒使用方法检测范围:96T7 U/L -200 U/L使用目的:本试剂盒用于测定人血清、血浆及相关液体样本中α葡萄糖苷酶(α-glucosidase)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中人α葡萄糖苷酶(α-glucosidase)水平。
用纯化的人α葡萄糖苷酶(α-glucosidase)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入α葡萄糖苷酶(α-glucosidase),再与HRP标记的α葡萄糖苷酶(α-glucosidase)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的α葡萄糖苷酶(α-glucosidase)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人α葡萄糖苷酶(α-glucosidase)浓度。
试剂盒组成1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤1.标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
在酶标包被板上标准品准确加样50μl,待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。
加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3.温育:用封板膜封板后置37℃温育30分钟。
4.配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干。
6.加酶:每孔加入酶标试剂50μl,空白孔除外。
α-葡萄糖苷酶的基本资料
关于α-葡萄糖苷酶的介绍α-葡萄糖苷酶作为淀粉水解酶家族中的重要一员,被广泛应用于食品和发酵工业、化学工业以及临床检测和疾病治疗等领域。
对它的研究一直受到人们的高度重视,多年来α-葡萄糖苷酶在不同领域的应用均产生了很好的经济和社会效益。
1、α-葡萄糖苷酶的简介α-葡萄糖苷酶(EC.3.2.1.20)为淀粉水解酶类中的一种,它又被称为α-葡萄糖苷水解酶或葡萄糖基转移酶(GTase),是一种α-D-葡萄糖苷酶。
主要在细胞外起作用。
它从多糖的非还原末端水解底物的α-葡萄糖苷键,产生α-D-葡萄糖,通常把它们归类于水解酶第3类,主要水解二糖、低聚糖、芳香糖苷,能以蔗糖和多聚糖为底物。
同时,它还具有转糖苷作用,可将低聚糖中的,α-1,4-糖苷键转化成α-1,6-糖苷键或其他形式的链接,从而得到非发酵性的低聚异麦芽糖或糖酯、糖肽等。
按一级结构可将α-葡萄糖苷酶归为水解酶13类的31家族。
α-葡萄糖苷酶通常按底物专一性分为3个类型。
Ⅰ型α-葡萄糖苷酶水解芳基葡萄糖苷如对--硝基苯酚α-D-葡萄糖吡喃苷(pNPG),且水解速率比低聚麦芽糖快。
Ⅱ型α-葡萄糖苷酶对麦芽糖具有高活性,而对芳基葡萄糖苷活性低。
Ⅲ型α-葡萄糖苷酶与Ⅱ型类似,但它水解低聚糖和淀粉的速率基本一样。
2、α-葡萄糖苷酶来源及分布α-葡萄糖苷酶在自然界分布广泛,种类繁多,性质各异,几乎存在于所有生物体内。
目前已经进行研究的α-葡萄糖苷酶除少数来源于植物和动物外,绝大多数均来自于微生物中。
细菌、霉菌及酵母菌等一些菌株能分泌此酶,其中产酶较多的是黑曲霉,市场上销售的α-葡萄糖苷酶产品大都为黑曲霉发酵生产所得。
3、微生物α-葡萄糖苷酶研究现状微生物来源的α-葡萄糖苷酶相对分子量一般在50~120kDa之间。
不同来源的α-葡萄糖苷酶的相性质则差异很大。
同一种属的微生物,除少数外,它们所产生的α-葡萄糖苷酶性质差异也较大。
例如,枯草杆菌属的不同α-葡萄糖苷酶分子量一般在65~120kDa,有些属酸性水解酶,有些属中性水解酶,合适温度各异,底物专一性也不尽相同,有的主要降解直链淀粉、有的水解麦芽糖和低聚麦芽糖、有的具有较宽的底物专一性,可水解多种底物。
α葡萄糖苷酶作用化学式
α葡萄糖苷酶作用化学式α-葡萄糖苷酶是一种酶类,它催化葡萄糖与其他化合物之间的酯键水解反应。
这种酶在生物体内广泛存在,并在多种生物过程中发挥作用。
α-葡萄糖苷酶的化学式如下所示:葡萄糖+水→反应物+葡萄糖其中,葡萄糖是酶的底物,水是反应的一部分,反应产物则取决于底物的特定结构。
α-葡萄糖苷酶作用的化学式可以进一步解释为以下三个步骤:1.亲核攻击:在这个步骤中,底物的亲核氧原子与酶活性位点上的中心金属离子形成一个稳定的配合物。
这种配合物被称为基质复合物。
2.底物解构:在这个步骤中,基质复合物结构发生变化,形成相应的中间体。
这种中间体包括负离子和正离子间的一个环状六元环结构。
3.水解:在这个步骤中,中间体的六元环结构被水分子攻击,导致酯键断裂并最终生成葡萄糖和剩余的底物。
α-葡萄糖苷酶的催化活性依赖于多种因素,如温度、pH和离子强度。
它的活性受到一些抑制剂和激活剂的调控。
此外,结构和底物异构体的效应也能对酶的催化活性产生影响。
尽管α-葡萄糖苷酶作用的化学式非常简单,但它在生命体中扮演着重要的角色。
这种酶在人体中被广泛表达,尤其是在肠道和胃中。
它参与碳水化合物消化和能量代谢。
在植物中,α-葡萄糖苷酶参与纤维素和淀粉的降解,释放出葡萄糖作为植物生长所需的能量和营养物质。
此外,α-葡萄糖苷酶也被应用于工业领域。
它被用于葡萄糖转化和生产高度纯化的葡萄糖。
此外,它还参与食品加工和医药制造中的底物转化反应。
总的来说,α-葡萄糖苷酶作用的化学式为葡萄糖+水→反应物+葡萄糖。
它在生物体内发挥着重要的作用,参与碳水化合物代谢和能量产生,并且在工业应用中也具有广泛的用途。
人α葡萄糖苷酶αglucosidase试剂盒使用方法
人α葡萄糖苷酶(α-glucosidase)试剂盒使用方法检测范围:96T7 U/L -200 U/L使用目的:本试剂盒用于测定人血清、血浆及相关液体样本中α葡萄糖苷酶(α-glucosidase)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中人α葡萄糖苷酶(α-glucosidase)水平。
用纯化的人α葡萄糖苷酶(α-glucosidase)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入α葡萄糖苷酶(α-glucosidase),再与HRP标记的α葡萄糖苷酶(α-glucosidase)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的α葡萄糖苷酶(α-glucosidase)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人α葡萄糖苷酶(α-glucosidase)浓度。
1 30倍浓缩洗涤液20ml×1瓶7 终止液6ml×1瓶2 酶标试剂6ml×1瓶8 标准品(400 U/L)×1瓶3 酶标包被板12孔×8条9 标准品稀释液×1瓶4 样品稀释液6ml×1瓶10 说明书1份5 显色剂A液6ml×1瓶11 封板膜2张6 显色剂B液6ml×1/瓶12 密封袋1个标本要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤1.标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀释。
200 U/L5号标准品150μl的原倍标准品加入150μl标准品稀释液100 U/L4号标准品150μl的5号标准品加入150μl标准品稀释液50 U/L3号标准品150μl的4号标准品加入150μl标准品稀释液25 U/L2号标准品150μl的3号标准品加入150μl标准品稀释液U/L1号标准品150μl的2号标准品加入150μl标准品稀释液2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
α-葡萄糖苷酶(α-Glucosidase)使用说明
货号:G8820
规格:1g/5g
级别:BR
其他名称:α-D-葡萄糖苷酶;α-葡糖苷酶
CAS号:9001-42-7
提取来源:黑曲霉
产品简介:
α-葡萄糖苷酶(α-Glucosidase,EC 3.2.1.20)又被称为α-葡萄糖苷水解酶或葡萄糖基转移酶(GTase),是一种α-D-葡萄糖苷酶。
它可以从低聚糖类底物的非还原末端切开α-1,4-糖苷键释放出葡萄糖,或将游离的葡萄糖残基转移到另一糖类底物形成α-1,6-糖苷键,从而得到非发酵性的低聚糖。
α-葡萄糖苷酶来源广泛,在人体糖原的降解和动植物、微生物的糖类代谢方面具有重要的生理功能。
α-葡萄糖苷酶广泛应用于食品和发酵工业、化学工业以及医学应用等行业。
酶活定义:
每小时产生1μg葡萄糖所需的酶量定义为一个α-葡萄糖苷酶活力单位。
酶活检测方法:参见QB2525-2001。
产品特性:
酶活力:300000U/g
最适作用温度:50℃,合适的作用温度:50-55℃。
最适作用pH:5.0,合适的作用pH:4.8-5.4。
外观:淡白色粉末或淡黄色液体,分子量约为68.5KD,无臭无味,溶于水,不溶于乙醚和乙醇。
用途:
生化研究。
能水解葡萄糖苷(Glucoside)成葡萄糖和其他组成物质,是一种具有生物催化剂功能的蛋白质。
本产品的建议添加量为800U/g干物质,根据实际情况改变添加量。
抑制剂:
铜、钛、钴等金属离子对本品有一定的影响。
铅、铝、锌等金属离子对本品有较强的抑制作用。
贮存:
建议密封储藏于干燥、低温的环境中(≤25℃),最好在冷藏条件下(4-8℃)储藏。
25℃以下,液体可以储存3个月,保质期内酶活不会降低于产品标示的活力;4℃以下,可较长时间储存。
