高三化学镁铝及其化合物1
高中化学专题复习-镁和铝的单质及其化合物.ppt

镁
铝
结
周期表 中位置
第三周期ⅡA族
第三周期ⅢA族
金属性
镁强于铝
构 单质的 还原性
镁强于铝
共性:密度小熔点较低,硬度较小银
物理性质 白色金属.
不同点:Al的上述性质都比镁略高.
1.跟O2及 其它非金
2Mg+O2=2MgO
属反应 3Mg+N2=Mg3N2
4Al+3O2=2Al2O3 2Al+3S=Al2S3
Al(OH)3显酸性.
▪ Al(OH)3溶解度很小,无论酸式或碱式电离 的程度都很小,其碱性略强于酸性,故仍
属于弱碱.
重要的铝盐:
▪ 明矾:十二水合硫酸铝钾[KAl(SO4)2·12H2O] ▪ 结构:硫酸铝钾是由两种不同的金属离子和一种
酸根离子组成的化合物,它电离时能产生两种金 属的阳离子,是一种复盐。
▪
Al3++3AlO2-+6H2O = 4Al(OH)3↓
③有关图像:
n(沉淀)
O
n(AlCl3)
五、课堂练习:
2.跟某些 2Mg + CO2 =
2Al+Fe2O3=2Fe+Al2O3
化 氧化物
2MgO + C
(铝热反应)
学 3.跟水反 Mg + 2H2O =
性
应 Mg(OH)2 + H2↑
质
(冷水慢,沸水快)
很难反应
4.跟酸的 Mg + 2H+ =
反应
Mg2+ + H2↑
2Al+6H+=3Al3++3H2↑ (在浓H2SO4、浓HNO3 中钝化)
镁铝及其化合物(1)概要

反应现象:镁条剧烈燃烧,放出大量的热,发出耀
眼的白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有 熔融物落入沙中。
高温
Fe2O3+2Al === 2Fe + Al2O3
铝热剂 问题 1、镁条的作用是什么?
2、氯酸钾的作用是什么? 结论:铝也是还原剂,在一定的条件下与某些金属
氧化物反应,把其中的金属还原成单质。所以一些 活泼的金属也可作还原剂。
O2
具有抗腐蚀的性能
点燃
点燃
2Mg+ O2 = 2MgO 4Al+ 3O2 = 2Al2O3
点燃
N2 3Mg+ N2 = Mg3N2
质
加热
反 S Mg+ S = MgS
加热
2Al+ 3S =Al2S3
应
点燃
点燃
Cl2 Mg+Cl2 = MgCl2
2Al+ 3Cl2 = 2AlCl3
与 氧
H2O Mg+2冷H水2O反应=△缓M慢g(OH)2↓+2HA2l↑+6H冷2O水△几= 乎2A不l(反O应H)3 ↓+3H2↑
Al(OH)3+OH-=AlO2ˉ+2H2O
类别 主要用途
中强碱,水溶液能够使酚 酞变红
两性氢氧化物
制MgO和镁盐 制备Al2O3和净水剂,治疗胃酸
实验室 制法
Mg2++2OHˉ = Mg(OH)2↓Al3++3NH3•H2O=Al(OH)3
↓+Biblioteka NH4+ 其它方法思考:
(1)Al(OH)3为何既能与酸又能与强碱液反应?
4、镁、铝的制备及用途
高三化学总复习 镁、铝及其重要化合物

第2讲镁、铝及其重要化合物复习目标知识建构1.结合真实情景中的应用实例或通过实验探究,了解镁、铝及其重要化合物的主要性质,了解其在生产、生活中的应用。
2.结合实例认识金属性质的多样性,了解通过化学反应可以探索物质性质、实现物质的转化,认识物质及其转化在自然资源综合利用和环境保护中的重要作用。
一、镁、铝1.原子结构和存在(1)原子结构:镁、铝原子结构示意图分别为和,分别位于元素周期表的第三周期ⅡA族和ⅢA族。
(2)存在:在自然界中均以化合态的形式存在,铝是地壳中含量最多的金属元素。
2.单质的物理性质(1)相同点:均为银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度、硬度均较小。
(2)不同点:铝的熔点比镁高,硬度比镁大。
3.单质的化学性质镁铝4.镁、铝的冶炼(1)Mg :化学方程式 MgCl 2(熔融)=====电解Mg +Cl 2↑; (2)Al :化学方程式2Al 2O 3(熔融)=====电解冰晶石4Al +3O 2↑。
【判一判】 判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)工业上制造镁粉时,可将镁蒸气在N 2中冷却( )(2)相同质量的镁条分别在足量的CO 2和O 2中完全燃烧,所得固体的质量相同( )(3)冶炼铝时常用焦炭作还原剂()(4)铝与少量NaOH溶液反应得到铝盐,与足量NaOH溶液反应生成偏铝酸盐()(5)铝制餐具可长时间存放酸性或碱性食物()(6)镁在空气中燃烧的产物固体只有MgO()答案(1)×(2)×(3)×(4)×(5)×(6)×二、镁、铝的重要化合物1.MgO与Al2O32.Mg(OH)2与Al(OH)33.明矾(1)化学式为KAl(SO4)2·12H2O,它是无色晶体,可溶于水。
(2)明矾净水的原理电离方程式为KAl(SO4)2===K++Al++2SO-4,其中Al3+发生水解反应,产生Al(OH)3胶体,能吸附水中悬浮物形成沉淀,使水澄清。
高三化学一轮复习【镁、铝及其化合物】

在空气中都能跟氧气反应,表面覆盖一层致密而坚硬的氧化物薄膜,都具有自我抗腐蚀能力铝合金汽车、船舶、飞机制造、防锈油漆、导线、电缆等易错点:(1)常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是二者能使铝发生“钝化”,而不是铝与浓硫酸、浓硝酸不反应。
(2)铝不但能与酸(H +)反应,还能够与碱溶液反应,表现为特殊性。
2Al +2OH -+2H 2O===2AlO -2+3H 2↑。
其反应机理应为:铝先与强碱溶液中的水反应生成H 2和Al(OH)3,然后Al(OH)3再与NaOH 反应生成H 2O 和NaAlO 2,反应中铝作还原剂,水作氧化剂,NaOH 无电子得失。
(3)铝热反应是在高温干态下进行的置换反应,铝只能与排在金属活动性顺序其后的金属氧化物反应。
铝不能与MgO 反应,铝热反应不能用来冶炼大量的金属铁、铜等(要考虑冶炼成本)。
(4)Mg 在CO 2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器和泡沫灭火器灭火。
同时镁与氮气反应生成Mg 3N 2。
二、铝的重要化合物1.氧化铝(1)物理性质 色态: ;硬度: ;熔点: 。
(2)化学性质①属于两性氧化物,写出有关反应的离子方程式:,②电解 化学方程式为 2Al 2O 3(熔融)=====电解4Al +3O 2↑。
(3)用途熔点很高,是一种较好的耐火材料,天然产刚玉的成分是Al 2O 3,还可制作各种宝石。
2.氢氧化铝 (1)物理性质Al(OH)3是一种难溶于水的白色胶状物质,具有较强的吸附能力。
(2)化学性质 ①两性Al(OH)3的电离方程式为Al(OH)3既能溶于强酸又能溶于强碱,且都生成盐和水。
与强酸反应: , 与强碱溶液反应: 。
②不稳定性Al(OH)3受热分解: 。
(3)制备①向铝盐中加入氨水,离子方程式为 。
②NaAlO 2溶液中通入足量CO 2,离子方程式为 。
③NaAlO 2溶液与AlCl 3溶液混合:离子方程式为 。
镁铝及其化合物1.ppt
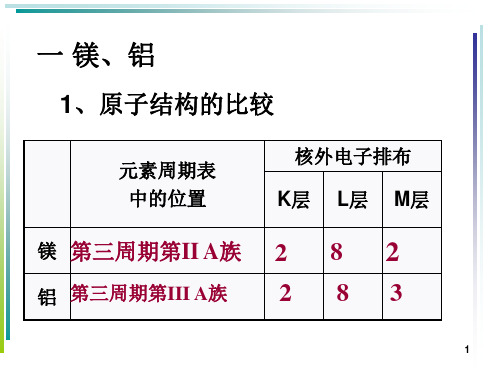
1、原子结构的比较
元素周期表 中的位置
核外电子排布 K层 L层 M层
镁 第三周期第II A族 2 8 2
铝 第三周期第III A族
2 83
1
2、物理性质的比较
相似点:均为 银白色 ;均为 轻金属 ; 熔点均 较低 ;硬度均 较小。都具有金属的 通性 不同点:镁在密度、熔点、沸点、硬度上 均 小于(或低于) 铝。
D.反应速率之比为2∶3
【解析】由关系式:Mg~H2,2Al~3H2,可知产生 等量H2时,消耗Mg、Al物质的量之比为3∶2,故A 项 正 确 。 二 者 质 量 之 比 为 4∶3 , 摩 尔 质 量 之 比 为
8∶9,反应速率之比为3∶2。
25
二、“铝三角”及其应用
1.“铝三角”是指Al3+、Al(OH)3和AlO2-相 互转化的三角关系(如下图)
分析依据:
2Al+6HCl === 2AlCl3+3H2↑ 2Al~6HCl~3H2↑
2Al+2NaOH+2H2O === 2NaAlO2+3H2↑
2Al~2NaOH~3H2↑
【思考】
1.等质量的铝分别与足量的盐酸、氢氧化钠溶液反应,
所得H2的体积之比是多少? VHCl(H2):VNaOH(H2)=1:1
共存
②AlO2-不能与 H+、HCO3-(直接反应); Al3+、NH4+、 Fe3+(双水解)大量共存 28
即时巩固
4、某无色溶液中加入铝粉只产生氢气,则下列离子
组中可能大量共存的是 ( C D )
A.K+ 、NH4+、Cl- 、NO3- B.K+、Na+、Cl-、HCO3C.K+、NH4+、Cl-、SO42- D.K+、CO32-、Cl-、SO325、某无色透明溶液跟金属Al反应,放出H2。试判断 下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、 OH-、 CO32-、HCO3-、NO3-,下列两种情况能存在此溶液中。 当生成Al3+时,可能存在 __H_+_、__M__g_2_+_、__S_O_4_2- 当生成AlO2-时,可能存在_O__H_-_、__B__a_2_+、__N_ O3_-_ 29
高三化学镁铝及其化合物试题

高三化学镁铝及其化合物试题1.(本题16分)工业上用白云石制备高纯氧化镁的工艺流程如下:已知Ⅰ.白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O32.18%;SiO20.96%;其他 43.78%。
(1)为了提高白云石的煅烧效果,可以采取的措施是将矿石。
若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要(填序号)。
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网(2)加入H2SO4控制pH时,终点pH对产品的影响如图8所示。
则由图示可得到的结论及原因是:①pH过高会导致___________________________下降,其原因是_______________________②pH过低会引起____________________________ ,其原因可能是__________(填序号)A.Fe2O3溶于H2SO4最终使产品混有杂质 B.SiO2溶于H2SO4最终使产品混有杂质C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质(3)已知MgSO4、CaSO4的溶解度如下表:温度(℃)4050607042的操作步骤是、。
(4)写出沉淀反应中的离子方程式:。
(5)该生产流程中还可得到的一种副产品是_______________。
(6)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为(25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12)。
【答案】32. 答案(16分)(1)粉碎(2分)BC (2分)(2)①镁浸出率降低(1分)Mg(OH)2或MgO未完全溶解(1分)②产品纯度下降(1分)AC (1分)(3)升温结晶、趁热过滤(2分,各1分))(4)Mg2+ +2NH3.H2O = Mg(OH)2↓+ 2NH4+(2分)(5)(NH4)2SO4(2分)(6)蓝色(2分)【解析】(1)提高矿石煅烧效果的措施通常是对矿石进行粉碎处理,以增大反应的接触面积,从而加快反应速率,使煅烧更加充分。
LT高考一轮复习镁铝及其化合物

(用V1、V2表示) 表示) (V2 -V1) : (4V1-3V2)
0
v1 V
5V/4 V2
NaOH溶液体积 溶液体积
2.将0.1 mol的镁 铝混合物溶于 将 的镁.铝混合物溶于 溶液中, 的镁 铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后 再滴加1 mol/L NaOH溶液。请回答: 再滴加 溶液。请回答: 溶液 若在滴加NaOH溶液的过程中,沉淀质量 随加入 溶液的过程中, 随加入NaOH溶液 ⑴若在滴加 溶液的过程中 沉淀质量m随加入 溶液 的体积V变化如下图所示 变化如下图所示。 的体积 变化如下图所示。 当V1=160mL时,则金属粉末中 时 则金属粉末中n(Mg)=___________mol, = 0.06 , 440 V2=___________mL。 。 +刚好沉淀完全, 若在滴加NaOH溶液过程中,欲使 2+.Al3+刚好沉淀完全, 溶液过程中, ⑵若在滴加 溶液过程中 欲使Mg + 400 则滴入NaOH溶液的体积 溶液的体积V(NaOH)___________mL。 则滴入 溶液的体积 。 若混合物仍为0.1 mol,其中 粉的物质的量分数为 ,用 粉的物质的量分数为a, ⑶若混合物仍为 ,其中Mg粉的物质的量分数为 100 mL 2 mol/L的硫酸溶解此混合物后,再加入 的硫酸溶解此混合物后, 的硫酸溶解此混合物后 再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无 溶液, 的 溶液 所得沉淀中无Al(OH)3。满足此条件 的取值范围是: 0.5≤a<1 。 的a的取值范围是:___________。 的取值范围是
0
NaOH/mol
2.向NaOH溶液中逐滴加入AlCl 2.向NaOH溶液中逐滴加入AlCl3 溶液至过量 溶液中逐滴加入
高三化学人教版一轮复习镁铝及其化合物教学案+例题+练习+总结+作业含答案

镁铝及其化合物课 题 镁、铝及其化合物教学目的1.掌握镁、铝的重要物理性质和化学性质及重要用途; 2.掌握Mg 、Al 重要化合物的性质及相互转化。
教学内容一、上节课作业检查及纠错二、课前回顾 1.铝热反应是什么?2.Mg(OH)2与Al(OH)3的比较?3.怎样理解两性物质与物质的两性?三、针对上节课的练习1.按右图装置持续通入X 气体,并在管口P 处点燃,实验结果使澄清的石灰水变浑浊。
则X 、Y 可以是( ) A .H 2、NaHCO 3 B .CO 、Na 2CO 3 C .CO 、Na 2O 2 D .H 2、Fe 2O 32.下图中A 至F 是化合物,G 是单质。
高考化学考试大纲(节选) (三) 常见无机物及其应用。
1.常见金属元素(如Na 、Al 、Fe 、Cu 等) (1) 了解常见金属的活动顺序。
(2) 了解常见金属及其重要化合物的主要性质及其应用。
写出A、B、E、F的化学式:A________、B________、E________、F________。
参考答案:二、课前回顾1.某些金属氧化物粉末,与铝粉混合后在较高温度下剧烈反应生成Al2O3和其它金属并放出大量的热的反应,叫铝热反应。
2.Mg(OH)2Al(OH)3物理性质均为白色固体,不溶于水化学性质不稳定性Mg(OH)2===MgO+ H2O 不稳定性2Al(OH)3===Al2O3+3H2O碱性Mg(OH)2+2H+===Mg2++H2O 两性Al(OH)3+3H+===Al3++3H2OAl(OH)3+OH- ===AlO2-+2H2O制备Mg2++2OH–=== Mg(OH)2↓Mg2++2NH3·H2O===Mg(OH)2↓+2NH4+Al3++3NH3·H2O===Al(OH)3↓+3NH4+ 不用强碱AlO2–+CO2+2H2O=== Al(OH)3↓+HCO3–不用强酸3.(1)两性物质指即能与酸反应,又能与碱作用生成盐和水的化合物,如Al2O3、ZnO、Zn(OH)2、Al(OH)3、氨基酸、蛋白质等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
典例精析
【备选题】在标准状况下进行下列实验,甲、乙、丙各取 30.0 mL同浓度的盐酸,加入不同质量的同种镁、铝合金粉末 产生气体,有关数据列表如下:
实验序号 合金质量(mg) 气体体积(mL) 甲 255 280 乙 385 336 丙 459 336
(1)盐酸的物质的量浓度为 1 mol· L–1,在表中可作为计 算依据的是 乙、丙 (填写实验序号,要求全部写出)。 (2)根据实验序号 甲 中的数据,可计算出镁、铝合金 1∶1 中镁和铝的物质的量之比为 。 【解析】 (1)图中可知实验乙和丙产生氢气量不再变化,说明盐 酸 已 经 反 应 完 全 , 依 据 2HCl ~ H2 即 可 求 出 HCl 物 质 的 量 为 336mL÷22400 mL/mol×2=0.03 mol,所以盐酸的物质的量浓度为 1 mol· L−1。
典例精析
【备选题】在标准状况下进行下列实验,甲、乙、丙各取 30.0 mL同浓度的盐酸,加入不同质量的同种镁、铝合金粉末 产生气体,有关数据列表如下:
实验序号 合金质量(mg) 气体体积(mL) 甲 255 280 乙 385 336 丙 459 336
(1)盐酸的物质的量浓度为 1 mol· L–1,在表中可作为计 算依据的是 乙、丙 (填写实验序号,要求全部写出)。 (2)根据实验序号 甲 中的数据,可计算出镁、铝合金 1∶1 中镁和铝的物质的量之比为 。 【解析】 (2)计算镁铝合金各成分质量,必须从实验甲分析,因为 实验甲中盐酸过量,合金全部反应完。假设0.255 g合金中镁和铝 物质的量分别为x和y,可以列出代数式:
课前体验 5. 某学习小组用下图装置测定铝 镁合金中铝的质量分数和铝的相 对原子质量。
(4)B中发生反应的化学方程式为 2Al+2NaOH+6H2O2 Na[Al(OH)4]+3H2↑或2Al+2NaOH+2H2O2 NaAlO2+ 3H2↑或2Al+2OH–+2H2O2 AlO2–+3H2↑ (5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换 算为标准状况),B中剩余固体质量为c g,则铝的相对原子质量 为 33600(a-c)/b
经测定体系中有不溶物c g,则滤液中的溶质是
A.NaOH C.Na[Al(OH)4] B.NaOH和Na[Al(OH)4] D.无法判断
【解析】金属钠与水反应生成NaOH和氢气,金属铝再与氢 氧化钠溶液反应生成 Na[Al(OH)4] 和氢气,最后还有不溶物, 只能是铝单质,说明溶液中没有NaOH,只有Na[Al(OH)4]。
典例精析
【例2】某无色透明溶液,跟金属铝反应放出H2,试判断下列离 子: Mg2+ 、 Cu2+ 、 Ba2+ 、 H+ 、 Ag+ 、 SO42– 、 SO32– 、 HCO3– 、 OH–、NO3–,何者能存在于此溶液中? 2+ +、SO 2– 3+ H (1)当生成Al 时,一定存在 ,可能存在 Mg 。 4 – – 2+ – NO OH 、 Ba 3 (2)当生成AlO2 时,一定存在 ,可能存在 。 【解析】跟金属铝反应放出H2,原溶液可能含有大量的H+,也可 能含有大量OH–,溶液无色透明,说明溶液中没有Cu2+。 (1)当生成Al3+时,说明溶液中含有大量H+时,溶液中不能有NO3–, 因为硝酸与铝反应无氢气产生;另外弱酸根离子SO32–、HCO3–以 及OH–均能与氢离子反应,也不能大量共存;作为溶液,至少要 有一种阴离子,因此必定含有 SO42–,有硫酸根离子一定没有 Ba 2+,其他离子就不能确定了。
课前体验
罐壁内凹而瘪说明罐 CO2,然后往罐内注 内气压减小,二氧化 4. (1) 往一金属铝的易拉罐内充满 碳被碱吸收; 入足量的NaOH溶液,立即用胶布封罐口。经过一 罐壁重新鼓起来说明 段时间后,罐壁内凹而瘪,而过一段时间后,瘪了 气压增大,铝单质与 碱反应产生氢气. 的罐壁重新鼓起来。解释定述变化的实验现象,配
平有关化学方程式。 ①罐壁内凹而瘪的原因:CO2被NaOH吸收,压强减小 反应的化学方程式是:
CO2+2NaOH Na2CO3+H2O ②罐再鼓起的原因:Al与NaOH反应生成H2,压强变大 反应的化学方程式是: 2Al+2NaOH+6H2O 2Na[Al(OH)4]+3H2↑
课前体验 4. (2)请写出下列反应的化学方程式或离子方程式: 氧化铝分别与强酸、强碱反应: Al2O3+6H+ 2Al3++3H2O、 Al2O3+2OH–+3H2O 2[Al(OH)4]– 金属镁分别与氮气、二氧化碳反应: N2+3Mg Mg3N2、
典例精析
【例1】将5.4 g Al投入到200.0 mL 2.0 mol· L–1的某溶液 中有氢气产生,充分反应后有金属剩余。该溶液可能为 ( D ) A.HNO3溶液 B.Ba(OH)2溶液 C.H2SO4溶液 D.HCl溶液
【评注】考查金属铝的化学性质,特别是金属铝与氢离子、 氢氧根离子的定量关系;同时注意金属与硝酸反应没有氢气 生成。
典例精析
变式1 等量镁铝合金粉末分别与下列4种过量的溶液充分 反应,放出氢气最多的是 ( A )
A.2 mol· L–1 H2SO4溶液 B.18 mol· L–1 H2SO4溶液 C.6 mol· L–1 KOH溶液 D.3 mol· L–1 HNO3溶液
【解析】浓硫酸、硝酸( 无论浓稀)与金属反应一般都不产生 氢气, B 、 D 错;金属铝既能与酸反应又能与碱反应生成氢 气,但是镁只能与酸反应产生氢气,所以A正确。
【解析】铝的相对原子质量数值上等于铝的摩尔质量,依据铝的 质量为(a-c)g,依据3n(Al)=2n(H2)可以求得铝的物质的量,进而求 得铝的相对原子质量。
课前体验 5. 某学习小组用下图装置测定铝 镁合金中铝的质量分数和铝的相 对原子质量。 (6)实验过程中,若未洗涤过滤所 得的不溶物,则测得铝的质量分 数将 偏小 (填“偏大”、“偏 小”、“不受影响”)。 【解析】过滤后不溶物表面沾有溶液,如果没有洗涤, 干燥后就有部分溶质留在固体表面,导致剩余固体质 量增大,参加反应的铝的质量(a-c)g将偏小。
典例精析
【例1】将5.4 g Al投入到200.0 mL 2.0 mol· L–1的某溶液 中有氢气产生,充分反应后有金属剩余。该溶液可能为 ( D ) A.HNO3溶液 B.Ba(OH)2溶液 C.H2SO4溶液 D.HCl溶液
【解析】 5.4 g金属铝物质的量0.2 mol,可以消耗H+ 0.6 mol, 消耗OH– 0.2 mol,依据题意反应后金属有剩余,说明溶液中 提供的H+小于0.6 mol,OH–物质的量小于0.2 mol。硝酸与铝 反应不产生氢气,A错;B中提供OH–0.8 mol,C中提供H+ 0.8 mol,D中提供氢离子0.4mol,所以只有D符合题意。
【解析】与铝粉作用能放出H2的溶液中可能有大量氢离子,也 可能有大量氢氧根离子,因此,能与氢离子或氢氧根离子反应 的离子都不能大量与之共存。A中的离子都不会与氢离子或氢 氧根离子反应,正确;B中既能与氢离子反应,又能与氢氧根 离子反应,错误;C选项中铵根离子能与碱反应,在酸性条件 下由于存在硝酸根,也不能产生氢气,错误;D中Al[(OH)4]–不 能与氢离子大量共存,错误。
课前体验 3.等体积、等物质的量浓度的稀硫酸、氢氧化钠溶液 分别放在甲、乙两烧杯中,各加等质量的铝,生成氢 气的体积比为5∶6,则甲、乙两烧杯中的反应情况可 能分别是 A.甲、乙中都是铝过量 B.甲中铝过量、乙中碱过量 C.甲中酸过量、乙中铝过量 D.甲中酸过量、乙中碱过量
【解析】根据反应方程式可知: 2Al+3H2SO4 Al2(SO4)3+3H2↑ 2Al+2NaOH+6H2O2 Na[Al(OH)4]+3H2↑ 如果酸碱均足量,产生氢气应为 1∶1;如果酸碱均不足,产生氢 气量 ( 以酸、碱的量计算 ) 应为 2∶3 ,现在实际比例为 5∶6 ,只能 说明酸不足,碱过量。
2+,其他离子
典例精析
【例2】某无色透明溶液,跟金属铝反应放出H2,试判断下列离 子: Mg2+ 、 Cu2+ 、 Ba2+ 、 H+ 、 Ag+ 、 SO42– 、 SO32– 、 HCO3– 、 OH–、NO3–,何者能存在于此溶液中? 2+ + 2– (1)当生成Al3+时,一定存在 H 、SO4 ,可能存在 Mg 。 – – 2+ – NO OH 、 Ba 3 。 (2)当生成AlO2 时,一定存在 ,可能存在
典例精析
【备选题】在标准状况下进行下列实验,甲、乙、丙各取 30.0 mL同浓度的盐酸,加入不同质量的同种镁、铝合金粉末 产生气体,有关数据列表如下:
实验序号 合金质量(mg) 气体体积(mL) 甲 255 280 乙 385 336 丙 459 336
【评注】本题属于离子大量共存问题的判断,必须熟悉离子之 间的反应情况。思路是判断有什么离子后,必须思考还有什么 离子不能共存。
典例精析 变式2 在与铝粉作用能放出H2的溶液中,一定能大量 共存的离子组 ( A )
A.K+、Na+、Cl–、SO42– B.K+、Na+、HCO3–、NO3– C.Ba2+、NH4+、NO3–、Cl– D.Na+、K+、Al[(OH)4]–、Cl–
第31讲
课前体验 1.下列有关厨房铝制品的使用中,你认为合 理的是 A.盛放食醋 B.烧煮开水 C.用金属丝擦洗表面的污垢 D.用碱水洗涤 【解析】铝单质既能与酸反应又能与强碱溶液反应,A、D 错误;金属铝硬度小容易被坚硬物体磨损,C错。
