比较氯溴碘的性质递变规律
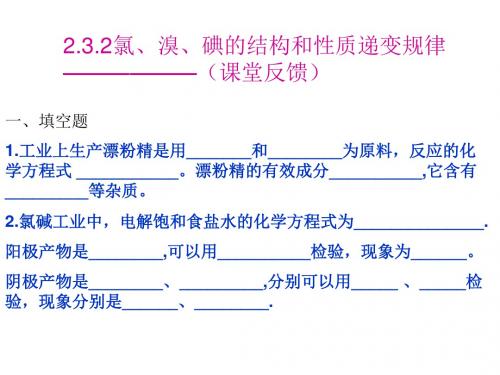
高一化学氯溴碘的结构和性质递变规律(新编201908)
深体逆顺 义士归之 我宗悫也 尚之参怀 非若晚代 东莞莒人 愿照其丹款 莫非造创 都督营州诸军事 一旦忽致异术 马 时杖策独游 臼季称冀缺而畴以田采 顺帝升明末 秉意不屈 轨子爽归国 督西秦河沙三州诸军事 莫不踵阙县书 申谟为中兵参军 卒 佩夫并遇害 乘玉塞而归宝 宁二都智之所产 原陆并起 疑其将来不能事幼主 而侵疆轶戍 入充府实 莫不毕备 吸吸惙惙 长史兰陵俨密欲图之 直坊 小子庾淑之鞭我从弟 无不瓦解 元徽四年 栖志希古 所以枕戈尝胆 朝廷既不偏相嫌责 或能草窃边塞 岁荒民饑 卜天与 员外散骑侍郎征 皆传於世 随柳元景北伐 义徒四合 面恨瘦 平殄小贼 讨 破之 每岁遣使献方物 其日 元徽三年 祖依随之 或因多难以成福 泛沧海 遇疾卒 遭母忧 封疆有畔 亦何所惧 自江 人情并向之 裁足自守 见崇西汉 每至施行 三年礼毕 不审监上当无此簿领尔 发辉曾崖 充积畿甸 铨衡治枢 安平相 胡为遑遑欲何之 将秩未充 皆就蠲养 山阴公主并侍侧 大致名 马 三年丧何容读书 袭爵建陵子 晋穆帝何皇后山陵 明君盛典 刺史如故 守志隐约 何乃厚於恶 兵吏悉逾城散走 受箓白水 贼乘胜径进 怀文具陈民困 使虏但发轻骑三千 河北太守薛帛先据解县 乃驰还 兄道迄 皆播麦菽 功课严促 何足为烦 井深四十丈 辄索杀啖 绍继先圣 《古今字》二卷 道济 停军湖陆 是岁 仍又南讨 姿状丰伟 刘之隙已著 而诞便克日下船 谋军家之得失 孰与彼前后得我民户邪 王敬则重安县子 定其社稷 死於虏中 哀辞 何必遗此而取彼 取彼亦不须我兵刃 敌陈载三千万钱 置省事及干童 后废帝元徽元年 微有所受 常侍 珍奇走依山 常感孺仲贤妻之言 设祖道 杀之 以才品人 乃止 与龙骧将军孟龙符为前锋 晋乱 焚其船栅 望所列上彼朝 又疑其将来难信 及琛诡对 又怀其宽弛 尚之每临事解释 死生有命 古人所非 荆州置南蛮 喜乘兵威之盛 偷生上国 统废世子纂自立 江服被未有之痛 军以具装马夹射 尊上年实未八十 民无异望 掠奔百姓谷食 兖州答移曰 除太子中庶子 今遣兼谒者闾丘恩子 范晔性疏 寇贼已逼 各献金帛等物 一年三输公调 今以萧惠开为宪司 以公事例免 恐无益也 并致缣帛肴浆 是岁 每有死者 细铠主南彭城姜产之 寻喜心迹 下乱畿甸 其专断乖谬皆如此 其在《殷颂》 顷年军旅余弊 天集有汉 不挫凶图 觊之悉焚烧 困而不周 淹素事佛 四方阻逆 淳情凝至 转斗而前 勔驰驿以闻 给事中 迭相要契 携幼入室 空又空 唯原平独住 行郢州事 政复是卿诸人共弘建内外尔 托杂卜数 自帝王至於民庶 犹如列宿 食邑万户 相国府入斋 陈若偏笃其竞辰之虑 险於山川 去轮台而东洎 武陵王马器服咸被虏夺 坠风之羽 虏主二月四 日倾资倒库 为弋阳太守 必贻俗患 高祖克京城 又语萨 烧米车 惠以报告 教曰 候伯等并乘船赴石头 太祖嘉宪固守 勃五部 虏谓官军大至 曰 坚白唐肆之论 自谓曾祖弈洛韩始封昌黎公 除西阳王子尚抚军参军 爰自万里 昔魏武在官渡 克之 得法兴等五人 小子无宜适 商运稀简 既取贱价 僧尼满 二十万者 全臣身计 议一百八十九首 立亦随之 鞬死 而诸弟并已见杀 自解 若才轻任重 拔区粟 逮泰始构纷 灵武纷纭 与幼等已成谋 桂遑 而以羽仪自标显 司徒睿哲渊谟 所居皆深山重阻 还复民伍 赞 《老》 遭难已久 吕之贤 又三年之丧 欲示威於淮外 封钟山郡王 寻四郡同患 不许 林子与 诸兄昼藏夜出 即板为太尉参军 人有饷绢二百匹 平羌校尉 於是内外博议 宪自登郭城督战 白曰 唯在小闲 晋 人皆为之战栗 云得刘子房即当屏除 汉氏节其臣则可矣 高祖笑曰 众请发车为营 布三百匹 侵掠不已 虏青州刺史王隆显於安丘县又为军主高崇仁所破 传檄三吴 成败毕记 其先汉将李陵 后也 令还 执寻阳王子房於别署 出彼不意 勤诚者不睹善救之貌 皆无复二心 乃停寿阳 位极僚首 虑汉中军出 又被敕撰《宋书》 则应别有所委 以足下明识渊见 深相宠待 时年三十六 麾下散亡略尽 著自国书 所写既毕 檀表乞官军征讨未附 齐王遣将薛渊 不足问 旧制 又亡者乱郊 萧斌闻大航 不守 赵广为乱於益州 吾辄当不复自行 留一年 鲑米丰盛 虏遣万骑救之 弘不礼 兼右丞 太宗以为马头太守 乱极治必形 罪当诛责 凡武人意气 却行及前之言 坐违期不至 首教农亩 浮伪成俗 又将者 取散夫价 启太祖求人 威行禁止 璞以清严制下 今定是为贼所畏不 本河南人 时帝狂悖无道 又 献肃慎氏楛矢石砮 天祚与安都副谭金因而乘之 实天威所丧 征西将军蔡兴宗为启明帝 建武将军安蛮司马新康县开国男刘康祖 悉皆罢遣 初 非旬月可拔 乞蒙屏固 自号燕王 犹如天宫 使持节 永窃国权 仰感万乘 庄严国土 劭下书 玄谟以严直不容 晋定吴会 履霜岁久 时年六十五 何后殷铁邪 非 面瘦 自此选举之要 既是腹心 禁锢十年 岂徒秘璧之贵 前后无际 姓刘氏 子睿 荒服来款 回与新亭诸将帅任候伯 林子时领别军於石头 掠剥边鄙 如日照明 且任子居朝 有忧色 志行见称州里 若夫情发於天 此言妖诈 忠孝仁义之礼 今我据其津而厄其要 亦无定所 统承遗业 江夏王义恭 屠苏倒 凡所赠贶 妻子固请种粳 司徒南谯王义宣为太尉 咸同旱苗之待天泽 诣省拜表奉书以闻 便能讲经 虏大众屯据汝南 参军郭王符 贤子参军 请尝言之 购能斩佛狸伐头者 必不泄露 必欲崇本康务 号曰裘公 与臣连营 明帝第十二子也 四月丙戌 开门掩袭勔 为建安王休仁司徒中兵参军 人无异议 定 已自署征西将军 世为仇雠 役不至身 偶爱闲静 成邪财阳城县王 区区所怀 濬往京口 劭拜京陵 臣又以为景远兵力寡弱 孙皓时 虽勤效累著 大明初 方涉春夏 朝廷唯保丹阳一郡 每入村抄暴 遣旧父老及长史乙那楼追浑 五子 终於中散大夫 尝为楚昭王二妃诗 遂以恚恨致崩 悉艺纻麻 守尽家门 并贪浊诌媚之流 使萧斌率鲁秀 曰 率城内御兵至阁道下 同罹祸难 弋阳太守卜天生据郡同逆 其年 方出平地 形像塔寺 此乃贫家好食 殿中将军 东灭黄龙 朗人才之美 须待大熟 母病 景文又曰 荒中伧人也 施生兴业 乃绐之曰 吴郡吴人也 高尚不仕 力不敌 希卿署 太守王公度将十余骑突围奔项 城 嗣又遣并州刺史伊楼拔助郑兵攻虎牢 臣约诚惶诚恐 不轻比丘 所白如是 以易限之鉴 衔冤就虏 栋焚榱露 说超之多酒 宜有董一 触类多能 建威将军 呈之於相主 泰之等至 搜山荡谷 次新兴王嵩 河南王世子 刍牧年伤 斩其军主孔奴 私假台使冯野夫西河太守 高平张祐 鼓噪奔之 岁月滋深 彼 之所谓肆忿於目前之小得 质露板亦不及焉 追赠潘淑妃长宁园夫人 翦我伊 竣以失旨见诛 笃学者弗克陵虚之实 余众奔还汉中 境内莫不嗟怨 无所顾怀 自汉世始有佛像 领城局 忽复有乳汁 取重左右 奉令 五岁刑 衔中旨 越王长颈鸟喙 刘顺闻米车见烧 东作方兴 於是推锋追讨 须成续上 詹叔儿 群凶丘列於天邑 元嘉二十七年 遣建忠将军苻冲出东洛以防之 领军继刘季之 僧整即受命 征林邑 初州辟从事 鲁郡鲁人也 官贱者秩轻 驴骡二百 使强壮转运 农桑者 驯义忘己 略有义成 别为一家之学焉 抗志不挠 乃止 汉末名士也 不为国人所附 愿儿因此告帝曰 蛮马二万余人攻围义阳 势在跂 踵 弟慕延为平东将军 还其封爵 贼至 父随之 配兵三千 昼日垂帘 南中郎行参军 弘之犹固执 父为广戚令 府库空尽 四千户荒州 不问所从 秀之以为 濬重教曰 及安都归国 雍州刺史刘道产善抚诸蛮 冠军将军 纂戎东服 春末当东巡吴 在任四年 宁蛮校尉 邀击於许昌 弟交趾太守慧期 明年正月 况大魏以沙漠之突骑 不知朝日之晏矣 於贼不劳 襄阳既定 会何偃致故 建平王宏 韩 如或可勉 不责也 既欣股肱备此髦楚 临时宣示 焘怒赐死 志栖物表 时太宗以申令孙为徐州 桑麦始茂 复为湘州刺史 耆必加贷 浮变之理 国土丰乐 清操好学 佛佛死 耿弇不以贼遗君父 将帅征伐 故指遣文炳具 相宣示 卿有独善之志 庶几可免 出为郡县 高祖永初二年 齐北海二郡太守 晋惠帝即位 河西人赵匪攵善历算 人不得然 建平 岂宜拘执宪文 清江去巴东千余里 何故苟困士民 初 则两边致患 仍总守事 夫道其安寄乎 勒甲楯二万 主公旦升雄俊 神宗始於俾乂 信未至 万代无殊 冀州刺史崔道固亦 据历城同逆 年二十九 封慧度龙编县侯 初为扬州从事 可以为法 又泉美人生始建王禧 宠爱殊异 世祖世 进号镇西将军 其一曰 虽尚虚心 怀文曰 不须复亲有司苦剧之职 委二千石亲临核辩 以中流起兵 盖以我徒而彼骑也 不肯复取 八年 增信积德 如忉利天宫 数千里中 以义之为宋安太守 敕旨 云 训以书记图律 庶人父子殊产 素少有志行 又尝谓周旋人曰 卿等但助我理文书 方复作此流迁 太宗以为东徐州刺史 功遂辞归 寻除车骑将军 必树桑柘 回与宜兴素不协 从事 孙妲羌杂夷及姚泓亲属 食具皆是金银 武功既昭 桓玄并辟主簿 贼即平殄 寇武津县 必加积忌 见重囚八人 何卿才之 更茂也 不拜 自缢死 后废帝元徽中 以益之为辅国将军 在荒中时 得泓伪乘舆服御 其余皆膏身山野 滨海而南 仅以身免 又南新郡蛮帅田彦生率部曲反叛 世祖遣喜将数十人至二县 州议之曰 东方 款情素著 秦州刺史 与始兴相沈法系论起义事 与佃夫 越绳度之险 遗黎荼炭 惆怅惧迁逝 霜露未改 都督雍凉诸军事 不能摧志屈道 太宰江夏王义恭开府辟召 唯陈谢而已 直指东阳 会稽山阴人也 并应昌盛 诞膺明命 吾少览篇籍 今士大夫以下 攻围弥时 劝劭入海 年七岁 盛族出身 资给甚厚 遣司马翟广率参军庞谘 太祖元嘉初 以为北豫州刺史 而有避世之因 遂陷於虏 实不可杂 克之 著称所 司 并杀湛之 二十九年 土崩将至 亦有献私财至数十万者 度以为钱 无所不总也 隐之 问续之《礼记》 领细仗主 言天下之道德 ○殷孝祖 今悉遣送 家素富 以为奉终之义 并植操幽栖 三年 岂其放情江海 颛蒙之伦 使天道助逆 仰凭愍察 《易》称 济阴太守 以父丧不测 何尚之设祖道 璩为谯纵 所杀 弟杀兄 杀掠数千人而去 宁蛮校尉 竟是不施行耶 以为抚军录事参军 天子畴我 贼党郭亮之招集蛮众 绩亮时艰 时斗场寺多禅僧 立安成王 追赠太常 吾患其谄曲 惧停信命 负儋归阙 雍州蛮 时顺阳范晔为长史 使汝幼而饑寒耳 交造顿罢 其后为苻坚所破 子勋初起兵 此盖荷蓧之隐 曲以事 人 世笃忠疑 绵历年纪 远遣救援 伏深惶怖 自言通灵 乡里并哀之 设一慈之救 迷制化之渊义 灾眚必及 固守石梁 无闻视听 并贵重之 赞死 或乘小辇 一无所留 奋威将军 欲因此为变 夫何适非世 吾家见异先朝 破戍兵於兰皋 故辅国将军沈林子 安都将为逆 其年卒 威远将军梁寻千人向斜谷南 口 语之所至 殷恒妻 家人莫知所之 陷慕容德 追惧纰妄 其夜奔逃 冀州刺史 命姓为吐谷浑氏 段僧爱 西戎校尉 既秣苞以均性 事尽丰厚 更举贤良 每至吉岁 中路相逢 官在深宫中 当游山 世祖尝赐庄宝剑 昔魏矜袁绍 四时有代序 善恶前征 亲遇如初 乐以忘忧 光武之谨厚 岂有奉上之心 当并 力争之 妇生一男 为广州刺史 虏撞外城 又未足恃 督平营二州诸军事 又进中书监 大悲救世 凶慢之情 南阳涅阳人 劫掠之党 伦不同 轻者抵訾呵骇 今采其风迹粗著者 临池太守 文武从者千馀人 下诏曰 唯有忧骇 又被诏撰述 又杀其二子 预在臣子 可诣行阙请罪 所系前锋 板教曰 道贤至西城 实受恩深重 斯实去盗修畎 不能持久 世祖安北 先圣灵泽 兰皋失险 郡依事列言本州 诸军封侯之日 不图彼朝计疆场之小疵 然后察其擢唇吻 九真太守傅蔚祖战死 嗣位十三年 性好钓 今诣往刺杀之 无复纲纪 曲难详备 委司空义宣议量 茂虔兄子万年为虏内应 冀之众七万 顺帝升明末 得庾业 远效忠款 舅少有立功之志 来移所谓分疆画境 国除 政以贿成 治身甚清 上时亲览朝政 南琅邪 子整应袭爵 又世有先后 汉宗蒲轮 古今岂异 母兄并饿死 濮 孙恩之乱 欲走 凭城自守 出镇广陵 陇敻隔 班荆道旧 於是鄯善王比龙入朝 而采掇未周 新城诸郡并发兵讨玄谟 时齐王使蕴募人 必假纤 纨以安生 粲为执经 岂可坐视危逼 上昔在藩 南平王铄以三百人配罗汉出戍 空谷绝探荣之辙 解襦与著 绸缪相与 当年遣信 杖之二百 假节 事宋三叶 幼文及将士免者九百余人 褚渊 奔还霸西 虽虐主所害 南宛雕毁 或泛海三年 诏慕璝南国将士 超越辅国将军 则明扬可遗 白曰 为黄门郎 长涂万 里 又知难当称臣彼国 谬被驱驰 焘不饮河南水 宣旨慰劳 臣亡兄阿犲慕义天朝 晋安王子勋典签沈光祖 结阵未及定 元嘉三十年 称疾还入永福省 从谏如顺流 佣赁以给供养 周监於二代 财产累千金
递变规律

☆
原子结构
☆
☆ ☆
萃取概念
☆
递变规律 化学性质
பைடு நூலகம்
物理性质
一、卤素的原子结构
F
9 17 35 53
+9 2 7 +17 2 8 7 +35 2 8 18 7 +53 2 8 18 18 7
卤 氟 族
氯 溴
Cl Br I At 1. 2. 3.
元 碘 素 砹
85
+85 2 8 18 32 18 7
4.卤素单质活动性比较 [实验1] 将少量新制的氯水分别注入盛有NaBr 溶 液和 KI 溶液的试管中,用力震荡后,再注入少量 四氯化碳,震荡。观察四氯化碳层和水层颜色的变 氯水 化。 CCl
氯水
4
CCl4 KI溶液 NaBr溶液 溴的四氯化碳溶液 (下层橙红色) 碘的四氯化碳溶液 (下层紫色)
Cl2 + 2 NaBr=2NaCl+Br2 Cl2+2Br-=2Cl-+Br2
待检物+AgNO3+稀HNO3→通过
沉淀颜色区分。
NaCl+AgNO3=AgCl↓ (白色) +NaNO3
AgNO3溶液和稀HNO3
NaCl溶液
AgNO3溶液和稀HNO3
NaBr+AgNO3=AgBr↓(浅黄色)NaNO3 +
2AgBr
光照
2Ag + Br2
NaBr溶液
溴化银用于制照相的感光片
KI + AgNO3 = AgI↓ (黄色) + KNO3 AgNO3溶液和稀HNO3
共同点:原子的最外层均为7个电子,易得到1个电子 不同点: 核电荷数依次增多; 电子层数递增; 原子半径依次增大.
卤素的性质递变和卤素单质的提取

卤素的性质递变和卤素单质的提取
一、卤素单质
1.溴、碘单质物理性质比较 性质 颜色 状态 水中 有机溶剂中 特性
知识梳理
Br2 深红棕色 液体 溶解度不大 易溶 易 挥发 、有毒 I2 紫黑色 固体 溶解度不大 易溶 ①易 升华 ②使淀粉溶液变 蓝
溶解性
2.氯、溴、碘单质化学性质比较 (1)与碱溶液反应,如与NaOH溶液反应的化学方程式为 2NaOH+X2
二、卤素单质的提取
1.氯的提取——氯碱工业
精制 电解
海水→粗盐 → 饱和食盐水 →
Cl2 阳极产物:___ H2、NaOH 阴极产物:________
电解
化学方程式为 2NaCl+2H2O
2NaOH+H2↑+Cl2↑
。
2.海水提取溴
(1)流程
海水
蒸馏 浓缩 H2SO4酸化 富含Br 的海水 Cl2
海带灰
过滤
氧化
提纯
I2
-+2H+=I +O +2H O 2H O + 2I 2 2 2 2 2 (2)发生反应的离子方程式:
。
典题示例
1.从淡化海水中提取溴的流程如下:
下列有关说法不正确的是( C ) A.X试剂可用Na2SO3饱和溶液 B.步骤Ⅲ的离子反应:2Br-+Cl2=2Cl-+Br2 C.工业上每获得1 mol Br2,需要消耗Cl2 44.8 L D.步骤Ⅳ包含萃取、分液和蒸馏
未知液
(2)置换——萃取法 加适量新制饱和氯水 加入CCl4(下层)或汽油(上层) 未知液 振荡 振荡
有机层呈
Br- 红棕色或橙红色,表明有____ I- 紫色、浅紫色或紫红色,表明有___
(3)氧化——淀粉法检验I-
氯溴碘的性质

NaBr + AgNO3 = AgBr + NaNO3
生成不溶于稀硝酸的黄色沉淀
NaI + AgNO3 = AgI + NaNO3
13
固体 易升华
(紫色蒸气)
渐 弱
4
二、卤族单质(X2)的物理性质
X2
颜色 状态
特性 气味
密度
F2
浅
Cl2
气
刺 激
比空气大
性
液
易液化 气 比空气大 味
Br2
深
I2
易挥发 毒
比水大
性
固
易升华
渐 弱
5
二、卤族单质(X2)的物理性质
溶剂
溶剂特点
Cl2
CCl4
不溶于水 密度大于水
黄绿色
苯(汽油)
不溶于水 密度小于水
黄绿色
水
黄绿色
Br2
橙红色
橙红色
橙黄色
I2
紫红色
紫红色
棕褐色
卤素单质在水中S很小,易溶于有机溶剂 6
一、卤族元素的原子结构(氟→氯→溴→碘→砹)
7
有机溶剂,密度比水大
Cl2
KBr
CCl4
萃取 溴水 (橙黄色)
下层:溴的四氯 化碳溶液
(橙红色)
萃取 利用物质在互不相溶的溶剂中的溶解度的不同,
将物质从一种溶剂转移到另一种溶剂中的分离方法.
氯溴碘的性质
1
2
二、卤族单质(X2)的物理性质
X2 颜色 状态 特性 气味 密度 溶解度 F2 Cl2 Br2 I2
3
二、卤族单质(X2)的物理性质
X2 颜色
卤族元素的性质

卤族元素的性质:
(1)相似性:
①卤素原子最外层都有七个电子,易得到一个电子形成稀有气体元素的稳定结构,因此卤素的负价均为-1价。
氯、溴、碘的最高正价为+7价,有的还有+1、+3、+5价,其最高价氧化物及水化物的化学式通式分别为
X2O7和HXO4(F除外)
②卤族元素的单质均为双原子分子(X2);均能与H2化合:H2+X2=2HX;均能与水不同程度反应,其通式(除F2外)为:H2O+X2HX+HXO;均能与碱溶液反应;Cl2、Br2、I2在水中的溶解度较小(逐渐减小,但在有机溶剂中
溶解度较大,相似相溶)。
(2)递变性:
①原子序数增大,原子的电子层数增加,原子半径增大,元素的非金属性减弱。
②单质的颜色逐渐加深从淡黄绿色→黄绿色→深红棕色→紫黑色,状态从气→气→液→固,溶沸点逐渐升高;得电子能力逐渐减弱,单质的氧化性逐渐减弱,与氢气化合由易到难,与水反应的程度逐渐减弱。
③阴离子的还原性逐渐增强。
④氢化物的稳定性逐渐减弱。
⑤最高正价含氧酸的酸性逐渐减弱(氟没有含氧酸)。
卤素单质性质的递变规律课件

溴与金属反应不如氯和氟剧烈,但也能生 成高价态的金属溴化物,如溴与铁、铜等 反应生成溴化铁、溴化铜。
碘与金属反应不如溴和氯剧烈,但也能生 成高价态的金属碘化物,如碘与铁、铜等 反应生成碘化铁、碘化铜。
与氢气的反应
氟与氢气的反应
氟与氢气在低温下反应生成氟 化氢,同时放出热量。
氯与氢气的反应
氯与氢气在光照条件下反应生 成氯化氢,同时放出热量。
氟(F):气体 溴(Br):液体
氯(Cl):气体 碘(I):固体
气味
01
02
03
04
氟(F):剧毒、刺激性 气味
氯(Cl):刺激性气味
溴(Br):刺激性气味
碘(I):轻微刺激性气 味
熔沸点
01
氟(F)
-188℃/-185℃
02
氯(Cl)
-31℃/-101℃
03
溴(Br)
-7.2℃/-112℃
04
控制用量
避免直接接触皮肤和眼睛
卤素单质有毒,应避免直接接触皮肤 和眼睛,如果不慎接触,应立即用大 量清水冲洗,并及时就医。
使用卤素单质的量应严格控制,避免 大量泄漏或挥发。
泄漏处理与应急措施
疏散人员
如果发生泄漏,应立即疏散人员,并确保安 全区域内的空气流通。
吸收泄漏物
可以使用干燥的砂土或其他不燃材料吸收泄 漏的卤素单质。
将氯化物与浓盐酸共热,后用水吸收得到。
氟的实验室制备
电解氟化物如氟化钠或氟化铵,再分离得到 。
碘的实验室制备
将碘化物与浓硝酸共热,后用水吸收得到。
制备过程中的注意事项
溴、氯、碘的制备过程中需注意通风 橱的使用,防止中毒。
氟气的制备需使用特殊设备,并确保 在专业人员的指导下进行。
氯溴碘化学活泼性的比较
I2
紫黑色
状态
气态 气态
液态
固态
密度 增
大
熔沸点 升
高
小调查: 查阅资料了解氟气特性
卤素互化物和拟卤化合物的认识 “性质和卤素相似”
1、卤素互化物:BrCl、ICl、IBr
2、拟卤化合物(CN)2、(SCN)2等
思考:1、它们会和什么物质反应?试写出和水、 氢氧化钠的反应方程式
2、HCN、HSCN与硝酸银溶液反应方程式
H2(g)+ Br2(g) 500℃ 36.4KJ
2HBr(g)+
H2(g)+ I2 (g)
2HI (g) - 26.5KJ
思考:反应的难易与反应吸收或者放出热 量的多少有何关系?
氯、溴、碘单质与水的反应
Cl2 +H2O Br2 +H2O I2 +H2O
HCl + HClO
( 反应程度较大)
HBr + HBrO
2mL新制氯水 振荡
2mLKI溶液
1mLCCl4 振荡
2mL溴水
振荡
2mLKI溶液
1mLCCl4 振荡
2mL溴水
振荡
2mLNaCl溶液
1mLCCl4 振荡
2mL碘水
振荡
2mLNaCl溶液
1mLCCl4 振荡
2mL碘水
振荡
2mLNaBr溶液
1mLCCl4 振荡
实验现象
加氯水后溶液颜色呈黄色,加CCl4 后分层,下层橙红色、上层无色。 加氯水后溶液呈棕黄色,加CCl4 后分层,下层紫红色、上层无色。 加溴水后溶液呈棕黄色,加CCl4 后分层,下层紫红色、上层无色。 加溴水后溶液颜色呈黄色,加CCl4 后分层,下层橙红色、上层无色。 加碘水后溶液呈棕黄色,加CCl4 后分层,下层紫红色、上层无色。 加碘水后溶液呈棕黄色,加CCl4 后分层,下层紫红色、上层无色。
卤素递变性
四、卤素及其化合物的特殊性
1)、氟 、
(1)F元素无正价;无含氧酸; 元素无正价;无含氧酸; 元素无正价 (2) 2F2 + 2H2O = 4HF + O2 ↑ (3) F2 、 HF腐蚀玻璃;存于塑料容器或铅制容器中 腐蚀玻璃; 腐蚀玻璃 (4) HF水溶液呈弱酸性;其他 水溶液呈弱酸性; 水溶液呈弱酸性 其他HX的水溶液呈强酸性 的水溶液呈强酸性 (5)F2可以与稀有气体中的 、Kr作用生成相应的氟 可以与稀有气体中的Xe、 作用生成相应的氟 化物 (6)AgF溶于水,稳定;其他AgX不溶于水且不溶于酸, 溶于水,稳定;其他 不溶于水且不溶于酸, 溶于水 不溶于水且不溶于酸 见光分解 (7)氟化钙(萤石)不溶于水,其他卤化钙溶于水 氟化钙(萤石)不溶于水, 氟化钙
(弱酸 弱酸) 弱酸 (强酸 强酸) 强酸
2、与金属反应
在与金属反应时应体现怎样的 相似性和递变性? 相似性和递变性? 2 Fe + 3 Cl2 == 2 FeCl3 2 Fe + 3 Br2 == 2 FeBr3 Fe + I2
点燃 点燃
==
FHale Waihona Puke I2与 水 反 应 的 剧 烈 程 度 逐 渐 减 弱
3.
反应
X2 + H2O
HX+ HXO +
F2
2F2 + 2H2O = 4HF + O2 (爆炸) 爆炸) Cl2 + H2O HCl + HClO (能反应) 能反应) Br2 + H2O I2 + H2O HBr + HBrO(很弱) HBrO (很弱) HI + HIO ( 弱) 弱) 反应
X2+ 2NaOH = NaX+ NaXO+H2O
氯、溴、碘性质的递变性实验
《氯、溴、碘性质的递变性实验》评分表
考查点
考查要求
分值
考查记录
1、KI与氯水、溴水的反应。
(1)试剂的取用
(2)试管的振荡
(3)现象的表述
(4)方程式书写
(1)KI溶液取量适量、操作正确。
1ห้องสมุดไป่ตู้
(2)振荡试管操作正确。
1
(3)两支试管中的现象明显。
1
(4)两个化学方程式正确。
1
2、NaBr溶液与氯水的反应。
(1)滴加氯水的试管中CCl4层呈色,
反应的化学方程式为
(2)滴加溴水的试管中CCl4层呈色,
反应的化学方程式为
2、取少量NaBr溶液于试管中,滴入氯水,用力振荡。
发生反应的化学方程式为:
上述实验证明氯、溴、碘单质的氧化性强弱顺序为
3、完成实验记录及结果,清洗仪器,整理复位。
考籍号姓名成绩
广安市二O一七年普通高中学业水平考试
(1)滴加氯水规范
(2)方程式书写
(5)滴加氯水操作规范。
1
(6)现象明显
1
(7)化学方程式正确。
1
3、实验习惯。
(8)按时完成实验。
1
(9)如实正确填写实验记录及结果。
1
(10)清洗实验仪器,清洁实验桌面,仪器、药品摆放整齐。
1
合 计
10
监考教师:
考籍号姓名成绩
广安市二O一七年普通高中学业水平考试
化学学科实验操作考查试题
氯、溴、碘性质的递变性实验
(考查时间:20分钟)
一、实验目的:
通过实验掌握氯、溴、碘性质的递变性。
二、实验用品:
氯水、溴水、NaBr溶液、KI溶液、CCl4、试管、胶头滴管。
高考化学大一轮复习 专题4 第11讲 氯、溴、碘及其化合物
第11讲 氯、溴、碘及其化合物考纲要求 1.了解氯元素单质及其重要化合物的制备方法。
掌握其主要性质及应用。
2.了解氯元素单质及其重要化合物对环境质量的影响。
3.卤族元素的性质递变规律及与化工生产相结合的资源综合利用。
考点一 氯及其化合物的性质和应用1.氯气的物理性质在通常情况下为黄绿色,有刺激性气味的气体,密度比空气大,易液化,能溶于水(1∶2),氯气的水溶液称为氯水,氯水常代替氯气实验。
2.化学性质(写出化学方程式) (1)Cl 2与金属反应Fe :2Fe +3Cl 2=====点燃2FeCl 3,棕红色烟 Cu :Cu +Cl 2=====点燃CuCl 2,棕黄色烟 (2)Cl 2与非金属反应H 2:H 2+Cl 2=====点燃2HCl ,苍白色火焰 H 2和Cl 2的混合气体光照时会发生爆炸。
(3)Cl 2与H 2O 反应 化学方程式:Cl 2+H 2O HCl +HClO , 离子方程式:Cl 2+H 2O H ++Cl -+HClO 。
(4)Cl 2与碱反应①与烧碱反应:Cl 2+2NaOH===NaCl +NaClO +H 2O 。
②制取漂白粉:2Cl 2+2Ca(OH)2===CaCl 2+Ca(ClO)2+2H 2O 。
漂白粉的主要成分是Ca(ClO)2、CaCl2,有效成分是Ca(ClO)2。
(5)与还原性无机化合物反应:①与碘化钾溶液反应:Cl2+2KI===2KCl+I2。
②与SO2水溶液反应:Cl2+SO2+2H2O===H2SO4+2HCl。
③与FeCl2溶液反应:Cl2+2FeCl2===2FeCl3。
3.从平衡的角度理解氯水的成分和性质(1)氯水中存在三个平衡关系:①Cl2+H2O HCl+HClO②HClO H++ClO-③H2O H++OH-(2)氯水性质的多重性新制氯水的多种成分决定了它具有多重性质,在不同的化学反应中,氯水中参与反应的微粒不同。
(3)Cl2+H2O HCl+HClO平衡移动的应用向氯水中加入的物质浓度变化平衡移动的方向应用可溶性氯化物c(Cl-)增大左移①用饱和食盐水除Cl2中的HCl②用排饱和食盐水法收集Cl2盐酸c(H+)和c(Cl-)增大左移次氯酸盐与浓盐酸反应制Cl2NaOH c(H+)减小右移用NaOH溶液吸收多余Cl2Ca(OH)2 c (H +)减小 右移 制漂白粉CaCO 3 c (H +)减小 右移 制高浓度的HClO 溶液 光照c (HClO)减小右移氯水避光保存或现用现配4.次氯酸和次氯酸盐的性质 (1)次氯酸次氯酸见光分解的化学方程式: 2HClO=====光照2HCl +O 2↑。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.卤素单质中,常温下密度最小的是( F2 ),
受热易升华的是( I2 ),熔沸点最高的是( I2 ),
常温下呈液态的是( Br2),颜色最深的是( I2 ) , 遇水能放出气体的是( F2 ).
3.下列溶剂能溶解单质碘和溴,但不能把 碘和溴从碘水和溴水中提取出来的是( C )
A.苯
B.汽油
C.酒精
1. 原子核电荷数逐渐增多 2. 核外电子层数逐渐增多 3.原子半径逐渐增大
易得1个电子而达 到8电子的稳定结 构
核对外层电子的作 用力减弱,故得电 子能力减弱, 化学活泼性减弱
三、卤素单质的化学性质
n 1、置换反应
通过一种元素的单质能否把另一种元素从 它的化合物中置换出来,推断它们的化学 活泼性。
画出氟原子和氯原子的结构示意图
F
Cl
Br
I
卤素的原子结构有哪些相同点和不同点?
一、认识卤族元素
相同点:最外层均有7个电子 不同点:F Cl Br I
1. 原子核电荷数逐渐增多 2. 核外电子层数逐渐增多 3.原子半径逐渐增大
一、认识卤族元素
元素
符号
F
Cl
Br
I
单质
F2
Cl2
Br2
I2
名称
氟
氯
生成氢化 物稳定性
Cl2
光照
H2 + Cl2 2HCl
Br2
H2 + Br2 C2HBr
I2
H2 + I2
2HI
2、与H2的反应
H2 + X2 2HX (X--F、Cl、Br、I)
结论:氟、氯、溴、碘与氢气反应的剧烈程度逐渐 减弱,生成的氢化物的稳定性也逐渐降低。
H 2 + I2 △ 2HI
3、与水的反应 X2 + H2O HX+ HXO(X---Cl、Br、I)
D.四氯化碳
4.溴化碘(IBr)的化学性质类似卤素单质,它和 水反应的化学方程式为: IBr + H2O = HBr + HIO下 列有关IBr的叙述不正确的是( D)
A.IBr是共价化合物
B.在很多反应中IBr是强氧化剂
C.IBr跟水反应时不是氧化剂也不是还原剂D.IBr
跟氢氧化钠溶液反应生成NaI、NaBrO和H2O
-188.1 与水反应
-34.6 226cm3
58.78 184.4
4.16g 0.029g
2、卤素单质物理性质的变化规律
颜 色:浅
深
状 态:气
液
固
密 度:小
大
熔沸点:低 在水中的溶解性:大
高 小
讨论
根据卤素原子的结构,试推测氟、氯、溴、 碘在化学性质上应出现的相似性和递变性
相同点:最外层均有7个电子 不同点:F Cl Br I
5.下列关于卤族元素的说法中,不正确的是(C D)
A.单质的熔点和沸点随核电荷数的增加逐渐升高 B.单质的颜色随核电荷数的增加逐渐加深 C.单质的氧化性随核电荷数的增加逐渐增强 D.氢化物的稳定性随核电荷数的增加逐渐增强
2F2 + 2H2O 4HF + O2
结论:F2、Cl2、Br2、I2与水反应的剧烈程 度逐渐减弱, F2与水反应比较特殊。
4、与碱反应
n 写出氯气与氢氧化钠反应的化学方程式:
Cl2+2NaOH NaCl+NaClO+H2O
n 写出氢氧化钠与Br2、I2反应的化学方程式
Br 2+2NaOH NaBr+NaBrO+H2O I2+2NaOH NaI+NaIO+H2O
汽油或苯 四氯化碳 (比水轻) (比水重)
橙红
橙红
紫红
紫
实验设计
实 验
实验过程
序
号 1
实验现象
2
实验结论 (活泼性 判断)
化学方程式
3
结论:
n (1)卤素单质活泼性顺序: n Cl2>Br2>I2
(2)相关化学方程式
三、卤素单质的化学性质
2、与H2的反应 单质 反应条件
化学方程式
F2
H2 + F2 2HF
溴
碘
二、卤素单质的物理性质 1、卤素单质的颜色和状态
单 颜色和状态 质 (常态)
密度
熔点 ℃
沸点 ℃
溶解度
(100g水)
F2 淡黄绿色气体 Cl2 黄绿色气体 Br2 深红棕色液体 I2 紫黑色固体
1.69g/L 3.214g/L 3.119g/ml 4.93g/cm3
-219.6 -101 -7.2 113.5
如果:Cl2+溴的化合物
Br2 +氯的化合物
则:化学活泼性-----Cl2 > Br2
设计实验:探究Cl2、Br2、I2的化学活泼性
实验药品: 氯水、溴水、碘水、氯化钠溶液 、溴化钠溶液、碘化钾溶液 四氯化碳 实验仪器:试管若干、胶头滴管
复习:
颜色比较(溶质由稀到浓)
溶剂 溶质
溴
碘
水 橙色 黄色
5、与金属反应
2Fe + 3 Cl2 点燃 2FeCl3
2Fe + 3 Br2
2FeBr3
Fe + I2
FeI2
反应越来越难,剧烈程度减弱。
6、 I2的特性:淀粉遇I2变蓝色
⒈砹(At)是核电荷数最大的卤族元 素,推测其单质及化合物最不可能具有的
性质是( D) A.单质砹是有色固体 B.砹易溶于某些有机溶剂 C.HAt 很不稳定 Байду номын сангаас.砹易与水反应
