注射用水质量标准
注射用水质量标准

、目的:为确保工艺用水的质量,强化内控标准的管理,特制定本标准。
、适用范围:适用于公司注射用水检验和放行。
、职责:QA负责质量标准实施的监督检查,QC负责标准实施,生产部负责按标准制备、使用。
四、内容:
1、其他类的基本信息
1.1名称和代码:注射用水代码:。
1.2质量标准依据:《中国药典》2015年版二部
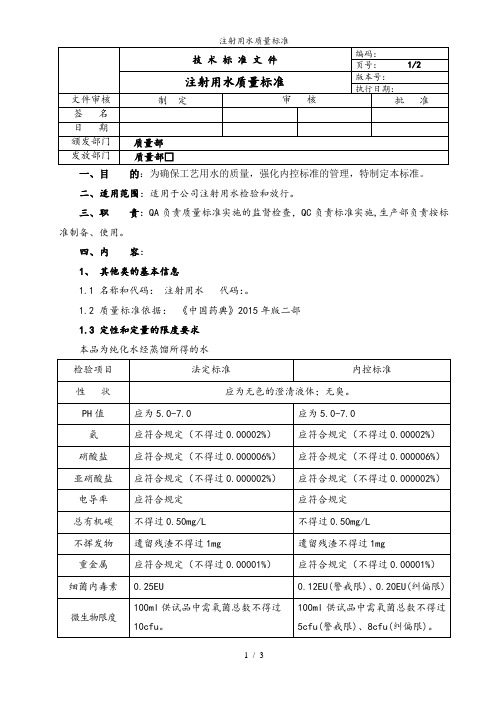
1.3定性和定量的限度要求
本品为纯化水经蒸馏所得的水
14来源:散剂制水间
1.5. 取样、检验方法或相关操作规程编号:检验方法见《注射用水取样标准操作规程》() 1.6. 贮存条件和注意事项:70C以上循环贮存。
1.7检验周期:每月全检一次,
五、相关文件及记录
《注射用水检验标准操作规程》()
《注射用水取样标准操作规程》()
六、文件变更历史
附表1纯化水温度与电导率的限度。
注射水标准

中国药典2010年版注射用水质量标准测试项目标准要求性状本品为无色的澄明液体;无臭,无味。
检查1、pH值取本品l00ml,加饱和氯化钾溶液0.3ml,依法测定,pH值应为5.0-7.0。
2、氨取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化铵31.5mg,加无氨水适量使溶解并稀释成l000ml)1.0ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(0.000 02%)3、硝酸盐取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液【取硝酸钾0.163g,加水溶解并释至l00ml,摇匀,精密量取1ml,加水稀释成l00ml,再精量取l0ml,加水稀释成l00ml,摇匀,即得(每1ml相当于1µg NO3)】0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000 006%)4、亚硝取本品l0ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液( 1→100) 1ml与盐酸萘乙二胺溶液(0.1→100)lml,产生的粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.750g(按干燥品计算),加水溶解,稀释至l00ml,摇匀,精酸盐密量取1ml,加水稀释成l00ml,摇匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1µg NO2)]0.2ml,加无亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(0.000 002%)5、电导率μS/cm 25℃时小于1.3,60℃时小于2.2,70℃时小于2.5,75-90℃时小于2.7,95℃时小于2.9,100℃时小于3.1。
6、总有机碳不得过0.50mg/L。
7、不挥发物取本品l00ml,置105℃恒重的蒸发皿中,在水浴上蒸干,并在105℃干燥至恒重,遗留残渣不得过1mg。
注射用水质量标准
一、目的:为确保工艺用水的质量,强化内控标准的管理,特制定本标准。
二、适用范围:适用于公司注射用水检验和放行。
三、职责:QA负责质量标准实施的监督检查,QC负责标准实施,生产部负责按标准制备、使用。
四、内容:
1、其他类的基本信息
1.1 名称和代码:注射用水代码:。
1.2 质量标准依据:《中国药典》2015年版二部
1.3 定性和定量的限度要求
本品为纯化水经蒸馏所得的水
1.4.来源:散剂制水间
1.5.取样、检验方法或相关操作规程编号:
检验方法见《注射用水取样标准操作规程》()。
1.6.贮存条件和注意事项:70℃以上循环贮存。
1.7 检验周期:每月全检一次,
五、相关文件及记录
《注射用水检验标准操作规程》()
《注射用水取样标准操作规程》()
六、文件变更历史
附表1 纯化水温度与电导率的限度。
灭菌注射用水临床应用指南

灭菌注射用水临床应用指南灭菌注射用水在临床上扮演着重要的角色,确保注射用水的质量和安全性对于患者的健康至关重要。
本指南旨在介绍灭菌注射用水的临床应用,以确保医护人员正确操作并保障患者的安全。
一、灭菌注射用水简介灭菌注射用水是一种经过特殊处理的无菌水,用于配制药物溶液或直接注射。
其主要作用是稀释药物、注射溶解剂和稳定注射液的渗透压,保证药物的有效性和安全性。
二、灭菌注射用水的质量标准1. 外观:应为无色透明液体,无悬浮物和沉淀。
2. pH值:应在5.0~7.0之间。
3. 溶解氧:应小于0.5mg/L。
4. 重金属:含铜、铁、镍等重金属离子的含量应符合国家标准。
5. 微生物指标:细菌总数应小于100cfu/mL,霉菌和酵母菌数应小于10cfu/mL。
三、灭菌注射用水的应用范围1. 配制药物溶液:绝大部分注射药物都需要用灭菌注射用水来稀释或溶解。
2. 血透治疗:血液透析、血液滤过等治疗过程中需要大量使用灭菌注射用水。
3. 注射液制备:一些注射液的制备需要使用无菌水作为原料。
四、灭菌注射用水的操作规范1. 应使用灭菌注射用水瓶盖上的塑料盖,不得触摸瓶口。
2. 打开瓶盖后,应立即使用,不得长时间放置。
3. 使用过程中应避免二次污染,避免与外界环境接触。
4. 剩余的灭菌注射用水不得回灌瓶中,以免污染。
五、灭菌注射用水的储存和处理1. 应存放在阴凉干燥处,避免阳光直射。
2. 储存时间不得超过有效期限,过期的灭菌注射用水不得使用。
3. 一旦发现灭菌注射用水出现浑浊、沉淀或异物,应立即停止使用。
六、结语灭菌注射用水在临床中扮演着重要的角色,医护人员应了解其质量标准和操作规范,保证患者用药安全。
只有做到严格遵守相关规定,才能确保患者获得良好的治疗效果,健康得到有效保障。
希望本指南能够对临床人员有所帮助,提高医疗服务质量,保障患者安全。
感谢您的阅读!。
中国药典2020注射用水

中国药典2020注射用水
摘要:
1.注射用水的定义和性质
2.注射用水的检查项目及其标准
3.注射用水的应用范围和注意事项
正文:
注射用水是一种在医药领域中广泛应用的溶剂或稀释剂,其质量直接关系到药品的安全性和有效性。
根据我国《中国药典2020》的规定,注射用水应为无色的澄明液体,无臭,pH 值应在5.0~7.0 之间。
此外,注射用水中氨、硝酸盐与亚硝酸盐、电导率、总有机碳、不挥发物与重金属等成分的含量也应符合相关标准。
在检查细菌内毒素和微生物限度方面,注射用水的标准则更为严格。
每
1ml 中含内毒素的量应小于0.25EU,而100ml 供试品中的需氧菌总数不得超过10cfu。
这些标准的制定,旨在确保注射用水在药品制备过程中的安全性和可靠性。
注射用水的应用范围十分广泛,不仅可用作注射用灭菌粉末的溶剂,还可作为注射液的稀释剂。
在制药过程中,注射用水的质量直接影响到药品的质量。
因此,在注射用水的储存和运输过程中,应严格按照相关规定进行操作,确保其质量不受影响。
总之,注射用水作为药品制备过程中的重要组成部分,其质量要求和检查标准十分严格。
三类医疗器械纯化水标准

三类医疗器械纯化水标准医疗器械纯化水是指为医疗器械的清洁、消毒、灭菌、注射等使用提供的高纯水。
纯化水的质量直接关系到医疗器械的清洁度和安全性,因此有一些标准被制定出来来确保医疗器械纯化水的质量。
一般来说,医疗器械纯化水标准可分为三类:工艺用水、灌装用水和注射用水。
1.工艺用水标准:医疗器械生产过程中需要使用许多纯净水用于清洗、冲洗、消毒等工艺。
医疗器械工艺用水的标准主要包括水质指标、微生物指标、有机物指标、离子指标等。
对于水质指标,一般要求水的电导率低于5 µs/cm,总溶解固体(TDS)低于5 mg/L,pH值在6.0-8.0之间,溶解氧(DO)高于5 mg/L。
在微生物指标方面,细菌、霉菌和大肠菌群细菌数量应符合卫生部对工艺水的规定。
有机物指标中,要求有机碳(TOC)低于0.5 mg/L,挥发性有机物(VOCs)含量低于0.1 mg/L。
离子指标包括主要的阳离子、阴离子和重金属,如铁、钠、钾、钙、镁等离子的浓度要符合国家有关标准。
2.灌装用水标准:医疗器械灌装用水是指用于制备注射用水或其他各类注射液配制的纯净水。
灌装用水的标准要求比工艺用水更高,水质指标包括电导率低于1 µs/cm,TDS低于0.5 mg/L,pH值在5.0-9.0之间,DO高于8 mg/L。
在微生物指标方面,要求无菌。
有机物指标中,要求TOC低于0.1 mg/L,VOCs应低于0.01 mg/L。
离子指标要求更严格,主要离子的浓度要求更低。
3.注射用水标准:医疗器械注射用水是指用于注射、输液、洗眼和灌肠等各种需要直接与人体接触的医疗用水。
注射用水的标准要求最高,主要是为了保证患者使用的水是安全可靠的。
注射用水的水质指标包括电导率低于1 µs/cm,TDS低于0.1 mg/L,pH值在5.0-7.0之间,DO高于8 mg/L。
在微生物指标方面,要求无菌。
有机物指标中,TOC低于0.1 mg/L,VOCs应低于0.01 mg/L。
TSYF302 注射用水质量标准

文件编码:TSYF302页码: 1/3复印号: /题目:注射用水质量标准制订人:审核人:批准人:颁发部门:制订日期:审核日期:批准日期:生效日期:分发部门:文件编写/修订历史:2011年制订,本文件为第三版1.目的本标准规定了注射用水的判定标准、检验方法、贮存等要求,以保证注射用水质量。
2.范围本标准适用于判定注射用水是否符合规定。
3.责任本标准由QC人员负责起草,质保部经理负责审核,质量副总经理负责批准,质保部负责实施。
4.引用标准《中国药典》2010年版二部第500页。
5.品名、物料代码5.1.品名注射用水英文名 Water for Injection5.2.物料代码 YF089O5.3.化学式 H26.用途生产用水7.来源注射用水系统8.取样方法按《工艺用水取样标准操作规程》SOP010003的规定进行。
9.检测项目9.1.性状本品为无色的澄明液体;无臭、无味9.2.检查页码: 2/3题目:注射用水质量标准9.2.1.pH值取本品100ml,加饱和氯化钾溶液0.3ml,依《pH值测定法标准操作规程》SOP01034测定,pH 值应为5.0~7.0。
9.2.2.氨取本品50ml,照纯化水项下的方法检查,但对照用氯化铵溶液改为1.0ml,应符合规(0.00002%)。
9.2.3.硝酸盐取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液(取氯化钾10g,加水至100ml,即得)0.4ml与0.1%二苯胺硫酸溶液(取0.1g二苯胺,加硫酸溶解并稀释成100ml)0.1ml摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1μgNO)]0.3ml,加无硝酸盐的3水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000006%)。
注射用水标准

注射用水标准注射用水是指用于制备药物注射剂的水,其质量标准对于保障患者用药安全至关重要。
注射用水的质量标准涉及到药品的质量和安全,因此必须严格执行相关标准,确保注射用水的纯净和安全性。
本文将就注射用水的标准进行详细介绍,以便相关从业人员加强对注射用水质量的认识和管理。
一、注射用水的纯度要求。
1. 细菌和内毒素含量。
注射用水中的细菌和内毒素含量必须严格控制在合格范围内,以确保注射用水的无菌性和安全性。
在生产过程中,必须采取严格的无菌操作,确保生产设施和设备的清洁和消毒,避免细菌和内毒素的污染。
2. 重金属和有机污染物含量。
注射用水中的重金属和有机污染物含量必须符合国家药典的规定,以保证注射用水的纯净度和安全性。
生产过程中应采用适当的工艺和设备,确保水质符合相关标准要求。
二、注射用水的生产和储存要求。
1. 生产设施和设备。
注射用水的生产设施和设备必须符合GMP要求,采用合理的工艺流程和设备,确保生产过程的卫生和无菌性。
生产设施和设备应定期进行清洁和消毒,避免对水质的污染。
2. 储存和运输。
注射用水在储存和运输过程中,必须避免受到外界污染和变质,保持水质的稳定性和纯净度。
储存容器和包装材料必须符合相关的卫生标准,确保水质不受污染。
三、注射用水的质量控制要求。
1. 质量控制体系。
生产企业必须建立健全的注射用水质量控制体系,包括原辅料的采购、生产过程的控制、成品的检验等环节,确保注射用水的质量符合标准要求。
2. 质量检验。
注射用水的质量检验必须严格执行国家药典的规定,包括对细菌和内毒素含量、重金属和有机污染物含量等指标进行检测,确保水质符合标准要求。
四、注射用水的使用要求。
1. 使用前检查。
在使用注射用水之前,必须对水质进行检查,确保水质符合使用要求,避免对药品质量和患者安全产生影响。
2. 使用过程中的注意事项。
在使用注射用水的过程中,必须严格执行操作规程,避免对水质的污染和变质,确保药品的质量和患者的安全。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、目的:为确保工艺用水的质量,强化内控标准的管理,特制定本标准。
二、适用范围:适用于公司注射用水检验和放行。
三、职责:QA负责质量标准实施的监督检查,QC负责标准实施,生产部负责按标准制备、使用。
四、内容:
1、其他类的基本信息
1.1 名称和代码:注射用水代码:。
1.2 质量标准依据:《中国药典》2015年版二部
1.3定性和定量的限度要求
本品为纯化水经蒸馏所得的水
1.4.来源:散剂制水间
1.5。
取样、检验方法或相关操作规程编号:
检验方法见《注射用水取样标准操作规程》().
1。
6.贮存条件和注意事项:70℃以上循环贮存.
1。
7 检验周期:每月全检一次,
五、相关文件及记录
《注射用水检验标准操作规程》()
《注射用水取样标准操作规程》()
六、文件变更历史
附表1纯化水温度与电导率的限度。
