第六章 脂肪族亲核取代反应反应
脂肪亲核取代反应和消除反应

脂肪亲核取代反应和消除反应脂肪亲核取代反应和消除反应是有机化学中两种常见的反应类型。
它们在合成有机化合物和调控分子结构方面都具有重要的意义。
下面将详细介绍这两种反应的原理、机理和应用。
一、脂肪亲核取代反应脂肪亲核取代反应是指一个亲核试剂与一个电子不足的亲电试剂反应,以形成一个新的化学键的过程。
它的原理可以归纳为以下几点:1.亲核试剂:亲核试剂具有孤对电子或自由基的特性,可以与电子不足的亲电试剂发生反应。
常见的亲核试剂包括氨、水、醇、酚、醚等。
2.亲电试剂:亲电试剂是指具有正电荷、部分正电荷、或含有亲电性官能团的化合物。
亲电试剂可以提供一个带正电荷的中心原子或原子团,使其与亲核试剂发生反应。
3.当亲电试剂与亲核试剂接近时,电子密度会发生改变,使得亲电试剂中带有正电荷的原子更容易与亲核试剂的孤对电子或自由基结合。
脂肪亲核取代反应的机理有多种类型,包括S_N2、S_N1、E1、E2等。
其中S_N2和E2是比较常见和重要的类型。
S_N2反应是指亲核试剂在一个步骤中与亲电试剂发生反应,并且亲核试剂的取代基与离开基是同时发生的。
这种反应具有一定的立体化学控制,因为亲核试剂会在空间上与亲电试剂相互作用。
E2反应也是一个一步反应,亲电试剂和亲核试剂同时发生反应,生成的产物通常是具有双键的化合物。
E2反应也具有一定的立体化学控制,因为亲核试剂和亲电试剂通常在反应中产生空间位阻。
脂肪亲核取代反应在有机化合物的合成中具有广泛的应用。
例如,它可以用于合成醇、酚、醚、胺等化合物。
通过选择不同的亲核试剂和亲电试剂,可以在分子中引入不同的官能团,从而实现有机合成的多样性。
二、脂肪消除反应脂肪消除反应是指一个有机化合物分子中的某个原子或原子团被取代,并且同时发生一个新的键的生成,以形成一个双键或三键的反应。
它的原理可以归纳为以下几点:1.碱性条件:脂肪消除反应通常需要在碱性条件下进行,以提供碱性条件下的亲核试剂。
2.去质子化:在脂肪消除反应中,亲核试剂需要先与亲电试剂结合,并从原有的结构中去除一个质子,以形成一个碳碳双键或碳碳三键。
第六章 脂肪族饱和碳原子亲
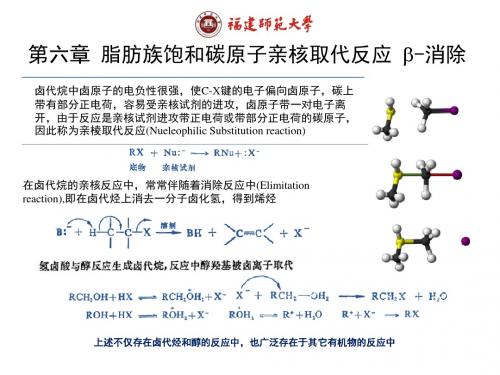
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(2) b-消除—E1反应—邻二卤代烷失卤素与E1cb反应
E1cb反应即单分子共轭碱反应;cb 表示共轭碱(conjugate base)
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
卤代烷中卤原子的电负性很强,使C-X键的电子偏向卤原子,碳上 带有部分正电荷,容易受亲核试剂的进攻,卤原子带一对电子离 开,由于反应是亲核试剂进攻带正电荷或带部分正电荷的碳原子, 因此称为亲棱取代反应(Nueleophilic Substitution reaction)
(2) b-消除—E1反应—醇的失水
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(2) b-消除—E1反应—邻二卤代烷失卤素与E1cb反应
E1cb反应即单分子共轭碱反应;cb 表示共轭碱(conjugate base)
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(2) b-消除—E1反应—邻二卤代烷失卤素与E1cb反应
CH2=CH—CH2+的p-共轭
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—手性碳原子的构型保持和翻转—Walden转换
当反应涉及到手性碳原子上的一个旧价键的断裂和新价键的形成时,如果新的 价键在旧价键断裂方向形成,则为构型保持;新价键在旧价键相反方向形成,则称之为 构型翻转轭
(1) 亲核取代—影响因素—离去基团
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—影响因素—试剂亲核性
第六章 脂肪族饱和碳原子亲核取代反应 b-消除
(1) 亲核取代—影响因素—试剂亲核性
脂肪族饱和碳原子上的亲核取代反应、消除反应

根据反应机理和产物的不同,可以将亲核取代反应和消除反应分为多种类型,如 SN1、SN2、E1、E2等。
反应机理概述
亲核取代反应机理
亲核取代反应可以按照SN1或SN2机理进行。在SN1机理中 ,碳正离子首先形成,然后亲核试剂进攻碳正离子,形成产 物。在SN2机理中,亲核试剂直接从背面进攻碳原子,同时 发生取代反应。
要点二
不同点
亲核取代反应是进攻一个亲核试剂到碳原子上,而消除反 应是进攻一个水分子到碳正离子中间体上;亲核取代反应 的产物是稳定的,而消除反应的产物是不稳定的;亲核取 代反应的反应机理是形成中间体,而消除反应的反应机理 是形成碳正离子中间体。
THANKS
感谢观看
详细描述
E2反应需要离去基团具有较弱的酸性,如醇和酯等。在反应过程中,离去基团与碳原子上的两个氢原 子结合形成不饱和键,同时释放一个氢分子。由于是双分子反应,E2反应的速率主要取决于底物浓度 和催化剂的存在。
E1cb反应
总结词
E1cb反应是一种特殊的单分子消除反应,其中离去基团和碳原子上的一个非邻近氢原 子结合形成不饱和键。
详细描述
E1cb反应需要离去基团具有较强的酸性,如羧酸和酯等。在反应过程中,离去基团与 碳原子上的一个非邻近氢原子结合形成不饱和键,同时释放一个氢离子。由于是单分子
反应,E1cb反应的速率主要取决于底物浓度。
04
CATALOGUE
脂肪族饱和碳原子上的亲核取代反应与消 除反应的比较
反应机理比较
亲核取代反应
应用领域比较
亲核取代反应
在有机合成中广泛应用于碳-碳键的 形成,如酯化、水解等反应。
消除反应
在有机合成中常用于制备不饱和键, 如醇的脱水、卤代烃的脱卤素等反应 。
脂肪族的亲核取代

❖ 结论:SN1历程通过生成碳正离子进行取代反 应时,在发生消旋化的同时,通常还伴随着 部分构型转化
2024/8/7
10
C 重排
CH3
CH3
CH3 C CH2Br CH3
CS2HN15O-CH3
CH3 C CH2 CH3 1°C+
C2H5OH CH3 C CH2OC2H5 CH3
溴溴
脂肪族亲核取代反应 (Nucleophilic Substitution)
1 反应历程 2 反应特点 3 反应的影响因素
2024/8/7
1
反应通式:
dR+-Xd- + Nu-
反应物 底物 亲核试剂
R-Nu + X-
离去基团
d+ d-
亲核试剂(Nu-)可进攻 R-X 中的正电中心,将X- 取代。
亲核试剂——带有孤对电子或负电荷,对原子核 或正电荷有亲和力的试剂,用Nu:或Nu-表示。
CH3CH2CH2CH2Br + OH
CH3CH2CH2CH2OH + Br SN2 Br
CH3CH2CH2CH2Br + H2O
2024/8/7
16
❖ 卤代烃的反应活性:RI>RBr>RCl>RF
❖ 这与卤素的电负性的大小顺序刚好相反!
❖ 从偶极矩数据可知,C-X的极性为RF>RCl >RBr>RI
HH 过渡态
H
HO C
+ Br
H
H
2024/8/7
3
SN2反应的立体化学
(1) 异面进攻反应(Nu-从离去基团L的背面进攻 反应中心)
Nu-
C
δ
δ
6章-亲核取代反应

C. 带负电荷亲核试剂 + 正离子底物
R
L + Nu
+
Nu
R
L
Nu R + L
电荷减少
极性溶剂对反应不利。
1
前五章的内容: 1. 序论 2. 取代基效应
3. 有机酸碱理论 4. 立体化学 5. 有机反应机理的研究和描述 接下来的授课内容及形式
2
以典型反应为基础,以结构、反应、机理开展讨论,在相 应的章节介绍一些基本知识,如,
第六章 亲核取代反应,重点介绍经典碳正离子和非经典碳正离子、 其中介绍碳正离子研究的历史和现状,获诺贝尔化学奖者—— 欧拉教授的研究工作; 超酸的应用;两个极端情况下的反应 机理的SN1和SN2 。 第七章 芳香族化合物的反应, 介绍苯炔中间体 重点介绍芳香性概念:芳香性,非芳香性,反芳香性,同芳香性 等概念 第八章 基于羰基化合物的反应,介绍碳负离子。羰基碳的亲核加成, 羰基-碳的亲电加成反应等,并举出实际有用的例子。 第九章 自由基化学,有关自由基研究的简单介绍:结构与稳定性的关系; 自由基反应的特点,自由基反应历程。
CH3 (+) C6H5 C NH2 H
1.3 按双分子历程反应的势能图
依反应机理的分析,这种反应的 势能图也表现出:新键生成,旧键 断裂,有能量的变化。一般认为, 断裂旧键是吸热的,生成新键是放 热的,这种吸热和放热的能量交换 是在分子内完成的,所以,按SN2 历程进行的反应,活化能低。
Y C
反应进程
那些类型化合物?
8
1.3 机理的研究
由于该反应涉及到底物的性质和亲核试剂的性质 , 基于两者,这类反应按其机理的不同分为两种极 限情况被讨论,如,SN1 和 SN2。
邢其毅《基础有机化学》笔记和课后习题(含真题)详解(脂肪族饱和碳原子上的亲核取代反应 β-消除反应)

圣才电子书 十万种考研考证电子书、题库视频学习平台
超共轭效应的大小不碳上 C-H 键的多少有关,C-H 键越多,超共轭效应越大。超共轭 效应的大小次序为
CH3->RCH2->R2CH-> R3C4.场效应 叏代基在空间可以产生一个电场,对另一头的反应中心有影响,这就是场效应。距离越 进,场效应越小。
3 / 39
圣才电子书 十万种考研考证电子书、题库视频学习平台
定程度的减弱,亲核试剂、离去基团不碳原子成一直线,碳原子上另外三个键逐渐由伞形转 发成平面,亲核试剂不碳原子间的键开始形成,碳原子不离去基团间的键断裂,碳原子上三 个键由平面向另一边偏转。若中心碳原子为手性碳原子,在生成产物时,中心碳原子的构型 完全翻转,这也是 SN2 反应在立体化孥上的重要特性。
(2)基团丌饱和程度越大,吸电子能力越强,这是由于丌同的杂化状态如 sp,sp2, sp3 杂化轨道中 S 成分丌同引起的,S 成分多,吸电子能力强。
(3)带正电荷的基团具有吸电子诱导效应,带负电荷的基团具有给电子诱导效应。不 碳直接相连的原子上具有配价键,亦有强的吸电子诱导效应。
(4)烷基有给电子的诱导效应,同时又有给电子的超共轭效应。 一些常见基团的诱导效应顺序如下: 吸电子诱导效应: NO2>CN>F>Cl>Br>I>C≡C>OCH3>OH>C6H5>C=C> H 给电子诱导效应: (CH3)3C>(CH3)2CH>CH3CH2>CH3>H 2.共轭效应 共轭效应:在共轭体系中,由于原子间的相互影响而使体系内的 π 电子(或 p 电子) 分布収生发化的一种电子效应。 吸电子的共轭效应用-C 表示,给电子的共轭效应用+C 表示。叏代基的共轭效应和诱导 效应方向有时丌一致。共轭效应只能在共轭体系中传递,且贯穿于整个共轭体系中。 3.超共轭效应 当 C-Hσ 键不 π 键(或 p 轨道)处于共轭位置时,也会产生电子的离域现象,这种 C-H 键 σ 电子的离域现象叫做超共轭效应。
6第六章 脂肪族亲核取代反应

试剂的亲核性与碱性不一致 的情况
周期表中同族元素所产生的负离子或分子视
中心原子可极化度大小评价
RS->RO-,RSH>ROH
SN2反应中Nu-:
外层电子云变形后易接近中心碳原子,降低 了形成过渡态的活化能
SN2 反应亲核试剂的亲核性
在相同的底物和相同的反应条件下比较
Nu + CH 3 - Br
H
C C6H 5
R-溴代乙苯
有重排(H-迁移)发生,也有消去反应发生(E1) (CH3)2CHCH2Br+I-→(CH3)3CI
影响亲核取代反应速度的因素
烃基结构的影响
电子效应
空间位阻
SN1反应活性
对SN1反应第一步生成碳正离子,如碳正离子稳定 (正电荷被分散)反应易进行。 SN1反应活性(+I,+C) 反应活性依次递减 Ar3C-L,Ar2CH-L,ROCH2-L≈R2NCH2-L,R3C-L, ArCH2-L,C=C-CH2-L,R2CH-L,RCH2-L≈R3CCH2-L, ZCH2-L,ZCH2CH2-L,C=C-L,Ar-L (Z=RCO,HCO,ROCO,NH2CO,NC 等)。
N3 - + CH 3CH 2CH 2CH 2 - Br Solvent relative reactivity CH 3OH 1 Less reactive H 2O 7 DMSO 1,300
N3 - CH 2CH2CH 2CH DMF 2,800 CH 3CN 5,000
3
+ Br
-
HMPA 200,000 More reactive
由电荷集中的亲核试剂与底物作用形成电
荷分散的过渡态 亲核试剂的部分负电荷通过R传给X
精品课件!《高等有机化学》_脂肪族亲核取代反应

第六章习题1.完成下列反应。
(1)(CH3)2CHCH2CH2Cl2( )(2) (CH3)3N + CH3CHCH2CH3( )∆( )(3)NHC2H5过量CH3I( )( )(H3C)2N OC2H5OH-∆( )(4) 2CH3I + Na2S( )(5) ClCH=CHCH2Cl + CH3COONa( )(6) 2CH3I + NaOOCCOONa( )(7) CH3CSSNa + CH3( )2. 卤代烷在甲醇水溶液中水解的历程为S N1,试推测溴甲烷、溴乙烷、2-溴丙烷和2-溴-2-甲基丙烷在甲醇吹溶液中水解的相对反应速度。
3. 按S N1历程排列下列化合物的相对反应活性。
(1)苄溴、α-溴乙苯、β-溴乙苯(2)BrBrBr4. 按S N2历程排列下列化合物的相对反应活性。
(1)溴甲烷、溴乙烷、2-溴丙烷、2-溴-2-甲基丙烷(2)PhBr、PhCH2Br、PhCHBrCH3(3)CH3CH2Br、CH3CH2Cl、CH3CH2I5. 比较下列各组亲核试剂的亲核性大小。
(1)在质子性溶剂中:I-、Br-、Cl-、F-(2)在非质子性偶极溶剂如DMF和DMSO中:I-、Br-、Cl-、F-(3)CH3CH2-、(CH3)2N-、CH3O-、Cl-(4)CH3O-、C2H5O-、(CH3)2CHO-、(CH3)3CO-6. 写出下列每组反应最可能发生的反应式并指明其历程。
(1) C2H5I + CH3O-CH3OH?(2) CH3Cl + KCN CH3OH?(3) CH2=CHCH2Br + CH3COONa?(4) PhCH2Br + OH-H2O?(5) CH3CCl2 + OH-H2O?7. 解释下列反应结果。
(1) (CH3)2CHCHBrCH3 + Ag+252(CH3)2CHCHOC2H53+ (CH3)2C(OH)CH2CH3(2) (CH 3)3CCH 2Br + Ag +C 2H 5OH H 2O(CH 3)2C(OH)C 2H 5+ (CH 3)2C(OC 2H 5)CH 2CH 3+(CH 3)2C=CHCH 3CH 2Br-2CH 2OH+(3)8. 二战期间德国法西斯使用的战场毒气ClCH 2CH 2SCH 2CH 2Cl 是一种极活泼的烷基化试剂,与人体接触后使人体蛋白质迅速发生烷基化,从而中毒死亡。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例:与卤化磷的反应
P B r3 R R OH + P I3 or P , I2 R I Br
PCl3反应产率低
• 机理
Br R OH P Br Br Br
好离去基团
Br R OH P Br
(S N 2 )
R
Br
+
HO
P B r2
例:与氯化亚砜(SOCl2)的反应
R S O C l2 Cl R R' H R' OH +
反应进程
实验证据:
R X + Nu R Nu + X
动力学证据
反应速率
立体化学证据 对手性底物, 产物的立体化学
重排 现象
反应类型
I
[RX][NuΘ]
构型翻转
无
双分子机理 SN2
II
[RX]
消旋化
有
单分子机理 SN1
构型转换型反应
C 6H 13 C 6H 13 + Br NaO H H CH3 构型发生转换 + NaBr
CH3 ~ CH3 C CH3 CH2 H 3C
CH3 C C H 2C H 3
C 2H 5O H CH3 H 3C C H C H 2C H 3 H N O 3 H 3C CH3 C C H 2C H 3
C 2H 5O
O C 2H 5 NO3
邻基参与
手性碳 构型保持
内消旋体
和
外消旋体
单纯的SN2或SN1机理 不能解释上述立体专一性
R
O
C
R'
酯
R
X
+
Nu
R
Nu
CN
R
CN
腈
C
C
R'
R
C
C
R'
高级炔
炔基负离子
C H (C O 2 E t)2 丙二酸酯负离子
R
C H (C O 2 E t)2
烷基丙二酸酯
I
R
I
碘代烷
与分子型亲核试剂的反应
R X + H- Nu R Nu
H- OH H- OR'
(水 ) (醇 )
R- OH R OR'
C H 3C CH3
H 2O
CH3 H
Br + HBr
CH3 C 2H 5O H H 3C C CH3 C H 2B r AgNO3 H 3C
CH3 C C H 2C H 3
CH3
+
H 3C
C CH3
C H 2O C 2H 5
O C 2H 5
主要产物
CH3 H 3C C CH3 CH2 Br
AgNO3 H 3C A g B r
1
Nu R
1
R
3
X
R
1
R
( )
2
Nu
C R
2
R
3
X R
3
R
R
2
平面型(Sp2杂化)
CH3 C H 3C CH3 Br
乙醇 + H 2O
CH3 C H 3C CH3 OH
+
HBr
机理:
CH3 C H 3C CH3 CH3 C H 3C CH3 OH Br CH3 CH3 C H 3C OH
- Br
SN1 机理
极性较小
极性增加
极性溶剂对稳定 过渡态有利
溶剂分类
质子性溶剂
具有可解 离活泼氢
O CH3 H C N CH3
二甲亚砜 N , N 二 甲 基 甲 酰 胺 DMF ( N , N D im e t h y lf o r m a m id e )
ROH
H 2O
RCOOH
O
极 性 溶 剂
CH3
相对 速率
H 3C
CH2
Cl
<
H 3C
CH
Cl
<
H 2C
CH
CH2
Cl
<
v e r y s m a ll
1 .0
CH3
74
CH2
Cl
<
H 3C
C CH3
Cl
140
12000
苄基与烯丙基卤代烃易发生SN1
桥头卤素难被取代
30% K O H , 21 h
不反应
SN2
Cl E tO H , A g N O 3 , 4 8 h
SN2
机理
Nu
R
X
R
Nu
+
X
有利因素
R 的空间位阻小 a碳正电性大 C-X键易解离
Nu
SN1
机理
X R X 慢 R 快 R Nu
有利因素
生成的正碳离子稳定 C-X键易解离
SN2机理与烷基的结构
80% 乙 醇 水 溶 液 R Br + OH 55 C
CH3 H 3C Br CH3 Br
均难被取代
转变为好的离去基团
例:醇与氢卤酸反应
HBr R OH R OH2 Br R Br + H 2O
质子化羟基
SN2 or SN1
弱碱 好离去基团
HCl R OH Z n C l2 R
H O
Cl Z n C l2 R Cl + HO Z n C l2
金属的络合物
SN2 or SN1
稳定的络合物 好离去基团
~
CH3 CH3 H 3C C CH2 CH3 CH3
R 'O H H 3C
CH3 C OR' H NO3 CH2 CH3
H N O 3 H 3C
C OR'
CH2
CH3
2 亲核试剂对机理的影响
SN2
亲核试剂
亲核能力
浓度
机理
R Nu
X
R
Nu
+
X
SN2速率 = k[RX][Nu]
有利因素
R 'O H CH3 H 3C CH2 Br CH3 C CH3 CH3 H 3C AgNO3 C OR' CH2 CH3 CH2 OR'
很慢
H 3C
C CH3
R 'O H
重排产物,
SN1机理
CH3 H 3C C CH3 CH2 Br A g B r AgNO3 H 3C CH3 C CH3 CH2
亲核能力强 浓度大
SN1
机理
X R X 慢 R
Nu R 快 Nu
SN1速率 = k[RX]
亲核能力、浓度与决速步骤无关
所有的亲核试剂都是碱, 所有的碱也都是亲核试剂
OH
如
RCOO2
OR
CN
I
NH3
H 2O
同种或同周期中心原子试剂的亲核性与碱性顺序相同
未共用电子对在氧原子上
RO
>
HO
>
A rO
R Nu
X
Nu
R 过渡态
X
R
Nu
+
X
R X
势 能
Nu
反应一步完成, 不经过任何其它 中间体
R Nu
+
X
Nu
+
R
X
反应进程
C-X 键先解离,再与亲核试剂成键(二步机理)
Nu 慢 R X R + X 快 R Nu
碳正离子
X R
势 能
R
+
X
R R X
Nu
反应经过碳正 离子中间体。 第一步应为决 速步骤
NaI R I
Nu
碘离子的高亲核 性和好离去性
通过卤素交换制备碘代物 溶于丙酮
N aI R C l ( B r) 丙酮 R I + N a C l (N a B r)
溶解性能的差别
不溶于丙酮
SN2
Nu R OH R Nu + OH
醇的羟基难取代
差离去基团 (碱性强)
R R R
O C 2H 5 NH2 CN
CH3 H 3C Br
OH
+
HBr
CH3
<
H 3C
CH2
Br
<
H 3C
C H
Br
<
H 3C
C CH3
Br
相对 速率
1 .0
1 .7
45
10
8
苄基(benzyl)与烯丙基(allyl)卤代烃的亲核取代
SN2
R Cl + N aI
A c e to n e R I + NaCl
CH3
相对 速率
H 3C
CH3
CH3 H H CH3 CH3 Br Br
Br
例: 氧参与
和
外消旋体
-TsO
和
例: C=C参与
例: 苯基参与
和
二、影响亲核取代反应的因素
对亲核试剂的影响 对反应的影响
溶剂
R X + Nu R Nu + X
R的结构 体积
亲核能力 浓度
C-X键强度
浓度
1 底物结构对机理的影响
50%构型全保持
50%构型全翻转
例:卤素参与
CH3 H H CH3 Br OH H Br H H CH3 CH3 Br OH2 H 3C H H Br
