14第十四章氮族元素
合集下载
无机化学课件氮族元素

(iii) 王水的氧化性:浓HNO3:浓HCl为3:1 叫做 王水,它的氧化性比硝酸更强,可溶解金、铂等不活 泼金属(实际上是多种氧化剂+配位剂Clˉ在起作用)
D.硝化反应—— 与有机化合物发生反应,生成 硝基化合物(RNO2).
硝酸盐NO3ˉ: (i) 结构: 正三角形,sp2杂化,有个大π36键
盐溶液显酸性(水解) 与碱溶液的反应:
NH4+ + OH- == NH3 + H2O
(iii) NH4+ 的鉴别: A. 若NH4+量多,可用加强碱加热,用湿润的蓝 色石蕊试纸(变兰)检验气体;
B. 若NH4+量少,加Nessler试剂(K2[HgI4]的KOH 溶液)检验(通常为红棕色)
NH4+ + [HgI4]2- + OH-
白磷、红磷的物理性质
白磷
红磷
色、态
白色蜡状
红棕色粉末
溶解性 毒性
着火点
不溶于水,溶于CS2 剧毒
40℃ , 易自燃
不溶于水和CS2 无毒 240℃
保存 用途 分子结构
相互转化
密封,保存于冷水中
密封,防止吸湿
制高纯度磷酸
制安全火柴、火药
P4 正四面体 键角60°
结构复杂
白磷
隔绝空气加热到260℃ 红磷
氨气的化学性质:
可发生三类反应:
A. 加合反应:NH3作为一种典型的Lewis碱,可与许多 金属离子(如Ag+、Cu2+、Co3+、Ni2+)形成配合物;与某些盐 晶体加合(如8NH3+CaCl2 → CaCl2·8NH3 )
B. 取代反应:NH3中的氢可被活泼的金属取代生成氨 基化合物(-NH2)和氢气。
第14章 氮族元素
神奇的一氧化氮 —— “两面人”
我们知道汽车尾气中的 NO 会造成大气的公害。大气中的 氧可将NO 氧化为 NO2,但在低浓度条件下的氧化速率极慢。 这使得某些大都市上空的 “光化学烟雾” 长期弥漫,NO 是造 成光化学烟雾的祸首。 “ 天不转地在转 ” ,这个祸首当今竟成 了 “明星”。科学家发现NO可以令血管放松和扩阔,帮助血液 流通;美国 Pfizer 药厂利用这个发现,生产出 Viagra 。 NO 气 体还具有治疗哮喘和关节炎,抵御肿瘤,杀死感性细菌、真 菌和寄生虫的能力。三位美国药理学家由于发现NO的药理作 用而获得1998年诺贝尔医学奖。
28
水解:
δ-
. .
NF3 NCl3 sp3杂化,三角锥形
N F F F
NCl3 + 3H2O = NH3+ 3HClO Cl 原因有二:
·· N
δ+
Cl
Cl
NCl3: NH3 + 3Cl2 = NCl3 + 3HCl 在90℃,爆炸分解: NCl3 = 1/2N2 + 3/2Cl2
△rHmӨ = -295.5 kJ·mol-1
第14章 氮族元素
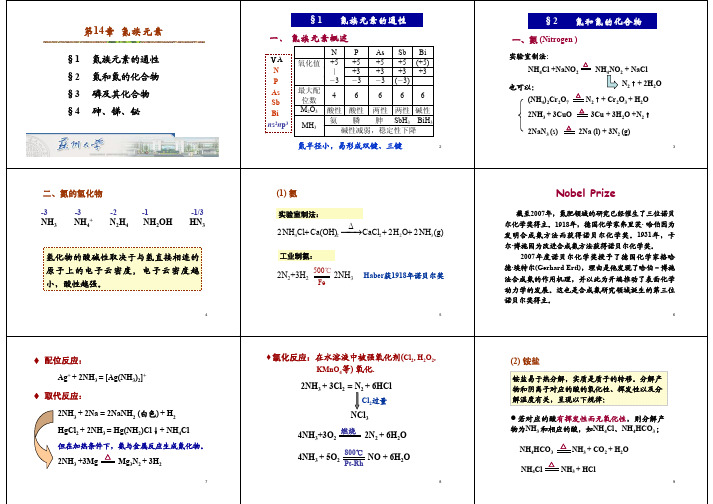
§1 §2 §3 §4 氮族元素的通性 氮和氮的化合物 磷及其化合物 砷、锑、铋
§1
N +5 | -3
氮族元素的通性
P +5 +3 -3 As +5 +3 -3 Sb Bi +5 (+5) +3 +3 (-3)
§2
氮和氮的化合物
一、 氮族元素概述
ⅤA N P As Sb Bi ns2np3
8
♦ 取代反应:
2NH3 + 2Na = 2NaNH2 (白色) + H2 HgCl2 + 2NH3 = Hg(NH2)Cl↓+ NH4Cl
14氮族元素

2、PH3 P2H4(不稳定) Ca3P2+H2O→PH3+Ca(OH)2 P4(g)+H2→4PH3 3、含氧酸 ① H3PO2 一元酸 ② H3PO3 二元酸 P4O6+H2O→H3PO3 P+Br2+H2O→H3PO3+ HBr PCl3+H2O→H3PO3 + HCl
H3PO4 2H3PO4﹣H2O→H4P2O7 焦磷酸 3H3PO4 ﹣2H2O→H5P3H10 三磷酸 4H3PO4﹣4H2O→(HPO3)4 四偏磷酸 注:磷酸正盐,常难溶;二氢盐,常可溶。 检验:H3PO4+Ag+→Ag3PO4↓(黄) H4P2O7+Ag+→Ag4P2O7↓(白) 4、磷卤化物:PCl3、PCl5、 POCl3 易水解,注意NCl3的水解,NF3 呢?
3.氧化物及其水合物酸碱性
_______________碱 Bi2O3 ∣As2O3(砒霜) Sb2O3 ∣两性偏酸 中、碱性 碱性 ↓ As2O5 Sb2O5 (Bi2O5) 酸
均难溶于水: Sb(OH)3 Bi(OH)3 (碱性) H3AsO3 ↓HCl↓OH﹣ ↓HCl ↓OH﹣ ↓HNO3 AsCl3 AsO33﹣ SbCl3 Sb(OH)4﹣ Bi(NO3)3
AsH3(剧毒) SbH3 (BiH3)
Na3As+3H2O→AsH3+3NaOH As2O3+6Zn+6H2SO4→2AsH3+6ZnSO4+3H2O 2AsH3+12AgNO3+3H2O→12Ag↓+As2O3+12HNO3 (古氏试砷法,可检出0.005mgAs2O3) 2AsH3→2As(砷镜)+3H2(绝O2 加热)——马氏 试砷法 SbH3(锑镜)类似 但:2As+5NaClO+3H2O→2H3AsO4+5NaCl Sb则不溶解
【优】高中化学氮族元素PPT资料

条件 氢化物的稳定
性
*与同周期氧族,卤族元素相比较:
5、某元素R原子的最外层上有5个电子,它的含氧酸的钾盐的化学式不可能是( )
N、O、F 三元素性质比较。 三、有关氮氧化物的计算
磷是生物体不可缺少的元素之一。
练习1:用大试管收集满NO2气体,倒扣在盛水的水槽中,不久看到红棕色消失,试管里水面上升到容积的_______处,再往试管里通
④最高价含氧酸的酸性减弱:
氢化物的稳定 注意: 的酸酐是 ,而不是 NO2
N表现-3,+1→+5价。
性
分解温度: 800°C
分解温度 1000°C
不分解
P、S、Cl三元素性质比较。
第三周期元素
P
S
Cl
氢化物分子式
PH3
H2S
HCl
氢化物的生成 条件
磷蒸气和 H2 能 硫蒸气和 H2 能
反应生成 PH3,反应生成 H2S,
3、砷、锑、铋在地壳中的含量不大,它们可以以游离态存在 自然界中,但主要以硫化物矿存在。例如:雄黄(As4S4)雌黄
(As2S3)辉锑矿(Sb2S3)辉铋矿(Bi2S3)。
很难
加热
光照,点燃
氢化物的稳定 很不稳定,易
性
分解
加热至高温 加热能分解 ( 3000°C 以
上)少许分解
最高价含氧酸 的酸性
H3PO4 中强酸
H2SO4 强酸
HClO4 最强酸
小结:
2、磷在自然界中总是以磷酸盐的形式出现的,例:Ca3(PO4)2——磷酸钙,Ca5F(PO4)3——磷灰石。
①非金属性较氧族、卤族元素弱; 在植物体中磷主要含于种子的蛋白质中,在动物体中,则含于脑、血液和神经组织的蛋白质中,骨骼中也含有磷。
性
*与同周期氧族,卤族元素相比较:
5、某元素R原子的最外层上有5个电子,它的含氧酸的钾盐的化学式不可能是( )
N、O、F 三元素性质比较。 三、有关氮氧化物的计算
磷是生物体不可缺少的元素之一。
练习1:用大试管收集满NO2气体,倒扣在盛水的水槽中,不久看到红棕色消失,试管里水面上升到容积的_______处,再往试管里通
④最高价含氧酸的酸性减弱:
氢化物的稳定 注意: 的酸酐是 ,而不是 NO2
N表现-3,+1→+5价。
性
分解温度: 800°C
分解温度 1000°C
不分解
P、S、Cl三元素性质比较。
第三周期元素
P
S
Cl
氢化物分子式
PH3
H2S
HCl
氢化物的生成 条件
磷蒸气和 H2 能 硫蒸气和 H2 能
反应生成 PH3,反应生成 H2S,
3、砷、锑、铋在地壳中的含量不大,它们可以以游离态存在 自然界中,但主要以硫化物矿存在。例如:雄黄(As4S4)雌黄
(As2S3)辉锑矿(Sb2S3)辉铋矿(Bi2S3)。
很难
加热
光照,点燃
氢化物的稳定 很不稳定,易
性
分解
加热至高温 加热能分解 ( 3000°C 以
上)少许分解
最高价含氧酸 的酸性
H3PO4 中强酸
H2SO4 强酸
HClO4 最强酸
小结:
2、磷在自然界中总是以磷酸盐的形式出现的,例:Ca3(PO4)2——磷酸钙,Ca5F(PO4)3——磷灰石。
①非金属性较氧族、卤族元素弱; 在植物体中磷主要含于种子的蛋白质中,在动物体中,则含于脑、血液和神经组织的蛋白质中,骨骼中也含有磷。
氮族元素氮气及固氮

无色气体 -195.8℃ ℃ 无色液体 -209.9℃ ℃
如何收集 氮气? 氮气?
雪花状固体
自然界中含有大量的氮元 但占空气体积78% 素,但占空气体积78%的氮气 却不能被大多数植物直接利用。 却不能被大多数植物直接利用。 这是什么原因呢? 这是什么原因
原子结构示意图 原子的电子式 分子的电子式 分子的结构式 键能
生物固氮: 生物固氮:
N2
NH3
自然界中的氮循环
大气中的N 大气中的N2
尿素及动 植物遗体 土壤中的微生物
NO3NH3
NO3-
氮素化肥
作业
1、练习册P11 5.4(一) 练习册P11 5.4( 走进新课程》P272、《走进新课程》P27-29
氮族元素
氮族元素
第VA族:氮7N、磷15P、砷33As、锑51Sb、铋83Bi 族 、 、 、 、
氮是植物体内蛋白质, 氮是植物体内蛋白质,叶绿素的重要组成元素
书P20
氮肥的种类
铵态氮肥:常用的有NH4HCO3、NH4NO3 铵态氮肥:常用的有 硝态氮肥:常用的有KNO3、NH4NO3 氮肥 硝态氮肥:常用的有 、 有机氮肥:主要有尿素[ 有机氮肥:主要有尿素[CO(NH2)2]
氮肥的功用
充足的氮肥能使农作物枝叶茂盛,叶片增大, 充足的氮肥能使农作物枝叶茂盛,叶片增大,促 的形成, 光合作用, 叶绿素的形成 从而有利于光合作用 进叶绿素的形成,从而有利于光合作用,提高农作物 产量和质量。 的产量和质量。
1.相似性: .相似性:
(1) 最外层均为 个电子,能结合 个电子达到稳定 最外层均为5个电子 能结合3个电子达到稳定 个电子, (2)最高价氧化物通式:R2O5 最高价氧化物通式: 最高价氧化物通式 (3)氢化物:RH3 氢化物: 氢化物 (Sb、Bi金属无负价 、 金属无负价 金属无负价) (4)最高从价氧化物对应水化物:H3RO4、HRO3 最高从价氧化物对应水化物: 最高从价氧化物对应水化物 (5) 主要化合价: 氮-3、+1、+2、+3、+4、+5 主要化合价: 、 、 、 、 、 磷和砷:- :-3、 、 锑和铋: 、 磷和砷:- 、+3、+5 锑和铋:+3、+5
如何收集 氮气? 氮气?
雪花状固体
自然界中含有大量的氮元 但占空气体积78% 素,但占空气体积78%的氮气 却不能被大多数植物直接利用。 却不能被大多数植物直接利用。 这是什么原因呢? 这是什么原因
原子结构示意图 原子的电子式 分子的电子式 分子的结构式 键能
生物固氮: 生物固氮:
N2
NH3
自然界中的氮循环
大气中的N 大气中的N2
尿素及动 植物遗体 土壤中的微生物
NO3NH3
NO3-
氮素化肥
作业
1、练习册P11 5.4(一) 练习册P11 5.4( 走进新课程》P272、《走进新课程》P27-29
氮族元素
氮族元素
第VA族:氮7N、磷15P、砷33As、锑51Sb、铋83Bi 族 、 、 、 、
氮是植物体内蛋白质, 氮是植物体内蛋白质,叶绿素的重要组成元素
书P20
氮肥的种类
铵态氮肥:常用的有NH4HCO3、NH4NO3 铵态氮肥:常用的有 硝态氮肥:常用的有KNO3、NH4NO3 氮肥 硝态氮肥:常用的有 、 有机氮肥:主要有尿素[ 有机氮肥:主要有尿素[CO(NH2)2]
氮肥的功用
充足的氮肥能使农作物枝叶茂盛,叶片增大, 充足的氮肥能使农作物枝叶茂盛,叶片增大,促 的形成, 光合作用, 叶绿素的形成 从而有利于光合作用 进叶绿素的形成,从而有利于光合作用,提高农作物 产量和质量。 的产量和质量。
1.相似性: .相似性:
(1) 最外层均为 个电子,能结合 个电子达到稳定 最外层均为5个电子 能结合3个电子达到稳定 个电子, (2)最高价氧化物通式:R2O5 最高价氧化物通式: 最高价氧化物通式 (3)氢化物:RH3 氢化物: 氢化物 (Sb、Bi金属无负价 、 金属无负价 金属无负价) (4)最高从价氧化物对应水化物:H3RO4、HRO3 最高从价氧化物对应水化物: 最高从价氧化物对应水化物 (5) 主要化合价: 氮-3、+1、+2、+3、+4、+5 主要化合价: 、 、 、 、 、 磷和砷:- :-3、 、 锑和铋: 、 磷和砷:- 、+3、+5 锑和铋:+3、+5
14 无机化学 第十四章 氮族元素

ns2 np3
1、最高氧化态为+5价。
其中,Bi(V)不稳定,是强氧化剂
2、基态原子都有半充满的p轨道,与同周期 前后的元素相比,有较大的电离能数据。
除氮外,其它元素的电负性都不太大。因此,本
族元素易和电负性较大的元素形成共价型的化合
物。如: NF3、PCl5、AsF5、SbF5 。
3、最低氧化态为-3价。
:
H
下列化合物热稳定性最高的是(
(A)NaN3 (B)AgN3 (C) Pb(N3)2
)。
(D)Ba(N3)2
用何种原理 来解释?
制备
NaN3+H2SO4===HN3+NaHSO4 N2H4+HNO2===2H2O+HN3
比较HN3、N2H4、 NH2OH的酸碱 性、还原性、 稳定性的大小?
根据HN3有弱酸性,可用强酸和对应的盐制备:
从而降低了弱酸与强酸之间 强度差异,称NH3为强、弱酸 的拉平溶剂。
Na+ +xNH3
e- + yNH3
e(NH3)y-
碱金属可以溶解在液氨中, 并呈现特征颜色
化 (1)还原性: 学 4NH3 + 3O2 (纯氧) === 2N2+6H2O 4NH3 + 5O2 === 4NO + 6H2O 性 2NH3 + 3CuO === 3Cu + N2 + 3H2O 质
由于NH4+与K+(或Rb+)的电荷相等,半径相近,因 此同类型的K+盐(或Rb+盐)与NH4+盐性质相似。
例如: KCl 、 NH4Cl 、 K2SO4 、 (NH4)2SO4 应该具有差不多 的晶格能。
第十四章氮族元素

第十四章氮族元素§本章摘要§1.氮和氮的化合物单质氮的氢化物氮的含氧化合物2.磷和磷的化合物单质磷的氢化物磷的含氧化合物磷的卤化物和硫化物3.砷、锑、铋单质砷锑铋的氢化物砷、锑、铋的氧化物及其水合物砷、锑、铋的三卤化物砷、锑、铋的硫化物3B: 杂化,与2也是一种拟卤离子。
反应类似于卤除浅黄色的一般易溶。
盐,生成沉淀物。
但以氧化性为主,N 不等性杂化,大键中电亚硝酸的分子结构阳离子离子电场较弱一个电子形成第十四章氮族元素§本章摘要§1.氮和氮的化合物单质氮的氢化物氮的含氧化合物2.磷和磷的化合物单质磷的氢化物磷的含氧化合物磷的卤化物和硫化物3.砷、锑、铋单质砷锑铋的氢化物砷、锑、铋的氧化物及其水合物砷、锑、铋的三卤化物砷、锑、铋的硫化物: 由于动力学原因,这种歧化只有在碱中才能成为现实。
PH轨道相互成键,+2°氧化物的性质离子形成可溶性配合物所以分析中常用做为的掩蔽剂D)缩合性链聚多磷酸的通式B)、Array B) 歧化反应的鸡蛋清溶液,使蛋白溶按顺序X第十四章 氮族元素§本章摘要§ 1.氮和氮的化合物单质 氮的氢化物 氮的含氧化合物 2.磷和磷的化合物单质 磷的氢化物 磷的含氧化合物 磷的卤化物和硫化物3.砷、锑、铋单质 砷锑铋的氢化物 砷、锑、铋的氧化物及其水合物 砷、锑、铋的三卤化物 砷、锑、铋的硫化物可与F 2反应有五价化合物生成。
,在碱性介质中而在强酸中,即] =1时,可以氧化,在酸介质中却弱酸,碱性比,若用浓盐酸抑制水解,体系中会有存在,但用水解,溶液中也不会有。
则要在浓盐酸中通入只有在浓盐酸中才会有存在,通入H无.。
氮族元素

(3)强氧化性、 ①与金属反应(除Au、Pt外,大部分金属能与硝 酸反应) a.Cu与浓、稀硝酸均能反应,其反应方程式分别为: 。 b.铁、铝遇冷的浓硝酸能发生钝化,原因是故可用铁、铝容器运输冷的浓硝酸。 ②与非金属的反应 碳、硫、磷与浓硝酸反应的化学方程式分别为: 。
二、氮气 1.分子结构 电子式为
,结构式为 , 氮氮三键很牢固。 2.化学性质 (1)与H2的反应:N2+3H2 2NH3 (2)与O2的反应: 。 (3)与Mg的反应: Mg3N2与H2O反应的化学方程式为: Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑。
3.氮的氧化物 (1)氮的五种正价能生成六种氧化物,它们均有 毒,能污染空气。其中属于酸酐的有亚硝酸 酐: N2O3 ,硝酸酐: N2O5 。 (2)NO是无色、难溶于水的 气 体,在常温下 它很容易与空气中的O2化合,生成红棕色、刺激 性气味的有毒的NO2,反应方程式为 ,NO与O2 不能 (填“能”或“不能”)共存。 实验室常用 Cu 和 稀硝酸 反应制取NO,反应方程 式为 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O , 排水集气 收集方法为 。 工业上用氨氧化法制取NO。
一、氨 1.分子结构 电子式: ,结构式: ,三角锥形, 极性 分子 2.物理性质 无色,有 刺激性 气味的气体,比空气轻, 易 液化, 700 极易溶于水(1: )。
3.化学性质 氨水呈碱性,密度 小于 3 1g/cm NH3+H2O NH3•H2O NH4++ OH– NH3+HCl→ (白烟,可用于检验) NH3+HNO3→ (用于制造氮肥、炸药) 2NH3+H2SO4=(NH4)2SO4 (肥田粉) NH3+O2→ + H2O(工业制硝酸) NH3+Cl2→N2+NH4Cl(产生白烟,可用于检验Cl2) NH3 +Al3++ H2O→ + NH4+ 4.用途:制氮肥、硝酸、铵盐、纯碱、化纤,作制 冷剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验室法:
NH4Cl+NaNO2 = NaCl+N2↑+ 2H2O 除O2,使气体通过炽热的铜丝; 除NH3,使气体通过浓硫酸洗涤; 除H2O,使气体通过碱石灰干燥剂。
其它反应:
(NH4)2Cr2O7(s) = N2↑+ Cr2O3 + 4H2O
8NH3 + 3Br2(aq) = N2↑+ 6NH4Br T2、写出NH4Cl、 (NH4)2SO4、 (NH4)3PO4和NH4NO3热分解
中心N原子sp杂化
N原子sp2杂化
2个N原子sp2杂化
2个N原子sp2杂化
2020/4/22
2个N原子sp2杂化
固体为NO2+·NO3-
7
T7. 什么棕色环反应,其用途是什么?
NO+FeSO4=Fe(NO)SO4(棕色)
硫酸亚硝酰合铁(Ⅱ)
检验NO3-
T8、饱和NaNO2 与稀H2SO4反应时,一开始显淡蓝色然后 又消失,为什么?
液氨溶解活泼金属生成蓝色溶液: Na →Na+ + e- Na+ + xNH3= Na(NH3)x+ e- + yNH3 = (NH3)y- (蓝色) 该溶液能导电,较稳定,有强还原性,蒸干得到原来的碱金 属,放置产生氢气。金属液氨溶液的特性是含“氨合电子”。
T4、分别写出Mg3N2和 Li3N的水解反应式。(思考) 2-5 氮的含氧化物(P659)
反应式。(P654)
2020/4/22
4
T3、写出NH3、N2H4(l)、NH2OH(s)和HN3(s)的结构 式;指出N原子的杂化方式;比较碱性的大小,并说明碱 性大小原因。(P655-659)
12
3
∶N=N≡N∶
N3-
H
有1个π43
有2个π
4 3
顺式联氨(肼) N以sp3杂化
羟氨 N以sp3杂化
T5、写出NO的MO式,说明键级,比较NO与N2的稳定性。
NO[KK(σ2s)2 (σ*2s)2 (σ2px)2 (π2py)2 (π2pz)2 (π*2py)1]
有1个3电子键,键级=2. 5,比N2活泼。
2020/4/22
6
T6、画出N2O、NO2、N2O4、N2O3和N2O5 的结构式,指出N 原子杂化方式和分子中大键情况。 (p660,表14-5)
T14.说明为什么Au、Pt易溶于王水,写出反应方程式(P667-) Au + HNO3 + 3HCl =AuCl3 + NO↑ + 2H2O
➢ 形成一个共价叁键,C≡N-;N3-中间的 N原子以sp杂化;
➢ 氮的氧化物大多形成不定域大π键;
➢ NO2-、NO3- 、HNO3有大π键。 3. 配位键:Cu(NH3)42+、[Os(NH3)5(N2)]2+、Pt(NH3)2(N2H4)2 2+ 2-2 氮元素的氧化态-吉布斯自由能图 (P644)
As 4s24p3
-3, +3, +5
共价半径/pm
75
110
122
M3-离子半径/pm
171
212
222
M3+离子半径/pm
M5+离子半径/pm
11
电负性(Pauling) 3.04
69
34
47
2.19
2.18
锑 Sb 5s25p3
+3, +5 143 245 92 62 2.05
铋 Bi 6s26p3
有1个π43
2020/4/22
8
T11.画出HNO3 和NO3- 结构式,说明大π键情况。
H O -------氢键--------
O
N
4 3
O
6 4
N以sp2杂化
T12.写出Zn( 或Fe)与HNO3的反应式。
Zn +4HNO3(浓)=Zn(NO3)2 +2NO2+2H2 O
3Zn + 8HNO3(稀1:2)=3Zn(NO3)2+2NO+4H2O 4Zn +10HNO3(热、稀)= 4Zn(NO3)2+N2O+5H2O
2HNO2(冷)= N2O3 (蓝)+ H2O N2O3=NO2+NO
T9、分别写出NaNO2与MnO4-、I-、Cl2、Ag+ 的反应方程式。 (p663)
T10.画出NO2+、NO2和NO2- 的结构,说明N的杂化方式。(p663)
NO2+ 直线形
有2个π43
NO2 V形 有1个π33
NO2V形
+3, +5 152
108 74 2.02
2020/4/22
2
§14-2 氮和它的化合物
2-1 氮的成键特征(P641) 1. 离子键:如Mg 3N2,Li3N等。 2. 共价键:
➢ 三个共价单键,如NH3、NCl3, N以sp3杂化;
➢ 一个共价单键和一个共价双键,如Cl-N=O,N以sp2杂化;
4Zn +10HNO3(稀1:10)= 4Zn(NO3)2+NH4NO3+3H2O (气室法检验NH4+)
2020/4/22
9
T13.分别写出NaNO3、Pb(NO3)2和AgNO3的热分解反应 式,用离子极化理论说明产物不同的原因。(p668-669) 离子极化能力:Ag+>Pb2+>Na+ 产物的稳定态: Ag 、PbO、 NaNO2
N2和 NH4+是热力学稳定状态; 0~+5之间的氧化态易发生歧化。
2020/4/22
3
2-3 氮在自然界中的分布和单质氮(P644)
T1、实验室中怎样制备N2 ,怎样除去其中的O2、H2O、 NH3 杂质?(P646—647)
N2[KK(2s)2(*2s)2(2py)2(2pz)2(2p)2] N2的键能941. 69kJ·mol-1,是最稳定的双原子分子
§14-1 氮族元素的通性 §14-2 氮和它的化合物 §14-3 磷和它的化合物 §14-4 砷、锑、铋 §14-5 盐类的热分解
重点掌握
2020/4/22
1
§14-1 氮族元素的通性
表14-1 氮族元素的性质
氮
磷
砷
元素符号 价电子构型 主要氧化数
N
P
2s22p3
3s23p3
-3, -2, -1, -3, +1……+ 5 +1,+3, +5
氢叠氮酸 1是sp2,2是sp杂化
氨的衍生物: NH3 N的氧化数: -3
N2H4 -2
NH2OH -1
HN3 -1/3
Kθ: 10-5
10-6
10-9
质子酸
与氢相连的N原子电子云密度小,酸性强、碱性弱。
2020/4/22
5
氨的衍生物制备方法:
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑+ 2H2O 2NH3 + ClO- = N2H4 + Cl- + H2O 在催化剂作用下,H2还原NO2得到NH2OH(s)
NH4Cl+NaNO2 = NaCl+N2↑+ 2H2O 除O2,使气体通过炽热的铜丝; 除NH3,使气体通过浓硫酸洗涤; 除H2O,使气体通过碱石灰干燥剂。
其它反应:
(NH4)2Cr2O7(s) = N2↑+ Cr2O3 + 4H2O
8NH3 + 3Br2(aq) = N2↑+ 6NH4Br T2、写出NH4Cl、 (NH4)2SO4、 (NH4)3PO4和NH4NO3热分解
中心N原子sp杂化
N原子sp2杂化
2个N原子sp2杂化
2个N原子sp2杂化
2020/4/22
2个N原子sp2杂化
固体为NO2+·NO3-
7
T7. 什么棕色环反应,其用途是什么?
NO+FeSO4=Fe(NO)SO4(棕色)
硫酸亚硝酰合铁(Ⅱ)
检验NO3-
T8、饱和NaNO2 与稀H2SO4反应时,一开始显淡蓝色然后 又消失,为什么?
液氨溶解活泼金属生成蓝色溶液: Na →Na+ + e- Na+ + xNH3= Na(NH3)x+ e- + yNH3 = (NH3)y- (蓝色) 该溶液能导电,较稳定,有强还原性,蒸干得到原来的碱金 属,放置产生氢气。金属液氨溶液的特性是含“氨合电子”。
T4、分别写出Mg3N2和 Li3N的水解反应式。(思考) 2-5 氮的含氧化物(P659)
反应式。(P654)
2020/4/22
4
T3、写出NH3、N2H4(l)、NH2OH(s)和HN3(s)的结构 式;指出N原子的杂化方式;比较碱性的大小,并说明碱 性大小原因。(P655-659)
12
3
∶N=N≡N∶
N3-
H
有1个π43
有2个π
4 3
顺式联氨(肼) N以sp3杂化
羟氨 N以sp3杂化
T5、写出NO的MO式,说明键级,比较NO与N2的稳定性。
NO[KK(σ2s)2 (σ*2s)2 (σ2px)2 (π2py)2 (π2pz)2 (π*2py)1]
有1个3电子键,键级=2. 5,比N2活泼。
2020/4/22
6
T6、画出N2O、NO2、N2O4、N2O3和N2O5 的结构式,指出N 原子杂化方式和分子中大键情况。 (p660,表14-5)
T14.说明为什么Au、Pt易溶于王水,写出反应方程式(P667-) Au + HNO3 + 3HCl =AuCl3 + NO↑ + 2H2O
➢ 形成一个共价叁键,C≡N-;N3-中间的 N原子以sp杂化;
➢ 氮的氧化物大多形成不定域大π键;
➢ NO2-、NO3- 、HNO3有大π键。 3. 配位键:Cu(NH3)42+、[Os(NH3)5(N2)]2+、Pt(NH3)2(N2H4)2 2+ 2-2 氮元素的氧化态-吉布斯自由能图 (P644)
As 4s24p3
-3, +3, +5
共价半径/pm
75
110
122
M3-离子半径/pm
171
212
222
M3+离子半径/pm
M5+离子半径/pm
11
电负性(Pauling) 3.04
69
34
47
2.19
2.18
锑 Sb 5s25p3
+3, +5 143 245 92 62 2.05
铋 Bi 6s26p3
有1个π43
2020/4/22
8
T11.画出HNO3 和NO3- 结构式,说明大π键情况。
H O -------氢键--------
O
N
4 3
O
6 4
N以sp2杂化
T12.写出Zn( 或Fe)与HNO3的反应式。
Zn +4HNO3(浓)=Zn(NO3)2 +2NO2+2H2 O
3Zn + 8HNO3(稀1:2)=3Zn(NO3)2+2NO+4H2O 4Zn +10HNO3(热、稀)= 4Zn(NO3)2+N2O+5H2O
2HNO2(冷)= N2O3 (蓝)+ H2O N2O3=NO2+NO
T9、分别写出NaNO2与MnO4-、I-、Cl2、Ag+ 的反应方程式。 (p663)
T10.画出NO2+、NO2和NO2- 的结构,说明N的杂化方式。(p663)
NO2+ 直线形
有2个π43
NO2 V形 有1个π33
NO2V形
+3, +5 152
108 74 2.02
2020/4/22
2
§14-2 氮和它的化合物
2-1 氮的成键特征(P641) 1. 离子键:如Mg 3N2,Li3N等。 2. 共价键:
➢ 三个共价单键,如NH3、NCl3, N以sp3杂化;
➢ 一个共价单键和一个共价双键,如Cl-N=O,N以sp2杂化;
4Zn +10HNO3(稀1:10)= 4Zn(NO3)2+NH4NO3+3H2O (气室法检验NH4+)
2020/4/22
9
T13.分别写出NaNO3、Pb(NO3)2和AgNO3的热分解反应 式,用离子极化理论说明产物不同的原因。(p668-669) 离子极化能力:Ag+>Pb2+>Na+ 产物的稳定态: Ag 、PbO、 NaNO2
N2和 NH4+是热力学稳定状态; 0~+5之间的氧化态易发生歧化。
2020/4/22
3
2-3 氮在自然界中的分布和单质氮(P644)
T1、实验室中怎样制备N2 ,怎样除去其中的O2、H2O、 NH3 杂质?(P646—647)
N2[KK(2s)2(*2s)2(2py)2(2pz)2(2p)2] N2的键能941. 69kJ·mol-1,是最稳定的双原子分子
§14-1 氮族元素的通性 §14-2 氮和它的化合物 §14-3 磷和它的化合物 §14-4 砷、锑、铋 §14-5 盐类的热分解
重点掌握
2020/4/22
1
§14-1 氮族元素的通性
表14-1 氮族元素的性质
氮
磷
砷
元素符号 价电子构型 主要氧化数
N
P
2s22p3
3s23p3
-3, -2, -1, -3, +1……+ 5 +1,+3, +5
氢叠氮酸 1是sp2,2是sp杂化
氨的衍生物: NH3 N的氧化数: -3
N2H4 -2
NH2OH -1
HN3 -1/3
Kθ: 10-5
10-6
10-9
质子酸
与氢相连的N原子电子云密度小,酸性强、碱性弱。
2020/4/22
5
氨的衍生物制备方法:
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑+ 2H2O 2NH3 + ClO- = N2H4 + Cl- + H2O 在催化剂作用下,H2还原NO2得到NH2OH(s)
