材料热力学--第五章二组元材料热力学共66页文档
合集下载
材料热力学全套课件

2.1 熵和热力学第二定律6
热力学第二定律表达式 可逆过程 不可逆过程 热力学第二定律表述: 一个隔离体系的熵值总 是增加,直至平衡态
dS Qrev / T dS Q / T
2.2 熵的统计概念
熵作为体系“混乱程度”的量度 统计力学假设体系的平衡态只是各种可能 微观态中的最可几态。 玻耳兹曼公式(熵的一般表达式) S k ln 表达体系的熵值和它内部粒子混乱度Ω之间 的定量关系。在一定的总能量U、体积V和 粒子数n时,体系的混乱度越大,熵值越大。 当呈最可几态( Ω最大 ),熵值最大,即 体系的平衡态。
a d
a b
H bc H cd
例1.2
H ab H bc
第二章 热力学第Βιβλιοθήκη 定律和第三定律
2.1 熵和热力学第二定律 2.2 熵的统计概念 2.3 配置熵(组态熵、混合熵) 2.4 固溶体的混合熵 2.5 振动熵和磁性熵 2.6 热力学第三定律 2.7 Richard和Trouton规则 2.8 例题
2.3 配置熵(组态熵、混合熵)
配置熵: 体系进行吸热或放热过程时,使内部粒 子混乱度Ω改变 体系内部粒子在空间有效位置间进行不 同配置(混合)时,混乱度Ω改变 引起的熵变。
配置(1) = 1 N! S配置=k ln 配置(2) k ln n!( N n )!
2.4 固溶体的混合熵
1.3 焓和比热容1
焓是状态函数
等压过程
H u pV dp 0 Q dH H Q p
1.3 焓和比热容2
恒容比热容 Cv 恒压比热容 Cp
材料热力学第五章相图热力学

X
(2) 2 1
(5.13)
敞开系统的 d T V d P i d ni
i
dG SdT VdP i*dni RT ln X i dni RT ln i dni (5.14)
i i i
例氢 关气 系溶 如解 图度 和 所氢 示气 。压 力 的 平 方 根 的 比
5.2
含图 量 的总 变结 化说 对明 于了 氢在 气熔 溶融 解铁 度中 的合 影金 响元 。素
5.1
化学势定义为(2.40)
G i n i T , P , n j
引入活度,如式子(3.77), with
k
(5.23)
将 ei 的定义代入,当X0→1时, 根据3.84式的 定义 % i / X i 100 M i / M 0 得:
j
( j) i
230 M i ( j ) M 0 M j ei M0 M0
(5.24)
相应的5.13式也可以写成:
log
% i
e %j
( j) i j
ai lim i 1 X i 1 X i
如果溶质浓度由重量百分比来表示,上面的式子 可以表示为:(3.81)
a % i RT ln a & lim i 1 X 0 1 % i
i % i
% i
由 X 0 1(下标0表示溶剂)和温度以及压力可以 确定系统的状态 (此时 )。 X 1 0和 X 2 0
(5.25)
对于图5.1中所示的氢溶解在低浓度的铁合金中, 则5.25式可写成:
log
% H
材料热力学课件-第五章-3

13
b t/℃
•t
* A
Ⅱ
• s(A)+ b1
• 140 l(A+B)
C
b2
Bi(A)
④ 描述b点变化情况
Ⅰ l(A+B)
p一定
t/℃
•t
* B
321
•a1
Ⅲ
开始析出Bi(s)
液相消失,
l(A+B) + s(B)
E• Ⅳ • D
s(A)+s(B)
wE
wB
Cd(B)
剩2个固相
又开始析出Cd(s)
图 5-8 Bi(A)-Cd(B)系统相图
相态
度数
区
P 3,s(A),s(C),l(A+B) 0
lp +s(A)
s(C)
3,s(A),s(C),lp(A+B) 0
F lp +s(A)
s(C)
tA* 2,s(A),l(A)
0
III 2,s(A),s(C)
1
IV 2,s(C),l(A+B)
1
V 2,s(B),l(A+B)
1
JEG — s(C)+s(B)+lE(A+B) HFP — s(A)+s(C)+lP(A+B)
• • • 140 l(A+B)
C
E
Ⅳ
D
III 2 IV 2
s(A)+s(B)
wE
tA* 2
Bi(A)
tB* 2
wB
Cd(B) CED 3
图 5-8 Bi(A)-Cd(B)系统相图
相态
l(A+B) l(A+B)+s(A) l(A+B)+s(B)
b t/℃
•t
* A
Ⅱ
• s(A)+ b1
• 140 l(A+B)
C
b2
Bi(A)
④ 描述b点变化情况
Ⅰ l(A+B)
p一定
t/℃
•t
* B
321
•a1
Ⅲ
开始析出Bi(s)
液相消失,
l(A+B) + s(B)
E• Ⅳ • D
s(A)+s(B)
wE
wB
Cd(B)
剩2个固相
又开始析出Cd(s)
图 5-8 Bi(A)-Cd(B)系统相图
相态
度数
区
P 3,s(A),s(C),l(A+B) 0
lp +s(A)
s(C)
3,s(A),s(C),lp(A+B) 0
F lp +s(A)
s(C)
tA* 2,s(A),l(A)
0
III 2,s(A),s(C)
1
IV 2,s(C),l(A+B)
1
V 2,s(B),l(A+B)
1
JEG — s(C)+s(B)+lE(A+B) HFP — s(A)+s(C)+lP(A+B)
• • • 140 l(A+B)
C
E
Ⅳ
D
III 2 IV 2
s(A)+s(B)
wE
tA* 2
Bi(A)
tB* 2
wB
Cd(B) CED 3
图 5-8 Bi(A)-Cd(B)系统相图
相态
l(A+B) l(A+B)+s(A) l(A+B)+s(B)
材料热力学--第五章二组元材料热力学

Graphic construction of P. D.
2012-3-19
19/65
Graphic construction of P. D.
2012-3-1920/655.2 固-液两相平衡
2012-3-19
21/65
5.2 固-液两相平衡
2012-3-19
22/65
5.2 固-液两相平衡
2012-3-19
64/65
• 下一部分: 相变热力学
新相的形成 析出相的表面张力效应 自由能有序-无序转变
固溶体的分解 固溶体的磁性转变 自由能晶间偏析
2012-3-19
65/65
2012-3-19
58/65
5.5 相稳定化参数
2012-3-19
59/65
5.5 相稳定化参数
2012-3-19
60/65
5.5 相稳定化参数
2012-3-19
61/65
5.5 相稳定化参数
2012-3-19
62/65
5.5 相稳定化参数
2012-3-19
63/65
5.5 相稳定化参数
公切线确定偏聚固溶体的分解
吉布斯自由能- 吉布斯自由能-成分公切线确定两相平衡
2012-3-19 10/65
相平衡的公切线法则
α-L及β-L的两相平衡 及 的两相平衡
二元合金系中的三相平衡
2012-3-19
11/65
相平衡的公切线法则
固溶体与中间相的平衡
二中间相的两相平衡
2012-3-19
12/65
Gm = Gm
2012-3-19 7/65
α
β
相平衡的公切线法则 • 两相平衡的化学势相等条件——公切线法则 (Common tangent law)。 • 对两相的自由能曲线作公切线,可求出:(1)两相 平衡的成分范围;(2)平衡相的成分点。 • 切点成分满足同一组元 在两相中化学位相等—— 两相平衡的条件
材料热力学 ppt课件

相变)、无核相变(连续相变)。
ppt课件
6
4.1 新相的形成和相变驱动力 4.2 马氏体相变热力学 4.3 珠光体转变(共析分解)热力学 4.4 脱溶分解热力学 4.5 调幅(Spinodal)分解热力学
ppt课件
7
4.1 新相的形成和相变驱动力
4.1.1 新相的形成
材料发生相变时,在形成新相前往往出现浓度起伏, 形成核胚再成为核心、长大。无论核胚是稳定相还是 亚稳相,只要符合热力学条件都可能成核长大。因此, 相变中可能出现一系列亚稳定的新相。
材料热力学
第四章 相变热力学 / 第五章 界面热力学
ppt课件
1
参考书目
徐祖耀 主编,材料热力学,高等教育出版社, 2009.
赵乃勤 主编,合金固态相变,中南大学出版社, 2008.
江伯鸿 编著,材料热力学,上海交通大学出版社, 1999.
徐瑞等 主编,材料热力学与动力学,哈尔滨工业 大学出版社,2003.
基本内容:
计算相变驱动力,以相变驱动力大小决定相 变的倾向,帮助判定相变机制,在能够估算临 界相变驱动力的条件下,可求得相变的临界温 度。相变驱动力与相变阻力的平衡。
ppt课件
5
相变的分类:
1. 按热力学分类:一级相变、二级相变…… 2. 按原子迁移特征分类(固态相变):扩散型
相变、无扩散型相变。 3. 按相变方式分类:形核-长大型相变(不连续
匀形核,因此所需的过冷度也小。
ppt课件
第四章 相变热力15 学
4.2 马氏体相变热力学
4.2.1 马氏体相变
高碳钢经淬火发生了马氏体相变,获得马氏体显 微组织,具有很高的硬度,但塑性较差。
马氏体相变是钢件热处理强化的主要手段,要求 高强度的钢都是通过淬火来实现。
ppt课件
6
4.1 新相的形成和相变驱动力 4.2 马氏体相变热力学 4.3 珠光体转变(共析分解)热力学 4.4 脱溶分解热力学 4.5 调幅(Spinodal)分解热力学
ppt课件
7
4.1 新相的形成和相变驱动力
4.1.1 新相的形成
材料发生相变时,在形成新相前往往出现浓度起伏, 形成核胚再成为核心、长大。无论核胚是稳定相还是 亚稳相,只要符合热力学条件都可能成核长大。因此, 相变中可能出现一系列亚稳定的新相。
材料热力学
第四章 相变热力学 / 第五章 界面热力学
ppt课件
1
参考书目
徐祖耀 主编,材料热力学,高等教育出版社, 2009.
赵乃勤 主编,合金固态相变,中南大学出版社, 2008.
江伯鸿 编著,材料热力学,上海交通大学出版社, 1999.
徐瑞等 主编,材料热力学与动力学,哈尔滨工业 大学出版社,2003.
基本内容:
计算相变驱动力,以相变驱动力大小决定相 变的倾向,帮助判定相变机制,在能够估算临 界相变驱动力的条件下,可求得相变的临界温 度。相变驱动力与相变阻力的平衡。
ppt课件
5
相变的分类:
1. 按热力学分类:一级相变、二级相变…… 2. 按原子迁移特征分类(固态相变):扩散型
相变、无扩散型相变。 3. 按相变方式分类:形核-长大型相变(不连续
匀形核,因此所需的过冷度也小。
ppt课件
第四章 相变热力15 学
4.2 马氏体相变热力学
4.2.1 马氏体相变
高碳钢经淬火发生了马氏体相变,获得马氏体显 微组织,具有很高的硬度,但塑性较差。
马氏体相变是钢件热处理强化的主要手段,要求 高强度的钢都是通过淬火来实现。
热力学第五章6162474页PPT文档
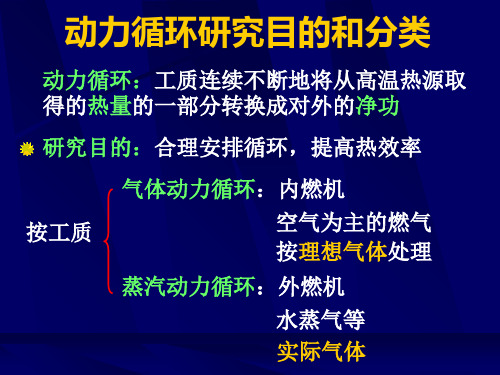
四冲程高速柴油机的理想化
1. 工质
p3 4
定比热理想气体
工质数量不变
2
P-V图p-v图
2’
2. 0—1和1’ —0抵消 开口闭口循环
3. 燃烧外界加热
p0 0
5 1’
1
4. 排气向外界放热
V
5. 多变绝热
6. 不可逆可逆
理想混合加热循环(萨巴德循环)
分析循环吸热量,放热量,热效率和功量
p
3
4
T
4 3
1
2’ 喷柴油
V
2 开始燃烧
2—3 迅速燃烧,近似 V
p↑5~9MPa
四冲程高速柴油机工作过程
3—4 边喷油,边膨胀
p3 4
近似 p 膨胀
t4可达1700~1800℃
2 2’
4 停止喷柴油
5
4—5 多变膨胀
p0
1’
p5=0.3~0.5MPa
0
1
t5500℃
V
5—1’ 开阀排气, V 降压
1’—0 活塞推排气,完成循环
p 3
T
3
2
2
4
4
1
1
v
s
定容加热循环的计算Βιβλιοθήκη 吸热量T3
q1cvT3T2
放热量(取绝对值)
2
4
q2cvT4T1
1
热效率
s
t
wq1q21q21T 4T 1
q1 q1
q1 T 3T 2
定容加热循环的计算
热效率
T
t
1 T4 T3
T1 T2
1
T1
T4 T1
T2
T3 T2
材料科学基础(讲稿5章)

Cu-Ni合金的铸态组织 ×50 树枝状
39
3)特点 (ⅰ) 冷却速度较快. (ⅱ) 开始结晶温度低于液相线. (ⅲ) 结晶中,剩余液相特别是晶粒内部成分不 均匀,先结晶的部分含高熔点组元较多,后 结晶的部分含低熔点组元较多;固相平均成 分偏离固相线,液相平均成分是否偏离液相 线随冷却速度而异. (ⅳ) 结晶终了温度低于固相线. (ⅴ) 通常不能应用杠杆定律. (ⅵ) 室温铸态有晶内偏析,形成树枝状组织.
Zn 2+、Ga 3+、Ge 4+、As 5+在Cu+中的最大固溶度(摩尔分数) 分别为38%、20%、12%、7%
6
Zn 2+、Ga 3+、Ge 4+、As 5+在Cu+中达最大 固溶度时所对应的e/a≈1.4→极限电子浓度
超过极限电子浓度,固溶体就不稳定,会 形成新相。 计算电子浓度时,元素的原子价指的是: 原子平均贡献出的共有电子数,与该元素 在化学反应时的价数不完全一致。
不平衡共晶形成原因分析
56
3)离异共晶——合金中 先共晶相的量很多,共晶 体的量很少时,共晶体中 与先共晶相相同的相依附 于先共晶相生长,将共晶 体中的另一相孤立在先共 晶相的晶界处.这种共晶 体两相分离的组织称为离 异共晶.
57ቤተ መጻሕፍቲ ባይዱ
Pb-Sb共晶离异组织(铸态)×400 α 相依附初生晶α 析出,形成离异的 白色网状β
58
3、包晶相图及其结晶
(1)相图分析 液相线 单相区 两相区 固相线 三相区 固溶度曲线 (2)包晶反应 在一定温度下,由一固定成分的液相与一个固定成 分的固相作用,生成另一个成分固定的固相的反应, 称为包晶反应。
材料化学热力学课件

详细描述
熵的大小与系统的微观状态数目成正比,当系统从有序向无序转变时,熵会增加。在材料化学热力学中,熵是描 述系统平衡态的重要参数,对于化学反应的方向和平衡常数具有决定性作用。
焓
总结词
焓是表示物质能量的物理量,包括内能和压力势能等。
详细描述
焓的大小与物质的种类和状态密切相关,对于化学反应而言,焓的变化会影响反应的能量变化。在材 料化学热力学中,焓是描述系统能量状态的重要参数,对于化学反应的能量平衡具有重要影响。
详细描述
在高温高压环境下,物质的热力学性质会发生显著变 化,如相变、化学反应等。这需要研究者发展更为精 确的热力学模型和实验技术,以适应极端条件下的研 究需求。
新型测量技术的发展
总结词
随着科技的发展,新型测量技术为材料化学热力学提供 了更准确、更便捷的实验手段。
详细描述
新型测量技术如原子力显微镜、光电子能谱、核磁共振 等,能够提供高分辨率和高灵敏度的热力学参数测量。 这些技术的发展将有助于推动材料化学热力学研究的深 入和广泛应用。
材料化学热力学课件
目
CONTENCT
录
• 材料化学热力学基础 • 材料化学热力学中的重要参数 • 材料化学热力学的应用 • 材料化学热力学的实验方法 • 材料化学热力学的挑战与未来发展
01
材料化学热力学基础
定义与概念
定义
材料化学热力学是研究在等温、等压条件下,材料化学反应中能 量转化和物质转变的规律的科学。
热力学第二定律
总结词
揭示了自然发生的反应总是向着熵增加的方向进行,即向着更加混乱无序的状态发展。
详细描述
热力学第二定律指出,自然发生的反应总是向着熵增加的方向进行。熵是一个衡量系统 无序度的物理量,代表着系统的混乱程度。在材料化学反应中,这一规律表现为自发反 应总是向着物质状态更为混乱、能量更为分散的方向进行。这一原理对于理解材料化学
熵的大小与系统的微观状态数目成正比,当系统从有序向无序转变时,熵会增加。在材料化学热力学中,熵是描 述系统平衡态的重要参数,对于化学反应的方向和平衡常数具有决定性作用。
焓
总结词
焓是表示物质能量的物理量,包括内能和压力势能等。
详细描述
焓的大小与物质的种类和状态密切相关,对于化学反应而言,焓的变化会影响反应的能量变化。在材 料化学热力学中,焓是描述系统能量状态的重要参数,对于化学反应的能量平衡具有重要影响。
详细描述
在高温高压环境下,物质的热力学性质会发生显著变 化,如相变、化学反应等。这需要研究者发展更为精 确的热力学模型和实验技术,以适应极端条件下的研 究需求。
新型测量技术的发展
总结词
随着科技的发展,新型测量技术为材料化学热力学提供 了更准确、更便捷的实验手段。
详细描述
新型测量技术如原子力显微镜、光电子能谱、核磁共振 等,能够提供高分辨率和高灵敏度的热力学参数测量。 这些技术的发展将有助于推动材料化学热力学研究的深 入和广泛应用。
材料化学热力学课件
目
CONTENCT
录
• 材料化学热力学基础 • 材料化学热力学中的重要参数 • 材料化学热力学的应用 • 材料化学热力学的实验方法 • 材料化学热力学的挑战与未来发展
01
材料化学热力学基础
定义与概念
定义
材料化学热力学是研究在等温、等压条件下,材料化学反应中能 量转化和物质转变的规律的科学。
热力学第二定律
总结词
揭示了自然发生的反应总是向着熵增加的方向进行,即向着更加混乱无序的状态发展。
详细描述
热力学第二定律指出,自然发生的反应总是向着熵增加的方向进行。熵是一个衡量系统 无序度的物理量,代表着系统的混乱程度。在材料化学反应中,这一规律表现为自发反 应总是向着物质状态更为混乱、能量更为分散的方向进行。这一原理对于理解材料化学
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Phase diagram 材料中相状态与成分、温度的关系图
21.05.2020
12
Graphic construction of P. D.
21.05.2020
13
Graphic construction of P. D.
21.05.2020
吉布斯自由能曲线建立匀晶相图
14
Graphic construction of P. D.
28
Magnesium Alloys- Metal of the 21st Century
21.05.2020
29
5.2 固-液两相平衡
21.05.2020
30
5.2 固-液两相平衡
21.05.2020
31
5.2 固-液两相平衡
21.05.2020
32
5.3 溶解度曲线
21.05.2020
21.05.2020
22
5.2 固-液两相平衡
21.05.2020
23
理想溶体二元匀晶相图的计算
21.05.2020
24
5.2 固-液两相平衡
21.05.2020
25
5.2 固-液两相平衡
21.05.2020
26
5.2 固-液两相平衡
21.05.2020
27
5.2 固-液两相平衡
21.05.2020
第五章 二组元材料热力学
• 二组元材料的热力学理论是材料热力学最基本的 内容。
• Goal: 以二元系相平衡(Phase equilibrium)为基础,
分析材料学中的一些基本问题,掌握运用热力学 分析材料平衡相成分以及平衡组织的基本方法。
21.05.2020
1
第五章 二组元材料热力学
5.1 两相平衡 5.2 固-液两相平衡 5.3 溶解度曲线 5.4 固溶体间的两相平衡 5.5 相稳定化参数
7
相平衡的公切线法则
• 公切线法则(Common tangent law):
• 切点成分:给定温度下 的两平衡相成分。
• 成分位于公切点之间的 合金,处于多相平衡, 因为此时自由能的值最 低。 Why?
• 成分位于公切点之外, 自由能?相?
21.05.2020
8
相平衡的公切线法则
公切线确定偏聚固溶体的分解
21.05.2020
15
Graphic construction of P. D.
21.05.2020
16
Graphic construction of P. D.
吉布斯自由能曲线建立共晶相图(两固相具有相同的晶体结构)
(A.H Ctroll. Theoretical Structural Metallurgy. Edward Arnold, London,1955 )
33
5.3 溶解度曲线
• 严格地说,溶解度应该是—个相在另—个相的溶 解度,而不是一个组元在另一个组元中的溶解度, 也不是一个组元在一个相中的溶解度。
(1)渗碳体在奥氏体中的溶解度。√
(2)石墨在铁素体中的溶解度。√
(3)碳在奥氏体中的溶解度。×
(4)碳在铁中的溶解度。×
• 相图中溶解度的热力学含义:与某一相α平衡时 另—相β的浓度。
• 如:上述(1)是指与渗碳体平衡时,奥氏体中的碳 的含量;上述(2)是指与石墨平衡时,铁素体中的 碳的含量。
21.05.2020
34
5.3 溶解度曲线
• 固溶体在与第二相平衡时的浓度也称为固溶度。 • 第二相有两种情况:(1)纯组元(Pure component),包括
21.05.2020
2
5.1 两相平衡
• For two phases to be in thermodynamic equilibrium, they must be in:
1. Thermal equilibrium (Temps are equal). 2. Mechanical equilibrium (Pressures are equal). 3. Chemical equilibrium (equilibrium with respect to transfer of components).
dGα+β = dGα+dGβ=0
21.05.2020
4
5.1 两相平衡
两相平衡的热力学条件:每个组元在各相中的
化学位相等.
21.05.2020
5
5.1 两相平衡
• Condition for phases at equilibrium 两相平衡的热力学条件:每个组元在各相中
的化学位相等.
• How about the condition for phases at equilibrium in single component materials? 单组元的化学位就是摩尔自由能。 单组元材料两相平衡的热力学条件:
21.05.2020
3
5.1 两相平衡
• 两相平衡的基本判据即平衡态判据(Equilibrium state criterion):体系的Gibbs自由能为极小值 (min),即: G = min, 或 dG = 0
• A-B二元系,在P、T一定时,在α和β两相平衡共 存的状态下,根据平衡态判据应该有: Gα+β = min,或dGα+β = 0,
21.05.2020
吉布斯自由能-成分公切线确定两相平衡
9
相平衡的公切线法则
α-L及β-L的两相平衡
二元合金系中的三相平衡
21.05.2020
10
相平衡的公切线法则
固溶体与中间相的平衡
二中间相的两相平衡
21.05.2020
11
Graphic construction of P. D.
• 根据材料的摩尔吉布斯自由能曲线和相平衡热力 学条件,可以确定一定温度、成分下材料所存在 的相的平衡状态。
21.05.2020
17
Graphic construction of P. D.
21.05.2020
18
Graphic construction of P. D.
21.05.2020
19
5.2 固-液两相平衡
21.05.2020
20
5.2 固-液两相平衡
21.05.2020
21
5.2 固-液两相平衡
Gm Gm
21.05.2020
6
相平衡的公切线法则
• 两相平衡的化学势相等条件——公切线法则 (Common tangent law)。
• 对两相的自由能曲线作公切线,可求出:(1)两相 平衡的成分范围;(2)平衡相的成分点。
• 切点成分满足同一组元 在两相中化
21.05.2020
12
Graphic construction of P. D.
21.05.2020
13
Graphic construction of P. D.
21.05.2020
吉布斯自由能曲线建立匀晶相图
14
Graphic construction of P. D.
28
Magnesium Alloys- Metal of the 21st Century
21.05.2020
29
5.2 固-液两相平衡
21.05.2020
30
5.2 固-液两相平衡
21.05.2020
31
5.2 固-液两相平衡
21.05.2020
32
5.3 溶解度曲线
21.05.2020
21.05.2020
22
5.2 固-液两相平衡
21.05.2020
23
理想溶体二元匀晶相图的计算
21.05.2020
24
5.2 固-液两相平衡
21.05.2020
25
5.2 固-液两相平衡
21.05.2020
26
5.2 固-液两相平衡
21.05.2020
27
5.2 固-液两相平衡
21.05.2020
第五章 二组元材料热力学
• 二组元材料的热力学理论是材料热力学最基本的 内容。
• Goal: 以二元系相平衡(Phase equilibrium)为基础,
分析材料学中的一些基本问题,掌握运用热力学 分析材料平衡相成分以及平衡组织的基本方法。
21.05.2020
1
第五章 二组元材料热力学
5.1 两相平衡 5.2 固-液两相平衡 5.3 溶解度曲线 5.4 固溶体间的两相平衡 5.5 相稳定化参数
7
相平衡的公切线法则
• 公切线法则(Common tangent law):
• 切点成分:给定温度下 的两平衡相成分。
• 成分位于公切点之间的 合金,处于多相平衡, 因为此时自由能的值最 低。 Why?
• 成分位于公切点之外, 自由能?相?
21.05.2020
8
相平衡的公切线法则
公切线确定偏聚固溶体的分解
21.05.2020
15
Graphic construction of P. D.
21.05.2020
16
Graphic construction of P. D.
吉布斯自由能曲线建立共晶相图(两固相具有相同的晶体结构)
(A.H Ctroll. Theoretical Structural Metallurgy. Edward Arnold, London,1955 )
33
5.3 溶解度曲线
• 严格地说,溶解度应该是—个相在另—个相的溶 解度,而不是一个组元在另一个组元中的溶解度, 也不是一个组元在一个相中的溶解度。
(1)渗碳体在奥氏体中的溶解度。√
(2)石墨在铁素体中的溶解度。√
(3)碳在奥氏体中的溶解度。×
(4)碳在铁中的溶解度。×
• 相图中溶解度的热力学含义:与某一相α平衡时 另—相β的浓度。
• 如:上述(1)是指与渗碳体平衡时,奥氏体中的碳 的含量;上述(2)是指与石墨平衡时,铁素体中的 碳的含量。
21.05.2020
34
5.3 溶解度曲线
• 固溶体在与第二相平衡时的浓度也称为固溶度。 • 第二相有两种情况:(1)纯组元(Pure component),包括
21.05.2020
2
5.1 两相平衡
• For two phases to be in thermodynamic equilibrium, they must be in:
1. Thermal equilibrium (Temps are equal). 2. Mechanical equilibrium (Pressures are equal). 3. Chemical equilibrium (equilibrium with respect to transfer of components).
dGα+β = dGα+dGβ=0
21.05.2020
4
5.1 两相平衡
两相平衡的热力学条件:每个组元在各相中的
化学位相等.
21.05.2020
5
5.1 两相平衡
• Condition for phases at equilibrium 两相平衡的热力学条件:每个组元在各相中
的化学位相等.
• How about the condition for phases at equilibrium in single component materials? 单组元的化学位就是摩尔自由能。 单组元材料两相平衡的热力学条件:
21.05.2020
3
5.1 两相平衡
• 两相平衡的基本判据即平衡态判据(Equilibrium state criterion):体系的Gibbs自由能为极小值 (min),即: G = min, 或 dG = 0
• A-B二元系,在P、T一定时,在α和β两相平衡共 存的状态下,根据平衡态判据应该有: Gα+β = min,或dGα+β = 0,
21.05.2020
吉布斯自由能-成分公切线确定两相平衡
9
相平衡的公切线法则
α-L及β-L的两相平衡
二元合金系中的三相平衡
21.05.2020
10
相平衡的公切线法则
固溶体与中间相的平衡
二中间相的两相平衡
21.05.2020
11
Graphic construction of P. D.
• 根据材料的摩尔吉布斯自由能曲线和相平衡热力 学条件,可以确定一定温度、成分下材料所存在 的相的平衡状态。
21.05.2020
17
Graphic construction of P. D.
21.05.2020
18
Graphic construction of P. D.
21.05.2020
19
5.2 固-液两相平衡
21.05.2020
20
5.2 固-液两相平衡
21.05.2020
21
5.2 固-液两相平衡
Gm Gm
21.05.2020
6
相平衡的公切线法则
• 两相平衡的化学势相等条件——公切线法则 (Common tangent law)。
• 对两相的自由能曲线作公切线,可求出:(1)两相 平衡的成分范围;(2)平衡相的成分点。
• 切点成分满足同一组元 在两相中化
