钠的氧化物和氢氧化物的性质和制法
钠及其化合物PPT

(3) (3)焰色系元指素_____的焰色,物属_理_____变
化。
精选版课件ppt
29
(2006年全国理综I、28).(15分)
在呼吸面具和潜水艇中可用过氧化纳作为供氧剂。请选用适当的化学试剂和实验用品、
用上图中的实验装置进行实验,证明过氧化钠可作供氧剂。
2、将Na、Mg、Al各0.3mol分别放入100mL1mol/L的盐酸中,
同温同压下产生的气体体积比是( )C
A、1:2:3
B、6:3:2
C、3:1:1
D、1:1:1
精选版课件ppt
32
练习:
1、某种H2和CO的混合气体,其密度为相同条件下O2密度的
1/2,将3.2g这种混合气充入一盛有足量Na2O2的密闭容器
结构
性质
制取 保存 应用
物理性质 化学性质
精选版课件ppt
2
教材回顾:
一、Na
碱
钠的氧化物
金 二、钠的化合物 NaOH
属
NaCl Na2CO3和NaHCO3
三、碱金属元素
精选版课件ppt
3
一、钠的性质
(一)、钠的物理性质
钠是 银白 色金属,具有金属光泽,质地
,
可以柔用软刀切割,密度
,熔点小
,是热
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
与酸反应 Na2O+2HCl=2NaCl+H2O 2Na2O2+4HCl=4NaCl+2H2O+O2↑
类别
碱金属的氧化物和氢化物

碱金属的氧化物和氢化物碱金属在一定条件下与氧化合,可以形成多种氧化物,除一般氧化物外,还有过氧化物,超氧化物和臭氧化物。
(1)碱金属的氧化物Li2O Na2O K2O Rb2O Cs2O白色白色淡黄色亮黄色橙红色它们均能直接和水反应生成碱,而且和水反应的速率依次增快,氧化铷、氧化铯和水反应十分激烈。
化钠用途最大,熔化状态的钠和不含二氧化碳的干燥空气,在300—400℃时反应,可制得淡黄色的过氧化钠粉末。
4Na+2O2=2Na2O2过氧化钠可和水或稀酸反应,生成过氧化氢,继而分解放出氧气。
过氧化钠可做漂白剂。
它和二氧化碳反应,也可放出氧气,因而既是二氧化碳的吸收剂又是氧气的发生剂。
2Na2O2+2CO2=2Na2CO3+O2用作防毒面具和潜艇中紧急时供氧。
也用于纺织造纸工业的漂白剂。
过氧化钠还可以氧化某些矿物,使它转化成可溶性盐类,如在熔融条件下,使难溶的二氧化锰或三氧化二铬氧化成锰酸盐或铬酸盐。
在分析化学中常作为分解矿石的熔剂。
另外在酸性高锰酸钾溶液作用下,过氧化钠又表现出还原性。
5Na2O2+2KMnO4+8H2SO4===K2SO4+2MnSO4+5Na2SO4+8H2O+5O2↑氧气中燃烧,可得超氧化物:KO2、RbO2、CsO2。
它们分别为橙黄色、深棕色、深黄色的固体,它们都是强氧化剂,与过氧化物的性质相似,可以跟水或二氧化碳反应放出氧气。
2KO2+2H2O=2KOH+H2O2+O2↑4KO2+2CO2=2K2CO3+3O2↑因此也用于急救,以吸收二氧化碳和再生氧之用。
钠与氢气共热可生成氢化钠,是白色晶体。
钠和氢反应时,氢原子得到1个电子,使K电子层达到2个电子的稳定结构。
在氢化钠中,氢以负一价的阴离子形式存在,因此氢化钠是离子型的氢化物。
氢化钠有强还原性,遇水立即发生反应放出氢气。
NaH+H2O=NaOH+H2↑所以它是一种氢气发生剂。
在无水条件下,氢化钠与四氯化钛共热。
可以制得金属钛。
与钠有关的化学方程式高中

钠及其化合物的化学方程式及应用钠是一种金属元素,化学性质非常活泼,能与多种物质发生反应,生成不同的化合物。
本文介绍了钠及其化合物的性质、制备、反应和用途,以及相关的化学方程式。
本文主要包括以下几个部分:钠的性质和制备钠与非金属的反应钠与水和酸的反应钠的氧化物和氢氧化物钠的碳酸盐和碳酸氢盐钠的其他盐类钠的性质和制备钠是一种银白色的金属,有金属光泽,质软,易切割,密度小于水,导电导热性良好。
钠原子最外层有一个电子,容易失去电子形成正离子,所以钠是一种强还原剂,能与许多氧化剂发生氧化还原反应。
钠在自然界中以化合物的形式存在,最常见的是食盐(NaCl)。
工业上,钠的制备方法是通过电解熔融的食盐水或熔融的氯化钠。
电解时,在阳极产生氯气,在阴极产生钠。
电解的化学方程式如下:2NaCl→2Na+Cl2实验室中,也可以用钙还原氯化钠来制取少量的钠。
反应时,在干燥瓶中加入少量水,使氯化钠溶解成饱和溶液。
然后在干燥瓶中加入少量的钙粉末,并用橡皮塞封住瓶口。
用酒精灯加热干燥瓶,使溶液沸腾。
此时,钙会与氯化钠反应,生成氯化钙和钠。
反应过程中会放出大量的氢气,所以要注意安全。
反应结束后,用镊子从干燥瓶中取出钙块,并用滤纸吸去表面的水分。
在钙块上刮去一层黑色的氧化物,就可以看到银白色的金属钠。
反应的化学方程式如下:Ca+2NaCl→CaCl2+2Na+H2由于钠非常活泼,容易与空气中的氧气和水蒸气反应,所以要保存在不含水分的煤油中。
取用时要用滤纸吸干表面的煤油,并迅速切去表面的氧化层。
钠与非金属的反应钠与氧气钠在空气中缓慢氧化,生成白色固体氧化钠(Na2O)。
如果将钠点燃,在空气或纯净的氧气中燃烧,会生成淡黄色固体过氧化钠(Na2O2)。
过氧化钠中含有过量的氧原子,具有较强的氧化性。
两种反应的方程式如下:4Na+O2→2Na2O2Na+O2→Na2O2钠与卤素钠能与卤素(氯、溴、碘)反应,生成白色或淡黄色的卤化钠(NaCl、NaBr、NaI)。
钠的氧化物和氢氧化物的性质和制法
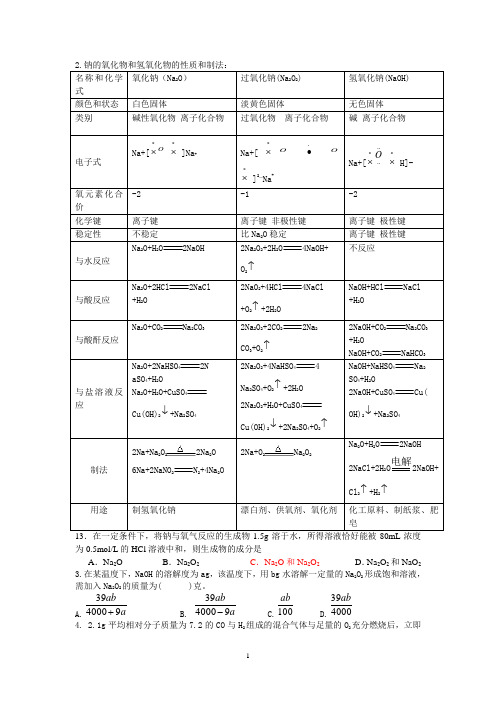
2NaOHO O+2HCl +4HCl 4NaClNaOH+HCl 2Na 222NaHCO 444 4 44422Na 222NaOH13.在一定条件下,将钠与氧气反应的生成物1.5g 溶于水,所得溶液恰好能被80mL 浓度为0.5mol/L 的HCl 溶液中和,则生成物的成分是 A .Na 2O B .Na 2O 2 C .Na 2O 和Na 2O 2 D .Na 2O 2和NaO 2 3.在某温度下,NaOH 的溶解度为ag ,该温度下,用bg 水溶解一定量的Na 2O 2形成饱和溶液,需加入Na 2O 2的质量为( )克。
A.a ab 9400039+B. a ab9400039- C.100ab D.400039ab4. 2.1g 平均相对分子质量为7.2的CO 与H 2组成的混合气体与足量的O 2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( )A.2.1gB.3.6gC.7.2gD.无法计算12.“二氧化碳是否在有水存在时才能与过氧化钠反应?”这个问题实验室里可通过以下实验加以说明:①按图装置,在干燥的试管C中装入Na2O2后,在通入CO2之前,应事先用弹簧夹(K1、K2)夹持好,其目的为。
②试管A内的试剂X应是时,打开弹簧夹K1、K2,加热试管C约几分钟后,将火星的小木条插入试管B的液面上,可观察到带火星的小木条不能剧烈地燃烧起来,且试管C 内淡黄色粉末未发生变化。
则所得的化学结论是。
③试管A内试剂为CO2饱和水溶时,其他操作同②,通过的现象可以证明Na2O2与潮湿的CO2能反应且放出O2。
④CO2和Na2O2反应机理也可用示踪原子分析加以证明。
请完成下列反应:Na2O2+ C18O2+H218O——。
钠的物理性质和化学性质

钠的物理性质和化学性质钠是一种化学元素,原子序数为11,化学符号为Na。
它是一种银白色的金属,具有许多独特的物理性质和化学性质。
首先,让我们来看一下钠的物理性质。
钠的原子质量为22.99g/mol,密度为0.97 g/cm³(室温下),熔点为97.72℃,沸点为883℃。
这意味着钠具有相对较低的熔点和沸点,属于较为活泼的金属之一。
此外,钠是一种柔软的金属,在室温下可以轻松地被切割或压成薄片。
它的导电和导热性能也非常好,是许多电子设备和导电材料的重要成分。
现在让我们转向钠的化学性质。
钠是一种高度活泼的金属,在空气中与氧气反应产生氧化物,因此必须保持干燥。
它在水中也可以迅速与水分子反应,产生氢气和氢氧化钠。
这种反应非常剧烈,甚至可以导致火花和火焰。
由于钠的反应性非常高,它在存储和处理时需要特别小心。
钠还可以与许多其他元素发生反应。
例如,它可以与氯气反应形成氯化钠,这是我们日常生活中使用的食盐。
此外,钠还与许多非金属元素如氧、氮、硫等反应,产生相应的化合物。
这些化合物在各种工业生产和实验室研究中都具有重要的应用。
总结一下,钠是一种具有特殊物理性质和化学性质的金属元素。
它具有较低的熔点和沸点,良好的导电和导热性能,以及柔软的特点。
在化学反应中,钠非常活泼,与氧气和水分子都能迅速反应,还能与其他元素形成多种化合物。
了解钠的这些性质对于应用和研究领域都具有重要意义。
除了上述提到的物理性质和化学性质外,钠还具有一些其他的重要特性和应用。
首先,钠是一种良好的还原剂。
由于其具有较低的电离电位和较高的活动性,钠可以从其他物质中夺取电子,并还原为钠离子。
因此,钠常用于一些化学反应中作为强还原剂,例如在有机合成中还原醛、酮等化合物。
此外,钠也可以与一些金属氧化物反应,例如氧化铁,将其还原为金属铁。
其次,钠在核反应中也有重要的应用。
钠与中子反应可以产生一个稳定的同位素钠-23,并释放出大量的能量。
这种核反应通常被用于核反应堆中的控制棒,用于控制核裂变反应的速率和效应。
钠的氧化物教案

钠的氧化物教案教案标题:钠的氧化物教案教案目标:1. 了解钠的氧化物的性质和用途。
2. 掌握钠的氧化物的命名和化学式的表示方法。
3. 能够解释钠的氧化物与水反应的过程和产物。
教学重点:1. 钠的氧化物的性质和用途。
2. 钠的氧化物的命名和化学式的表示方法。
3. 钠的氧化物与水反应的过程和产物。
教学准备:1. 钠的氧化物的样品和实验器材。
2. 相关的教学资料和图表。
3. 演示实验所需的化学药品和实验器材。
教学过程:Step 1: 引入钠的氧化物的概念(10分钟)- 向学生介绍钠的氧化物的概念和定义。
- 展示钠的氧化物的一些实际应用,如在玻璃制造和金属冶炼中的应用。
Step 2: 钠的氧化物的命名和化学式表示(15分钟)- 介绍钠的氧化物的命名规则,例如氧化钠、过氧化钠等。
- 解释如何根据化学式表示钠的氧化物,例如Na2O、Na2O2等。
- 提供一些练习,让学生实践命名和化学式表示。
Step 3: 钠的氧化物与水反应(20分钟)- 解释钠的氧化物与水反应的过程和产物。
- 进行实验演示,展示钠的氧化物与水反应的现象。
- 引导学生观察实验现象,并解释产生的气体和溶液的性质。
Step 4: 总结和讨论(10分钟)- 总结钠的氧化物的性质、命名和化学式表示以及与水反应的过程和产物。
- 鼓励学生提出问题和讨论钠的氧化物在其他领域的应用。
Step 5: 拓展活动(15分钟)- 提供一些拓展活动,如设计实验探究不同条件下钠的氧化物与水反应的速率变化。
- 鼓励学生进行小组讨论和实验设计,并分享他们的结果和观察。
教学评估:1. 课堂参与度:观察学生在课堂讨论和实验演示中的积极参与程度。
2. 练习和作业:布置练习和作业,包括命名和化学式表示的练习题以及钠的氧化物与水反应的解释题目。
3. 实验报告:要求学生撰写关于钠的氧化物与水反应实验的报告,包括实验步骤、观察结果和结论。
教学延伸:1. 钠的氧化物的其他用途:让学生进行研究和报告钠的氧化物在其他领域的应用,如医药、环境保护等。
《钠的氧化物》课件

与其他氧化剂反应
总结词
多种反应可能,取决于具体氧化剂。
详细描述
钠的氧化物与其他氧化剂的反应取决于具体的氧化剂。有些氧化剂可能与钠的氧 化物发生剧烈反应,产生热量和光,而有些则可能只发生缓慢的化学反应。
钠的氧化物可能与其他物质发生反 应,产生有害物质,降低水质,对 人类和其他生物的健康造成威胁。
对土壤的影响
土壤酸化
钠的氧化物在土壤中溶解后,可 能导致土壤酸碱度失衡,影响土
壤肥力和植物生长。
土壤污染
钠的氧化物可能与其他物质发生 反应,产生有害物质,污染土壤 ,影响植物和土壤微生物的生存
。
降低土壤质量
钠的氧化物的制备
钠的氧化物可以通过钠与氧气在 高温下反应制备。
另一种制备方法是钠与过氧化钠 反应,生成过氧化钠和氧化钠。
在实验室中,也可以通过钠与氯 气反应,生成氯化钠和氧化钠。
钠的氧化物的用途
钠的氧化物在工业上可用于制 造其他钠的化合物,如硫化钠 、亚硝酸钠等。
钠的氧化物也用于生产玻璃、 陶瓷、肥皂等产品中作为添加 剂。
钠的过氧化物的特殊性质
总结词
强氧化性,不稳定,易分解。
详细描述
钠的过氧化物具有强氧化性,是一种不稳定的化合物,容易分解。在常温下,过氧化钠会与水或二氧化碳发生反 应,产生氧气。
03
钠的氧化物在日常生活中的应用
在食品工业中的应用
01
02
03
食品添加剂
钠的氧化物可作为食品添 加剂,用于改善食品的口 感和外观,如膨松剂、防 腐剂等。
食品加工助剂
在食品加工过程中,钠的 氧化物可作为助剂,帮助 食品加工顺利进行,如乳 化剂、稳定剂等。
金属氧化物中的酸碱性与化学反应

金属氧化物中的酸碱性与化学反应金属氧化物是由金属与氧元素结合形成的化合物,具有重要的酸碱性质和化学反应。
这些性质和反应对于理解金属氧化物的性质、应用以及环境中的化学过程都具有重要意义。
一、酸碱性质金属氧化物中的酸碱性质是由其中的金属离子和氧化物离子的化学性质决定的。
金属氧化物中的金属离子通常具有阳离子特性,可与水分子中的氧原子形成氢氧根离子,使溶液呈碱性。
例如,氧化钠(Na2O)中的钠离子能与水反应生成氢氧根离子,使溶液呈碱性。
而氧化铝(Al2O3)中的铝离子则不具有与水反应生成氢氧根离子的能力,因此溶液呈中性。
另一方面,金属氧化物中的氧化物离子通常具有阴离子特性,可与水分子中的氢原子形成氢氧根离子,使溶液呈酸性。
例如,二氧化硫(SO2)中的氧化物离子能与水反应生成氢氧根离子,使溶液呈酸性。
而三氧化硫(SO3)中的氧化物离子则不具有与水反应生成氢氧根离子的能力,因此溶液呈中性。
二、化学反应金属氧化物在化学反应中起着重要的作用。
其中最常见的反应是与酸反应和与碱反应。
1. 与酸反应金属氧化物与酸反应可以生成盐和水。
这是一种酸碱中和反应。
例如,氧化钠与盐酸反应生成氯化钠和水:Na2O + 2HCl → 2NaCl + H2O氧化钠中的钠离子与盐酸中的氯离子结合形成氯化钠,氧化钠中的氧化物离子与盐酸中的氢离子结合形成水。
这种反应是一种常见的化学反应,也是制备盐的重要方法之一。
2. 与碱反应金属氧化物与碱反应可以生成盐和水。
这也是一种酸碱中和反应。
例如,氧化铝与氢氧化钠反应生成氯化铝和水:Al2O3 + 6NaOH → 2Na3AlO3 + 3H2O氧化铝中的铝离子与氢氧化钠中的氧离子结合形成氯化铝,氧化铝中的氧化物离子与氢氧化钠中的氢离子结合形成水。
这种反应在工业上常被用于制备氯化铝。
除了与酸和碱反应外,金属氧化物还可以参与其他多种化学反应,如与其他金属离子反应、与非金属元素反应等。
这些反应对于金属氧化物的应用和性质研究具有重要意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2NaOH
O O+2HCl +4HCl 4NaCl
NaOH+HCl 2
Na 222NaHCO 44
4 4 4
442
2Na 2
2
2NaOH
13.在一定条件下,将钠与氧气反应的生成物1.5g 溶于水,所得溶液恰好能被80mL 浓度为0.5mol/L 的HCl 溶液中和,则生成物的成分是 A .Na 2O B .Na 2O 2 C .Na 2O 和Na 2O 2 D .Na 2O 2和NaO 2 3.在某温度下,NaOH 的溶解度为ag ,该温度下,用bg 水溶解一定量的Na 2O 2形成饱和溶液,需加入Na 2O 2的质量为( )克。
A.a ab 9400039+
B. a ab
9400039- C.100ab D.400039ab
4. 2.1g 平均相对分子质量为7.2的CO 与H 2组成的混合气体与足量的O 2充分燃烧后,立即
通入足量的Na2O2固体中,固体的质量增加( )
A.2.1g
B.3.6g
C.7.2g
D.无法计算
12.“二氧化碳是否在有水存在时才能与过氧化钠反应?”这个问题实验室里可通过以下实验加以说明:
①按图装置,在干燥的试管C中装入Na2O2后,在通入CO2之前,应事先用弹簧夹(K1、K2)夹持好,其目的为。
②试管A内的试剂X应是时,打开弹簧夹K1、K2,加热试管C约几分钟后,将火星的小木条插入试管B的液面上,可观察到带火星的小木条不能剧烈地燃烧起来,且试管C 内淡黄色粉末未发生变化。
则所得的化学结论是。
③试管A内试剂为CO2饱和水溶时,其他操作同②,通过的现象可以证明Na2O2与潮湿的CO2能反应且放出O2。
④CO2和Na2O2反应机理也可用示踪原子分析加以证明。
请
完成下列反应:Na2O2+ C18O2+H218O——。
