原料药中残留溶剂限度的确定方法
残留溶剂测定法

残留溶剂测定法残留溶剂测定法1 简述药品中的残留溶剂系指在原料药或辅料的生产中,以及在制剂制备过程中使用过,但在工艺过程中未能完全去除的有机溶剂。
药物中常见的残留溶剂及限度参照《中国药典》2015年版四部通则0861附表1的规定,除另有规定外,第一、第二、第三类溶剂的残留量应符合其规定;对其他溶剂,应根据生产工艺的特点,制订相应的限度,使其符合产品质量标准的要求。
本法照气相色谱法(《中国药典》2015年版四部通则0521测定。
本测定方法适用于对各论项下未收载残留溶剂检测方法的品种中残留溶剂的检验,也可用于指导建立各论项下具体品种的残留溶剂检查方法。
2 仪器和用具2.1 气相色谱仪,带FID检测器,顶空进样器。
2.2 计算机,安装工作站软件。
2.3 色谱柱2.3.1 毛细管柱除另有规定外,极性相近的同类色谱柱之间可以互代使用。
2.3.1.1 非极性色谱柱固定液为100%的二甲基聚硅氧烷的毛细管柱。
2.3.1.2 极性色谱柱固定液为聚乙二醇(PEG-20M)的毛细管柱。
2.3.1.3 中极性色谱柱固定液为(35%)二苯基-(65%)二甲基聚硅氧烷,(50%)二苯基-(50%)二甲基聚硅氧烷,(35%)二苯基-(65%)二甲基亚芳基聚硅氧烷,(14%)氰丙基苯基-(86%)二甲基聚硅氧烷,(6%)氰丙基苯基-(94%)二甲基聚硅氧烷的毛细管柱。
2.3.1.4 弱极性色谱柱固定液为(5%)苯基-(95%)甲基聚硅氧烷,(5%)二苯基-(95%)二甲基亚芳基硅氧烷共聚物的毛细管柱。
2.3.2 填充柱以直径为0.18~0.25mm的二乙烯苯-乙基乙烯苯型高分子多孔小球或其他适宜的填料作为固定相。
3 供试品溶液和对照品溶液的制备3.1 供试品溶液的制备3.1.1 顶空进样除另有规定外,精密称取供试品0.1~1g;通常以水为溶剂;对于非水溶性药物,可采用N,N-二甲基甲酰胺、二甲基亚砜或其他适宜溶剂;根据供试品和待测溶剂的溶解度,选择适宜的溶剂且应不干扰待测溶剂的测定。
气相色谱法测定瑞格列奈原料药的有机溶剂残留量

气相色谱法测定瑞格列奈原料药的有机溶剂残留量梁丽娟;黄薇【摘要】目的:建立瑞格列奈原料药残留溶剂的测定方法.方法:采用Agilent DB-FFAP毛细管色谱柱(50 m×0.32mm)、顶空进样法,以FID检测.结果:正己烷、丙酮、乙酸乙酯、乙醇、甲苯分别在7.3 ~58.4、125.7~1 005.5、125.3~1 002.7、125.9~1 007.2和22.4 ~ 179.5 μg/ml范围内线性关系良好,平均回收率分别为97.5%、95.6%、96.6%、97.8%和94.8%,RSD分别为1.4%、1.6%、1.7%、1.2%和1.2%.结论:所建立方法专属性好,简便准确,可用于瑞格列奈原料药残留溶剂的限度检查.【期刊名称】《天津药学》【年(卷),期】2012(024)005【总页数】3页(P6-8)【关键词】气相色谱法;瑞格列奈;残留溶剂;正己烷;丙酮;乙酸乙酯;乙醇;甲苯【作者】梁丽娟;黄薇【作者单位】天津医药集团津康制药有限公司,天津300270;天津医药集团津康制药有限公司,天津300270【正文语种】中文【中图分类】R927.11瑞格列奈属于甲基苯甲胺苯甲酸(CBMA)家族的一种新型口服降糖药物,能促进胰岛素分泌,具有吸收快、起效快、作用时间短的特点,可在Ⅱ型糖尿病患者中模拟生理性胰岛素分泌,有效控制餐后高血糖。
《中国药典》2010年版[1]收载了该原料药,规定进行二氯甲烷与正己烷的残留量检查。
根据本产品生产工艺中使用了《中国药典》2010年版规定的二类溶剂正己烷和甲苯,以及三类溶剂丙酮、乙醇和乙酸乙酯,《中国药典》规定方法不能囊括工艺中使用的全部五种溶剂,故笔者参考文献[2-4]采用气相-顶空进样法建立了瑞格列奈原料药的残留溶剂检测方法,方法简便准确。
1 仪器与试药1.1 仪器安捷伦6890N气相色谱仪(FID检测器),安捷伦7694E自动顶空进样仪。
1.2 试药正己烷、丙酮、乙酸乙酯、乙醇、甲苯及二甲基甲酰胺均为色谱纯试剂,高纯氮气由天津东方气体厂提供。
气相色谱法测定原料药中的残留溶剂

气相色谱法测定原料药中的残留溶剂发布时间:2021-09-25T00:47:37.013Z 来源:《探索科学》2021年8月下16期作者:高倩魏浩明闫志营[导读] 建立气相色谱法测定原料药中的残留溶剂乙腈的分析方法,并对该方法进行相关的方法学研究及验证,充分保证了分析方法的准确性。
方法:色谱条件以聚乙二醇为固定液的毛细管柱(如Agilent DB-WAX,30m×0.32mm×0.5μm,或极性相近)为色谱柱;起始温度35℃,维持5分钟,以每分钟10℃的速率升温至200℃,维持2分钟;进样口温度为250℃;检测器为氢火焰离子化检测器(FID);检测器温度为250℃;载气为氮气;载气流速为每分钟2.0ml;分流比为10:1;顶空瓶平衡温度80℃,平衡时间30分钟。
河南新天地药业股份有限公司高倩魏浩明闫志营河南省许昌市 461500[摘要]:建立气相色谱法测定原料药中的残留溶剂乙腈的分析方法,并对该方法进行相关的方法学研究及验证,充分保证了分析方法的准确性。
方法:色谱条件以聚乙二醇为固定液的毛细管柱(如Agilent DB-WAX,30m×0.32mm×0.5μm,或极性相近)为色谱柱;起始温度35℃,维持5分钟,以每分钟10℃的速率升温至200℃,维持2分钟;进样口温度为250℃;检测器为氢火焰离子化检测器(FID);检测器温度为250℃;载气为氮气;载气流速为每分钟2.0ml;分流比为10:1;顶空瓶平衡温度80℃,平衡时间30分钟。
[关键词]:气相色谱法;乙腈;乙醇;残留溶剂;乙腈是合成原料药及医药中间体的常用溶剂,是一种无色液体,极易挥发,有类似于醚的特殊气味,有优良的溶剂性能,能溶解多种有机、无机和气体物质。
有一定毒性,与水和醇无限互溶。
乙腈能发生典型的腈类反应,并被用于制备许多典型含氮化合物,是一个重要的有机中间体。
根据原料药中残留溶剂的研究,我们分别从专属性、检测限、定量限、线性和范围这三个方面,对样品中的乙腈的残留进行研究分析,确定残留溶剂的检测方法快速简单、准确可靠。
气相色谱法测定药物中有机溶剂残留量

验证性实验实验二十五 气相色谱法测定药物中有机溶剂残留量一、目的要求1.掌握内标法、外标法计算杂质含量。
2.熟悉气相色谱-氢火焰离子化检测器法(GC-FID )测定原料药中残留有机溶剂的方法。
3.熟悉气相色谱仪的工作原理和操作方法。
4.了解顶空气相色谱仪的作用原理。
二、仪器与试药气相色谱仪(弱极性或中等极性气相色谱柱,1~5μL 微量注射器)甲醇 乙腈 二 氯甲烷 三氯甲烷 丙酮 正丙醇 地塞米松磷酸钠原料药三、实验方法1.地塞米松磷酸钠(Dexamethasone Sodium Phosphate )中甲醇和丙酮的检查(1)色谱条件 色谱柱:3% OV-17 玻璃柱,柱长 2m ,内径 3mm ;检测器:FID ;柱温:50℃;气化室温度:120℃;检测器温度:140 ℃;载气:N 2;流速:30mL/min ;空气:0.5 kg/cm ;灵敏度:102;进样量:2μL 。
(2)溶液制备与测定 精密量取甲醇 10µL (相当于 7.9mg )与丙酮 100µL (相当于 79mg ), 置 100mL 量瓶中,精密加 0.1%(mL/mL )正丙醇(内标物质)溶液 20mL ,加水稀释至 刻度,摇匀,作为对照溶液;另取本品约 0.16g ,精密称定,置10mL 量瓶中,精密加入上述内标溶液 2mL ,加水溶解并稀释至刻度,摇匀,作为供试品溶液。
取上述溶液,照气相色谱法,按正丙醇计算的理论板数应大于700。
含丙酮不得过 5.0%(g/g ), 并不得出现甲醇峰。
(3)计算 按下式计算定量校正因子(f )和检品中丙酮的含量(g/g ):A /A /C f C 正丙醇正丙醇甲醇甲醇校正因子()= 2.顶空气相色谱法测定有机溶剂甲醇、乙腈、二氯甲烷、三氯甲烷(1)色谱条件 色谱柱:HP-5 毛细管柱(5% phenyl methyl siloxane, 30m×0.25mm );柱温:45℃;气化室温度:180℃;检测室温度:200℃ (FID);氢气流速:40 mL·min -1;空气:450 mL· min -1,氮气:1mL·min -1;分流比:31׃;样品液:90℃,加热10min ,(自动)顶空进样。
药物中常见残留溶剂及其限度
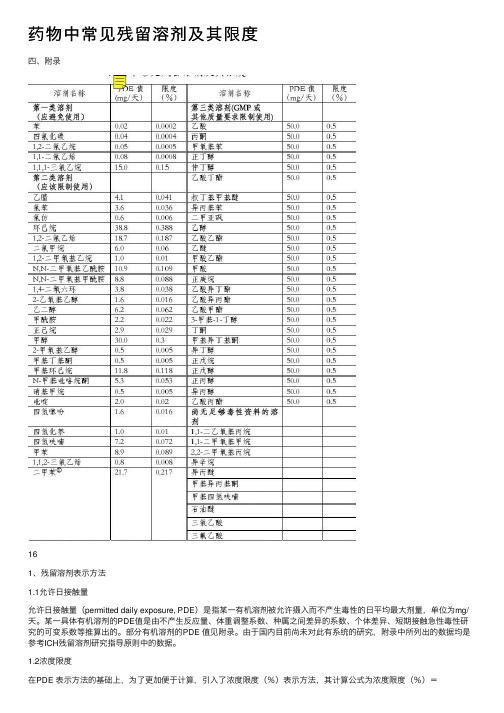
药物中常见残留溶剂及其限度四、附录161、残留溶剂表⽰⽅法1.1允许⽇接触量允许⽇接触量(permitted daily exposure, PDE)是指某⼀有机溶剂被允许摄⼊⽽不产⽣毒性的⽇平均最⼤剂量,单位为mg/天。
某⼀具体有机溶剂的PDE值是由不产⽣反应量、体重调整系数、种属之间差异的系数、个体差异、短期接触急性毒性研究的可变系数等推算出的。
部分有机溶剂的PDE 值见附录。
由于国内⽬前尚未对此有系统的研究,附录中所列出的数据均是参考ICH残留溶剂研究指导原则中的数据。
1.2浓度限度在PDE 表⽰⽅法的基础上,为了更加便于计算,引⼊了浓度限度(%)表⽰⽅法,其计算公式为浓度限度(%)=PDE(mg/天)9 /(1000×剂量(g/天))×100%,其中剂量初步定为10g/天。
部分有机溶剂的浓度限度见附录。
1.3两种表⽰⽅法的⽐较以上两种表⽰⽅法在残留溶剂研究中均可⾏,但需要指出的是,PDE值是绝对值,也就是说⽆论原料药、辅料和制剂,只要能明确各成分的溶剂残留量,以PDE值来计算是很精确的;⽽对于某⼀具体制剂来说,由于很难确定处⽅中各活性成分和各辅料的残留溶剂⽔平,因此以浓度限度来计算更为简便,只要⽇摄⼊总量不超过10g,就⽆需进⼀步计算。
综合以上情况并考虑⽬前国内的实际情况,由于⼤多数药物的⽇摄⼊量不会超过10g(包括活性成分和辅料),浓度限度表⽰⽅式是⽬前更为简便可⾏的。
当然,在某些原料、辅料或制剂的残留溶剂不符合浓度限度时,可根据实际测定的各种残留溶剂量及⽤法⽤量计算实际⽇接触量,并与PDE值⽐较,如符合限量要求则也属可⾏。
此外,虽然本指导原则采⽤浓度限度的表⽰⽅式,但由于PDE 值的精确性,药物研发者可采⽤适当的PDE 值的⽅式进⾏残留溶剂研究。
原料药溶剂残留分析方法验证8大项

原料药溶剂残留分析方法验证
1.专属性:a、保留时间和相对保留时间,同一次检验误差可接受范围为±2%(具体怎么做呢?)b、分离度(这个药典上有说明)
2.精密度(是否取6份对照品依次进样,看被测残留溶剂色谱峰RSD<10%?系统精密度,方法精密度各应怎么做?中间精密度:不同仪器、不同操作人员、不同时间,应该取几台仪器,几个操作人员,几个不同时间做?)
3.检测线
4.定量限(3、4两项中不同浓度梯度的样品,每个浓度需要配几分平行样品测?)
5.线性(应满足哪些数据要求?)
6.线性范围(5、6有什么不同?线性范围需要做几个点,一般范围取残留限量的多少范围内做?)
7.回收率(准确度)(取100%浓度,进六个平行样;或者取80%,100%,120%每个浓度各进3个平行样?哪种方案更好?)
8.耐用性(GC应具体做哪几个参数,参数变化范围在预定值的多大范围内做,结果在统计学上应满足何中要求)
1.专属性:可以用空白与样品的合样,不必用保留时间
2.精密度:总样品检样量多余3个,够算RSD值就可以了
3.检测限:可以用信噪比3:1的浓度作为检测限
4.定量限:不用做。
5.线性:至少5个,满足你的检测时上限和下限就行
6.现行范围:满足回收率合格,且适用
7.回收率:选80%,100%,120%为好
8.耐用性:改变检测器温度,分流比,柱温,样品存放时间及温度等。
残留溶剂的测定方法

• 载气流速 与柱子规格有关 • 柱温 溶剂数量少,一般采用恒温条件,溶剂数量多,
常用程序升温。采用程序升温的优点?初始柱温的确 定。程序升温的速率。
• 汽化室温度
• 顶空进样条件
顶空温度
顶空温度应根据溶解供试品溶剂的特性及供试品中 残留溶剂的沸点选择。以水为溶剂及测定低沸点残留 溶剂时,顶空温度不宜超过85℃;测定沸点较高的残 留溶剂时,通常选择较高的顶空温度;但此时应兼顾 供试品的热分解特性,尽量避免供试品产生的挥发性 热分解产物干扰测定结果。以DMSO为溶剂时,顶空 温度不宜超过115℃。
通风的功能主要有:
(1) 提供人呼吸所需要的氧气; (2) 稀释室内污染物或气味; (3) 排除室内工艺过程产生的污染物; (4) 除去室内多余的热量(称余热)或湿量 (称余湿); (5) 提供室内燃烧设备燃烧所需的空气。 建筑中的通风系统可能只完成其中的一项 或几项任务。其中利用通风除去室内余热和 余湿的功能是有限的,它受室外空气状态的
顶空瓶的平衡温度应低于溶解样品所用溶剂的沸点 10℃以下,能满足检测灵敏度即可;
对于沸点过高的溶剂,如DMF、DMSO、聚乙二醇 等,用顶空进样测定的灵敏度不如直接进样,不适宜
采用顶空法
• 2.溶液的配制
• 空白溶液、对照品溶液和供试品溶液 • (1)溶解性
要重视溶解性的问题。
供试品要能完全溶解(特殊情况下,常温下不能溶解 的能加热溶解的也行);对照品也要能完全溶解,对 于被测残留溶剂不能溶解于选定的溶剂时应怎么办? (如氯仿不溶于水的情况)
• 定义:药物中的残留溶剂( Residual Solvent )系指 在原料药或辅料的生产中,以及在制剂制备过程中使 用的,但在工艺过程中未能完全去除的有机溶剂。
0861残留溶剂测定法

0861残留溶剂测定法药品中的残留溶剂系指在原料药或辅料的生产中,以及在制剂制备过程中使用的,但在工艺过程中未能完全去除的有机溶剂。
药品中常见的残留溶剂及限度见附表1,除另有规定外,第一、第二、第三类溶剂的残留限度应符合附表1中的规定;对其他溶剂,应根据生产工艺的特点,制定相应的限度,使其符合产品规范、药品生产质量管理规范(GMP)或其他基本的质量要求。
本法一般采用色谱法,如照气相色谱法(通则0521)测定。
色谱柱1. 毛细管柱除另有规定外,极性相近的同类色谱柱之间可以互换使用。
(1)非极性色谱柱固定液为100%的二甲基聚硅氧烷的毛细管柱。
(2)极性色谱柱固定液为聚乙二醇(PEG-20M)的毛细管柱。
(3)中极性色谱柱固定液为(35%)二苯基-(65%)甲基聚硅氧烷、(50%)二苯基-(50%)二甲基聚硅氧烷、(35%)二苯基-(65%)二甲基聚硅氧烷、(14%)氰丙基苯基-(86%)二甲基聚硅氧烷、(6%)氰丙基苯基-(94%)二甲基聚硅氧烷的毛细管柱等。
(4)弱极性色谱柱固定液为(5%)苯基-(95%)甲基聚硅氧烷、(5%)二苯基-(95%)二甲基硅氧烷共聚物的毛细管柱等。
2. 填充柱以直径为0.18~0.25mm的二乙烯苯-乙基乙烯苯型高分子多孔小球或其他适宜的填料作为固定相。
系统适用性试验(1)用待测物的色谱峰计算,毛细管色谱柱的理论板数一般不低于5000;填充柱的理论板数一般不低于1000。
(2)色谱图中,待测物色谱峰与其相邻色谱峰的分离度应大于1.5。
(3)以内标法测定时,对照品溶液连续进样5次,所得待测物与内标物峰面积之比的相对标准偏差(RSD)应不大于5%;若以外标法测定,所得待测物峰面积的RSD 应不大于10%。
供试品溶液的制备1. 顶空进样除另有规定外,精密称取供试品0.1~1g;通常以水为溶剂;对于非水溶性药物,可采用N,N-二甲基甲酰胺、二甲基亚砜或其他适宜溶剂;根据供试品和待测溶剂的溶解度,选择适宜的溶剂且应不干扰待测溶剂的测定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原料药中残留溶剂限度的确定方法
前言
药品的三个性质为安全、有效和质量可控。
杂质的研究应从对药品安全性和质量可控性两个方面的影响来考虑。
化学试剂作为广义概念上的杂质的一部分,也需要评估其残留对药品安全性和质量可控性的影响,其残留限度的制定也是如此。
如某化学试剂有基因警示结构,其限度应根据相应指导原则(《ICHM7》)制定。
如为无机盐,应根据无机盐的控制策略及相应指导原则制定,在API成品检测炽灼残渣,研究元素杂质(《ICHQ3D》)等。
某些有机试剂如残留溶剂中的四类溶剂的限度则应该先查找相应的安全性的数据,如动物毒理研究数据、职业环境暴露量研究数据等,然后根据安全性的数据计算相应的残留限度。
本文着重论述如何根据查到的安全性的数据计算化学试剂允许的残留限度。
通过PDE 计算限度
ICHQ3C中收载了PDE的计算方法:
PDE = NOEL x Mass Adjustment/[F1 x F2 x F3 x F4 x F5]
其中PDE为允许日暴露量,单位为mg/天;NOEL为该杂质的最大无作用的剂量,单位为mg/kg/天。
Mass Adjustment为体重调整系数,一般取为50kg。
F1…..
F5为各种修正因子,其含义与应取的值请查阅ICHQ3C相应内容,不再细述。
通过以上公式得出PDE的值之后,然后除以药品的最大日剂量,即得出该化学试剂的限度。
从LD50 计算NOEL
很多时候我们查找不到NOEL的数据,我们只能查到LD50(半数致死量)。
目前最权威的计算方法出自欧盟原料药委员会在其发布的《原料药工厂中清洁验证指南》,其中收载了由LD50计算NOEL的公式:NOEL=LD50×70/2000。
但这一公式却会误导PDE的计算,因为很多人会用这一公式计算出来的NOEL直接代入上文的公式计算PDE,却没有注意到《原料药工厂中清洁验证指南》一文中的NOEL 的单位是mg/天,而不是上文公式中的mg/kg/天。
原因就是公式中的70是欧洲人的评价体重。
所以如果需要用LD50计算NOEL用于计算PDE,则不应该乘以70,公式应该是NOEL=LD50/2000,2000是经验常数。
该公式可参见文献Layton D W,Mallon B J,RosenblattD H,et.Deriving allowable daily intakes for systemic toxicants lacking chronic toxicity data[J].Reg02 To'xicol Pharm,1983,3(1):224。
由ppm 计算相应NOEL
有些时候我们查到的相应药理毒理研究数据(特别是某些低沸点溶剂)是研究空气中特定含量的吸入产生的效果,
其单位常见的是ppm为体积比,如何换算成mg/kg/天的单位呢?以三乙胺为例,其研究数据为大鼠每周5天,每天6小时,持续28周,NOEL为247ppm。
247ppm=247×101.19/24.45=1.02mg/L,其中101.19为三乙胺的分子量,24.45为25℃气体摩尔体积。
每天平均吸入量为1.02×6×5/24/7=0.183mg/L。
NOEL(mg/kg/天)
=0.183×290/0.425=124.9,其中290为大鼠每日吸入空气体积,0.425为大鼠平均体重。
如何确定限度
化学试剂的限度制定如上文所述应根据安全性和质量可控性两个方面综合制定,某些化学试剂的安全性非常好,如氯化钠、氨基酸之类,其限度就需要根据质量可控性的要求制定。
如上文的三乙胺,PDE(计算过程见上文PDE相关内容)为62.5mg/天,假设药物每日最大剂量为
100mg,根据PDE计算三乙胺在该药物中的限度可为
62.5%。
这明显不合理,这时应根据实际工艺可能达到的值确定一个合理的限度,即质量控制可以实现的限度,例如0.1%。
作者介绍:占小兵,2004年毕业于江西医学院药学系(现南昌大学药学院),多年从事药物研发的分析工作,现就职于上海博志研新药物技术有限公司分析部。
(化药注射剂再评价研发思路与关键技术暨原辅包新政法规解读)(凡是从
药事纵横报名,均可享受底价2200元/人,2月10日前报名缴费折上折,完成培训,药事纵横还有红包。
单独报名模块一可享受800/人,模块二享受1600/人,其它渠道均不能享受。
)(改良型创新/505(b)(2)立项研发暨中美双报研讨会邀请函)(普通渠道报名5000元/人,凡是从药事纵横报名,均可享受底价3600元/人,3月10日前报名缴费折上折,完成培训的朋友凭发票享受红包回馈。
其它渠道均不能享受。
)。
