无机化学实验—第一过渡系元素(II)(铁,钴,镍)
实验二十四:第一过渡系元素(二)(铁、钴、镍)
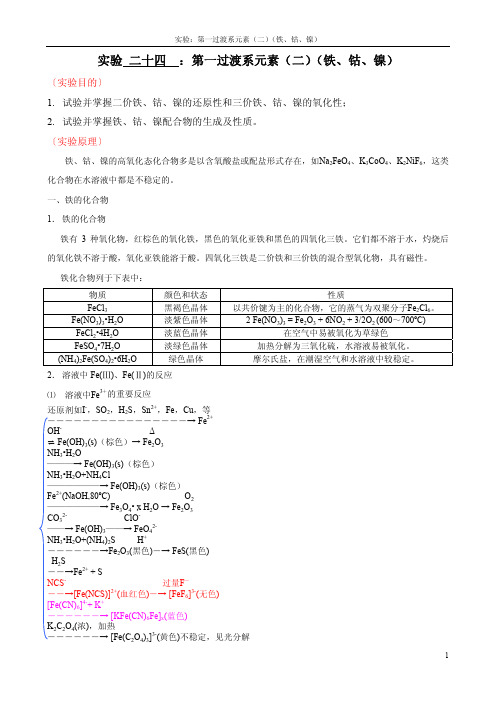
实验二十四:第一过渡系元素(二)(铁、钴、镍)〔实验目的〕1.试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2.试验并掌握铁、钴、镍配合物的生成及性质。
〔实验原理〕铁、钴、镍的高氧化态化合物多是以含氧酸盐或配盐形式存在,如Na2FeO4、K3CoO4、K2NiF6,这类化合物在水溶液中都是不稳定的。
一、铁的化合物1.铁的化合物铁有3种氧化物,红棕色的氧化铁,黑色的氧化亚铁和黑色的四氧化三铁。
它们都不溶于水,灼烧后的氧化铁不溶于酸,氧化亚铁能溶于酸。
四氧化三铁是二价铁和三价铁的混合型氧化物,具有磁性。
铁化合物列于下表中:物质颜色和状态性质FeCl3黑褐色晶体以共价键为主的化合物,它的蒸气为双聚分子Fe2Cl6。
Fe(NO3)3 = Fe2O3 + 6NO2 + 3/2O2 (600~700ºC) Fe(NO3)3•H2O 淡紫色晶体 2FeCl2•4H2O 淡蓝色晶体在空气中易被氧化为草绿色FeSO4•7H2O 淡绿色晶体加热分解为三氧化硫,水溶液易被氧化。
(NH4)2Fe(SO4)2•6H2O 绿色晶体摩尔氏盐,在潮湿空气和水溶液中较稳定。
2.溶液中Fe(Ⅲ)、Fe(Ⅱ)的反应⑴溶液中Fe3+的重要反应还原剂如I-,SO2,H2S,Sn2+,Fe,Cu,等――――――――――――――――→ Fe2+OH-Δ⇌ Fe(OH)3(s)(棕色)→ Fe2O3NH3•H2O———→ Fe(OH)3(s)(棕色)NH3•H2O+NH4Cl——————→ Fe(OH)3(s)(棕色)Fe2+(NaOH,80ºC) O2——————→ Fe3O4• x H2O → Fe2O3CO32-ClO-——→ Fe(OH)3——→ FeO42-NH3•H2O+(NH4)2S H+――――――→Fe2O3(黑色)―→ FeS(黑色)H2S――→Fe2+ + SNCS-过量F-――→[Fe(NCS)]2+(血红色)―→ [FeF6]3-(无色)[Fe(CN)6]4-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)K2C2O4(浓),加热――――――→ [Fe(C2O4)3]3-(黄色)不稳定,见光分解⑵溶液中Fe2+的重要反应氧化剂如Cr2O72-,浓HNO3等―――――――――――→ Fe3+OH-O2⇌ Fe(OH)2(s)(纯白色)→Fe(OH)3(s)(棕色)NH3•H2O――→ Fe(OH)2(s)(纯白色)NH3•H2O+NH4Cl――――――→无沉淀CO32-H2O + CO2 O2――→ FeCO3(白色)――→ Fe(HCO3)2―→Fe(OH)3(s)(NH4)2S―――→ FeS(黑色)NO――→[Fe(NO)( H2O)5]2+( 棕色)H2O2 +过量F-―――――→ [FeF6]3-(无色)NCS-――→无溶液、无颜色CN-过量CN-Cl2―→Fe(CN)2(s) (白色) ――→[Fe(CN)6]4-――→[Fe(CN)6]3-[Fe(CN)6]3-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)二、钴的化合物1. 钴的化合物钴的氧化物与铁的氧化物类似,为暗褐色的Co2O3•xH2O和灰绿色的CoO。
过渡元素(2)

(4)在碱性溶液中,低氧化态的Fe,Co,Ni有一定程度的还原性; (5)单质无论在酸性或碱性介质中都有较强的还原性. 二,铁系元素离子的存在形式及常见反应 1,常见化合物 2,常见反应:稳定性,水解性,氧化还原性
表:铁系元素的常见化合物
氧化值 氧化物 +2 FeO黑,CoO灰绿 黑 灰绿 NiO暗绿 暗绿 氢氧化物 Fe(OH)2白, Co(OH)2粉红 Ni(OH)2浅绿 FeSO47H2O淡绿 淡绿 (NH4)2Fe(SO4)3H2O绿, 绿 CoCl26H2O粉红 粉红 NiSO47H2O绿 绿 +3 砖红, Fe2O3砖红,Co2O3黑, Ni2O黑 黑 Fe(OH)3棕红, 棕红, Co(OH)3棕, Ni(OH)3 黑 FeCl3 黑褐
三,铁系元素的配合物 1,氨合物 2,氰合物 3,硫氰配合物 下页表:铁系元素的常见配离子
�
[Fe(H2O)6 ]3+ + H2O = [Fe(OH )(H2O)6 ]2+ + H3O+ H 2[Fe(H2O)6 ]3+ = [(H2O)4
F O e F O H e
(H2O)4 ] + 2H2O
[Fe(OH )(H2O)5 ]2+ + [Fe(H2O)6 ]3+ = [(H2O)5 Fe OH Fe(H2O)5 ]5+ + H2O
的形状.具有这种特殊功能的材料在导弹,航空航天,石 油化工,机械仪器仪表,汽车等领域有广泛的应用前景. 20世纪60年代首次发现Ni-Ti合金具有非常独特的形状记忆 效应.美国设计的一种用Ti-Ni合金做的新式宇宙飞船天 线,在室温下该天线可以折叠成线团,便于发射,当飞船 升至高空时,温度升至77°C以上,天线即可自动打开. 本族元素价电子构型3d6-84s2,共用的常见氧化态为+2, +3,Fe最高为+6,Ni最高为+4. *铁系元素的元素电势图 (1)酸性溶液中,Fe2+,Co2+和Ni2+是元素的最稳定状态; (2)Fe(VI),Co(III),Ni(IV)在酸性溶液中是强氧化剂; (3)在碱性溶液中,Fe(III),Co(II),Ni(II)是各元素可以被空气中的氧所 氧化,例如:绿矾在空气中可逐渐失去部分结晶 水,同时晶体表面有黄褐色的碱性硫酸铁生成.
实验二十四第一过渡系元素二铁钴镍

一、工程概况 1、本工程为******工程,地址位于******。由****公司*开发建设,由 *****公司设计,监理单位:*****公司,施工单位:*****公司。 2、本工程为全现浇框剪结构。由裙楼及塔楼组成,结构布局较为复杂,造型 新颖。施工现场比较狭窄,可供使用的场地较小,给施工带来极大的不便。建筑物为**** 型。 3、根据本工程结构及施工特点,拟在建筑***物**轴中部靠外侧布置一台QTZ50塔 式起重机能满足施工中垂直运输和水平运输的需要。 二、准备情况 1、采用*****建筑机械有限公司生产的 QTZ50自升式塔式起重机。 2、安装塔机时,需一汽车吊,其性能适应起吊部件的需要。能妥善协调各种安 装和组装步骤,合理配置塔机安装人员及来往通道,组装现场之间的关系,则能将 使用汽车吊的时间减至最少。 3、组织有资质的专业安装队伍。
提高施工效率。 4、回转机构采用行星齿轮减速机,结构紧凑,采用液力偶合器联接,使起
动平稳,并设有回转制动装置,重物就位准确。 5、小车牵引机构采用蜗轮杆减速机,双速电机驱动,具有二种牵引速度,
以提高工效。 6、采用机械式力矩限制器和最大起重量限制器,结构简单,灵敏可靠,便于维修。 7、采用联动控制台操作,灵活轻便,舒适可靠。 四、塔吊基础 固定式塔式起重机的地基基础是保证塔机安全使用的必要条件,对基础的基本
B、安装基础节、标准节、套架 装基础节吊装到底架上,用件8 专用螺栓和16件专用螺母将底架与基础节相连, 再吊装2 件标准节( 标准节上有踏步的一方应与准备安装平衡臂的方向一 用),标致准节螺 栓连接好后吊装套架。使套架上的爬爪放在标准节的踏步上。再调整个8爬升好导轮与 标准节的间隙(间隙为2—3 毫米)。
G、安装司机室 司机室的电气设备安装齐全后,把司机室吊起到上支座右平台的前端,对准耳 板上孔的位置,然后用三根销轴联接并穿好开口销。 H、安装吊臂总成 先按照要求拼装好吊臂,把吊臂停靠在约 0.6在m高的支架上,将维修吊栏紧固在 变幅小车上,然后按要求将变幅小车装在吊臂上,并收紧变幅小车的钢丝绳,以小 车在载重情况下,不松弛为宜。再将吊臂拉杆按要求拼装好后与吊臂上的吊点用销 轴铰接,穿好开口销,放在吊臂上弦杆的定位托架内,检查吊臂上的电线路是否完 善,挂绳,试吊是否平稳,否则可适当移动挂绳位置。 I、安装平衡重 根据所使用的臂长,按要求选择相应的平衡重。本方案平衡重为: 2.2×2+1.5×2=7.4。各种臂长的平衡重的配置及安装位置严格按要求安装,然后在 于衡重的上部用连接板将每块平衡重互相串连好,并装入弹簧垫圈,拧紧螺母。再 用两件长拉拉板按要求安装。尾部两端分别装入开口销,前面用螺M母24拧紧。塔机工 作时不允许平衡重有摆动现象。吊装完毕后,按要求进行起升钢丝绳的穿绕,钢丝 绳从起升机构卷筒上放出,绕过塔顶上部导向滑轮向下,进入回转塔身上起重量限
实验二十四-第一过渡系元素(二)-铁钴镍

[Ni(NH3)6]2++6H+= Ni2++ 6NH4+
[Ni(NH3)6]2++6OH-= Ni(OH)2 + 6NH3 2[Ni(NH3)6]SO4+2H2O(沸水)=Ni2(OH)2SO4+10NH3+(NH4)2SO4
♦(四)分离并鉴定Fe3+ Co2+ Ni2+的混合液。
不溶。
钴的配合物
(1)往盛有1mL CoCl2 溶液的试管中加入少量硫氰酸钾固体,观察 固体颜色。再加入0.5mL 戊醇于0.5mL 乙醚,观察水相与有机相 的颜色,该反应可鉴别Co2+。
Co2++4SCN-
[Co(NCS)4]2-(蓝色)
(2)往0.5mL CoCl2溶液中滴加浓氨水,至生成的沉淀刚好溶解为 止,静置一段时间后观察溶液颜色。
和羟基配合物。有些配合物不但有特殊颜色而
且溶解度很小,稳定性高,因此可以作为离子
分离和鉴定的基础。
三、仪器与试剂
•
♦试管 试管架 酒精灯 离心机 点滴板
•
♦主要试剂有:
•
♦1% 丁二肟
•
♦3% H2O2
•
♦丙酮
•
♦PH试纸
•
♦淀粉-KI
•
♦溴水
•
♦CCl4
•
•
♦0.1mol·L-1 Pb(NO3)2
(1)在前面实验中留下的氢氧化铁(Ⅲ),氢氧化 钴(Ⅲ)与氢氧化镍(Ⅲ)溶液中均加入浓盐酸,震 荡后有何变化,并用碘化钾淀粉试纸检验放出的气体。
铁钴镍实验报告

铁钴镍实验报告
实验目的,通过实验了解铁钴镍的性质和用途,掌握相关实验操作技能。
实验仪器和试剂,铁钴镍样品、酸、碱、试管、酒精灯、玻璃棒、试剂瓶等。
实验步骤:
1. 取一小块铁钴镍样品,放入试管中;
2. 加入适量酸,观察样品的反应情况;
3. 加入适量碱,观察样品的反应情况;
4. 使用酒精灯加热样品,观察其变化;
5. 用玻璃棒测试样品的导电性。
实验结果:
1. 酸的作用,铁钴镍样品与酸接触后,发生了明显的气体生成反应,同时产生了气泡。
观察样品表面,发现有气体释放的迹象,推测为氢气的生成反应。
2. 碱的作用,加入碱后,铁钴镍样品发生了部分溶解,生成了混合溶液。
观察到溶液中有悬浮物质,可能是未反应完全的铁钴镍残留。
3. 加热反应,使用酒精灯加热样品后,观察到样品表面发生了颜色变化,从原来的灰色变成了暗红色,推测为铁钴镍的氧化反应。
4. 导电性测试,用玻璃棒测试样品的导电性,发现铁钴镍具有一定的导电性,但不如金属导电性强。
实验结论:
通过本次实验,我们了解到铁钴镍在酸、碱、加热和导电性方面的性质。
铁钴镍在酸中会产生氢气,与碱发生部分溶解,加热后会发生氧化反应,具有一定的导电性。
这些性质使得铁钴镍在工业生产和科学研究中具有重要的应用价值,例如用于制造电池、合金等材料。
通过本次实验,我们不仅了解了铁钴镍的性质和用途,还掌握了相关实验操作技能,为今后的实验和科研工作打下了良好的基础。
希望通过今后的实验学习,我们能够更加深入地了解各种物质的性质和应用,为科学研究和技术创新做出更大的贡献。
第一过渡系元素(二)

实 验 内 容
3、配合物的生成和性质 、
(1)铁的配合物 ) a. [Fe(CN)6]4- +Fe3+ + K+ = KFe[Fe(CN)6] 黄血盐 普鲁士蓝
实 验 内 容
(3)镍的配合物 ) Ni2++ 2NH3H2O = Ni(OH)2↓绿 绿 Ni(OH)2 + 6 NH3 = [Ni(NH3)6]2+绿色 + 2OH[Ni(NH3)6]2+的稳定性实验
思 考 题
1、FeCl3遇什么溶液时显血红、浅绿、蓝色、 黑 、 遇什么溶液时显血红、浅绿、蓝色、 色、红棕色?设计“白纸显画”图。 红棕色?设计“白纸显画” 2、怎样鉴别Fe2+、Co2+、Ni2+ ? 、怎样鉴别 3、 试从配合物的生成对电极电势的改变来解释 、 为什么Fe(CN)64- 能把 2 还原成 - , 而 Fe2+ 则不能 ? 则不能? 为什么
实 验 内 容
2、铁(Ⅲ)、钴(Ⅲ)、镍(Ⅲ)的氧化性 、
(1) Fe(OH)3 +6HCl(浓)=2FeCl3 + 3H2O 2 ( (2) Co(OH)3 + 6HCl(浓)=2CoCl2+Cl2↑+6H2O ( 2 Ni(OH)3+6HCl(浓)=2NiCl2+Cl2↑+6H2O ( (3) 2 Fe3++2 I- =2 Fe2++I2 I2溶于 溶于CCl4呈紫红色
实验二十四第一过渡系元素(二)(铁、钴、镍)
生成铁蓝。
鉴定Fe3+离子的反应:
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3
(4)FeCl3溶液中加入氨水,直至过量
得到棕红色沉淀;加入过量氨水,沉淀不消失;
Fe3+在氨水中不能得到配合物,只得到沉淀:
Fe3++3OH-=Fe(OH)3
c.加入Cl2水很快被氧化:
4Co(OH)2+O2+2H2O=4Co(OH)3(棕色或褐色)
2Co(OH)2+Cl2+2NaOH=2Co(OH)3+2NaCl
3 镍(II)的还原性
NiSO4溶液中加入NaOH,所得沉淀分成两份。一份在空气中放置,另一份加入Cl2水。
a.Ni2+?溶液中加入NaOH后,得到绿色沉淀。
总:
铁、钴、镍的主要化合价为+2和+3。
其中+2氧化态具有还原性,+3氧化态具有氧化性。
通常,酸性条件下的氧化能力增加;碱性条件下物质还原能力增加;
配合物的形成能够在较大的程度上能改变元素电对的电极电势;
还原性增强
Fe(II)
Co(II)
Ni(II)
Fe(III)
Co(III)
Ni(III)
氧化性增强
Fe3++nSCN-=[Fe(SCN)n]3-n(n=1~6)
(2)碱性介质:除去空气的酸性Fe2+溶液中缓慢加入3mL6molL-1的NaOH。沉淀留一段时间观察
首先观察到白色沉淀,放置,沉淀很快变成棕红色,其中可以观察到白-灰绿-黑色-棕红的颜色变化
Fe2+生成了氢氧化物沉淀Fe(OH)2为白色。Fe(OH)2的还原性很强,很容易被空气氧化生成Fe(OH)3而呈红棕色。期间可以观察到一系列颜色变化。中间产物Fe(OH)2.2Fe(OH)3为黑色
第一过渡系元素(一) Fe、 Co、Ni
(6 mol· L-1, 2mol· L-1),NH3H2O (6 mol· L-1),
FeSO4 ( 0.1 mol· L-1) ,FeCl3 (0.2 mol· L-1) ,CoCl2 (0.1 mol· L1)
,NiSO4 (1 mol· L-1) ,KI ( 0.1mol· L-1) 、溴水、氯水、碘
水、CCl4、K4[F、戊醇、乙醚、
KSCN (饱和)、H2O2 (3%) 、KNO2 (饱和) 。 固体试剂:硫酸亚铁铵、NaF。
实验步骤
一.二价Fe、Co、Ni化合物的还原性 1、酸性介质: + Br2
2、碱性介质:
+ 空气
二.三价铁、钴、镍化合物的氧化性 1、碱性介质产物 + 浓盐酸 三.配合物的生成 1、铁的配合物: CN-、SCN- 、NH3· H2O
第一过渡系元素 Fe、 Co、Ni
实验目的
• 试验并掌握二价铁、钴、镍的还原性和 三价铁、钴、镍的氧化性 • 试验并掌握铁、钴、镍配合物的生成和 性质。
实验仪器与试剂
实验材料:
KI – 淀粉
试剂:
液体试剂:H2SO4 (1 mol· L-1),HCL (浓),HAc (6 mol· L1 ),NaOH
2、钴的配合物: SCN- 、NH3· H2O 、NO23、镍的配合物: NH3· H2O; 产物分别用 酸、碱、水和热处理
思考题
1、 如果想观察纯Fe(OH)2的白色,原料硫酸亚铁不含Fe3+是 关键,如何检出和除去原料的Fe3+? 2、综合氧化性实验所观察到的现象,总结+2氧化态的铁、钴、 镍化合物的还原性和+3氧化态的铁、钴、镍化合物的氧 化性的变化规律? 3、制取Co(OH)3、Ni(OH)3时,为什么要以Co(II)、Ni(II)的 盐为原料,在碱性溶液中进行氧化,而不用Co(III)、 Ni(III)的盐为原料直接制取? 4、试从配合物的生成对电极电势的改变来解释为什么 [Fe(CN)6]4-能把I2还原成I-,而Fe2+则不能。 5、根据实验结果比较[Co(NH3)6]2+配离子和[Ni(NH3)6]2+配离 子氧化还原稳定性的相对大小及溶液稳定性。
下学期实验报告示范
三、?实验内容
步骤
实验操作
实验现象
解释及有关化学反应方程式
一、铁(II)、钴(II)、镍(II)化合物的还原性
1、1 铁(II)的还原性:
(1)酸性介质:酸性的Cl2水中滴加(NH4)2Fe(SO4)2溶液
绿色的Fe2+溶液很快转变为黄色。加入KSCN,立即得到血红色溶液
Cl2将Fe2+氧化成Fe3+而呈黄色。加入KSCN,由于生成了[Fe(SCN)n]3-n而呈血红色。
Fe3++nSCN-= [Fe(SCN)n]3-n(n= 1~6)
(2)碱性介质:除去空气的酸性Fe2+溶液中缓慢加入3mL6mol L-1的NaOH。沉淀留一段时间观察
首先观察到白色沉淀,放置,沉淀很快变成棕红色,其中可以观察到白-灰绿-黑色-棕红的颜色变化
Fe2+生成了氢氧化物沉淀Fe(OH)2为白色。Fe(OH)2的还原性很强,很容易被空气氧化生成Fe(OH)3而呈红棕色。期间可以观察到一系列颜色变化。中间产物Fe(OH)2.2Fe(OH)3为黑色
c.加入Cl2水很快被氧化:
4Co(OH)2+ O2+ 2H2O = 4Co(OH)3(棕色或褐色)
2Co(OH)2+ Cl2+ 2NaOH = 2Co(OH)3+ 2NaCl
3 镍(II)的还原性
NiSO4溶液中加入NaOH,所得沉淀分成两份。一份在空气中放置,另一份加入Cl2水。
a.Ni2+?溶液中加入NaOH后,得到绿色沉淀。
b. 沉淀放置在空气中没有变化;
c.加入Cl2水后,沉淀较慢变化为黑色,若加热,转变加快。
a.Ni2+?与NaOH反应生成绿色沉淀:
2020高中化学竞赛实验讲义设计-无机实验-第一过渡系元素(二)(铁,钴,镍)
实验第一过渡系元素(II)(铁,钴,镍)一、实验目的与要求:1.掌握二价铁,钴,镍的还原性和氧化性。
2.掌握铁,钴,镍配合物的生成及性质。
二、教学重点与难点:掌握二价铁,钴,镍的还原性和氧化性;掌握铁,钴,镍配合物的生成及性质。
三、教学方法与手段:讲授法;演示法四、教学课时: 4课时五、课的类型:实验课六、教学内容:[实验内容]:一、铁(II)、钴(II)、镍(II)的化合物的还原性1、铁(II)的还原性(1)酸性介质:往盛有0.5ml氯水的试管中加入3滴6 mol.L-1H2SO4溶液,然后滴加(NH4)2Fe(SO4)2溶液,观察现象,写出反应式:2Fe2+ + Cl2 === 2Fe3++ 2Cl-Fe3++nSCN-====[Fe(SCN)n]3-n(血红色)说明:Fe2+被氧化为Fe3+的现象不明显(淡绿色 黄棕色),可用KSCN检验Fe3+。
亚铁盐一般用硫酸亚铁铵,它稳定,不易分解,为防万一还需要加硫酸。
(2)碱性介质:在一试管中放入2ml蒸馏水和3滴6mol.L-1H2SO4溶液煮沸,以赶尽溶于其中的空气,然后溶于少量硫酸亚铁铵晶体。
在另一试管中加入3ml 6mol.L-1NaOH溶液煮沸。
冷却后,用一长滴管吸收NaOH溶液,插入(NH4)2Fe(SO4)2溶液到底部,慢慢挤出NaOH,观察产物颜色和状态。
Fe2++2OH- ====Fe(OH)2(为纯白色沉淀)4Fe(OH)2+O2+2H2O====4Fe(OH)3 (红褐色)说明:为了得到纯净的白色氢氧化亚铁沉淀,将溶液加热以赶净溶解在其中的氧气。
放置一段时间白色沉淀变为灰绿色,至实验结束也没有变为红褐色。
【现象:沉淀由白变成灰绿色再变成红棕色】2、钴(II)的还原性(1)、往盛有CoCl2溶液的试管中加入氯水,观察有何变化两者不反应.2Co2++Cl2+2H+ 不反应说明:在酸性溶液中,Co2+比较稳定,不易被氧化。
(2)、在盛有1ml CoCl2溶液的试管中滴入稀NaOH溶液(注:),观察沉淀的生成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验25 第一过渡系元素(II)(铁,钴,镍)
一、实验目的与要求:
1.掌握二价铁,钴,镍的还原性和氧化性。
2.掌握铁,钴,镍配合物的生成及性质。
二、教学重点与难点:
掌握二价铁,钴,镍的还原性和氧化性;掌握铁,钴,镍配合物的生成及性质。
三、教学方法与手段:讲授法;演示法
四、教学课时: 4课时
五、课的类型:实验课
六、教学内容:
[实验内容]:
一、铁(II)、钴(II)、镍(II)的化合物的还原性
1、铁(II)的还原性
(1)酸性介质:
往盛有0.5ml氯水的试管中加入3滴6 mol.L-1H2SO4溶液,然后滴加(NH4)2Fe(SO4)2溶液,观察现象,写出反应式:
2Fe2+ + Cl2 === 2Fe3++ 2Cl-
Fe3++nSCN-====[Fe(SCN)n]3-n(血红色)
说明:Fe2+被氧化为Fe3+的现象不明显(淡绿色 黄棕色),可用KSCN检验Fe3+。
亚铁盐一般用硫酸亚铁铵,它稳定,不易分解,为防万一还需要加硫酸。
(2)碱性介质:
在一试管中放入2ml蒸馏水和3滴6mol.L-1H2SO4溶液煮沸,以赶尽溶于其中的空气,然后溶于少量硫酸亚铁铵晶体。
在另一试管中加入3ml 6mol.L-1NaOH溶液煮沸。
冷却后,用一长滴管吸收NaOH溶液,插入(NH4)2Fe(SO4)2溶液到底部,慢慢挤出NaOH,观察产物颜色和状态。
Fe2++2OH- ====Fe(OH)2(为纯白色沉淀)
4Fe(OH)2+O2+2H2O====4Fe(OH)3 (红褐色)
说明:为了得到纯净的白色氢氧化亚铁沉淀,将溶液加热以赶净溶解在其中的氧气。
放置一段时间白色沉淀变为灰绿色,至实验结束也没有变为红褐色。
【现象:沉淀由白变成灰绿色再变成红棕色】
2、钴(II)的还原性
(1)、往盛有CoCl2溶液的试管中加入氯水,观察有何变化两者不反应.
2Co2++Cl2+2H+ 不反应
说明:在酸性溶液中,Co2+比较稳定,不易被氧化。
(2)、在盛有1ml CoCl2溶液的试管中滴入稀NaOH溶液(注:),观察沉淀的生成。
所得沉淀分成两份,一份置于空气中,一份加入新配置的氯水,观察有何变化,第二份留作下面实验用。
①、Co2+ +2OH- ====Co(OH)2↓(粉红色)
②、4Co(OH)2+O2+2H2O====4Co(OH)3↓(棕色)(反应慢)
③、2Co(OH)2+Cl2+2NaOH====2Co(OH)3↓(棕色)+2NaCl (反应快)
说明:①中刚开始生成蓝紫色的沉淀,摇荡后变为粉红色沉淀。
蓝紫色的沉淀可能是因为Co2+结合的水分子少而引起的。
3、镍(II)的还原性
用NiSO4溶液按2(1),(2)实验方法操作,观察现象,第二份沉淀留作下面实验用。
2Ni2++Cl2+2H+ 不反应
Ni2++2OH- ====Ni(OH)2↓(绿色)
Ni(OH)2+O2+H2O 不反应
2Ni(OH)2+Cl2+2NaOH====2Ni(OH)3↓(黑色)+2NaCl (反应慢)
说明:Ni2+比较稳定,不易被氧化,在碱性溶液中也不能被空气中的氧气氧化,只有用强氧化剂Cl2才能使之氧化。
二、铁(III)、钴(III)、镍(III)的化合物的氧化性
(1) 、在前面实验中保留下来的Fe(OH)3、Co(OH)3、Ni(OH)3沉淀中均加入浓盐酸,振荡后各有何变化,并用碘化钾淀粉试纸检验所放出的气体。
Fe(OH)3 + 3HCl === FeCl3 + 3H2O
2Co(OH)3 + 6HCl(浓) === 2CoCl2 + 6H2O + Cl2↑
2Ni(OH)3 + 6HCl(浓)=== 2NiCl2 + 6H2O + Cl2↑
说明:Co(III)、Ni(III)具有强氧化性,氧化Cl放出Cl2,能使湿润的淀粉KI试纸变蓝,再变为无色。
(2)、在上述制得的FeCl3溶液中加入KI溶液,再加入CCl4振荡后观察现象,写出反应方程式。
2Fe3+ +2I- ====2Fe2+ +I2 (CCl4)
说明:在介电常数较大的溶剂中,如不饱和烃、二氧化硫(液态)、醇等,碘呈现棕色或棕红色;而在介电常数较小的溶剂中,如四氯化碳、二硫化碳等,则呈紫色。
碘溶液颜色的不同是由于碘在极性溶剂中形成溶剂化物,而在非极性或极性较低的溶剂内,碘不发生溶剂化作用,溶解的碘以分子状态存在,故溶液的颜色与碘蒸气相同。
三、配合物的生成
1、铁的配合物
(1)、往盛有1毫升亚铁氰化钾溶液的试管中加入约0.5毫升的碘水振荡后,滴入数滴硫酸亚铁铵溶液,观察现象。
此为Fe2+的鉴定反应。
2[Fe(CN)6]4-+I2=====2[Fe(CN)6]3-+2I2
2[Fe(CN)6]3-+3Fe2+ ===Fe3[Fe(CN)6]2(滕氏蓝)
说明:由于配合物的生成,降低了Fe(II)的电极电势,使I2能氧化Fe(II)生成Fe(III):I2+2e =====2I- Eө =0.5355V
[Fe(CN)6]3-+e ====[Fe(CN)6]4-Eө =0.358V
Fe3+ +e ====Fe2+Eө =0.771V
(2)、向盛有1毫升新制(NH4)2Fe(SO4)2溶液的使馆中加入碘水,振荡试管后,将溶液分为两份,各滴入数滴硫氰酸钾溶液,然后向其中一支试管中注入约0.5毫升3%H2O2溶液,观察现象,此为Fe3+的鉴定反应。
Fe2++I2不反应
2Fe2++H2O2+2H+ =====2Fe3++2H2O
3Fe3+ + nSCN- === [Fe(SCN)n]3-n血红色,n值随SCN-的浓度而变化。
说明:目的是用KSCN 检验是否有Fe3+生成,但是,碘水与Fe(SCN)n]3-n的颜色相近,很难区分红色是碘水的颜色还是[Fe(SCN)n]3-n的颜色。
加入H2O2后,有黑色沉淀漂浮在溶液表面,是H2O2把I3-氧化为I2。
(3)、往FeCl3中加入K4[Fe(CN)6]溶液,观察现象。
写出反应方程式。
此为Fe3+的鉴定反应的常用方法:
3[Fe(CN)6]4-+4Fe3+ =====Fe4[Fe(CN)6]3↓(普鲁士蓝)
(4)、向盛有0.5毫升0.2mol/l FeCl3的试管中,滴入浓氨水直至过量,观察沉淀是否溶解:
Fe3++NH3H2O=====Fe(OH)3+3NH4+
说明:Fe(II)、Fe(III)均不形成氨的配合物。
2、钴的配合物
(1)、向盛有1毫升CoCl2溶液的试管中加入少量的硫氰酸钾固体,观察固体周围的颜色,再加入0.5毫升戊醇和0.5毫升乙醚,振荡后观察水相和有机相的颜色。
这个反应可用来鉴定Co2+。
Co2+ +4SCN-=====[Co(SCN)4] 2-(蓝色)K稳=10-3
说明:KSCN晶体周围呈现[Co(SCN)4]2的蓝色,它在水溶液中不稳定易解离,但它溶于丙酮或戊醇,在有机溶剂中比较稳定。
水相中是粉红色。
(2)、向盛有0.5毫升CoCl2溶液滴加浓氨水,直到生成的沉淀刚好溶解为止,静置一段时间后,观察溶液的颜色有何变化。
CoCl2+ NH3H2O=====Co(OH)Cl↓+NH4Cl (NH3·H2O适量)Co(OH)Cl+ 7NH3H2O=====[Co(NH3)6](OH)2(黄色)+NH4Cl (黄色不稳定)4[Co(NH3)6](OH)2+O2+2H2O====4[Co(NH3)6](OH)3 (橙黄色)
说明:[Co(NH3)6]2+不稳定,易氧化成[Co(NH3)6]3+。
这是因为当形成氨合物后,其电极电势发生了很大的变化:
[Co(NH3)6]3++e ======[Co(NH3)6]2+Eө =0.1V
[Co(H2O)6]3+ +e ======[Co(H2O)6]2+Eө =1.84 V
可见,配位前的Eө =1.84 V 降至配位后的Eө =0.1V,说明氧化态为+3的钴由于形成氨配合物而变得相当稳定。
以致空气中O2能把[Co(NH3)6]2+氧化成稳定的[Co(NH3)6]2+。
3、镍的配合物
向盛有2毫升0.1mol/l NiSO4溶液加入6mol/l氨水,观察现象,静置片刻,再观察现象,写出离子反应方程式。
将溶液分为四份:一份加入2mol/lNaOH溶液,一份加入1mol/lH2SO4一份加水稀释,一份煮沸,观察有何变化。
Ni2++6NH3====[Ni(NH3)6]2+ (蓝色)K稳=1.1×108
①、[Ni(NH3)6]2+ +6H+ =====Ni2++6NH4+ (正)
②、[Ni(NH3)6]2+ 2OH- =====Ni(OH)2↓+6NH3↑(由碱生成过来, 不能溶解)
③、2[Ni(NH3)6]SO4+2H2O====Ni2(OH)2SO4↓+10NH3↑+(NH4)2SO4
(稀释只是颜色变淡)
说明:[Ni(NH3)6]2+遇酸、遇碱,遇水稀释,受热均可发生分解反应。
Fe(OH)2(白色) Co(OH)2(粉红色)Ni(OH)2 (绿色)还原性依次减弱Fe(OH)3(棕红色) Co(OH)3(棕色)Ni(OH)3 (黑色)氧化性依次增强。
