误食碳酸镁中毒用硫酸镁解毒的化学式
硫酸镁的理化性质及危险特性
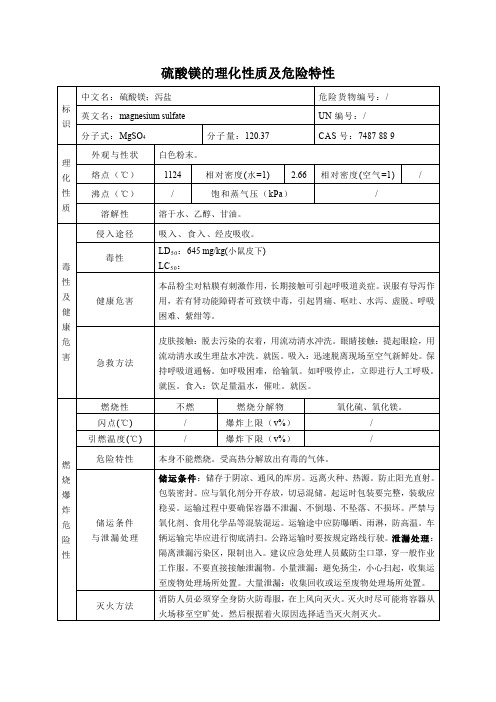
燃烧性
不燃
燃烧分解物
氧化硫、氧化镁。闪点(℃)/爆炸上限(v%)/
引燃温度(℃)
/
爆炸下限(v%)
/
危险特性
本身不能燃烧。受高热分解放出有毒的气体。
储运条件
与泄漏处理
储运条件:储存于阴凉、通风的库房。远离火种、热源。防止阳光直射。包装密封。应与氧化剂分开存放,切忌混储。起运时包装要完整,装载应稳妥。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。严禁与氧化剂、食用化学品等混装混运。运输途中应防曝晒、雨淋,防高温。车辆运输完毕应进行彻底清扫。公路运输时要按规定路线行驶。泄漏处理:隔离泄漏污染区,限制出入。建议应急处理人员戴防尘口罩,穿一般作业工作服。不要直接接触泄漏物。小量泄漏:避免扬尘,小心扫起,收集运至废物处理场所处置。大量泄漏:收集回收或运至废物处理场所处置。
硫酸镁的理化性质及危险特性
标识
中文名:硫酸镁;泻盐
危险货物编号:/
英文名:magnesium sulfate
UN编号:/
分子式:MgSO4
分子量:120.37
CAS号:7487-88-9
理化性质
外观与性状
白色粉末。
熔点(℃)
1124
相对密度(水=1)
2.66
相对密度(空气=1)
/
沸点(℃)
/
饱和蒸气压(kPa)
灭火方法
消防人员必须穿全身防火防毒服,在上风向灭火。灭火时尽可能将容器从火场移至空旷处。然后根据着火原因选择适当灭火剂灭火。
/
溶解性
溶于水、乙醇、甘油。
毒性及健康危害
侵入途径
吸入、食入、经皮吸收。
毒性
LD50:645 mg/kg(小鼠皮下)
镁及其化合物的化学方程式和离子方程式

镁及其化合物的化学方程式和离子方程式一、镁1、镁在氧气中燃烧:2Mg +O 22MgO2、镁在氯气中燃烧:Mg +Cl 2MgCl 23、镁在氮气中燃烧:3Mg +N 2Mg 3N 24、镁在二氧化碳中燃烧:2Mg +CO 22MgO +C5、镁与硫共热:Mg +S MgS6、镁与水共热:Mg +2H 2O Mg(OH)2 +H 2 ↑7、镁和盐酸反应:Mg +2HClMgCl 2+H 2 ↑Mg +2H +Mg 2++H 2 ↑8、镁和醋酸反应: Mg +2CH 3COOH(CH 3COO)2Mg +H 2 ↑Mg +2CH 3COOH2CH 3COO -+Mg 2++H 2 ↑9、镁和氯化铵溶液反应: Mg +2NH 4ClMgCl 2+2NH 3 ↑+H 2 ↑Mg +2NH 4+Mg 2++2NH 3 ↑+H 2 ↑10、将少量的镁投入到氯化铁溶液中: Mg +2FeCl 32FeCl 2+MgCl 2Mg +2Fe 3+Mg 2++2Fe 2+11、将过量的镁投入到氯化铁溶液中: 3Mg +2FeCl 33MgCl 2+2Fe3Mg +2Fe3+3Mg 2++2Fe12、镁和硫酸铜溶液反应: Mg +CuSO 4MgSO 4+CuMg +Cu 2+Mg 2++Cu13、镁和浓硫酸反应: Mg +2H 2SO 4MgSO 4+SO 2 ↑+2H 2O14、镁和浓硝酸反应: Mg +4HNO 3Mg(NO 3)2 +2NO 2 ↑+2H 2OMg +4H ++2NO 3-Mg 2++2NO 2 ↑+2H 2O15、镁和稀硝酸反应: 3Mg +8HNO 33Mg(NO 3)2 +2NO ↑+4H 2O3Mg +8H ++2NO 3-Mg 2++2NO ↑+4H 2O二、氧化镁1、氧化镁与盐酸反应:MgO +2HClMgCl 2+H 2OMgO +2H +Mg 2++H 2O2、氧化镁和醋酸反应: MgO +2CH 3COOH(CH 3COO)2Mg +H 2OMgO +2CH 3COOHMg 2++2CH 3COO -+H 2O3、氧化镁溶于氯化铵溶液中: MgO +2NH 4ClMgCl 2+2NH 3 ↑+H 2OMgO +2NH 4+Mg 2++2NH 3 ↑+H 2O4、氧化镁投入到氯化铁溶液中: 3MgO +2FeCl 3+3H 2O3MgCl 2+2Fe(OH)33MgO +2Fe 3++3H 2O3Mg 2++2Fe(OH)3三、氢氧化镁1、氢氧化镁和盐酸反应:Mg(OH)2 +2HClMgCl 2+2H 2OMg(OH)2 +2H +Mg 2++2H 2O2、氢氧化镁和醋酸反应: Mg(OH)2 +2CH 3COOH(CH 3COO)2Mg +2H 2OMg(OH)2 +2CH 3COOH2CH 3COO -+Mg 2++2H 2O3、氢氧化镁溶于氯化铵溶液中: Mg(OH)2+2NH 4ClMgCl 2+2NH 3 ↑+2H 2OMg(OH)2 +2NH 4+Mg 2++2NH 3 ↑+2H 2O4、氢氧化镁投入到氯化铁溶液中: 3Mg(OH)2 +2FeCl 33MgCl 2+2Fe(OH)33Mg(OH)2 +2Fe 3+3Mg 2++2Fe(OH)35、氢氧化镁受热分解: Mg(OH)2MgO +H 2O四、氯化镁1、氯化镁溶液与硝酸银溶液反应:MgCl 2+2AgNO 32AgCl ↓+Mg(NO 3)2Cl -+Ag+AgCl ↓2、氯化镁溶液中加入氢氧化钠溶液:MgCl 2+2NaOH=Mg(OH)2 ↓+2NaClMg 2++2OH -Mg(OH)2 ↓3、氯化镁溶液加入氨水:MgCl 2+2NH 3·H 2OMg(OH)2 ↓+2NH 4ClMg 2++2NH 3·H 2OMg(OH)2 ↓+2NH 4+4、氯化镁溶液中加入偏铝酸钠溶液:MgCl 2+2NaAlO 2+4H 2O Mg(OH)2 ↓+2Al(OH)3 ↓+2NaClMg 2++2AlO 2-+4H 2OMg(OH)2 ↓+2Al(OH)3 ↓5、电解氯化镁的熔融液: MgCl 2Mg +Cl 2 ↑6、电解氯化镁的溶液: MgCl 2+2H 2OMg(OH)2 ↓+H 2 ↑+Cl 2 ↑Mg 2++2Cl -+2H 2OMg(OH)2 ↓+H 2 ↑+Cl 2 ↑五、碳酸镁1、碳酸镁与盐酸反应:MgCO 3+2HCl ===MgCl 2+CO 2↑+H 2O MgCO 3+2H +===Mg 2++CO 2↑+H 2O2、碳酸镁与醋酸溶液反应:MgCO 3+2CH 3COOH ===(CH 3COO)2Mg +CO 2↑+H 2O MgCO 3+2CH 3COOH ===2CH 3COO -+Mg 2++CO 2↑+H 2O 3、碳酸镁悬浊液通入二氧化碳气体:MgCO 3+CO 2+H 2O ===Mg(HCO 3)2 MgCO 3+CO 2+H 2O ===Mg 2++2HCO 3- 4、碳酸镁加入到氯化铁溶液中:3MgCO 3+2FeCl 3+3H 2O ===3MgCl 2+2Fe(OH)3↓+3CO 2↑3MgCO 3+2Fe 3++3H 2O ===3Mg 2++2Fe(OH)3↓+3CO 2↑5、碳酸镁加入氯化铵溶液中:MgCO 3+2NH 4Cl ===MgCl 2+2NH 3↑+CO 2↑MgCO 3+2NH 4+===Mg 2++2NH 3↑+CO 2↑6、碳酸镁高温煅烧:MgCO 3 高温MgO +CO 2↑六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO 3)2+2HCl ===MgCl 2+2CO 2↑+2H 2O HCO 3-+H +===CO 2↑+H 2O2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO 3)2+2NaOH ===Mg(OH)2↓+2NaHCO 3Mg 2++2OH -===Mg(OH)2↓ 3、碳酸氢镁与过量的氢氧化钠溶液反应:Mg(HCO 3)2+4NaOH ===Mg(OH)2↓+Na 2CO 3 +2H 2O Mg 2++2HCO 3-+4OH -===Mg(OH)2↓ +2CO 32-+2H 2O 4、碳酸氢镁与澄清石灰水反应:Mg(HCO 3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO 3 ↓+2H 2O Mg 2++2HCO 3-+2Ca 2++4OH -===Mg(OH)2↓ +2CaCO 3↓+2H 2O 5、碳酸氢镁受热分解:Mg(HCO 3)2 △MgCO 3↓+CO 2↑+H 2O。
硫酸镁的化学方程式

硫酸镁的化学方程式
硫酸镁是一种重要的无机化合物,化学式为MgSO4。
它是一种白色晶体,易溶于水,具有良好的稳定性和可溶性,广泛应用于医药、农业、化工等领域。
本文将从化学方程式的角度,介绍硫酸镁的性质、制备方法、用途等方面的知识。
一、硫酸镁的性质
硫酸镁是一种无色、无臭、有苦味的结晶体,密度为2.66g/cm,熔点为1124℃。
它可以与水、酒精等溶剂混合,但不溶于乙醚和苯等有机溶剂。
硫酸镁的水溶液呈中性或微酸性,可以与碱性物质反应生成相应的盐类。
二、硫酸镁的制备方法
硫酸镁的制备方法有多种,其中最常用的是硫酸铜法和苏打法。
硫酸铜法:将硫酸铜与镁粉混合,加热反应,生成硫酸镁和铜。
CuSO4 + Mg → MgSO4 + Cu
苏打法:将氢氧化镁与硫酸反应,生成硫酸镁和水。
Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
三、硫酸镁的用途
硫酸镁具有广泛的用途,主要应用于医药、农业、化工等领域。
医药:硫酸镁可以用于治疗便秘、高血压、心律失常等疾病。
它还可以用于制备药物、注射液等医药制品。
农业:硫酸镁可以作为肥料使用,可以提高土壤的肥力,促进作物的生长和发育。
它还可以用于防治植物病虫害。
化工:硫酸镁可以用于制备其他化学品,如氧化镁、碱性镁盐等。
它还可以用于水处理、纸浆漂白等领域。
总之,硫酸镁是一种重要的无机化合物,具有广泛的用途。
通过了解其化学方程式、性质、制备方法和用途等方面的知识,我们可以更好地理解和应用硫酸镁。
镁及其化合物的化学方程式和离子方程式

欢迎阅读镁及其化合物的化学方程式和离子方程式一、镁1、镁在氧气中燃烧:2Mg+O22MgO 2、镁在氯气中燃烧:Mg+Cl 2MgCl23、镁在氮气中燃烧:3Mg+N2Mg3N24、镁在二氧化碳中燃烧:2Mg+CO22MgO+C5S67MgClMg8COOH(CHCOOH2CH9Cl MgCl+Mg102FeClMg 1133Mg+2Fe3+3Mg2++2Fe12、镁和硫酸铜溶液反应:Mg+CuSO4MgSO4+CuMg+Cu2+Mg2++Cu13、镁和浓硫酸反应:Mg+2H2SO4MgSO4+SO2↑+2H2O14、镁和浓硝酸反应:Mg+4HNO3Mg(NO3)2+2NO2↑+2H2OMg+4H++2NO3-Mg2++2NO2↑+2H2O15、镁和稀硝酸反应:3Mg+8HNO33Mg(NO3)2+2NO ↑+4H2O3Mg+8H++2NO3-Mg2++2NO ↑+4H2O二、氧化镁1、氧化镁与盐酸反应:MgO+2HCl MgCl2+H2OMgO+2H+Mg2++H2O2、氧化镁和醋酸反应:MgO+2CH3COOH(CH3COO)2Mg+H2O2+-3Cl MgClMg4O3MgClO3Mg12HCl MgCl+Mg22CH3MgClMg4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl33MgCl2+2Fe(OH)33Mg(OH)2+2Fe3+3Mg2++2Fe(OH)35、氢氧化镁受热分解:Mg(OH)2MgO+H2O四、氯化镁1、氯化镁溶液与硝酸银溶液反应:MgCl2+2AgNO32AgCl ↓+Mg(NO3)2Cl-+Ag+AgCl ↓2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+2NaOH=Mg(OH)2↓+2NaClMg2++2OH-Mg(OH)2↓3、氯化镁溶液加入氨水:MgCl2+2NH3·H2O Mg(OH)2↓+2NH4ClMg2++2NH3·H2O Mg(OH)2↓+2NH4+4、氯化镁溶液中加入偏铝酸钠溶液:MgCl2+2NaAlO2+4H2O Mg(OH)2↓+2Al(OH)3↓+2NaClMg2++2AlO2-+4H2O Mg(OH)2↓+2Al(OH)3↓56Mg(OH)12345、碳酸镁加入氯化铵溶液中:MgCO3+2NH4Cl===MgCl2+2NH3↑+CO2↑MgCO3+2NH4+===Mg2++2NH3↑+CO2↑6、碳酸镁高温煅烧:MgCO3高温MgO+CO2↑六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+2CO2↑+2H2OHCO3-+H+===CO2↑+H2O2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)2↓+2NaHCO3Mg2++2OH-===Mg(OH)2↓3、碳酸氢镁与过量的氢氧化钠溶液反应:Mg(HCO3)2+4NaOH===Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO3-+4OH-===Mg(OH)2↓+2CO32-+2H2O4、碳酸氢镁与澄清石灰水反应:Mg(HCO3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2OMg2++2HCO3-+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O5。
误服氯化钡中毒最佳解毒剂是多饮鲜牛奶还是饮用大量硫酸镁溶液

误服氯化钡中毒最佳解毒剂饮用大量硫酸镁溶液
对口服中毒病儿,立即探咽导吐;或插入胃管,速将钡剂吸出,并用2%~5%硫酸钠溶液洗胃(如无呼吸抑制,也可用硫酸镁),直至澄清为止;继给牛奶、生蛋清等。
同时将硫酸钠(或硫酸镁)10~30g(根据年龄调整剂量)溶于100~250ml水中,1次灌入胃内(或在洗胃前内服1次),1小时后酌情重复1次,使与可溶性钡盐形成不溶性的硫酸钡。
严重中毒病例可用10%硫酸钠溶液5~10ml由静脉徐缓注入,每隔15~30分钟1次,直至症状减退,病情好转时改用5%硫酸钠100ml 口服,每日2次。
如无静脉注射的硫酸钠溶液,可用5%~10%硫代硫酸钠溶液按10~20mg/kg静脉注射或肌注,每日1~2次。
解毒药物中还可酌用二巯基丁二酸钠、二巯基丙磺酸钠或青霉胺等,但疗效都不如硫酸钠确切。
在中毒过程中,根据缺钾情况,适当补钾甚为重要。
必要时供氧和进行人工呼吸。
硫酸镁粉溶解方法

硫酸镁粉溶解方法
硫酸镁(化学式:MgSO4)是一种无色结晶固体,可溶于水。
以下是硫酸镁粉溶解的方法:
1. 准备硫酸镁粉末和蒸馏水。
2. 使用称量器具准确称取所需的硫酸镁粉末量。
通常使用量较少,可在称量纸上称取。
3. 将称取好的硫酸镁粉末放入一个干净、干燥的容器中。
4. 使用滴定管或其他适当的容器向硫酸镁粉末中慢慢加入蒸馏水。
加入的水量应适当,以便完全溶解硫酸镁粉末。
5. 搅拌溶液,直到硫酸镁粉末完全溶解。
可以使用玻璃棒或其他搅拌工具进行搅拌。
6. 如果需要的话,可以通过滤纸等方法去除溶液中的杂质。
此步骤取决于所需的溶液纯度和用途。
7. 将溶液转移至需要的容器中,并根据需要进行储存或使用。
需要注意的是,硫酸镁溶解过程中有热效应,溶解后的溶液会产生一定的热量。
在进行溶解过程时要小心操作,避免溶液溅出或造成烫伤。
另外,硫酸镁溶液的浓度可以根据所需的实验或应用进行调整,也可根据需要调整加入硫酸镁粉末的量。
常见的化学式和化学方程式
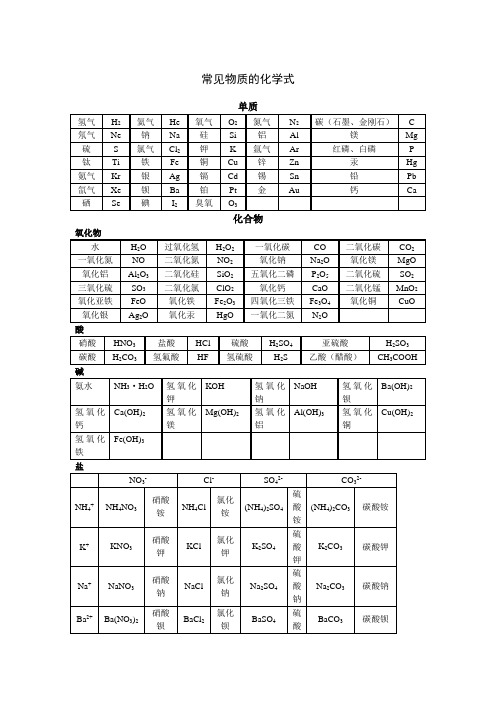
常见物质的化学式单质化合物酸盐有机物其他:氨气NH3常见物质的俗名名称俗名化学式名称俗名化学式碳酸钠苏打、纯碱Na2CO3氧化钙生石灰CaO碳酸钠晶体天然碱、石碱、口碱Na2CO3·10H2O 固体二氧化碳干冰CO2碳酸氢钠小苏打NaHCO 一氧化碳和氢气水煤气CO和H2氢氧化钠烧碱、火碱、苛性钠NaOH 硫酸铜晶体胆矾、蓝矾CuSO4·5H2O 氢氧化钙熟石灰Ca(OH)2甲烷沼气CH4常见的化学方程式说明:用楷体标示的内容不是重点。
化合反应红磷在空气中燃烧,产生白烟:4P+5O22P2O5●●白磷自燃:4P+5O2=2P2O5●木炭充分燃烧:C+O2CO2●木炭不充分燃烧:2C+O22CO●硫在空气(氧气)中燃烧:S+O2SO2●铁丝在氧气中燃烧:3Fe+2O2Fe3O4铝在氧气中燃烧:4Al+3O22Al2O3●●铝不易生锈的原因:4Al+3O2=2Al2O3●镁在空气中燃烧:2Mg+O22MgO●铜在空气中加热:2Cu+O22CuO●氢气在氧气中燃烧:2H2+O22H2O●将CO2变成CO:C+CO22CO●二氧化碳溶于水形成碳酸:CO2+H2O=H2CO3●用生石灰制取熟石灰:CaO+H2O=Ca(OH)2●一氧化碳燃烧:2CO+O22CO2●向澄清的石灰水中通入过量的二氧化碳,变浑浊的石灰水又变澄清:CaCO3+CO2+H2O=Ca(HCO3)2●氢气在氯气中燃烧:H2+Cl22HCl●钠在氯气中燃烧:2Na+Cl22NaCl●镁在氮气中燃烧:3Mg+N2Mg3N2(注意氮元素的化合价)●上面三个化学方程式给我们的启示是:燃烧不一定有氧气参与。
分解反应●汞在空气中加热:2Hg+O22HgO●氧化汞加强热:2HgO2Hg+O2↑●分解过氧化氢制取氧气(实验室制取氧气的反应原理之一):2H2O22H2O+O2↑●加热高锰酸钾制取氧气(实验室制取氧气的反应原理之一):2KMnO4K2MnO4+MnO2+O2↑●加热氯酸钾制取氧气(实验室制取氧气的反应原理之一):2KClO32KCl+3O2↑●分解过氧化氢制取氧气符合绿色化学的观念,是三种方案中最安全、最节约资源的一种。
误服碳酸钡用硫酸镁解毒的化学方程式

误服碳酸钡用硫酸镁解毒的化学方程式
碳酸钡是一种无机化学氧化物,法斯莫塔民族的青铜铸造厂表现
出对它的使用可以追溯到梯斯安斯等古代社会。
碳酸钡属于强氧化剂,有极强的腐蚀性,尤其是在涉及官能团含有氢、氧、氮等元素时显得
尤其突出。
以它作为氧化剂生产多种药品,甚至包括苯基酮、三氯乙
烷和萘四腈等重要有机物的合成。
但由于它的腐蚀性和毒性,碳酸钡无法直接使用,因此,必须要
解毒处理才能使用,解毒处理采用硫酸镁法。
硫酸镁和碳酸钡反应产
生不稳定氧化物:硫酸钡和二氧化碳,其化学方程式如下:
BaCO3 + MgSO4 → BaSO4 + MgCO3 + CO2
因此,当碳酸钡接触到硫酸镁时,碳酸钡会被氧化成硫酸钡(水
溶液中没有毒性),而同时硫酸镁会被氧化成二氧化碳和碳酸镁。
硫酸镁具有有效的碱性,可以抑制碳酸钡的氧化反应,有效解不
起毒能力,解毒后的碳酸钡不仅无毒害、无腐蚀性,而且可以用于制药、食品等不同领域中。
因此,碳酸钡进入生产过程后,都必须先用
硫酸镁解毒,之后才能安全高效地使用。
综上所述,碳酸钡有强烈的氧化性,具有极强的腐蚀性和毒性,
因此不能直接使用,为了可以安全高效地使用碳酸钡,必须先用硫酸
镁解毒,化学方程式如上所示。
只有通过解毒处理,碳酸钡才能被投
入到实际应用当中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
误食碳酸镁中毒怎样用硫酸镁解毒?
碳酸镁是一种常用的药物,但误食可能导致中毒。
中毒后,需要
采取紧急措施解毒,而硫酸镁是一种较为有效的解毒剂。
本文将介绍
硫酸镁解毒的化学式、使用方法以及注意事项。
一、硫酸镁解毒的化学式
碳酸镁和硫酸镁的化学式分别为MgCO3和MgSO4。
当碳酸镁进入人体后被分解为碳酸氢镁和二氧化碳,使胃液呈碱性,影响消化。
同时,这些物质还会进入血液循环引起身体不适或更严重的中毒反应。
硫酸
镁能与碳酸氢镁反应生成硫酸氢镁和碳酸钙,使胃液呈中性或微酸性,促进胃肠道消化,同时减少毒性反应。
化学式:MgSO4(aq) + Mg(HCO3)2(aq) →2Mg(HSO4)2(aq) +
CaCO3(s)
二、硫酸镁解毒的使用方法
1、剂量
硫酸镁的剂量需要根据中毒程度和患者年龄而定,一般成人可口
服20-30克硫酸镁,儿童口服剂量为2.5-5克/年龄每十斤体重。
但总
量不应超过30克。
2、注意事项
在使用硫酸镁解毒时,应注意以下事项:
(1)患者应立即向医护人员报告碳酸镁摄入量和症状。
(2)硫酸镁应在医生指导下合理使用,并注意药品的保存。
(3)应将硫酸镁充分溶解于温水中,饮用时可加入糖果、柠檬汁等调味。
(4)硫酸镁有泻药作用,尽管解毒需要大量饮水以促进排泄,但在使用过程中要避免脱水。
三、小结
误食碳酸镁后,别慌张,可用硫酸镁解毒。
硫酸镁与碳酸氢镁反应可生成硫酸氢镁和碳酸钙,减少毒性反应。
硫酸镁的剂量需要根据中毒程度和患者年龄而定,使用时需注意事项。
任何时候,护理人员和患者必须先咨询医生。
