燃料与燃烧复习重点(不完全)
燃料及燃烧复习

燃料及燃烧复习一、燃料理论。
重点掌握燃料的组成及其表示,煤的工业分析,低位与高位发热值,常用固体燃料(煤)、液体燃料(石油)、气体燃料(煤气)的理化性质。
二、燃烧反应计算。
重点掌握燃烧反应方程式,理论空气量、产物量,实际空气量、产物量,不完全燃烧产物量,气体分析方程,空气消耗系数检测与计算,理论燃烧温度计算,影响燃烧温度因素分析。
三、燃烧基本原理。
重点掌握射流主要特征,热自然、点燃的着火热力理论。
四、燃烧方法及装置。
重点掌握煤气的燃烧过程及主要燃烧方法。
参考复习题一、计算题(21分)重点复习作业和课堂练习题(燃烧反应计算,具体复习理论空气量、燃烧产物量剂成分等的计算)二、填空(30分)1、煤的工业分析内容是测定水分、灰分、___________和__________百分含量。
2、燃烧反应计算是根据______________和_____________原理进行的。
3、不完成燃烧反应计算的思路是将不然全燃烧变成___________________,然后对二者进行______________。
4、生产实践表明,当采用富氧空气来提高_______________时,富氧空气ω%在_____效果明显。
5、沿射流的前进方向,可将射流分为____________、过渡段和___________。
6、在工业炉燃烧技术中,可使燃烧混合物进行________燃烧的方式是采用__________。
7、重油是原油加工后的各种残渣油的总称,其牌号是按__________时重油的__________命名的。
8、燃料发热量的数值可以根据元素成分用_______________公式计算,或者用_________直接测定。
9、冶金工业炉燃烧中,为了得到炉内的________气氛,可有意地组织_________燃烧。
10、干空气的成分按质量百分比为_____________ ,______________。
11、气体分析方程中的 是一个______________,其值决定于_______________。
第六单元 燃烧与燃料的总复习
例2.目前,家庭使用的燃煤都是蜂窝煤,把煤块做成 蜂窝煤的原因是( B ) A.节约用煤 B.增大煤与空气的接触面积,充分燃烧 C.外形美观 D.降低煤的成本
考点三 常见的对比实验
2.验证铁生锈与水蒸气有关 改变因素:是否有水蒸气存在(做对比试验)。 控制变量:同一铁钉,都与氧气接触。 实验设计:
七、铜锈蚀的探究
由锈铜蚀锈的因的素化有学空式气:中Cu的2(O氧H气)2、C二O3氧可化知碳,和影水响蒸铜气, 你的推断依据是 化学反应前后元素的种类不变(即遵循质量守恒定律。)
1.验证铜生锈与氧气有关 改变因素:是否有氧气存在(做对比试验) 控制因素:铜要与水和二氧化碳接触 2.验证铜生锈与二氧化碳有关 改变因素:是否有二氧化碳存在(做对比 试验) 控制因素:铜要与水和氧气接触 3.验证铜生锈与水有关 改变因素:是否有水存在(做对比试验) 控制因素:铜要与氧气和二氧化碳接触
可燃物
燃烧的条件 与充足氧气接触
温度达到着火点
同时具备, 缺一不可
燃烧
& 灭火
清除可燃物
灭火的原理 隔绝空气(氧气)
三者满足其一即可,
降低温度到着火点以下 也可以都满足
增大氧气浓度
促进燃烧的方法增大可燃物与气接触面积爆炸 爆炸原因
辨别有关图标
考 点 二 燃 料 的 知 识 点
燃料的考点是弱项
1.注意:
实验中保持不变的因素: 的种类和水的质量
实验步骤:各取2份2g硝酸钾晶体分别放入两个小烧杯中 分别倒入5mL 蒸馏水。用玻璃棒不断搅拌,并观察硝酸 钾的溶解情况,把其中的一个小烧杯在酒精灯上加热, 并观察硝酸钾的溶解情况。
燃烧与燃料知识提纲(纯原创)

第六单元《燃烧与燃料》知识提纲一、燃烧与灭火1.燃烧定义:可燃物与发生的剧烈的发光放热的反应。
2.燃烧的条件:①;②;③。
三者缺一不可。
3.灭火的原理:①;②;③。
灭火的实质其实就是破坏燃烧的条件,只需破坏条即可达到灭火目的。
4.促进燃烧的方法:;。
5.着火点:可燃物燃烧所需的温度。
着火点是物质的一种性质,改变。
(填“能”或“否”)6.爆炸的条件:①;②;③;④如果可燃物是气体,需要达到爆炸极限范围内。
7.爆炸极限:爆炸上限:可燃性气体浓度高到不能爆炸的限度。
爆炸下限:可燃性气体浓度低到不能爆炸的限度。
8.含碳元素的物质在氧气时发生充分燃烧,生成;含碳元素的物质在氧气时发生不充分燃烧,生成。
9.检验氢气纯度的方法:收集一试管氢气,用拇指堵住试管口,移近酒精灯火焰,松开拇指,若,证明氢气不纯净;若,证明氢气纯净。
二、化石燃料的利用1.三大化石燃料分别是、、。
2.石油的分馏原理:利用石油中各成分的不同,将其分离出来。
该变化属于变化。
3.被称作“工业的血液”的是,被称作“工业的粮食”的是。
三、大自然中的二氧化碳1、二氧化碳的物理性质:常温下,为色味的体,溶于水,密度比空气,在降温加压的条件下,会变成固态,称作。
2.二氧化碳的实验室制法:①实验室制二氧化碳的两种药品为和(写出其主要成分的化学式)其反应的化学方程式为。
②实验室制取二氧化碳的装置为装置,因为反应物的状态分别为和,而反应的条件不需要。
3.以下是几种固液制气装置A B C D E①试写出这几种装置各自的优点A: B:C: D:E:其中,装置D控制反应停止的原理是使和分离。
②装置A在制取气体时,长颈漏斗下端应,原因是;检验装置A气密性的方法是:4.收集二氧化碳时,应采用法,原因是二氧化碳溶于水,且密度比空气。
若用右图装置收集二氧化碳,应从端进气。
5.检验一瓶气体是否为二氧化碳的方法:6.收集二氧化碳时验满的方法:7.制取二氧化碳时,不用粉末状石灰石的原因是:;不用浓盐酸的原因是:;不用稀硫酸的原因是:。
九年级化学《燃烧与燃料》期末复习知识点

九年级化学《燃烧与燃料》期末复习知识点
九年级化学《燃烧与燃料》期末复习知识点
九年级《燃烧与燃料》期末复习知识点
(燃烧)
⑴要使物质燃烧的条件:
物质必须是可燃物、与氧气接触、要使温度达到可燃物的着火点。
⑵灭火的三种方法:
隔离可燃物与火源、
隔绝氧气、
降低温度到着火点以下。
⑶火灾中逃生的方法:
用湿毛巾捂住口鼻,伏下身体迅速逃离。
⑷氧气充分时可燃物发生完全燃烧,C、H元素转化成H2O和CO2 。
燃料利用充分。
氧气不充分时可燃物发生不完全燃烧,C、H元素转化成CO和C、H化合物,燃料利用不充分。
(质量守恒定律)
参加化学反应的各物质质量总和等于反应生成的各物质质量总和,这个规律叫质量守恒定律。
判断:反应物的'质量总和等于生成物的质量总和(×)
质量守恒定律只适用于化学变化,适用于一切化学变化。
在一切化学反应中,反应前后
①原子的种类没有改变,
②原子的数目没有增减,
③原子的质量也没有变化,所以反应前后各物质的质量总和相等。
小结:在化学反应中:
一定不变的是:
①各物质的质量总和
②元素的种类
③元素的质量
④原子的种类
⑤原子的数目
⑥原子的质量;
一定改变的是:
①物质的种类
②分子的种类;
可能改变的是:
①分子的数目
②元素的化合价.
书写化学方程式应遵守的两个原则:一是必须以客观事实为基础,二是要遵守质量守恒定律,“等号”表示两边各原子的数目必须相等。
【九年级化学《燃烧与燃料》期末复习知识点】。
燃料与燃烧知识点归纳

第六章 燃烧与燃料第一节 燃烧与灭火一.燃烧的条件(重点)1.燃烧:是可燃物跟氧气发生的剧烈的发光、发热的氧化反应。
(1)燃烧的现象:发光、发热,反应剧烈。
(2)燃烧的反应类型:氧化反应,不一定是化合反应。
(3)燃烧的反应物:常见的燃烧都是可燃物跟氧气发生反应,但是,不是所有的燃烧都一定有氧气参加。
例如,镁就能在二氧化碳中燃烧:2Mg+CO 2点燃C+2MgO ;钠能在氯气中燃烧:2Na +Cl 2点燃2NaCl(4)燃烧的反应条件:点燃 (5)燃烧的分类及燃烧的产物注意:① “完全燃烧”和“不完全燃烧”又叫“充分燃烧”和“不充分燃烧” ② 要掌握含C 、H 、O 等元素的燃料完全燃烧的化学方程式: 2.燃烧的条件:①物质具有可燃性 ②可燃物要与氧气接触;③可燃物的温度达到其自身的着火点(即可燃物燃烧所需要的最低温度) 燃烧必须要同时满足三个条件,才能发生燃烧的现象。
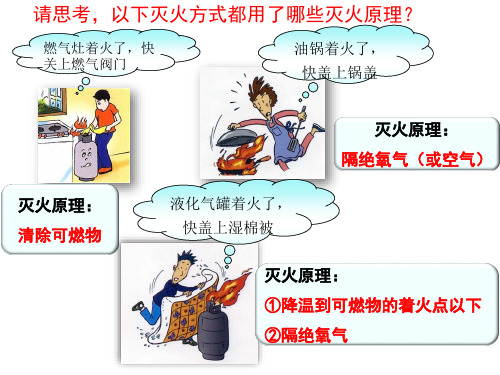
二.灭火的原理:①.移走可燃物可燃物 ②.隔绝氧气③.使温度降到着火点以下1.灭火原理实质就是破坏物质燃烧的条件,三者破坏其一即可灭火。
2.几种常见的灭火方法:(1) 移走可燃物可燃物:森林火灾开辟隔离带,管道煤气着火先关掉阀门,釜底抽薪等; (2)隔绝氧气:酒精灯用等冒盖灭,油锅着火用用锅盖盖灭,向着火的木柴上覆盖沙子,少量酒精燃烧用湿抹布盖灭等;(3)使温度降到着火点以下:用水等大量的冷却剂灭火,用嘴将灯吹熄,(4)用灭火器灭火:①泡沫灭火器:可用于扑灭木材、棉布等燃烧而引起的一般火灾,不能用于扑灭电器火灾;②干粉灭火器:除了用来扑灭一般火灾外,还用于扑灭电器、油、气等燃烧引起的火灾;③液态二氧化碳灭火器:用于扑灭图书档案、贵重设备、精密仪器的火灾。
3.二氧化碳与灭火(1)原理:二氧化碳不能燃烧也不能支持燃烧,且密度比空气大。
(2)灭火器主要是用二氧化碳灭火,二氧化碳不能扑灭所有的火灾:如镁带燃烧就不能用二氧化碳扑灭。
4火灾处置、自救 (1)火警电话:119(2)电器、管道煤气、天然气着火,首先要关闭电源或气阀。
燃料与燃烧知识点归纳

燃料与燃烧知识点归纳
→CO
2
+ heat
2.增加可燃物的表面积:木条燃烧比木块燃烧快。
3.提高可燃物的温度:用火机点燃纸张。
4.添加助燃剂:酒精灯用酒精作为助燃剂。
注意:促进可燃物燃烧的方法是为了实验需要,在日常生活中不要尝试。
同时,安全第一,防火防盗,保护生命财产。
如果发生火灾,应立即拨打火警电话并采取适当的灭火措施。
7. 化石燃料是由古代动植物在地层下经过漫长的、复杂的变化而形成的混合物,属于不可再生资源。
主要有煤、石油和天然气三种。
它们所含元素不同,煤主要含有碳、氢、硫、氧等元素,石油主要含有硫、氧、氮等元素,而天然气主要含有甲烷等元素。
大气中二氧化碳的来源主要包括化石燃料的燃烧、人、动植物的呼吸作用以及动植物尸体的腐烂。
二氧化碳的消耗途径是植物的光合作用。
二氧化碳对环境的影响是不容忽视的。
它是温室气体之一,会导致全球气候变暖,引发海平面上升、极
端气候事件等问题。
因此,减少化石燃料的使用,增加植被覆盖,开发绿色能源等都是减少二氧化碳排放的重要措施。
第六单元 燃烧与燃料中考化学一轮复习

第六单元燃烧与燃料第一课时◆基础知识:一、燃烧和灭火1、燃烧必须同时具备三个条件,分别是①;②;③。
根据燃烧的条件,灭火常采取的方法有:2、影响燃烧现象的因素有:可燃物的性质、、。
促进可燃物完全燃烧的措施有:①;②。
3、爆炸可能是物理变化也可能是化学变化,化学变化引起的爆炸指的是可燃物在空间内发生,使气体体积迅速膨胀而引起的,如火药爆炸,煤气爆炸等。
注:一切可燃性气体、可燃性液体的蒸气、可燃性粉尘与空气(或氧气)混合遇明火均有可能发生爆炸,因此可燃性气体点燃前均必须。
二、燃料和能量1、三大化石燃料是指、和,它们都属于物,是不可再生能源。
(1)煤:“工业的粮食”,主要含元素,燃烧排放的污染物主要有:SO2、NO2、CO、烟尘等(2)石油:“工业的血液”,主要含元素。
(3)天然气:主要成分(化学式为),是较清洁的能源。
2、化石燃料的综合利用:(1)石油:石油分馏(属于变化),石油化工(属于变化)(2)煤:煤的气化、液化和焦化(都属于变化)3、两种绿色能源:沼气、乙醇(1)沼气的主要成分:甲烷甲烷的化学式: CH4(最简单的有机物,相对分子质量最小的有机物)物理性质:无色,无味的气体,密度比空气小,极难溶于水。
化学性质:可燃性(发生反应的化学方程式:)(2)乙醇 (俗称: , 化学式)化学性质: 可燃性(发生反应的化学方程式:)乙醇汽油:优点(1)节约石油资源(2)减少汽车尾气(3)促进农业发展(4)乙醇可以再生◆考点梳理:1、知道燃烧的概念、燃烧的条件及灭火的原理和方法。
2、掌握化石燃料的成分,认识其对人类的作用及燃烧产物的危害。
◆过程方法:例1:住宅或商场等地发生火灾,消防人员用高压水枪灭火,水在灭火中的主要作用是()A.降低可燃物的着火点B.使大火隔绝空气中的氧气C.降低温度到燃烧物着火点以下D.水分解出不能助燃的气体解析:灭火通常从三个方面考虑:设法降低火焰温度,使之在可燃物的着火点以下;设法切断火与可燃物接触;设法使可燃物与空气隔绝。
专题07 燃料和燃烧(考点详解)(解析版)中考化学考点专题复习大全

专题07 燃料和燃烧燃烧和灭火1.物质燃烧需要三个条件:(1)物质具有可燃性;(2)可燃物与空气或氧气接触;(3)可燃物达到它燃烧所需要的最低温度(即它的着火点)。
2.灭火的原理:(1)清除可燃物或使可燃物与其他物品隔离;(2)使可燃物隔绝氧气(或助燃性的物质);(3)使可燃物的温度降到着火点以下。
3.可燃性气体泄漏时的注意事项:当室内天然气、液化石油气、煤气泄漏后,室内充满可燃性气体,在此环境中不能进行人工呼吸、打电话或打开换气扇,应先关闭总闸,开窗通风,并在杜绝一切明火的同时查找泄漏的原因。
4.火灾自救策略:(1)迅速找到安全通道;(2)发生火灾时上层空气中氧气少,毒气浓度大,所以要匍匐前进;(3)房间发生火灾时不能随便开门开窗,开门开窗会增加氧气量,使火势更加凶猛;(4)火灾时会产生大量烟尘,使人窒息而死,因此最好用湿布捂住口鼻;(5)若在山林中遇到火灾时,应逆风而跑,因为顺着风更易被烧伤和发生危险。
1.(2022山西中考)在一次家庭小实验中,当点燃装有半杯水的纸杯时,发现水面以下部分没有燃烧,其主要原因是()A. 纸杯着火点变低B. 温度低于着火点C. 与氧气接触面太小D. 纸杯不是可燃物【答案】B【解析】A、纸杯的着火点不变,故选项错误;B、杯有水,水能导热,且随着水的蒸发会吸收热量,导致纸杯下部分温度低于着火点,故选项正确;C、纸杯外壁直接与空气接触,所以和“与氧气的接触面积”大小无关,故选项错误;D、纸杯上部分可以燃烧,说明纸杯是可燃物,故选项错误。
故选B。
2.(2022湖南湘潭中考)下列关于燃烧与灭火的说法错误的是()A. 电器失火立即用水灭火B. 白磷放入水中保存,是为了隔绝空气C. 剪烛芯使蜡烛熄灭的原理是清除可燃物D. 扑灭图书、档案等物的失火,应使用二氧化碳灭火器【答案】A【解析】A、电器着火应先切断电源,不能浇水否则会引起触电,选项错误;B、白磷着火点很低只有40℃,在空气中与氧气接触很容易自燃,故放入水中,起到隔绝空气的作用,选项正确;C、剪烛芯使蜡烛熄灭,是因为烛芯是可燃物,剪断后没有了可燃物则燃烧停止,原理是清除可燃物,选项正确;D、扑灭图书、档案等物的失火,由于图书和档案需要尽可能保存完好,故使用二氧化碳灭火器,这样灭火后不留痕迹,有利于图书和档案的保存,选项正确;答案为:A。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(Nm3/kg)
(4-5)
或者可以写为:
L0. = 0.01 × (8.89C + 26.67H +3.33S 3.33O)
(Nm3/kg)
(4-5a)
第四章 空气需要量及燃烧产物生成量
§1 燃烧所需的空气量计算
三、气体燃料的理论空气需要量
气体燃料的体积百分数成分组成为: CO % + H2% + CH4 % + CnHm% + H2S % +COS2 % +O2% +N2 % +H2O % =100 % 各可燃组分的化学反应方程式为: 其中CO的燃烧: CO +0.5O2 = CO2 氢的燃烧: H2+0.5O2 = H2O 碳氢化合物的燃烧: m
第一章
二、煤的主要特性
(三) 粘结性和结焦性
固体燃料
粘结性:指粉碎后的煤在隔绝空气的情况下加热到一定的温度时, 煤的颗粒相互粘结形成焦块的性质。 结焦性:煤在工业炼焦的条件下,粉碎后的一种或者几种煤混合 后的粘结性,粘结性越好结焦性也越好.结焦性也就是煤能炼出冶金 焦的性质。 煤的粘结性强弱分为7个等级,1为最弱,7为最强。一般用坩 埚法进行测定,对形成的焦块进行观察判定。
第一章
二、煤的主要特性
(四) 热稳定性
固体燃料
热稳定性指煤在加热的情况下是否容易破碎而言。热稳定性的强 弱直接影响到煤的燃烧和气化效果。褐煤和无烟煤的热稳定性较差。
(五)反应性和可燃性(煤的活性)
煤的反应性指煤在一定温度下进行气化还原反应的能力。实际 上也就是煤中的碳与二氧化碳及水蒸气进行还原反应的速度。反应产 物中CO的含量越高,氧化层的温度越低,反应性就越好。 煤的可燃性是指燃料中的碳与氧发生氧化反应的的速度(燃烧速 度)。炭化程度越高的煤其反应性和可燃性就越差。
第三章
气体燃料
2.天然气 (T)(气田气和油田气)(Natural gas )
一种从气田或者油田直接开采的天然气体燃料(主要成分 CH4=90~98%)。 主要成分: CH4 CmHn N2 CO2 (微量H2O, H2S ) QL=35000~37000 kJ/Nm3 (8000-10000 kCal /Nm3) 密度:0.7~0.8 kg/Nm3
A —— C H O N S M
A —FC——————— V ————— M
灰分 固定炭 挥发分 水分
ar ad d daf
— — — —
as received air dry dry dry ash free
(应用基 y) (分析基 f) (干燥基 g) (可燃基 r)
第三章
气体燃料
3.液化石油气(Y)LPG — Liquified Petroleum Gas
石油炼制过程的副产品,主要成分为C3 和C4的烃类(主要是丙 烷、丁烷和丁烷、丁烯),在常温下加压(大约1.6MP)就可以液化, 可以用高压储罐储存,减压就可以汽化。
主要成分: C3H8 C4H8 C3H10 C4H10 CmHn 气态热值: QL=87900~108900 kJ/Nm3 (21000-26000 kCal /Nm3) 液态热值: QL=45200~46100 kJ/Nm3 气态密度: 1.95~2.36 kJ/Nm3
有机硫:煤中有机物中存在
无机硫:黄铁矿硫 FeS2 (可燃硫) 硫酸盐硫 FeSO4, CaSO4
第一章
固体燃料
四、煤的成分表示基准及其换算
———————— 应 用 基(ar) ———————— ———————— 空气干燥基(ad) —————— ———————— 干 燥 基 (d) ———— ———— 可 燃 基(daf) ————
2.重油的粘度 3.重油的密度: ρ20 = 0.92-0.98 t/m3 4.比热和导热系数 5.重油的发热量(高位/低位)
6.重油的含硫量
第三章
一、城市燃气
气体燃料
符合国家城市燃气标准的气体燃料叫城市燃气(城市燃气分类 GB/T13611-92)。 1.人工煤气 (R)(Manufactured gas) 焦炉煤气:炼焦过程的副产品 主要成分:H2 CO CH4 CmHn NCO 2 2 O2 QL=13200~19200 kJ/Nm3 (4000 kCal / Nm3)
第一章 固体燃料
二、煤的种类:泥煤,褐煤,烟煤,无烟煤 3.烟煤 由褐煤进一步变化而成,密度大,含炭量较高,含氢 和氧量较少,挥发分产率低,吸水性强,堆积密度750800kg/m3,机戒强度较大,最大特点是粘接性好。烟煤使 用范围广,是冶金和动力工业不可缺少的燃料,也是炼 焦的主要原料。 4.无烟煤 炭化程度最高,地质年代最久远的煤,含炭量最高, 密度大,机械强度大,挥发分极少,吸水性小,热值高, 灰分少,含硫量低。
第一章
§2 煤的使用性能
二、煤的主要特性
(一) 煤的发热量(热值)
固体燃料
1.煤的发热量的基本概念 煤的发热量是评价燃料质量的重要指标,也是计算燃烧温度和 燃料消耗量的重要依据。 高位发热量Qh(MJ/kg):单位燃料完全燃烧后燃烧产物冷却到 使其中的水蒸气凝结成常温水时放出的热量。 低位发热量Ql(MJ/kg):单位燃料完全燃烧后燃烧产物冷却到 常温时放出的热量。
第一篇 燃料概论
燃料的概念:
各种复杂化合物的混合物,通过燃烧可以将其化 学能转变为热能,同时在技术上是可行的,经济上是 合理的物质。
标准煤的概念:
标准煤是指每千克应用基低位热值为29.27兆焦 (MJ)(相当于每千克7000大卡)的煤。
第一章 固体燃料
二、煤的种类:泥煤,褐煤,烟煤,无烟煤
1、泥煤 地质年代最近的煤,含水量40%以上,风干堆积密度 300-450kg/m3,在化学成分上氧含量高达30%左右,含炭 量相对较低。挥发分高,可燃性较好。含硫量较低,机 械强度低。主要用于锅炉和汽化原料。 2.褐煤 由泥煤进一步变化而成,完成了植物遗体的炭化过程, 密度较大,含炭量较高,含氢和氧量较少,挥发分产率 低,吸水性小,机械强度较大。
(kg) (kg / kg)
第四章 空气需要量及燃烧产物生成量
§1 燃烧所需的空气量计算
二、固体和液体燃料的理论空气需要量
因此,每公斤燃料完全燃烧所需要的理论氧气质量为:
8 1 G0.O2 = ( C +8H + S O) 3 100
(kg/kg)
(4-2)
在标准状态下1kmol质量的气体体积量为22.4 Nm3,所以标 准状态下氧的密度为32/22.4=1.429 kg/Nm3 。 故每公斤燃料完全燃烧所需要的理论氧气体积量为:
CnHm + (n + 4 )O2 = nH2O +
m CO2 2
硫化氢的燃烧:
H2S + 1.5O2 = H2O + SO2
第四章 空气需要量及燃烧产物生成量
§1 燃烧所需的空气量计算
四、实际空气需要量与过剩空气系数
在实际的燃烧装置中为保证燃料能够完全燃烧,实际供应的空 气量总是大于理论空气量的。燃烧时实际供应的空气量叫实际空气 量。实 际空气 量与理 论空气 量的比 值称为 过剩空 气系数 。 过剩空气系数:n=Ln/L0 实际空气量: Ln=nL0 过剩空气量: Ln-L0= nL0-L0=(n-1) L0
S 0.2-1.0%
第二章
三、重油的物理性能
液体燃料
1.闪点、燃点和着火点
闪点:遇小火能发生闪火的温度(80-130 º C)。 燃点:遇小火闪火后能继续燃烧的温度(闪点+10 º C)。 着火点:温度继续升高并发生自燃的温度(500-600º C)。 重油的闪点、燃点和着火点是液体燃料的非常重要的性能 指标,关系到用油的安全技术和燃烧条件。
1.成分表示方法
气体燃料的组成是用所含各单一气体的体积百分数来表 示的,有所谓“湿成分”和“干成分”两种表示方法。 湿成分:COS %+ HS2% +CHS4% +COS2%+NS2% +OS2% +H2OS =100 % 干成分:COg %+ Hg2% +CHg4% +COg2%+Ng2% + Og2 % =100 %
Vn =VCO2 +VSO2 +VH2O +VN2 +VO2
(Nm3 / kg)或者(Nm3 / Nm3) (4-11)
第四章 空气需要量及燃烧产物生成量
一、固体和液体燃料的烟气量
将以上代入式(4-11)整理后可以得到燃料完全燃烧的实际烟气量为:
Vn = ( C S H M N 22.4 21 + + + + ) +(n )L0 +0.00124gnL0 12 32 2 18 28 100 100 (Nm3 / kg)(4-14-a)
当 n=1时,得到燃料完全燃烧的理论烟气量为:
V0 = ( C S H M N 22. 4 79 + + + + ) + L0 +0.00124gL0 12 32 2 18 28 100 100
第二章
3.石油产品
液体燃料
液化石油气、汽油、煤油、轻柴油、重柴油、重油、残渣油等。 汽油、煤油、轻柴油主要用于各种发动机的燃料;重柴油、 重油一般用于各种工业窑炉和锅炉的燃料;液化石油气主要用于 民用燃料。
二、 重油的化学组成
成分: C,H,O,N,S;A,M C H O + N 85-88% 10-13% 0.5-1.0%
第一章 固体燃料
三、煤的化学组成(煤都是由七种成分组成)
无机物——矿物质( A),水分 (M) 有机物—— C,H,O,N,S(元素形式)
