第四章_导向基的引入
7第四章碳负离子型延伸碳链反应2
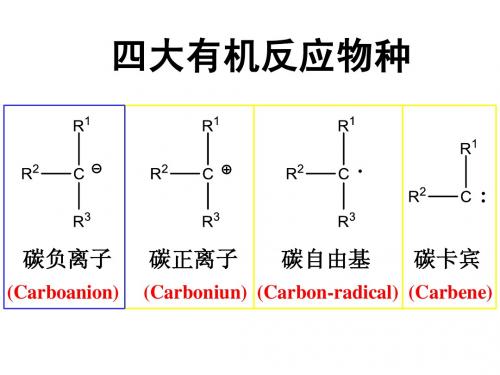
酯的分子内醇解
γ-羟基酯
γ-内酯
24
25
26
4.3 酰基化反应
27
4.4 缩合反应
28
29
4.4.1 Knoevenagel反应
2.反应通式:
30
3.反应机理:(p103-104)
4.影响因素:反应的产率与羰基化合物的反应活性、位 阻、催化剂的种类及其它反应条件有关。
41
4.4.4 Dickmann缩合
分子内的Claisen酯缩合-Dickmann缩合
Dickmann(迪克曼)缩合反应主要用于制备 五元和六元环状β-酮酸酯。
42
4.4.5 Thorp反应
Thorpe反应与Dickmann缩合相似:
β-羰基腈
Dickmann(迪克曼)缩合反应主要用于制备五元和 六元环状β-酮酸酯。 但Thorpe缩合反应,只要改变反应条件,从二腈化 合物就能合成较满意的大环。在苯溶液中加入碱以及大 量的乙醚,反应在很稀的溶液中进行,产率可以提高到 95%(七元环)、 88%(八元环)、 60~80%(十四 元或更多元环). 43
1.自身缩合:碳链增加一倍
2.混合缩反应
醛、酮与没有α-氢的酯(甲酸酯、苯甲酸酯或 草酸酯)发生的缩合反应,制备β-酮或β-二酮的 重要方法。
脱羰基
(有机化合物致活策略)
导向基
在有机合成路线的设计中,经常需要用到导向基来引 导原子或原子团进入到某些特定的位置,然后再将导 向基除去,得到合成产物。
膦酸酯α-碳的去质子化, 生成碳负离子
氧负离子进攻磷原子, 生成氧杂的四元环中间体
62
63
56学时的课件,未完待续
64
第四章导向基与合成的导向

3 2 4 5
β
1 α 6
CHO
CO 2H
+ CH3COOH
需导向
FGI
OH OH
dis
O 2
合成:
O 2
①Hg-Mg/苯 ②H3O+
OH OH
AI2O3/ 360℃
CH2(COOEt)2/C5H6N (Knoevenagel)
CO 2H
经验之四 以上两种单环化合物的合成中,片呐醇的制备及其酸性条件下 的脱水、亲核重排为片呐酮等,在有机合成中用途广泛。
合成:
NH2 + (CH3CO)2O
H2O
NHCOCH3
Br NHCOCH3 NHCOCH3 Br
NHCOCH3
+ Br2
CCI4
H2O / H+
TM
例2:设计N-丙基苯胺的合成路线。
HN
NH2
+
分析:
Br
这样拆开结果不好,因为反应产物的亲核性比反应物更强, 容易发生多烷基化的反应. 合成:
NH2
1)HOCI 2)OH O2/Ag/
C
C
C
C
C
C
C
O C C
古老方法,适合碱性条件
方法较新,适于中性 条件温和,适于酸性环境
C O C
CH3COOOH
-
H2O2 /HO
适用于αβ-不饱和羰基化合物
H2O2 , OsO4
C
C
催化剂较贵
通式:
C O C
C
+ 环氧化反应试剂
C
O
FGI
O O
O O
O
O
+
第四章导向基与合成的导向

CO 2H
Br + H3C CO2H
Br FGI
OH FGI
D_Adis
C O 2Et
+
C O 2Et
CO2Et CO2Et
合成:
C O 2Et
+
C O 2Et
LiAIH4
OH PBr3
Br
H2C(COOEt)2 NaOEt
①稀NaOH ②H+, △
CO2Et CO2Et
C O 2H + 2 HOEt + CO2
CH2(COOEt)2/ C5H6N (Knoevenagel)
CO2H
经验之四
以上两种单环化合物的合成中,片呐醇的制备及其酸性条件下 的脱水、亲核重排为片呐酮等,在有机合成中用途广泛。
例5 设计1,7- 二甲基-△1,9,7,8-六氢萘-2-酮的合成路线。 分析:
O
1,5 -dis
+
O
O
需活化导向
(1) 有利于合成的需要; (2) 便于引入; (3) 便于去掉。 招之即来,挥之即去。
三、导向基的选择与作用
有机合成中常用的导向方法有三种: 活化导向、钝化导向、封闭特定位置导向。
§4-1 活化导向——导向的主要手段
由于分子中引入导向基,分子的反应得到了活化,更有利 于反应进行;同时又起到了导向的作用,所以活化导向常是 导向的主要手段。
假设: ①C1处原是C=O。
②C2 之间C3有一个双健。
O
Ph
Ph
回忆几种除去它的方法。
OO C
+H
O
Br O
+
需活化导向
Br
合成:
CH3COCH2COOEt +
导向基-钝化导向的主要手段
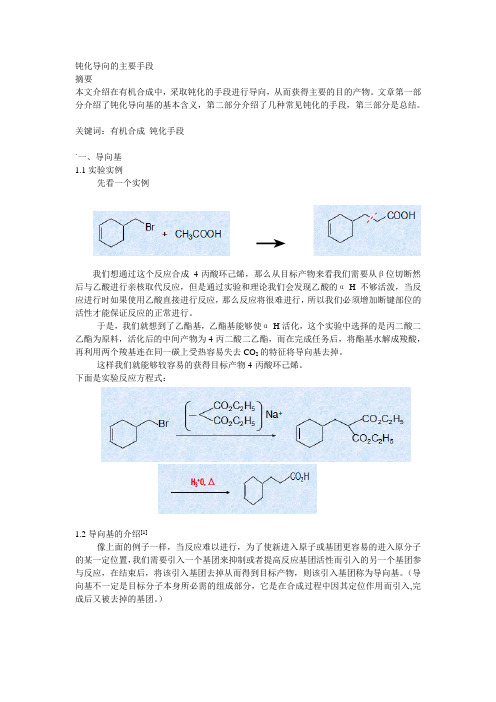
钝化导向的主要手段摘要本文介绍在有机合成中,采取钝化的手段进行导向,从而获得主要的目的产物。
文章第一部分介绍了钝化导向基的基本含义,第二部分介绍了几种常见钝化的手段,第三部分是总结。
关键词:有机合成钝化手段`一、导向基1.1实验实例先看一个实例→我们想通过这个反应合成4-丙酸环己烯,那么从目标产物来看我们需要从β位切断然后与乙酸进行亲核取代反应,但是通过实验和理论我们会发现乙酸的α-H不够活泼,当反应进行时如果使用乙酸直接进行反应,那么反应将很难进行,所以我们必须增加断键部位的活性才能保证反应的正常进行。
于是,我们就想到了乙酯基,乙酯基能够使α-H活化,这个实验中选择的是丙二酸二乙酯为原料,活化后的中间产物为4-丙二酸二乙酯,而在完成任务后,将酯基水解成羧酸,再利用两个羧基连在同一碳上受热容易失去CO2的特征将导向基去掉。
这样我们就能够较容易的获得目标产物4-丙酸环己烯。
下面是实验反应方程式:1.2导向基的介绍[1]像上面的例子一样,当反应难以进行,为了使新进入原子或基团更容易的进入原分子的某一定位置,我们需要引入一个基团来抑制或者提高反应基团活性而引入的另一个基团参与反应,在结束后,将该引入基团去掉从而得到目标产物,则该引入基团称为导向基。
(导向基不一定是目标分子本身所必需的组成部分,它是在合成过程中因其定位作用而引入,完成后又被去掉的基团。
)在有机合成中,由于有机物分子在一定的反应条件下,活性中心不一定是合成所需部位,而当引入导向基后能使反应分子的活性中心变成合成所需部位时,就需要引入导向基,即引入导向基能改变分子反应的活性中心,以适应有机合成的需要。
导向基通过电子效应和空间效应对反应中心产生影响。
1.2.1电子效应[2]电子效应通过影响分子中电子云的分布而影响有机物的性质.根据电子效应传递的方式,可分为诱导效应(包括场效应”和共扼效应‘包括超共扼效应):根据取代基对电子的约束能力大小,电子效应分为供电子效应(+I、+C)和吸电子效应(-I,-C);根据分子是否存在于试剂电场中,电子效应分为静态电子效应(I S、C s和动态电子效应(I d、C d)。
04.2 导向基的引入

Ph (1)NH3OH/H (2)LiAlH4 Ph N H
+
Ph H2N
钝化导向
例一: 例一:
NH2
+
NH2 3Br2 Br
Br 3HBr
Br
NH2
NHCOCH3
NHCOCH3
NH2
Br
Br
例二: 例二:
PhNH
PhNH2
Br
PhNH2 O PhNR2 Cl
RBr
RBr PhNH R O LiAlH4 PhNH PhNH PhNR2
NH2 NHCOCH3 H2SO4 NHCOCH3
SO3H NHCOCH3 NO2 HNO3 57%H2SO4 NH2 NO2
SO3H
利用封闭特定位置进行导向
例一: 例一:
NH2 HNO3 NH2 H2SO4 N H3HSO4 HNO3 N+H3 NH2
NaOH NO2
HNO3
NO2
Oxidation
例一: 例一:合成路线
NH2
NHCOCH3 H2SO4-HNO3
NHCOCH3 水解 (90%)
NH2
NO2
NO2
例二: 例二:合成路线
例三:合成路线 例三 合成路线
O Br2 HBr Br O
O O O
(1)NaOC2H5
O
(1)水解 碱
C2H5O2C O
O O
OC2H5 (2) Br
O
(2)脱羧
例四: 例四:逆合成分析
+ O A + CH2O O O O A O O + O O O O
例四:合成路线 例四:
O COC2H5 O O O COC2H5 O O CO2C2H5 O CO2C2H5 O O O O O O O
10:第三节 导向基和保护基的应用(一)

一、活化导向
【例3-2】设计
COOH
的合成路线
Br
分析:
COOH
+
CH3COOH
但是若按照上述逆向切断的方法所得的乙酸中的α H不够活泼。所以采用丙二酸二乙酯(或丙二酸)为原料 代替乙酸增加其活性。则合成路线为:
COOEt
Br
COOEt OH COOEt
+
H 2C COOEt
H 3O
+
- CO2 △
COCH 3 H 2C COOEt
BrBr
O
OH H-OH
-CO2 △
O
Ph-CHO OH
COOEt O
Ph [H]
OH
O
Ph
Zn-Hg H-Cl Ph
9
一、活化导向
当然,还可以有想法2和想法3,但都没有想法1合适:
Ph Ph Ph
O
想法 2
想Байду номын сангаас 3
10
6
一、活化导向
则合成路线为:
7
一、活化导向
【例3-5】设计1-环戊基-3-苯基丙烷的合成路线
分析:目标化合物的分子中没有官能团,好像无从下手, 但是可以自己加入官能团。作为它的前身,以帮助拆开。
想法1 :
O
O
Ph
Ph
+
OHC
Br + Br
O
8
一、活化导向
推导到这里可以看出,如果不把丙酮羰基两边的α -H 活性区分开来,则羰基的两边都可能接上1,4-丁基二溴的 骨架。所以拟采用乙酰乙酸乙酯来代替丙酮。则合成路线 为:
则合成路线为:
导向基:在有机合成的过程中,为了使新进入的原子或基团进入原 分子的某一定位置而预先引入的原子或基团,称为导向基。
4第四章 导向基与保护基
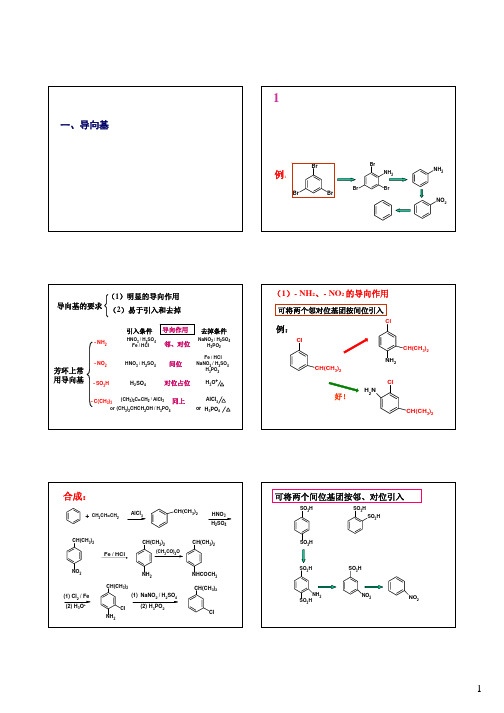
•凡需要环已烯或其衍生物作原料时,可拆开为“双烯合成的原料”及其衍生物。
•凡拆开原料需用乙酸时,为了导向并活化,应改为丙二酸或其酯。
分析过程合成路线
:
分析
—6—烯丙基环已酮的合成路线设计1—环戊基—3—苯基丙烷的合成路线
分子中没有官能团,好像无从下手,但是可以加入官能团。
作为它的前
身,以帮助拆开。
选择什么样的官能团?加在什么位置上?这是个关键
而困难的问题。
必须通过多种分析和比较,才可以做出决择。
TM
合成:
3.合成路线:
5:邻-
氯甲苯的合
4题解
来保护CSi(CH)
- NHCR
- N H C H
P h
2
氨基甲酸酯
乙酰基也可以
6、羧基的保护对酸稳定的羰基保护剂:
NC CN丙二腈
常用保护基及其作用一览表合成路线
合成路线
2. 4.
5.
5.。
导向基与保护基

ROH
NaOH,PhCH2Br Li,NH3
ROCH2Ph
问题:反应机理?
• 四)形成甲氧基甲醚(ROCH2OCH3)
制备时,使用甲氧基氯甲烷与醇类 作用,并以三级胺吸收生成的HCl。
ROH
ClCH2OCH3,i-Pr2NC2H5 TiCl4或CF3CO2H
ROCH2OCH3
注意:甲氧基甲醚在碱性条件下和一般质子酸中有 相当的稳定性,但此保护基团可用强酸或Lewis酸 在激烈条件下脱去。
引入保护基团存在的不足: 在有机合成中,利用保护-脱除保护的
方法应用极广,但存在不足: • 增加了额外的反应步骤,会使目标产物的产
率降低! • 弥补方法:在引入或除去保护基团时,优先
考虑高选择性、高产率及易脱除的方法。
保护基应满足的条件:
• (1)容易、高产率地引入被保护的分子中(温和条 件);
导向基特点:
➢“招之即来,挥之即去”------易引入,易 去除;
➢并非任何基团都能在合成中作为导向基。
Example:
目标分子
Br
NO2 Fe + HCl
Br
Br NH2
Br2 Br
①HNO2 ②H3PO2 / H2O
NH2 Br
Br
总产率:64%~71%
相关知识点回顾:定位规律
属于第一类取代基的主要有:-O-、-NR2、 -NHR、-NH2、-OH、-OR、-NHCOR、-OCOR、 -F、-Cl、-Br、-I、-NHCHO、-C6H5、-CH3、 -C2H5、-CH2COOH、-CH2F等;
• 五)形成四氢吡喃(ROTHP)
O
O
呋喃
吡喃
H
N
N
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
28
环戊基苯乙烯基甲酮可以如下拆开:
2012-8-16
29
由上面的例子可以认识到在合成工作中进行合理没 想的重要性。因为这样做,才能在“山穷水尽疑无路”时, 看到“柳暗花明又一村”。
2012-8-16 30
例8
设计合成如下化合物:
2012-8-16
31
分析:具有支链的伯胺能够由肟还原制备
2012-8-16
2012-8-16
23
合成:
2012-8-16
24
脱甲酰基的反应历程如下:
2012-8-16
25
例7
试设计1-环戊基—3—苯基丙烷的合成路线
分析:要拆开这个化合物,困难在于它是一个没有
官能团的烃类化合物,似乎是“无懈可击”。为将两个环
之间的饱和碳链拆开,我们不妨设想在合成过程中碳链上 留存在着官能团,这样就创造了“可乘之机”。
分析:苯胺容易被氧化,如果直接用硝酸作硝化剂,
则苯胺容易被氧化成为复杂的氧化产物;如果用混酸硝化, 则主要产物是间-硝基苯胺:
2012-8-16
43
2012-8-16
44
反应同时生成一定量的邻位和对位的硝基苯胺,但
间位硝基苯胺的收率即随硫酸的浓度增加而提高。
如果要防止在用硝酸作用时苯胺被氧化,又要使代
2012-8-16 52
例4
邻—二氯苯酚的合成,
分析:
2012-8-16
53
在苯环上的亲电取代反应中羟基是邻、对位定位基。
要使两个氯原子只进人羟基的两邻位、需要先将羟基的
对位处封闭,这可以利用叔丁基为阻塞基,它有下列两 个特点:①叔丁基体积大,具有一定的空间阻碍效应, 不仅可以堵塞它所在的部位,还能旁及其左右两侧。② 叔丁基易于从环上去掉而不致干扰环上的其他取代基。
2012-8-16
48
例2
设计邻氯甲苯的合成路线。
采用同样的道理设计邻氯甲苯的合成路线:
2012-8-16
49
例3
合成下列化合物:
2012-8-16
50
要控制间—苯二酚的直接演化在一取代是很困难的。
这不仅因为羟基对芳环有较强的活化效应,还由于两个羟
基互居间位,具有相互增强活化的作用。
解决这一问题的办法是在溴化之前先引入一个羧基,
21
虽然A上的迈克尔加成似乎可发生在任何一个双键上, 但由于在环外未取代的位置上比在环中二取代的位置要活 泼得多,因此只有所要的反应发生。 例6 设计合成2—甲基—6—烯丙基环己酮—1。
2012-8-16
22
可以预料,当α—甲基环己酮与烯内基溴作用时会生成 混合产物。这个困难可以利用活化导向的办法来解决。
2012-8-16
38
要想在苯胺的苯环上只引进一个溴取代基,则必须将 氨基的活性降低。这可以通过乙酰化反应来达到:
2012-8-16
39
当乙酰苯胺进行溴化时.主要产物是对位溴代乙酰苯胺
2012-8-16
40
例2
设计PhNHC3H7的合成路线。
分析:
目标分子如上拆开结果不好,因为反应产物比原料的 亲核性更强,又能发生多烷基化的反应:
2012-8-16
41
解决的办法是将胺酰化.生成的酰胺可用LiALH4还 原为所要的胺:
A A中具有末共享电子对与乙酰基的P-π共扼作用,使 得乙酰苯胺原来的PhNH2:活性要小。
2012-8-16 42
4.3 利用封闭特定位置进行导向
利用特定位置加以封闭,即引入封闭基(阻塞基)。 例1 试设计邻—硝基苯胺的合成路线。
13
2012-8-16
14
例3
设计合成3—叔丁基环戊烯—2—酮—1
2012-8-16
15
2012-8-16
16
例4
设计合成。α—对—苄氧苯基1,5—己内酯
2012-8-16
17
2012-8-16
18
2012-8-16
19
最后化合物要活化导向:
合成:首先活化导向:
2012-8-16
20
2012-8-16
32
2012-8-16
33
例9
制备如下化合物:
分析:若用最大的侧链中的分支点为指南,我们就可 以放人一个羟基.
2012-8-16
34
合成:要注意,对付氏反应来说,只有一个活泼位置 可起反应,即两个甲基的邻、对位,而不是甲基之间的那 个位置(位阻).
2012-8-16
35
2012-8-16
36
引入活化基的办法,下面举例说明:
2012-8-16
8
例1 合成苄基丙酮:
2012-8-16
9
直接采用上述方法制备的苄基丙酮收率低,因为反应 中除了副反应丙酮的自身缩合外,还会有对称的二苄基丙 酮等副产物形成:
2012-8-16
10
解决这个困难的办法在于设法使丙酮的两个甲基有显 著的活性差异,为此可以将一个乙酯基(导向基)引入到丙 酮的一个甲基上,这样就使所在羰上的氢较另一个甲基中 的氢有大得多的活性,使这个碳成为苄基溴进攻的部位。 在合成时使用的原料是乙酰乙酸乙酯而不是丙酮。任务完 成后将乙酯基水解成羧基,再利用β—酮酸易脱羧的性质 (一般在室温或略高于室温即可脱羧),将导向基去掉。
第四章
导向基的引入
主讲人:
2012-8-16
1
4.1 活化是导向的主要手段 4.2 钝化导向
4.3 利用封闭特定位置进行导向
2012-8-16
2
为了说明此问题,我们不妨从一个具体的设计 l,3,5—三溴苯合成的实例谈起:
2012-8-16
3
大家知道,在苯环上的亲电取代反应中,溴是 邻、对位定位基,现在它们互居问位.显然不是由
2012-8-16
11
合成:
2012-8-16
12
例2
设计下列化合物
但是乙酸的α—H不够活泼。为使烷基化在α—碳上发 生,需引入乙酯基(导向基)使α-H活化,于是用丙二酸二 乙酯为原料。任务完成后,将酯基水解成羧圣,再利用两 个羧基连在同一碳上受热容易失去CO2的特征,将导向基 去掉.
2012-8-16
2012-8-16
26
首先设想C1是个羰基的碳原子,做这样的设想是允许 的,因为羰基通过下列反应是可以变回亚甲基的:
再设想在C1与C2之间有个双键,这也是允许的,因为 通过催化氢化双键可以变回为单键:
2012-8-16
27
这样就将1-环戊基—3—苯基丙烷设想是从环 戊基苯乙烯基甲酮变化来的:
2012-8-16
4.2 钝化导向
活化能够导向,钝化能不能导向呢?回答是肯定的, 不妨在此举一些例子来说明。
2012-8-16
37
例1
试设计对溴苯胺的合成。 分析:氨基是很强的邻、对位定位基,进行取代反应 时容易生成多元取代物。例如,苯胺与过量的溴水作用, 就生成2,4,6—三溴苯胺的白色沉淀:此反应是定量的, 因此可用于苯胺的定性与定量分析:
73
2012-8-16
74
2012-8-16
75
本身的定位效应能够引入的。它们所以会互居间位,
可以推测是由于有一个强的邻、对位定位基的存在, 它的效应压到了溴基,使溴 基进入了它的邻、对 位,而使溴基因本身却互处间位。不过产物中并没 有这个基因存在,显然它是在合成过程中先被引入,
任务完成后披去掉的。此类基团在有机合成中称之
为导向基。
2012-8-16 4
那么,什么基团可以满足上述要求?显然,根据我们 所学的知识回想到氨基,它是一个强的邻、对位定位基, 既便于如下方式引入:
也便于如下去掉:
2012-8-16
5
因此,1,3,5—三溴苯的合成采用了下列的合成路线:
2012-8-16
6
为了帮助读者体会此类技巧,不妨用大家都熟悉的故 事“借东风”来比喻。在上面的合成中氨基就起了“东风” 的作用。在此之所以要“借”.是为实现特定的目的,因 此在任务完成后就应该“还”;所谓“还”,是指“还” 其本来的面目,也就是将“借”来的基团去掉。 但并非任何基团都能在合成过程中起到导向基的作 用.要起这种作用,在“借”与“还”上还必须能够尽量 满足下列要求:就是“招之即来,挥之即去”。如果不是 这样,而是“干呼万唤始出来”,并且还“主人忘归客不 发”,这样的基团是不配充做“东风”的。不过有时要 “借”的基团也可以设法使它已存在于所使用的原料中, 如在上面的例子中,直接可改用苯胺为起始原料。
60
2012-8-16
61
2012-8-16
62
2012-8-16
63
2012-8-16
64
2012-8-16
65
2012-8-16
66
2012-8-16
67
2012-8-16
68
2012-8-16
69
2012-8-16
70
2012-8-16
71
2012-8-16
72
2012-8-16
叔丁基的除去可用热解作用,但更方便的办法是将化合
物在苯中与三氧化铝共热,发生烷基转移作用 (transalkylation)。
2012-8-16
54
合成:
2012-8-16
55
作 业
2012-8-16562012-Fra bibliotek-1657
2012-8-16
58
2012-8-16
59
2012-8-16
入的基团主进入到原来氨基的邻、对位处, 则可以使
氨基乙酰化,使苯胺以N—乙酰基衍生物参加反应:
2012-8-16
45
