3.2分子结构和性质练习(有解析)
人教版初中高中化学选修二第二章《分子结构与性质》(含答案解析)

一、选择题1.下列描述中不正确的是A.CS2是含极性键的非极性分子B.CO2-3和ClO-3的具有相同的空间构型C.AlCl3和SF6的中心原子均不不满足8电子构型D.BF3和BF-4的中心原子杂化方式不同答案:B【详解】A. CS2含有C=S键,是极性键,分子是直线型,是含极性键的非极性分子,A正确;B. CO2-3中C原子孤电子对数42232+-⨯==、价电子对数303=+=,则其空间构型为平面三角形,ClO-3中Cl原子孤电子对数712312+-⨯==、价电子对数314=+=,则其空间构型为三角锥体,空间构型不相同,B不正确;C. AlCl3中Al原子满足6电子构型,SF6中的S原子满足12电子构型,故C正确;D. BF3中B原子孤电子对数3132-⨯==、价电子对数303=+=,则其空间构型为平面三角形,中心原子为sp2杂化,BF-4中B原子孤电子对数31142+-⨯==、价电子对数404=+=,则其空间构型为正四面体,中心原子为sp3杂化,故D正确;答案选B。
2.电子总数或价电子总数相等、原子数也相同的分子或离子的空间构型是相同的,下列各组微粒空间构型不相同的是()A.CO2和NO2B.CO2和N2O C.SO3和NO-3D.SO2-4和ClO-4答案:A【详解】A.CO2和NO2的价电子总数分别为16、17个,不相等,故空间构型不同,A正确;B.CO2和N2O价电子总数分别为4+2⨯6=16、2⨯5+6=16,均为16个,原子数均为3个,故空间构型相同,B正确;C.SO3和NO-3价电子总数分别为4⨯6=24、5+3⨯6+1=24,均为24个,原子数均为4个,故空间构型相同,C正确;D.SO2-4和ClO-4价电子总数分别为6+4⨯6+2=32、7+4⨯6+1=32,均为32个,原子数均为5个,故空间构型相同,D正确;答案选A。
3.最近《科学》杂志评出“十大科技突破”,其中“火星上‘找’到水的影子”名列第一。
新人教版高中化学选修3第二章分子的结构与性质课时练习附答案

15白磷结构式为正四面体在o2不足时燃烧则在每两个p原子之间嵌入一个氧原子此化合物的真实分子式为若此分子的分子结构中只含有单健且每个原子的最外层都满足8电子结构则该分子中含有的共价健的数目是
新人教版高中化学选修 3第二章分子的结构与性质课时练 习附答案
第一节《共价键》(1) 共价键的本质 1、下列说法正确的是() A、含有共价键的化合物一定是共价化合物 B、分子中只有共价键的化合物一定是共价化合物 C、由共价键形成的分子一定是共价化合物 D、只有非金属原子间才能形成共价键 2、下列有关σ键的说法错误的是() A、如果电子云图象是由两个s电子重叠形成的,即形成s--sσ键 B、s电子与p电子形成s--pσ键 C、p和p不能形成σ键 D、HCl分子里含有一个s--pσ键 3、下列过程中,共价健被破坏的是() A、碘升华 B、碘蒸气被木炭吸附 C、蔗糖溶于水 D、HCl气体溶于水 4、分子中所含的电子数与HF分子相等且只含有2个极性共价健的是() A.CO B.NO C.H2O D.CH4 ) 5、下列化合物电子式书写正确的是(
2020学年度人教版高中化学选修三第二章《分子结构与性质》章末测评(含解析)

1第二章《分子结构与性质》章末测评(时间:90分钟 满分:100分)第Ⅰ卷(选择题共48分)一、选择题(本题包括12小题,每小题4分,共48分)1.下列示意图或图示正确的是( )选项CO 2的分子中3个原子共线,为直线形,故A 项错;B 项是p-p π键电子云模型,故B项错误;C 项砷原子结构示意图应为○+33◝2◞◝8◞◝18◞◝5◞。
2.下列说法中正确的是( )A.存在手性异构体的分子只能含一个手性碳原子B.配合物[Cu(NH 3)4]Cl 2的配位数是6C.已知Zn 2+的4s 轨道和4p 轨道能形成sp 3型杂化轨道,则[ZnCl 4]2-的立体构型为正四面体形D.在AgCl 、Cu(OH)2、AgOH 这三种物质中只有AgCl 不能溶于浓氨水,A 错;B 项中该配合物的配位数是4而不是6,B 错;既然是sp 3型杂化轨道,[ZnCl 4]2-的立体构型与甲烷相似,是正四面体形,C 正确;因为Ag +和Cu2+都能与NH 3分子形成配合物,故AgCl 也能溶于浓氨水,D 错。
3.下列分子中的中心原子杂化轨道的类型相同的是( )A.CO2与C6H6B.CH4与NH3C.BeCl2与BF3D.C2H2与C2H42中C原子采取sp杂化,苯分子中C原子采取sp2杂化;CH4和NH3中的C原子、N原子都是采取sp3杂化;BeCl2中Be原子采取sp杂化而BF3中的B原子采取sp2杂化;C2H2中C原子采取sp杂化而C2H4分子中C原子采取sp2杂化。
4.在BrCH CHBr分子中,C—Br键采用的成键轨道是()A.sp-pB.sp2-sC.sp2-pD.sp3-psp2杂化,溴原子的价电子为4s24p5,4p轨道上有一个单电子,与碳原子的一个sp2杂化轨道成键。
5.下列说法正确的是()A.HF、HCl、HBr、HI的熔点、沸点依次升高B.H2O的熔点、沸点高于H2S,是由于H2O分子之间可以形成氢键C.乙醇分子与水分子之间只存在范德华力D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4分子间可以形成氢键,沸点最高,沸点高低顺序应为HF>HI>HBr>HCl,A错误;O元素的电负性较大,水分子间可以形成氢键,则H2O的熔、沸点高于H2S,B正确;乙醇分子与水分子之间还可以形成氢键,C错误;Cl元素的化合价越高,对应的氧化物的水化物的酸性越强,酸性强弱应为HClO<HClO2<HClO3<HClO4,D错误。
2021年高中化学选修二第二章《分子结构与性质》经典习题(答案解析)(3)

一、选择题1.下列物质中,所有原子最外层均达到8电子稳定结构的化合物是 A .5PClB .4CClC .4P (正四面体形)D .3NH答案:B 【详解】A. P 最外层有5个电子,与其他原子间共用3对电子成为稳定结构,Cl 最外层有7个电子,与其他原子间共用1对电子成为稳定结构,显然5PCl 中的P 最外层不满足8电子稳定结构,A 项错误;B. C 最外层有4个电子,与其他原子间共用4对电子成为稳定结构,则4CCl 中的原子最外层均满足8电子稳定结构,B 项正确;C. 画出正四面体图形,每个P 占据正四面体的一个顶点,每个P 与其他3个P 形成3对共用电子,从而使每个P 最外层均满足8电子稳定结构,但P 属于单质,C 项错误;D. N 最外层有5个电子,与其他原子间共用3对电子成为稳定结构,H 最外层有1个电子,与其他原子间共用1对电子成为2电子稳定结构,3NH 中N 原子最外层达到8电子稳定结构,而H 达到2电子稳定结构,D 项错误; 答案选 B 。
2.原子序数依次增大的元素a 、b 、c 、d ,它们的最外层电子数分别为1、6、7、1。
a -的电子层结构与氦相同,b 和c 的次外层有8个电子,c -和d +的电子层结构相同。
下列叙述错误的是( )A .元素的非金属性强弱次序为c b a >>B .a 和其他3种元素均能形成共价化合物C .d 和其他3种元素均能形成离子化合物D .元素a 、b 、c 各自最高和最低化合价的代数和分别为0、4、6 答案:B 【详解】A .根据题意可推知,a 为H ,b 为S ,c 为Cl ,d 为K 。
同一周期从左到右,非金属性增强,非金属性:Cl S H >>,选项A 正确;B .H 和K 只能形成离子化合物KH ,选项B 错误;C .K 和H 、S 、Cl 能分别形成离子化合物:KH 、2K S 、KCl ,选项C 正确;D .H 、S 、Cl 的最高化合价分别为1+、6+、7+,最低化合价分别为1-、2-、1-,故元素a 、b 、c 各自最高和最低化合价的代数和分别为0、4、6,选项D 正确。
人教版初中高中化学选修二第二章《分子结构与性质》经典练习题(含答案解析)
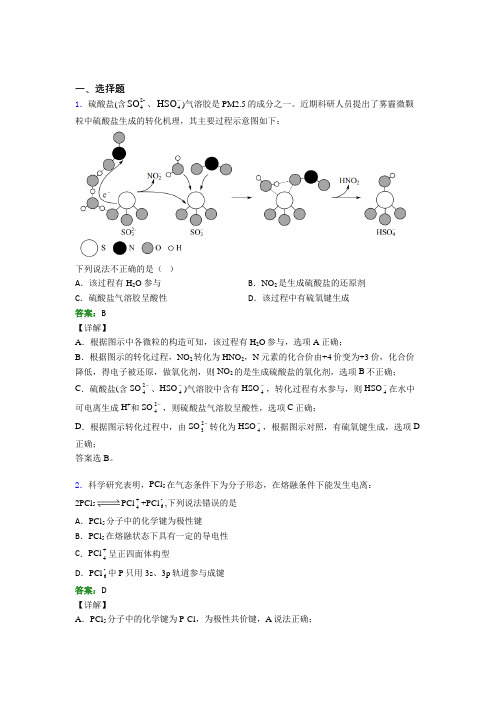
一、选择题1.硫酸盐(含2-4SO 、4HSO -)气溶胶是 PM2.5的成分之一。
近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下:下列说法不正确的是( )A .该过程有 H 2O 参与B .NO 2是生成硫酸盐的还原剂C .硫酸盐气溶胶呈酸性D .该过程中有硫氧键生成 答案:B【详解】A .根据图示中各微粒的构造可知,该过程有H 2O 参与,选项A 正确;B .根据图示的转化过程,NO 2转化为HNO 2,N 元素的化合价由+4价变为+3价,化合价降低,得电子被还原,做氧化剂,则NO 2的是生成硫酸盐的氧化剂,选项B 不正确;C .硫酸盐(含SO 24-、HSO 4-)气溶胶中含有HSO 4-,转化过程有水参与,则HSO 4-在水中可电离生成H +和SO 24-,则硫酸盐气溶胶呈酸性,选项C 正确;D .根据图示转化过程中,由SO 23-转化为HSO 4-,根据图示对照,有硫氧键生成,选项D 正确;答案选B 。
2.科学研究表明,PCl 5在气态条件下为分子形态,在熔融条件下能发生电离: 2PCl 5PCl +4+PCl -6,下列说法错误的是 A .PCl 5分子中的化学键为极性键B .PCl 5在熔融状态下具有一定的导电性C .PCl +4呈正四面体构型 D .PCl -6中P 只用3s 、3p 轨道参与成键答案:D【详解】A .PCl 5分子中的化学键为P-Cl ,为极性共价键,A 说法正确;B.PCl5在熔融状态下发生电离,生成PCl+4、PCl-6,存在自由移动的离子,具有一定的导电性,B说法正确;C.PCl+4中心P原子为sp3杂化,四个氯原子呈正四面体构型,C说法正确;D.PCl-6中心P原子,孤电子对数=12(5+1-1×6)=0,有6条共价键,用3s、3p、3d轨道参与成键,D说法错误;答案为D。
3.能够用键能解释的是()A.氮气的化学性质比氧气稳定B.常温常压下,溴呈液体,碘为固体C.稀有气体一般很难发生化学反应D.乙醇能够任意比例与水互溶答案:A【详解】A. 氮气中是氮氮三键,键能大于氧气的,所以氮气稳定,A选;B. 溴和碘的状态和熔沸点有关、熔沸和晶体类型点有关、溴和碘形成的晶体是分子晶体,其熔沸点和分子间作用力有关,碘的分子间作用力强于溴的,熔沸点高于溴的,B不选;C. 稀有气体的最外层电子已经达到稳定结构,其原子即分子,不存在共价键,化学性质稳定但与键能无关,C不选;D. 乙醇能够任意比例与水互溶,是因为乙醇分子与水分子间形成氢键,和键能无关,D不选;答案选A。
高二化学分子结构和性质试题答案及解析

高二化学分子结构和性质试题答案及解析1.下列各组分子或离子中,中心原子的杂化轨道类型相同的是A.CO2与NO2B.PCl3和BF3C.CO32-与SO32-D.CH4和SO42-【答案】D【解析】A、二氧化碳中C原子是sp杂化,二氧化氮中N是sp2杂化,错误;B、PCl3中P是sp3杂化,BF3中B是sp2杂化,错误;C、CO32-中C是sp2杂化,SO32-中S是sp3杂化,错误;D、CH4和SO42-都是sp3杂化,正确,答案选D。
【考点】考查原子杂化类型的判断2.下列说法中正确的是()A.分子中键能越大,键长越长,则分子越稳定B.sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道C.PCl5分子中P原子和Cl原子最外层都满足8电子结构D.用价层电子互斥理论预测H2S和BF3的立体结构,分别为V形和平面正三角形【答案】BD【解析】A.分子中键能越大,键长越短,则分子越稳定,错误;B.sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道,正确;C.PCl5分子中Cl原子最外层都满足8电子结构,P原子则未满足8电子结构,错误;D.用价层电子互斥理论预测H2S和BF3的立体结构,分别为V形和平面正三角形,正确。
【考点】考查物质分子的稳定性、原子的结构、原子的杂化、分子的空间形状的知识。
3.下列各组微粒属于等电子体的是()A.CO和CO2B.NO和NO2C.CH4和NH3D.CO2和N2O【答案】D【解析】原子数和价电子数分别都相等的微粒为等电子体,分子中质子数等于电子数,则A、CO和CO2的原子数和价电子数分别均不相等,所以两者不是等电子体,故A错误;B、NO和NO2的原子数和价电子数分别均不相等,所以两者不是等电子体,故B错误;C.CH4和NH3的原子数不相等,不属于等电子体,故C不正确;D、CO2和N2O的原子数和价电子数分别均相等,所以两者是等电子体,故D正确,答案选D。
高中化学《分子结构与性质》练习题(附答案解析)

高中化学《分子结构与性质》练习题(附答案解析)学校:___________姓名:___________班级:________________一、单选题1.下列分子中不.存在π键的是()A.CH4B.C2H4C.C2H2D.C6H6ClO 分子的空间构型是()2.气态3A.直线形B.平面三角形C.四面体形D.三角锥形3.化合物X是一种新型锅炉水除氧剂,其结构式如图,下列说法中正确的是()A.X分子中只有极性键没有非极性键B.X分子中的共用电子对数为11C.1molX分子中所含的σ键数目为10N A D.X是共价化合物4.下列叙述正确的是()A.含有极性键的分子一定是极性分子B.MCO3型碳酸盐,其分解温度越高,则分解后生成的金属氧化物的晶格能越大C.共价键产生极性根本原因是成键原子的原子核吸引共用电子对能力不同D.含有共价键的晶体一定是原子晶体5.下列说法中正确的是()A.碘化氢的范德华力比溴化氢的大,碘化氢稳定性强B.甲酸甲酯和乙酸相对分子质量相同,熔点相近C.氯化钠和氯化氢熔化时,破坏的都是离子键D.干冰气化和碘升华克服的作用力相同6.能用键能大小解释的是()A.稀有气体一般很难发生化学反应B.常温常压下,氟气的密度小于氯气C.相同条件下,NH3在水中的溶解度大于PH3D.SiC晶体的熔点比晶体硅的高7.设A N 为阿伏加德罗常数的值。
下列叙述正确的是( )A .78g 苯含有碳碳双键的数目为3A NB .46g 乙醇中的极性键数目为7A NC .420.5molCuSO 5H O ⋅晶体中含有2Cu +数目小于0.5A ND .标准状况下,22.4L 丙炔含有的π键数目为A N8.2CS 是一种重要的化工原料。
工业上可以利用硫(8S )与4CH 为原料制备2CS 。
下列有关说法错误的是( )A .2CS 的熔沸点比2CO 高B .2CS 可氧化为2CO 、2SOC .8S 分子中S 原子采用2sp 杂化D .2CS 是直线形的非极性分子9.第ⅤA 族元素的原子R 与A 原子结合形成RA 3气态分子,其立体结构呈三角锥形。
2021学年高中化学第二章3.2分子结构与分子的性质课时作业含解析人教版选修3.doc

分子结构与分子的性质[练基础]1.碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为( )A.CCl4与I2相对分子质量相差较小,而H2O与I2相对分子质量相差较大B.CCl4与I2都是直线形分子,而H2O不是直线形分子C.CCl4和I2都不含氢元素,而H2O中含有氢元素D.CCl4和I2都是非极性分子,而H2O是极性分子2.利用“相似相溶”这一经验规律可说明的事实是( )①HCl易溶于水②I2微溶于水③Cl2能溶于水④NH3易溶于水A.①②④ B.②③C.①②③ D.①②③④3.下列有机物分子具有手性异构体的是( )A.CH4 B.CH3CH2OHC. D.CH3COOH4.下图中两分子的关系是( )A.互为同分异构体 B.是同一种物质C.是手性分子 D.互为同系物5.有机物具有手性,发生下列反应后,分子仍有手性的是( )①与H2发生加成反应②与乙酸发生酯化反应③发生水解反应④发生消去反应A.①② B.②③C.①④ D.②④6.下列化合物中含有2个手性碳原子的是( )7.关于CS2、SO2、NH3三种物质的说法中正确的是( )A.CS2在水中的溶解度很小,是由于其属于极性分子B.SO2和NH3均易溶于水,原因之一是它们都是极性分子C.CS2为非极性分子,所以在三种物质中熔、沸点最低D.NH3在水中溶解度很大只是由于NH3分子为极性分子8.无机含氧酸的化学式可以用XO n(OH)m表示,n值越大,m值越小,则该酸的酸性就越强。
硫酸和磷酸的结构分别为,则下列说法正确的是( )A.硫酸和磷酸都是强酸B.硫酸是强酸,但酸性比磷酸弱C.磷酸是强酸,但酸性比硫酸弱D.硫酸是二元酸,磷酸是三元酸9.下列有机物分子中属于手性分子的是( )①乳酸[CH3CH(OH)COOH] ②2丁醇③④丙三醇A.① B.①②C.①②③ D.①②③④10.下列说法中正确的是( )A.CH4、C2H2、HCN都是含有极性键的非极性分子B.CO2与SO2的立体构型相似,都是非极性分子C.分子中含有1个手性碳原子D.含氧酸可用通式(HO)m RO n表示,若m值越大,则含氧酸的酸性越强11.374 ℃、22.1 Mpa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H +和OH-,由此可知超临界水( )A.显中性,pH等于7B.表现出非极性溶剂的特性C.显酸性,pH小于7D.表现出极性溶剂的特性[提素养]12.短周期的5种非金属元素,其中A、B、C的最外层电子排布可表示为A:a s a,B:b s b b p b,C:c s c c p2c,D与B同主族,E在C的下一周期,且是同周期元素中电负性最大的元素。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.2分子结构和性质练习(有解析)学校:___________姓名:___________班级:___________考号:___________一、选择题(题型注释)1.下列说法正确的是()A.H3O+是三角锥形结构,O原子为sp3杂化B.SO2是角形结构,S原子为sp3杂化C.CHCl3是三角锥形,C原子为sp3杂化D.AB2可能是V形或直线型,A的杂化方式可能为sp2或sp2.X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y 和共价化合物RY3、XW4,已知Y、R同主族,Z、R、W同周期。
下列说法不正确的是A.原子半径:Z>R>WB.X2W6分子中各原子均满足8电子结构C.气态氢化物的稳定性:H m W>H n RD.Y、Z形成的化合物中只可能存在离子键3.下列说法正确的是()A.氢键有方向性和饱和性,属于共价键B.分子形成氢键一定使物质的熔沸点升高C.甲醇(CH3OH)比甲硫醇(CH3SH)熔点高,原因是甲醇分子间易形成氢键D.H2O是一种非常稳定的化合物,这是由于氢键所致4.下列原子序数所对应的元素组中,两者可形成离子键的是()。
A.1和17B.12和9C.14和6D.15和85.下列变化是在克服分子间作用力的情况下进行的是()。
A.碘的升华 B.氨的液化C.铝的熔化 D.食盐的溶解二、填空题(题型注释)6.Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z。
(1)Q的最高价氧化物,其固态属于晶体,俗名叫;(2)R的氢化物分子的空间构型是,属于分子(填“极性”或“非极性”);它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是;(3)X的常见氢化物的空间构型是,它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是;(4)Q分别与Y、Z形成的共价化合物的化学式是和,Q与Y形成的分子的电子式是,属于分子 (填“极性”或“非极性”)。
(1)Y的最外层电子排布式是__ __,它的单质与碳生成的化合物与水反应生成甲烷和白色沉淀。
写出该反应的化学方程式__ 。
(2)元素T的单质与水反应的离子方程式是,在短周期主族元素中,X元素与其相邻元素的原子半径从小到大的顺序是_(写元素符号)。
(3)W形成的一种单质,其式量为256,易溶于CS2,该单质的化学式为___ __,它属于_ ___晶体(写晶体类型)。
(4)如图为Z元素所在周期气态氢化物R-H键的键能大小,则该周期元素气态氢化物键能大小与键长的关系为___ __ (用文字简述)。
原子序数递增8.钛(Ti)被誉为“21世纪的金属”。
工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti。
其反应如下:①TiO2+2Cl2+2C1173 K TiCl4+2CO ②TiCl4+2Mg 1220~1420 KTi+2MgCl2回答下列问题:(1)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体。
① TiCl4为______晶体。
② TiCl4分子为正四面体形,则Ti为________杂化。
③ TiCl4在潮湿空气中水解的化学方程式是_________________________________。
(2)配离子[TiCl(H2O)5]2+的中心离子化合价为,中心离子配位数为。
三、实验题(题型注释)9.某文献中指出“氯化铝、氯化锡为共价化合物”。
请你设计一个实验证实其结论的正确性。
10.(8分)相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期。
在一定条件下,X与Y化合生成M;X与Z化合生成N;M 能与N化合生成A。
实验室可分别用如图所示的发生装置制取X、Z和M(夹持装置已略)。
(1)制取X、Z、M的发生装置分别是(填写序号)X:________;Z:________;M:________。
(2)X、Y、Z三种单质分别是X:________;Y:________;Z:________。
(3)A的电子式是________,A中含有的化学键类型有__________________。
(4)已知Z能与M在常温下反应生成Y,同时有白烟产生。
反应的化学方程式是________________________________________________________________________。
用下图所示装置进行Z与M在常温下反应的实验,并收集Y。
①若从A中逸出的气体含有Z,则通入反应装置A中的Z和M的物质的量之比应满足________。
②若从A中逸出的气体无论含有Z或M,经洗气瓶B后,均能被吸收,则洗气瓶B中试剂与Z、M反应的离子方程式分别是__________________;__________________。
11.一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH3)4]SO4·H2O)是一种重要的染料及农药中间体。
某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SiO2杂质)为原料制备该物质的流程如下:请回答:(1)沉淀A的晶体中最小环上的原子个数为________,气体C分子中σ键和π键的个数比为________。
(2)溶液D的溶质阴离子的空间构型为__________,其中心原子的杂化轨道类型为________。
(3)MgO的熔点高于CuO的原因为______________________________________。
(4)画出一水硫酸四氨合铜(Ⅱ)中配离子([Cu(NH3)4]2+)的配位键________________。
(5)一种铜金合金晶体具有面心立方最密堆积的结构。
在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为,若该晶胞的边长为a pm,则合金的密度为g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为N A)。
四、计算题(题型注释)12.一种称为“摇头丸”的毒品已从国外流入我国,严重损害一些吸毒者的身心健康,司法机关予以坚决查缉和打击。
已知该毒品中氮的质量分数为10.37%,试完成下列问题:(1)“摇头丸”的分子结构可能是()(2)据①中“摇头丸”的分子结构分析,处于同一平面上的碳原子至少有()A.6个 B.7个 C.8个 D.9个(3)固体“摇头丸”属于()A.分子晶体B.原子晶体C.离子晶体D.金属晶体(4)摇头丸在一定条件下能否与浓HNO3发生硝化反应?(填“能”或“不能”)______________。
(5)写出“摇头丸”在加热加压和有催化剂时跟H2反应的方程式:_____________________。
(6)“摇头丸”能否跟浓盐酸反应?若能,写出生成物的结构简式;若不能,请说明理由__________________________________________________________。
13.(7分)由A、B两种物质组成的混合气体,其平均相对分子质量随A的物质的量分数变化关系如右图所示。
(1)A的相对分子质量为__________。
(2)若测得混合气体中仅含两种元素,A、B都是无机物时,化学式分别为_________、________,A、B都是有机物时,化学式分别为_________、________。
(3)某混合气由A、B等体积混合而成,将其与适量氧气混合,引燃后反应物均无剩余,将产物依次通过足量浓H2SO4(减少的体积恰好等于消耗氧气的体积)、足量碱石灰(体积减半),又知通过浓H2SO4与通过碱石灰所减少的气体体积之比为5∶2。
气体体积均在105℃和 1.01×105Pa条件下测定的,据此确定混合气体的组成为____________________________________________________________ 。
15.A和B两种物质互相溶解的关系如图1所示,横坐标表示体系的总组成,纵坐标为温度,由下至上,温度逐渐升高。
T1时a是B在A中的饱和溶液的组成,b是A在B中的饱和溶液的组成(T2时相应为c、d)。
T3为临界温度,此时A和B完全互溶。
图中曲线内为两相,曲线外为一相(不饱和液)。
某些物质如H2O和(C2H5)3N,C3H5(OH)3和间-CH3C6H4NH2有低的临界温度(见示意图2)。
请根据上述事实,回答下列问题:T3T2 c dT1 a b18.5 CA 100% 80% 60% 40% 20% 0% H2O (C2H5)3N0% 20% 40% 60% 80% 100% B图 1 图 22-1 解释图1中T3存在的原因。
2-2 说明图2所示的两对物质存在低的临界温度的原因。
2-3 描述图2所示的两对物质的互溶过程。
五、简答题(题型注释)16.A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族。
请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)(1)B单质分子中键数目比为____。
B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。
(2)H元素原子的价层电子排布式为____,H3+离子可以与上述元素中的三种形成的某阴离子生成血红色络合物;该阴离子又与A-I元素中的某些原子形成的分子互为等电子体,这种分子的化学式为____(写一种即可).该阴离子空间构型为____。
(3)D与G可以形成下图的晶胞,则黑点表示的是元素____(填写元素符号),该元素原子在该晶胞中的配位数为____.(4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),并将小点和圆圈对应的原子更改为另外两种元素的原子,则这个晶胞化学式为____,若再将留下的所有原子换成另外一种新元素的原子,成为另外一种晶胞,该成键原子键角为;(5)已知,F单质晶体的原子堆积为ABAB型,那么,该晶体的空间利用率为____。
如果F单质的摩尔质量为M,晶胞棱长为a,晶胞高度为c则,该晶体密度表达式为____。
(阿伏加德罗常数用表示,不化简)如果F的原子半径为R,用R表示的晶胞高度为____。
17.下表是元素周期表的一部分。
表中所列的字母分别代表一种化学元素。
试回答下列问题(凡涉及的物质均用化学式表示.............):(1)a的氢化物的分子构型为,中心原子的杂化形式为;d的最高价氧化物的分子构型为,中心原子的杂化形式为,该分子是(填“极性”或“非极性”)分子。
