草菇纤维素酶活测定实验方案(终)
纤维素酶酶活的测定方法

检测分析纤维素酶酶活的测定方法河南省科学院生物研究所 刘德海 杨玉华 安明理河南省饲料产品质量监督检验站 陈小鸽 饲用纤维素酶在饲料工业中已普及应用,对其质量检测显得日益重要。
纤维素酶是一种复合酶,按作用底物的能力划分为两部分,一部分是对棉花纤维素能起催化水解作用的酶,称为C1酶;另一部分是对羧甲基纤维素钠(Na-CMC)起水解作用的酶,称为C x酶。
据此,一般采用两种测定方法,一种是适用于C X酶的CMC法,另一种是适用于C1酶的滤纸法。
下面就此两种方法作一介绍。
1 C MC(羧甲基纤维素)法1.1 材料1.1.1 饲用纤维素酶 由河南省科学院生物研究所提供。
1.1.2 试剂 磷酸氢二钠、柠檬酸、羧甲基纤维素、3,5-二硝基水杨酸、氢氧化钠、酒石酸钾钠、亚硫酸钠、苯酚。
1.1.3 仪器 721型分光光度计、恒温水浴锅、PHS-2酸度计、秒表。
1.1.4 试剂配制1.1.4.1 pH5.0柠檬酸缓冲液 制取0.2mol/L 磷酸氢二钠液(称取7.16g磷酸氢二钠溶解于蒸馏水中,定容至100mL)和0.1mol/L的柠檬酸液(称取2.1g柠檬酸溶解于蒸馏水中,定容至100 mL),取磷酸氢二钠液24.3mL、柠檬酸液25.7mL 混匀,用精密酸度计测至pH值为5.0。
1.1.4.2 羧甲基纤维素溶液 准确称取2.0g羧甲基纤维素钠盐溶于200mL水中,沸水浴中加热至溶化,过滤,取滤液100mL,加柠檬酸缓冲液20 mL、蒸馏水40mL,混匀,贮存于冰箱中备用。
1.1.4.3 3,5-二硝基水杨酸显色液 准确称取6.3g3,5-二硝基水杨酸置于2mol/L氢氧化钠262mL溶液中,然后加酒石酸钾钠的热溶液(182.0g酒石酸钾钠溶于500mL水中),再加5.0 g苯酚和5.0g亚硫酸钠,搅拌至溶解,冷却后定容至1000mL,贮于棕色瓶中置冰箱中备用。
1.1.4.4 0.1%标准葡萄糖溶液 准确称取经105℃烘至恒重的无水葡萄糖250.000mg,溶于蒸馏水中,定容至250mL。
产纤维素酶真菌的酶活测定及复核鉴定-定稿

产纤维素酶真菌的酶活测定及复核鉴定摘要:试验中的真菌一部分来源于九寨沟的土壤中和枯枝落叶中,还有部分来自于河北迁安市及胜利油田的污染土壤中。
包括ACCC 31726、ACCC 32491、ACCC 32567、ACCC 32568等共计29株菌对其进行了微生物纯化、分离、筛选、酶活的测定及复核鉴定等。
关键词:纤维素酶活筛选真菌 ITS 鉴定纤维素是自然界存在量最大的一类天然资源,且可无限再生。
麻、麦秆、稻草、甘蔗渣等,都是纤维素的丰富来源。
并且我国每年产秸秆约7亿多吨,实现秸秆资源高效利用,是我国可持续发展面临的重要问题。
能源危机和环境危机是整个人类社会目前面临的严峻问题,而合理有效的处理和利用纤维素资源将为解决这些问题提供一种有效的手段。
本实验通过对菌种产纤维素酶活的测定确定其酶活高低,并综合形态观察和ITS序列分析对其进行鉴定。
1.材料与方法1.1试验材料1.1.1试验菌种试验菌种一部分来源于九寨沟的土壤中和枯枝落叶中,还有部分来自于河北迁安市及胜利油田的污染土壤中。
包括ACCC 31726、ACCC 32491、ACCC 32567、ACCC 32568等共计29株菌,所有菌种均来源于中国农业微生物菌种中心(ACCC)。
1.1.2 培养基马铃薯葡萄糖琼脂(PDA)培养基马铃薯200.0g 葡萄糖20.0g 琼脂15.0~20.0g蒸馏水1000.0mL pH 自然马铃薯去皮,切成块煮沸30.0min,然后用纱布过滤,再加糖及琼脂,溶化后补足水至1000.0mL羧甲基纤维素培养基(CMCNa)NH4NO3 1.0g KH2PO4 1.0g KCl 0.5g Mn SO4 0.004g ZnCl20.0017g CoCl20.002g MgSO4•7H2O 0.5g FeSO4 0.01g CMCNa 10g 琼脂20g 蒸馏水1000ml pH 6.5羧甲基纤维素液体培养基(同羧甲基纤维素固体培养基配方,不加琼脂)液体发酵培养基玉米秸秆粉(40目)10.0g 麸皮 2.5g KH2PO4 1.5g (NH4)2SO4 1.3g K2HPO4·3H20 2.9g CaCl20.15g MgCl2 1.0g FeSO4 0.005g MnSO40.0061g NaCl 1.0g 蒸馏水1000 mL1.1.3主要试剂1.0%羧甲基纤维素钠(CMC-Na):2g羧甲基纤维素钠(粘度300~600里泊)溶于200.0mL蒸馏水中,水浴加热至溶解,用一层纱布过滤,取滤液100.0mL加pH4.8的醋酸盐缓冲液20.0mL,再加蒸馏水410.0mL,贮冰箱备用。
纤维素酶活测定
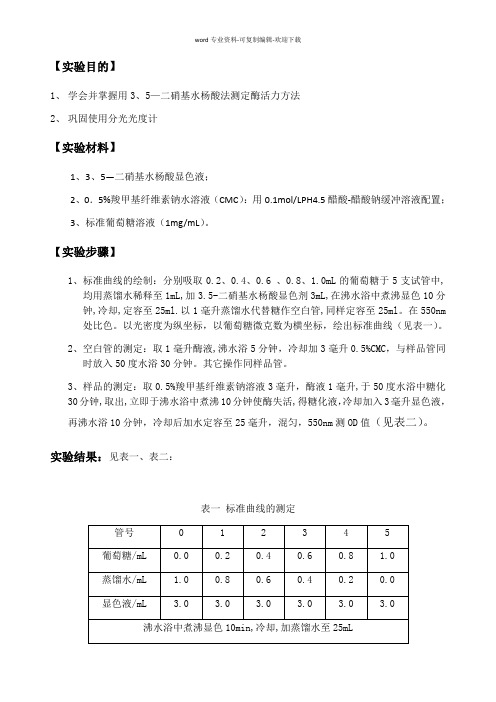
【实验目的】1、学会并掌握用3、5—二硝基水杨酸法测定酶活力方法2、巩固使用分光光度计【实验材料】1、3、5—二硝基水杨酸显色液;2、0.5%羧甲基纤维素钠水溶液(CMC):用0.1mol/LPH4.5醋酸-醋酸钠缓冲溶液配置;3、标准葡萄糖溶液(1mg/mL)。
【实验步骤】1、标准曲线的绘制:分别吸取0.2、0.4、0.6 、0.8、1.0mL的葡萄糖于5支试管中,均用蒸馏水稀释至1mL,加3.5-二硝基水杨酸显色剂3mL,在沸水浴中煮沸显色10分钟,冷却,定容至25ml.以1毫升蒸馏水代替糖作空白管,同样定容至25ml。
在550nm 处比色。
以光密度为纵坐标,以葡萄糖微克数为横坐标,绘出标准曲线(见表一)。
2、空白管的测定:取1毫升酶液,沸水浴5分钟,冷却加3毫升0.5%CMC,与样品管同时放入50度水浴30分钟。
其它操作同样品管。
3、样品的测定:取0.5%羧甲基纤维素钠溶液3毫升,酶液1毫升,于50度水浴中糖化30分钟,取出,立即于沸水浴中煮沸10分钟使酶失活,得糖化液,冷却加入3毫升显色液,再沸水浴10分钟,冷却后加水定容至25毫升,混匀,550nm测OD值(见表二)。
实验结果:见表一、表二:表一标准曲线的测定表二样品的测定图一:标准葡萄糖光吸收曲线结果分析:拟合所得的标准曲线为:Y=7.439×10-4X-0.00243。
拟合度为0.99917。
由样品的A值,可得三份溶液的葡萄糖含量分别为:652.5ug,648.5ug,653.9ug。
所以平均含量:651.6ug。
纤维素酶活力单位=651.6/0.01×30=2172 ug/mg×min【思考与讨论】1、在测定时为使各样品和空白管处理一致,应同时加入试剂,同时放入水浴中,同时取出水浴,以使反应得进行程度一致。
2、在测溶液的OD值之前,应将溶液摇匀,摇匀的方法是用保鲜膜蒙住试管口,然后来回震荡试管。
纤维素酶酶活测定可编辑全文

纤维素酶酶活测定纤维素酶活测定方法一、原理纤维素酶能将纤维素降解成纤维二糖和葡萄糖,具有还原性末端的纤维二糖糖和有还原基团的单糖在沸水浴条件下可与DNS试剂发生显色反应。
反应颜色强度与酶解产生的还原糖量成正比,而还原糖量又与反应液中的纤维素酶的活力成正比。
酶活定义纤维素酶活力单位是指55℃、pH5.0的条件下,以每分钟催化羧甲基纤维素钠水解生成1μmol还原糖所需的酶量定义为一个酶活力单位U。
二、实验试剂羧甲基纤维素钠(聚合度1700-2000),内切纤维素酶(苏柯汉)50mmol NaAC-HAC、DNS试剂三、实验仪器容量瓶(1000ml ×2、500 ml×3、100 ml ×4、50ml×4 ml)、移液器、烧杯(500ml×3、50ml×3)、具塞试管、电热套、水浴锅、分光光度计、pH计、电子天平四、标准曲线的绘制五、酶活测定由于苏柯汉给定的pH范围为4.8-5.2,故选用pH 5.0的50mmol NaAC-HAC缓冲液测定纤维素酶酶活。
1、样品的制备CMC-Na溶液的制备:用pH 5.0的50mmol NaAC-HAC缓冲液配置0.5%的CMC-Na (羧甲基纤维素钠)溶液,准确称量CMC-Na0.05g,精确至0.001g,溶于蒸馏水中,45℃水浴锅中搅拌溶解,冷却后定容至100ml。
纤维素酶液的制备:准确称取纤维素酶,精确到0.001g。
用50mmol NaAC-HAC pH5.0的缓冲液配置成适当的浓度10000倍,保证吸光度在0.2-0.6之间。
2、DNS法测酶活:取1.8ml 0.5% CMC-Na的溶液于25ml 具塞刻度试管中,55℃预热10min左右,加入0.2ml 适当稀释的酶液,于55℃水浴锅中保温30min后,然后加2ml DNS,混匀,沸水浴5min,冷却至室温,定容到25ml。
混匀测OD540nm。
(完整版)木质素酶活力的测定方法

1前言草菇是一种著名的食用菌,营养丰富,味鲜美,深受人们的喜爱。
草菇子实体含有人体必需的8种氨基酸,占其他氨基酸总量得38.2%,还含有14种维生素[1],不愧为一种比较理想的天然保健食品。
草菇喜高温高湿,生长速度快,生长周期短,一糙只需25天左右,在广西每年4月至9月均可以种植,是一种很有发展前途的食用菌,生产和市场前景广阔。
栽培草菇的生物学效率比较低(鲜菇与栽培料的比值),用稻草栽培草菇的生物学效率大都在10—15%左右。
过去研究认为草菇主要利用纤维素、淀粉,不大利用半纤维素以及木质素。
因为草菇的半纤维素酶活性低,又缺乏降解木质素的酶类,但是农作物秸杆中一般含有半纤维素15—30%,木质素占10—30%。
为此,本试验用透明圈法、氧化圈法观测V展1、V展2、V展3、V6、V广、V11六个菌株所产的胞外酶利用分解半纤维素,木质素的能力,看是否能够从其中初步筛选出利用半纤维素、木质素较强的菌株来。
探讨更合理地配制栽培料的途径对提高草菇的生物转化率有重要意义。
2 实验原理半纤维素是由五个碳原子为主的木糖聚合的高分子化合物,经木聚糖酶降解利用之后,基质生成透明圈[2]。
木质素是以苯环为基本结构的复杂大分子的有机化合物,含碳60—66%,在多酚氧化酶、过氧化酶降解后,能与愈创木酚进行反应生成棕红色或棕褐色轮环[3]。
亮兰试剂与蛋白质结合兰青色、在与过氧化酶作用则呈黄色透明圈[4]。
通过相应的平板基质培养,草菇菌丝分泌的酶类降解利用后,形成的透明圈迟早、直径大小、色泽深度等初步判断是否存在半纤维素酶和木质素酶降解酶类及其活性。
3 材料与方法3.1 材料3.1.1 菌株V 9购至广西大学微生物研究所,V广、V11购至广西农业科学院生物技术研究所,V展1、V展2、V展3采至广西现代农业展示中心经组织培养所得。
3.1.2 试剂可溶性淀粉、亮兰溶液自配、半纤维素自已提制、愈创木酚为国产分析纯、木聚糖为进口。
3.2 试验方法3.2.1 试剂配制3.2.1.1 亮兰溶液配制25 ml亮兰溶于25ml浓度为90%乙醇中,加入85%的H3PO4,最后定溶至500ml,灭菌。
实训三、纤维素酶活力的测定与稀释浓度的测定(完)

实训三、纤维素酶活力与最佳稀释浓度的测定一、实训目的1、了解纤维素酶活力的测定原理2、掌握纤维素酶活力的测定方法3、优化纤维素酶的稀释浓度,为后续实训创造条件二、实训原理纤维素酶在一定的温度和PH条件下,能够将纤维素底物(羧甲基纤维素钠)水解,释放出还原糖。
在碱性、煮沸条件下,具有还原性末端的寡糖和有还原基团的单糖可以与DNS试剂发生显色反应,反应液颜色的强度(吸光度OD值)与酶解产生的还原糖量成正比关系,而还原糖的生成量又与反应液中纤维素酶的活力成正比。
因此,可以通过分光比色测定反应液颜色的强度,可以计算反应液中纤维素酶的活力。
三、实训方法1、纤维素酶酶活的定义(根据中华人民共和国轻工行业标准QB2583-2003和中华人民共和国农业行业标准NY/T912-2004):1g固体酶(或者1ml液体酶),在50℃(预设),PH4.8(预设)的条件下,1h水解羧甲基纤维素钠底物,产生相当于1mg葡萄糖的还原糖量,为1个酶活力单位,以U/g(或者U/ml)表示。
简写成CMCA-DNS(羧甲基纤维素酶活力)。
2、还原糖法测定纤维素酶活力2.1 试剂的配制(1)0.05mol/L PH4.8的柠檬酸钠缓冲液:称取一水柠檬酸钠 4.83g,溶于约750mL水中,在搅拌的情况下,加入柠檬酸三钠7.94g,用水定容到1000mL,调节PH 到(4.8+0.05)备用。
(2) CMC-Na溶液:称取2gCMC-Na,精确至1mg,缓缓加入相应的柠檬酸钠缓冲液约200mL,并加热到80~90℃,边加热边磁力搅拌,直到全部溶解(不要沸腾!),冷却后用相应的缓冲液稀释到300mL,用2mol/L盐酸或氢氧化钠调节溶液PH到(4.8+0.05),最后定容倒300 mL,搅拌均匀,贮存到冰箱中备用。
(3)DNS溶液:具体配制见实训一。
2.2 样品的测定2.2.1待测酶液的制备称取固体酶样1g,精确到0.1mg(或吸取1.0mL 酶液,精确到0.01mL),用水溶解,准确稀释定容成100×,500×,1000×,2000×,从中选取一个合适的稀释度,最终使试样液与空白液的吸光度之差恰好落在0.33~0.35范围内),混匀放置10min,待测。
草菇木质纤维素酶活测定及其对木薯渣生物转化效率的影响

草菇木质纤维素酶活测定及其对木薯渣生物转化效率的影响吴圣进;王灿琴;韦仕岩;王茜;毛凯凯;郑聪聪【摘要】[目的]研究不同草菇菌株在木薯渣栽培基质中的木质纤维素酶活性和生物效率及其相关性,为筛选和培育适宜的草菇菌株及提高木薯渣栽培草菇的效率提供科学依据.[方法]采用木薯渣为主要原料的熟料基质,进行17个草菇菌株的栽培,测定针头期基质内的羧甲基纤维素酶(CMCase)、木聚糖酶(Xylanase)和漆酶(Laccase)活性,统计草菇的生物学效率,并采用SPSS 18.0软件进行酶活性与产量的相关分析.[结果]3种木质纤维素酶在不同草菇菌株间存在一定差异,其中羧甲基纤维素酶活性较高的菌株有V9、V26、V10、V112、Vh和V木-2,木聚糖酶活性较高的菌株有V9、V112和Vh,漆酶活性较高的菌株有V9、V112、VL和V木-2.不同草菇菌株在木薯渣栽培基质上的生物学效率存在明显差异,其中V112的生物学效率最高,达29.5%;其次是V9和V木-2,两个菌株的生物学效率均高于20.0%.羧甲基纤维素酶、木聚糖酶和漆酶活性与生物学效率均呈正相关,相关系数(R2)分别为0.2650、0.2545和0.4729.[结论]羧甲基纤维素酶、木聚糖酶和漆酶都是草菇高效转化木薯渣基质的重要影响因子,其中漆酶是关键的限制性因子.17个草菇菌株中,V9、V112和V木-2的生物学转化效率较高,是适宜木薯渣配方基质栽培的草菇菌株.【期刊名称】《南方农业学报》【年(卷),期】2014(045)005【总页数】5页(P749-753)【关键词】草菇;木薯渣;木质纤维素酶;生物学效率【作者】吴圣进;王灿琴;韦仕岩;王茜;毛凯凯;郑聪聪【作者单位】广西农业科学院微生物研究所,南宁530007;广西作物遗传改良生物技术重点开放实验室,南宁530007;广西农业科学院微生物研究所,南宁530007;广西农业科学院微生物研究所,南宁530007;广西农业科学院微生物研究所,南宁530007;广西作物遗传改良生物技术重点开放实验室,南宁530007;长江大学,湖北荆州 434025;长江大学,湖北荆州 434025【正文语种】中文【中图分类】S646.9【研究意义】草菇是一种高温型食用菌,其味道鲜美,肉质脆嫩,具有丰富的营养和保健功能,深受广大消费者喜爱。
纤维素酶活力的测定

目的本检测方法是用来确定本公司纤维素酶类的催化活性。
本方法适用于各种固体和液体纤维素酶制剂。
说明本方法适合于纤维素类酶的质量分析和质量控制领域。
但不是本公司产品及其它公司产品的绝对活力的预测,而各种酶制剂的最终的酶活力在良好的实验操作下仍可发挥出更好的催化活力。
原理纤维素被纤维素酶水解最终降解生成β-葡萄糖。
鉴于纤维素结构的复杂性,没有任何一种酶能将纤维素彻底水解。
1950 年Reese提出了C1-Cx概念。
C1是一水解因子,作用于纤维素的结晶区(如棉花纤维即为高度结晶性纤维),使氢键破裂,呈无定形可溶态,成为长链纤维素分子。
再由Cx最终催化形成还原性单糖。
而Cx通常包括:(1)内切葡萄糖苷酶(endo-1,4-β-D-glucanase,EC3.2.1.4,简称EG)。
这类酶随机水解β-1,4-糖苷键,将长链纤维素分子(羧甲基纤维素钠(CMC)即为人工合成的一种线形纤维素钠盐)截短。
(2)外切葡萄糖苷酶(exo-1,4-β-D-glucanase,EC3.2.1.91),又称纤维二糖水解酶(cellobiohydrolase,简称CBH)。
这类酶作用于β-1,4-糖苷键,每次切下一个纤维二糖分子。
(3)β-葡萄糖苷酶(β-glucosidase,EC3.2.1.21,简称BG),这类酶将纤维二糖(水杨素即为葡萄糖苷键连接的纤维二糖)水解成葡萄糖分子。
据上述理论,分别设计以滤纸(filter paper)、棉球、CMC、水杨素为底物,分别衡量纤维素的总体酶活性(FPA)、C1、Cx、Cb酶活性。
将底物水解后释放还原性糖(以葡萄糖计)与3,5-二硝基水杨酸(DNS)反应产生颜色变化,这种颜色变化与葡萄糖的量成正比关系,即与酶样品中的酶活性成正比。
通过在550nm的光吸收值查对标准曲线(以葡萄糖为标准物)可以确定还原糖产生的量,从而确定出酶的活力单位。
纤维素酶类活性的定义Ⅰ 1g酶粉(1ml酶液)于50℃pH4.8条件下,每分钟水解1×6cm的滤纸(FPA)产生1μg还原糖(以葡萄糖计)的酶量定义为1个FPA酶活力单位。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章草菇纤维素酶活性测定3.1 草菇菌丝培养3.1.1 培养基类型:A: 固体平板培养基:PDAB: 液体培养基:基础培养基+2%葡萄糖C: 种子培养基:基础培养基+1%甘油D: 诱导产酶培养基:基础培养基+1%诱导物基础培养基basal medium(g/L):KH2PO4 1.0、K2HPO40.4、MgSO4·7H2O 0.5、CaCl2·2 H2O 0.013、Yeast extract 0.1、L-asparagine 1.5、NH4NO30.5、thiamine·HCl 0.0025 (sterilized by filtration and added after autoclaving of other medium components)、Tween 80 0.2% ( vol/vol )、Mineral solution 0.1%;终pH用2 M KOH调至6.2,高压灭菌15-20min。
配置:0.25g溶于100 ml水中,配成2.5 mg/ml的Thiamine·HCI溶液,过滤除菌。
每个液体诱导培养三角瓶加0.1ml。
配置:Mineral solution (g/L):柠檬酸铁FeC6H5O7 4.8、ZnSO4·7H2O 2.64、MnCl2·4H2O 2.0、氯化钴CoCl2·6H2O 0.4、and CuSO4·5H2O 0.4。
配置100 ml。
3.1.2 诱导物类型:诱导物:a: 羧甲基纤维素钠(cabroxymethylcellulose) CMC 1%b: 纤维二糖cellobiose C.bi 2%c: α-乳糖α-lactose α-L 0.5%d: 微晶纤维素Microcrystalline cellulose M.C 1%e: 定量滤纸Filter paper F.P 1%3.1.3 草菇诱导产酶培养将PYD15、PYD21、H1521用薄的PDA固体平板培养。
32℃下培养7d。
接种到加葡萄糖的基础培养基中,32℃,150 rpm振荡培养7d。
取相同体积的菌丝接种到甘油培养基中,32℃,150 rpm振荡饥饿培养48h。
将相同容积的菌丝体接种到D诱导产酶培养基中。
32℃,150 rpm液体振荡培养48 h。
同时收集三个样品菌液和菌丝。
并将菌丝放入液氮中保存备用。
技术路线如下:药品配置:DNS试剂(GB):称取3,5-二硝基水杨酸(10.0) g,置于约600 mL水中,逐渐加入氢氧化钠10 g,在50℃水浴中(磁力)搅拌溶解,再依次加入酒石酸甲钠200 g、苯酚(重蒸) 2 g和无水亚硫酸钠5 g,待全部溶解并澄清后,冷却至室温,用水定容至1000 mL,过滤。
贮存于棕色试剂瓶中,于暗处放置7d后使用。
DNS试剂(Y.H.Percival Zhang):称取DNS 10.6 g,NaOH 19.8 g完全溶于1,416 mL水中。
再依次加入酒石酸甲钠360 g、7.6 ml融化的苯酚(50℃)和8.3 g焦亚硫酸钠。
贮存于棕色试剂瓶中,于暗处放置7d后使用。
磷酸缓冲液(GB):0.1 mol/L pH6.0 (适用于中性纤维素酶)分别称取一水磷酸二氢钠121.0g和二水磷酸氢二钠21.89 g,将其溶解在10 L去离子水中。
调节溶液的pH到6.0备用。
溶液在室温下可保存一个月。
磷酸缓冲液(实际配制):A:0.2 mol/L磷酸氢二钠:称取磷酸氢二钠-十二水71.64g,定容至1000ml。
B:0.2 mol/L磷酸二氢钠:称取磷酸二氢钠-二水31.21g,定容至1000ml。
A液:12.3;B液:87.7。
配成0.2M的母液,加1倍水即为0.1M缓冲液。
葡萄糖标准贮备溶液制备(10 mg/ml):称取于(103±2)℃下烘干至恒重的无水葡萄糖1g ,精确至0.1mg,用水溶解并定容至100mL。
标准曲线的制备:分光光度计、恒温水浴、计时器、沸水浴、试管架、20 ml具塞试管、擦镜纸、1 ml移液枪、枪头葡萄糖标准使用溶液分别吸取葡萄糖标准贮备溶液0.00、0.20、0.40、0.60、0.80、1.00、1.20、1. 50、2. 00、2. 50、3. 00、3. 50、4. 00 mL于50 ml离心管中,定容至10 mL,摇匀。
将标准管同时置于沸水浴中,反应5 min。
取出,迅速冷却至室温,用水定容至20mL。
盖塞,混匀。
波长520 nm处测量吸光度。
以葡萄糖量为横坐标,以吸光度为纵坐标,绘制标准曲线,获得线性回归方程。
3.2 酶活测定仪器:纱布、烧杯(过滤用)、液氮、研钵、研磨棒、离心管、滤纸透析袋的预处理:在200mL的2%碳酸氢钠和1mM的EDTA溶液中煮沸10min。
再用蒸馏水彻底洗涤后再放在1mM的EDTA溶液中煮沸10min。
最后蒸馏水煮沸冲洗后4℃蒸馏水中存放。
使用前用蒸馏水清洗透析袋内外,操作时用镊子或戴手套。
透析到氯化钡溶液滴入烧杯中不形成白色浑浊。
将透析袋埋入聚乙二醇-10000 中浓缩酶液。
3.2.1 样品酶液制备3.2.1.1 胞外酶液的制备将草菇的液体诱导培养液,用纱布过滤。
分别保留滤液和菌丝体。
将滤液加入20%的硫酸铵在4℃下静置几小时,然后4℃10000 rpm离心20 min后收集上清(50ml离心管)。
再缓慢加入60%的硫酸铵(*0.6g硫酸铵)4℃盐析12 h,然后4℃、12000 rpm离心20 min。
将沉淀溶于7ml的缓冲液,透析袋4℃透析20h,到BlCl2检验无沉淀后,用PEG20000吸水后,得浓缩酶液,作为胞外酶液,用于测定胞外纤维素酶活。
3.2.1.2 胞内酶液的制备将过滤所得的菌丝体,用预冷的缓冲液冲洗几次后,滤纸吸干,称重,并记录。
准确称取1 g菌丝,液氮研磨后,转移至洁净离心管中,加5ml缓冲液,10,000 rpm离心2~3min,再将上清转移至新离心管,加PMSF至终浓度1~2mmol/L,所得溶液作为胞内酶液,用于测定胞内纤维素酶活。
3.2.2 草菇纤维素酶总活力测定3.2.2.1 滤纸酶活力法(FPU Assay)底物:Whatman No. 1 号滤纸(日本用东洋1号),1.0×6.0 cm (≌50 mg)。
方法:样品管:酶+ 底物+ DNS空白管:缓冲液+ DNS酶对照管:酶+ DNS底物对照管:底物+ DNS1.取4支20 ml 刻度具塞试管,标号。
2. 按对应加入卷滚的FP和1 ml缓冲液。
50℃水浴预热30min。
3. 准确加入待测酶液2 ml,混匀,盖塞。
4. 置于50℃水浴中,不时振荡,反应120 min,取出。
5. 立即加DNS试剂2 mL。
摇匀。
6. 同时放入沸水浴中,准确沸腾5 min,取出,冰水浴冷却。
7. 用去离子水定容至20 mL。
以空白管调零,520 nm 下测量吸光度值。
FA酶活力按下式计算:吸光度=样品管-酶对照管-底物对照管X= A×l/2×n×1/2式中:X —酶活力(CMCA-DNS),u/g(或u/mL );A —根据吸光度在标准曲线上计算出的还原糖量,mg;1/2 —换算成酶液1 mL;n —酶样的稀释倍数;1/2 —时间换算系数。
3.2.3 草菇纤维素酶家族的各组分酶活力测定3.2.3.1 内切葡聚糖酶endocellulase (EC 3.2.1.4)(EG或CX)活力测定底物:1%羧甲基纤维素钠CMC-Na溶液方法:样品管:酶+ 底物+ DNS空白管:缓冲液+ DNS酶对照管:酶+ DNS底物对照管:底物+ DNS1.取4支20 ml 刻度具塞试管,标号。
2. 按对应加入1 ml底物CMC-Na溶液。
50℃水浴预热30min。
3. 准确加入待测酶液2 ml,混匀,盖塞。
4. 置于50℃水浴中,不时振荡,反应120 min,取出。
5. 立即加DNS试剂2 mL。
摇匀。
6. 同时放入沸水浴中,准确沸腾5 min,取出,冰水浴冷却。
7. 用去离子水定容至20 mL。
以空白管调零,520 nm 下测量吸光度值。
CMC酶活力按下式计算:吸光度=样品管-酶对照管-底物对照管X= A×l/2×n×1/2式中:X —酶活力(CMCA-DNS),u/g(或u/mL );A —根据吸光度在标准曲线上计算出的还原糖量,mg;1/2 —换算成酶液1 mL;n —酶样的稀释倍数;1/2 —时间换算系数。
3.2.3.2 外切葡聚糖酶exocellulase (EC 3.2.1.91)(CBH,EC或C1)活力测定底物:0.5%微晶纤维素(MC)溶液。
方法:样品管:酶+ 底物+ DNS空白管:缓冲液+ DNS酶对照管:酶+ DNS底物对照管:底物+ DNS1.取4支20 ml 刻度具塞试管,标号。
2. 按对应加入1 ml底物MC溶液。
50℃水浴预热30min。
3. 准确加入待测酶液2 ml,混匀,盖塞。
4. 置于50℃水浴中,不时振荡,反应120 min,取出。
5. 立即加DNS试剂2 mL。
摇匀。
6. 同时放入沸水浴中,准确沸腾5 min,取出,冰水浴冷却。
7. 用去离子水定容至20 mL。
以空白管调零,520 nm 下测量吸光度值。
EC酶活力按下式计算:吸光度=样品管-酶对照管-底物对照管X= A×l/2×n×1/2式中:X —酶活力(CBH),u/g(或u/mL );A —根据吸光度在标准曲线上计算出的还原糖量,mg;1/2 —换算成酶液1 mL;n —酶样的稀释倍数;1/2 —时间换算系数。
3.2.3.3 β-葡糖苷酶beta-glucosidase (EC 3.2.1.21)(CB,或纤维二糖酶Cellobiase)活力测定底物:纤维二糖(cellobiose)15 mM 。
pNPG (p-Nitrophenyl-β-D-Glucoside) 5 mM 。
方法:样品管:酶+ 底物+ DNS空白管:缓冲液+ DNS酶对照管:酶+ DNS底物对照管:底物+ DNS1.取4支20 ml 刻度具塞试管,标号。
2. 按对应加入1 ml底物CB溶液。
50℃水浴预热30min。
3. 准确加入待测酶液2 ml,混匀,盖塞。
4. 置于50℃水浴中,不时振荡,反应120 min,取出。
5. 立即加DNS试剂2 mL。
摇匀。
6. 同时放入沸水浴中,准确沸腾5 min,取出,冰水浴冷却。
7. 用去离子水定容至20 mL。
以空白管调零,520 nm 下测量吸光度值。
CB酶活力按下式计算:吸光度=样品管-酶对照管-底物对照管X= A×l/2×n×1/2式中:X —酶活力(CB),u/g(或u/mL );A —根据吸光度在标准曲线上计算出的还原糖量,mg;1/2 —换算成酶液1 mL;n —酶样的稀释倍数;1/2 —时间换算系数。
