不同温度下水的表面张力
液体表面张力的影响因素

液体表面张力的影响因素液体表面张力是指液体表面上一层分子受到的各个方向上的分子引力之和。
它是液体分子间相互作用的结果,是液体分子间吸引力和斥力的综合体现。
液体表面张力的大小决定了液体的一些特性,例如液滴的形状和液体在不同表面的润湿性。
本文将主要讨论液体表面张力的影响因素。
1. 温度温度是影响液体表面张力的重要因素之一。
随着温度的升高,液体表面张力会逐渐减小。
这是因为温度升高会增加液体分子的热运动,使分子间的相互作用减弱,从而降低了表面张力。
2. 分子间相互作用力液体表面张力的大小与分子间相互作用力的强弱密切相关。
当分子间的吸引力较强时,液体表面张力也相对较大。
例如,极性分子之间的氢键相互作用会增大液体的表面张力。
3. 溶质的存在当溶质存在于液体中时,溶质分子与溶剂分子之间的相互作用也会对液体表面张力产生影响。
有些溶质可以增加液体的表面张力,而有些溶质则会减小液体的表面张力。
这种影响可以通过浸润角的变化来观察。
4. 液体的纯度液体的纯度也对表面张力产生影响。
纯度较高的液体通常具有较高的表面张力,因为杂质的存在会扰乱液体分子的排列,从而减小液体的表面张力。
5. 外界因素液体表面张力还受到一些外界因素的影响,例如压力和电场等。
在高压下,由于分子间的距离减小,分子的相互作用增强,表面张力也会增大。
而在存在电场的情况下,离子的迁移和极性分子的取向也会影响液体的表面张力。
综上所述,液体表面张力受到多个因素的影响,包括温度、分子间相互作用力、溶质的存在、液体的纯度以及外界因素等。
了解并控制这些关键因素,可以更好地理解液体的特性,提高实际应用的效果。
不同液体之间的表面张力系数

不同液体之间的表面张力系数标题:深入探索不同液体之间的表面张力系数导语:表面张力是液体界面上自发形成的一种现象,它决定着液体在容器内的形状和液滴的稳定性。
不同液体之间的表面张力系数差异巨大,这种差异是由分子之间的力引起的。
本文将深入探索不同液体之间的表面张力系数及其影响因素,旨在帮助读者更全面、深刻地理解这一现象。
一、什么是表面张力表面张力是指液体界面上自发形成的一种力,使得液体呈现出一种将表面缩小的趋势。
表面张力决定着液体的形状和液滴的稳定性。
我们可以通过在水面上洒撒一些小颗粒来观察表面张力的效应,这些颗粒会在水面上聚集成团,并呈现出一个较小的弯曲角度。
二、影响表面张力的因素1. 分子之间的作用力:表面张力与液体分子之间的相互作用力密切相关。
分子之间的吸引力越大,表面张力越高。
一般来说,极性分子之间的吸引力比非极性分子之间的吸引力要强,因此极性液体的表面张力通常较高。
2. 温度:温度也会对表面张力产生影响。
随着温度的升高,分子的热运动增强,表面张力会减小。
这也是为什么在冷天气里,水滴往往形成较为圆润的原因,因为此时水的表面张力较高。
3. 杂质和溶质的存在:杂质和溶质的存在会干扰液体分子之间的相互作用力,进而影响表面张力。
特别是一些表面活性剂,它们可以改变液体的表面性质,使表面张力降低。
三、不同液体之间的表面张力差异不同液体之间的表面张力系数差异巨大,这是由液体本身的化学性质决定的。
以下是几种常见液体的表面张力系数(单位:N/m):1. 水:0.07282. 甲醇:0.02223. 乙醇:0.02124. 丙酮:0.02175. 水银:0.465从上述数据可以看出,水银的表面张力系数远远高于其他液体,这是因为水银是一种金属,具有比较强的分子间相互作用力。
四、不同液体之间的表面张力影响实际应用不同液体之间的表面张力差异直接影响到实际应用中的一些现象和现象。
以下是一些例子:1. 水滴形状:不同液体的表面张力决定了水滴的形状。
表面张力和附着力的关系

表面张力和附着力的关系一、引言表面张力和附着力是物体在接触面上的两种力,它们在很多自然和日常生活中都起着至关重要的作用。
本文将探讨表面张力和附着力之间的关系,并解释它们在不同情况下的作用。
二、表面张力的概念和特点表面张力是液体表面处的一种特殊力。
当液体分子位于表面时,由于表面分子的缺乏相互吸引力,因此它们会受到向内的拉力。
这种拉力使得液体表面呈现出一种薄膜状的状态,形成了液体表面的张力。
表面张力能够使液体表面保持平整,形成各种有趣的现象,比如水滴的形成、水面上的浮力等。
三、附着力的概念和特点附着力是物体在接触面上的一种力,它是由表面分子之间的相互作用力所产生的。
当两个物体接触时,它们的表面分子之间会发生相互吸引力,从而产生附着力。
附着力的大小取决于物体表面的粗糙程度、接触面积以及物体材质的特性等。
附着力在日常生活中非常常见,比如我们走路时脚与地面的附着力,胶水黏合物体的附着力等。
四、表面张力和附着力的关系表面张力和附着力在物理上是有关联的,它们都是由分子间的相互作用力所决定的。
虽然它们是不同的力,但在某些情况下可以相互影响。
下面将从不同角度讨论表面张力和附着力之间的关系。
1. 表面张力对附着力的影响表面张力的存在会影响物体与液体的接触面积,进而影响附着力的大小。
当液体表面张力较大时,液体会形成一个薄膜状的状态,接触面积减小,附着力较小。
相反,当液体表面张力较小时,液体表面不容易形成薄膜,接触面积增大,附着力较大。
这解释了为什么在一些情况下,液体很容易被吸附在物体表面,而在其他情况下则不容易。
2. 物体表面性质对附着力的影响物体的表面性质会影响附着力的大小。
具有较强吸附能力的表面分子能够与液体分子产生较强的相互作用力,从而增大附着力。
相反,具有较弱吸附能力的表面分子会减小附着力。
因此,物体表面的性质对附着力的大小起着重要的影响。
3. 温度对表面张力和附着力的影响温度对表面张力和附着力也有一定影响。
表面张力_与温度_解释说明以及概述

表面张力与温度解释说明以及概述1. 引言1.1 概述表面张力是指液体介质表面上存在的一种强大的分子间相互吸引力,导致液体表面呈现出拉力状态的现象。
温度是物质热运动的量度,对表面张力产生显著的影响。
本文将详细介绍表面张力与温度之间的关系,并探讨其背后的物质性质及应用领域。
1.2 文章结构本文主要分为五个部分。
首先,在引言部分我们将概述论文内容和结构,并明确研究目标。
然后,在第二部分中我们将详细介绍表面张力的概念以及温度对其影响的机制,配以具体实例进行分析。
接着,在第三部分中我们将探讨表面张力与物质性质之间的联系,包括不同物质溶液之间表面张力比较和解释、以及温度变化对物质表面张力行为造成的影响。
在第四部分中,我们将重点探讨工业应用中的表面张力研究意义和生物界面现象中的表面张力效应研究进展,同时展望未来可能的研究方向和挑战。
最后,在第五部分中我们将总结全文内容并得出结论。
1.3 目的本文的目的主要有两个方面:第一,通过深入探讨与表面张力相关的温度影响,加深对这一现象的理解;第二,介绍表面张力与物质性质的联系,为工业应用和生物界面现象中的相关研究提供基础和启示。
通过本文的阐述和探讨,希望能够拓宽读者对表面张力与温度之间关系的认识,并为相关领域的进一步研究提供参考和借鉴。
2. 表面张力与温度的关系2.1 表面张力的概念表面张力指的是液体表面上存在的一种引起液体表面缩小,使其尽可能形成最小表面积的趋势。
它是由于液体分子间的相互作用而产生的。
2.2 温度对表面张力的影响温度对表面张力有着明显的影响。
一般情况下,随着温度升高,液体分子具有更大的平均动能,分子活跃程度提高,因此表面张力会减小。
这是因为高温下分子运动趋势增强,造成了大量分子逸出并进入气相状态。
2.3 实例分析以水作为实例来说明温度对表面张力的影响。
在常温下(例如25°C),水的表面张力为72.8 mN/m。
但当水被加热至沸点时(100°C),水的表面张力降低到58.9 mN/m。
不同温度下水的表面张力
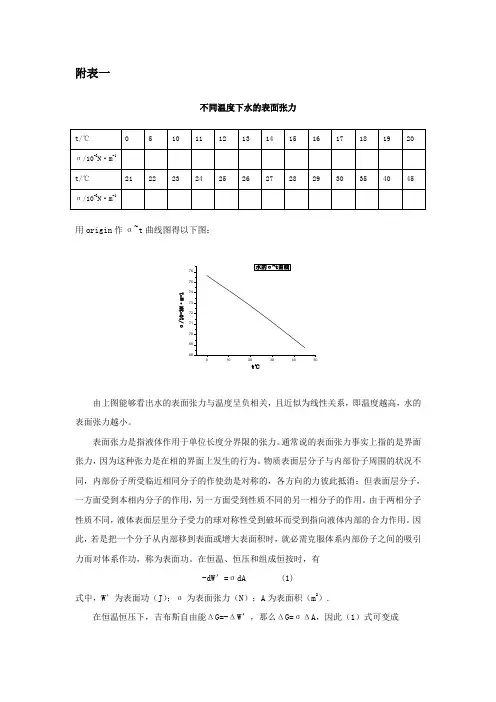
附表一不同温度下水的表面张力用origin 作σ~t 曲线图得以下图:σ/10-3N ·m -1t℃由上图能够看出水的表面张力与温度呈负相关,且近似为线性关系,即温度越高,水的表面张力越小。
表面张力是指液体作用于单位长度分界限的张力。
通常说的表面张力事实上指的是界面张力,因为这种张力是在相的界面上发生的行为。
物质表面层分子与内部份子周围的状况不同,内部份子所受临近相同分子的作使劲是对称的,各方向的力彼此抵消;但表面层分子,一方面受到本相内分子的作用,另一方面受到性质不同的另一相分子的作用。
由于两相分子性质不同,液体表面层里分子受力的球对称性受到破坏而受到指向液体内部的合力作用。
因此,若是把一个分子从内部移到表面或增大表面积时,就必需克服体系内部份子之间的吸引力而对体系作功,称为表面功。
在恒温、恒压和组成恒按时,有-dW ’=σdA (1)式中,W ’为表面功(J );σ为表面张力(N );A 为表面积(m 2).在恒温恒压下,吉布斯自由能ΔG=-ΔW ’,那么ΔG=σΔA ,因此(1)式可变成σ=(аG/аA )T,P (2)此式为温度、压强一按时,表面张力的经常使用概念式。
T ,P 表示在恒温恒压下。
依照(2)式及热力学的大体公式,可取得:(аσ/аT )A,V =-(аS/аA)T,V (3) (аσ/аT) A,P =-(аS/аA)T,P (4) 式中,S 为表面熵,V 为体积。
将(3)、(4)两式两边都乘以T ,那么有:-T (аσ/аT )=(T*dS/dA ) (5)-T (аσ/аT )的值等于在温度不变时扩大单位表面积所吸的热(T*dS/dA ),这是正值,因此(аσ/аT )<0,即该值随T 的升高而下降,从而可推知假设以绝热的方式扩大表面积,体系的温度必将下降。
附表二由σ=K*ΔP 可求得不同浓度的正丁醇溶液的表面张力σ,见下表:K=*10^(-4)m0.000.050.100.150.200.250.300.350.400.0350.0400.0450.0500.0550.0600.0650.070σ/(N /m )C/(mol/L)σ~C曲线如下图,正丁醇溶液的σ~C 曲线为近似滑腻的曲线,且正丁醇溶液的表面张力σ随浓度C的增大而减小,即(dσ/dc)T<0。
液体表面张力系数与温度和浓度的关系

液体表面张力系数与温度和浓度的关系液体由于表面张力的作用而具有自发收缩成球状的趋势.表面张力的大小, 可用表面张力系数来描述。
影响表面张力系数的因素主要有:一、温度越高表面张力系数越小;二、在液体中加入杂质可显著改变表面张力系数。
在实践中, 液体自发收缩成球状的现象有时对工农业生产是不利的。
例如, 在喷洒农药时, 药液在液面上收缩成液滴将影响叶片对农药的吸收, 因此必须减小液滴的表面张力系数使液滴在液面上呈延展分布。
减小液体表面张力最有实用意义的方法是添加表面活性物质如肥皂、皂素、皂角粉等。
液体表面张力与温度和浓度的关系表面张力是指液面作用于单位长度分界线的张力。
通常说的表面张力实际上指的是界面张力, 因为这种张力是在相的界面上发生的行为.物质表面层分子与内部分子周围的状况不同, 内部分子所受邻近相同分子的作用力是对称的, 各方向的力相互抵消;但表面层分子, 一方面受到本相内分子的作用, 另一方面受到性质不同的另一相分子的作用。
由于两相分子性质不同, 液体表面层里分子受力的球对称性遭到破坏而受到指向液体内部的合力作用. 因此如果把一个分子从内部移到表面或增大表面积时, 就必须克服体系内部分子之间的吸引力而对体系作功。
在温度上升时,表面张力将随着温度升高而下降。
液体表面张力与浓度的关系在纯液体中加入杂质时, 体系的表面张力会发生相应的变化。
根据试验, 稀溶液的表面张力和浓度的关系大致可分为3类:第一类的特征是浓度增加时, 溶液的表面张力随之下降, 大多数非离子型的有机物如短链脂肪酸、醇、醛类的水溶液都有此行为。
第二类溶液的特征是, 当溶质的浓度增加时, 溶液的表面张力随浓度上升。
第三类的特征是它与第一类曲线不同, 当溶液很稀时,表面张力随浓度的增加而急剧下降。
随后表面张力不会随着浓度而变化。
(有时也可能会出现最低值, 是由于溶液中含有杂质之故)。
当把表面活性物质加入到体系中时, 则会被吸附在该体系的表面上, 使这些表面的表面自由能明显降低, 从而降低表面张力。
水的密度、粘度及与空气界面上的表界面张力
不同温度时水的密度、粘度及与空气界面上的表界面张力表3 不同温度时水的密度、粘度及与空气界面上的表面张力在293K下水的表面张力系数为72.75×10-3 N·m-1,乙醇为22.32×10-3 N·m-1,正丁醇为24.6×10-3N·m-1,而水-正丁醇(4.1‰)的界面张力为34×10-3 N·m-1。
(1)定义或解释①促使液体表面收缩的力叫做表面张力[1]。
②液体表面相邻两部分之间,单位长度内互相牵引的力。
(2)单位表面张力的单位在SI制中为牛顿/米(N/m),但仍常用达因/厘米(dyn/cm), 1dyn/cm = 1mN/m。
(3)说明①表面张力的方向和液面相切,并和两部分的分界线垂直,如果液面是平面,表面张力就在这个平面上。
如果液面是曲面,表面张力就在这个曲面的切面上。
②表面张力是分子力的一种表现。
它发生在液体和气体接触时的边界部分。
是由于表面层的液体分子处于特殊情况决定的。
液体内部的分子和分子间几乎是紧挨着的,分子间经常保持平衡距离,稍远一些就相吸,稍近一些就相斥,这就决定了液体分子不像气体分子那样可以无限扩散,而只能在平衡位置附近振动和旋转。
在液体表面附近的分子由于只显著受到液体内侧分子的作用,受力不均,使速度较大的分子很容易冲出液面,成为蒸汽,结果在液体表面层(跟气体接触的液体薄层)的分子分布比内部分子分布来得稀疏。
相对于液体内部分子的分布来说,它们处在特殊的情况中。
表面层分子间的斥力随它们彼此间的距离增大而减小,在这个特殊层中分子间的引力作用占优势。
因此,如果在液体表面上任意划一条分界线MN把液面分成a、b两部分。
F表示a部分表面层中的分子对b部分的吸引力,F6表示右部分表面层中的分子对a部分的吸引力,这两部分的力一定大小相等、方向相反。
这种表面层中任何两部分间的相互牵引力,促使了液体表面层具有收缩的趋势,由于表面张力的作用,液体表面总是趋向于尽可能缩小,因此空气中的小液滴往往呈圆球形状。
水的密度、粘度及与空气界面上的表界面张力-精品
【关键字】情况、平衡、保持、位置、作用、速度、吸引、方向不同温度时水的密度、粘度及与空气界面上的表界面张力表3 不同温度时水的密度、粘度及与空气界面上的表面张力在293K下水的表面张力系数为72.75×10-3 N·m-1,乙醇为22.32×10-3 N·m-1,正丁醇为24.6×10-3N·m-1,而水-正丁醇(4.1‰)的界面张力为34×10-3 N·m-1。
(1)定义或解释①促使液体表面收缩的力叫做表面张力[1]。
②液体表面相邻两部分之间,单位长度内互相牵引的力。
(2)单位表面张力的单位在SI制中为牛顿/米(N/m),但仍常用达因/厘米(dyn/cm), 1dyn/cm = 1mN/m。
(3)说明①表面张力的方向和液面相切,并和两部分的分界线垂直,如果液面是平面,表面张力就在这个平面上。
如果液面是曲面,表面张力就在这个曲面的切面上。
②表面张力是分子力的一种表现。
它发生在液体和气体接触时的边界部分。
是由于表面层的液体分子处于特殊情况决定的。
液体内部的分子和分子间几乎是紧挨着的,分子间经常保持平衡距离,稍远一些就相吸,稍近一些就相斥,这就决定了液体分子不像气体分子那样可以无限扩散,而只能在平衡位置附近振动和旋转。
在液体表面附近的分子由于只显著受到液体内侧分子的作用,受力不均,使速度较大的分子很容易冲出液面,成为蒸汽,结果在液体表面层(跟气体接触的液体薄层)的分子分布比内部分子分布来得稀疏。
相对于液体内部分子的分布来说,它们处在特殊的情况中。
表面层分子间的斥力随它们彼此间的距离增大而减小,在这个特殊层中分子间的引力作用占优势。
因此,如果在液体表面上任意划一条分界线MN把液面分成a、b两部分。
F表示a部分表面层中的分子对b部分的吸引力,F6表示右部分表面层中的分子对a部分的吸引力,这两部分的力一定大小相等、方向相反。
这种表面层中任何两部分间的相互牵引力,促使了液体表面层具有收缩的趋势,由于表面张力的作用,液体表面总是趋向于尽可能缩小,因此空气中的小液滴往往呈圆球形状。
表面张力测定实验报告
表面张力测定实验报告表面张力测定实验报告引言:表面张力是液体表面因内聚力而产生的一种特性。
它是液体分子间相互作用力的结果,对于理解液体的性质和应用有着重要的意义。
本实验旨在通过测定不同液体的表面张力,探究其与温度、溶质浓度的关系,以及了解表面张力在生活和工业中的应用。
实验原理:表面张力的测定可以通过测量液体在平衡状态下液体与气体的接触角来实现。
接触角是液体与固体或气体交界面上所形成的一个角度,它与表面张力有关。
当接触角越小,液体与固体或气体的相互作用力越强,表面张力也就越大。
实验步骤:1. 实验前准备:a. 准备所需的实验器材和试剂,包括测量接触角的仪器、不同液体样品和测量温度的装置。
b. 将实验器材进行清洗和消毒,确保实验结果的准确性和可靠性。
2. 测定液体的表面张力:a. 将待测液体倒入测量接触角的仪器中,使其形成一个液滴。
b. 通过调节仪器,使液滴与仪器上的标尺平行,并记录液滴的直径。
c. 观察液滴与仪器上的标尺之间的接触角,并记录下来。
d. 重复以上步骤,测量不同液体的表面张力。
3. 探究表面张力与温度的关系:a. 将同一种液体分别加热和冷却至不同温度。
b. 重复步骤2,测量不同温度下液体的表面张力。
c. 分析实验结果,观察表面张力是否随温度的变化而变化。
4. 探究表面张力与溶质浓度的关系:a. 在同一种液体中加入不同浓度的溶质,如盐或糖。
b. 重复步骤2,测量不同溶质浓度下液体的表面张力。
c. 分析实验结果,观察表面张力是否随溶质浓度的变化而变化。
实验结果与讨论:通过实验测量得到的表面张力数据可以用于计算液体的相对分子质量等相关参数。
实验结果显示,不同液体的表面张力存在差异,这与液体分子间相互作用力的不同有关。
此外,实验结果还表明,表面张力随着温度的升高而减小,这可能是因为温度升高会增加液体分子的热运动,使其分子间的相互作用力减弱。
另外,实验结果还显示,溶质浓度的增加会导致表面张力的降低,这可能是因为溶质的存在会干扰液体分子间的相互作用力。
液体表面张力的测量
液体表面张力系数的测量实验液体沿表面总是存在着使液面紧张且向液体内收缩的力称为表面张力。
液体的许多现象,如毛细管现象、湿润现象、泡沫的形成等,都与表面张力有关。
表面张力系数是液体表面的重要力学性质:对于不同种类的液体,其表面张力不同,而对于同一种液体,其表面张力系数随着温度及其所含杂志的改变而增大或减小。
这些性质广泛应用于工业生产中,如浮法选矿、液体的传输技术、化工生产线的设计等等都要对液体的表面张力进行研究。
测定液体表面张力系数的方法很多。
常用的有拉脱法和毛细管升高法。
本次实验介绍用拉脱法测定液体表面张力系数。
一、实验目的1.用砝码对硅压阻力敏传感器进行定标,计算该传感器的灵敏度,学习传感器的定标方法; 2.观察拉脱法测量表面张力的过程,并用物理学基本概念进行分析,加深对物理规律的认识;3.测量纯水和其它液体(如:甘油)的表面张力系数。
二、实验仪器实验仪器主要由液体表面张力系数测量实验仪主机以及实验装置以及镊子、砝码组成。
应用电脑采集测量时需要壹根串口转USB 连接线、电脑和采集软件,仪器装置见下图。
三、实验原理一个金属环固定在传感器上,将该环浸没于液体中,并渐渐拉起圆环,当它从液面拉脱瞬间传感器受到的拉力差值f 为απ)(21D D f +=(1)式中: 1D 、2D 分别为圆环外径和内径,α为液体表面张力系数,g 为重力加速度,所以液体表面张力系数为:)](/[21D D f +=πα(2)实验中,液体表面张力可以由下式得到:B U U f /)(21-=(3)B 为力敏传感器灵敏度,单位V/N 。
1U ,2U 分别为即将拉断水柱时数字电压表读数以及拉断时数字电压表的读数。
四、实验步骤1.连接硅压阻力敏传感器,并开机预热15~20分钟。
测量吊环内外直径,然后清洗玻璃器皿(盛装待测液体)和吊环,给实验装置加水(注意加水量不可过多,可以参考装置外壁加水刻度线);2.将吊环挂在力敏传感器的钩上,将力敏传感器转至水容器外部,这样取放砝码比较方便。
