第2章官能团化和官能团转换的基本反应.
《有机官能团的转换》课件
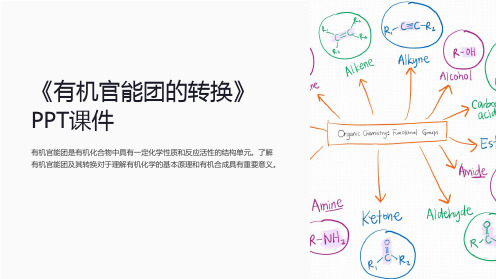
有机官能团的常见种类
1 羟基
在有机化合物中常见的官能团,具有亲水性 和参与酸碱反应的性质。
2 羰基
包括醛基和酮基,是有机化合物中常见的官 能团,具有亲电性和参与加成反应的性质。
3 氨基
含有氮原子的官能团,可以参与酸碱反应和 亲电取代反应。
4 酯基
它在医药、农业、材料科学等领域具有重要的应用价值。
总结和展望
通过对有机官能团的转换和应用的学习,我们能够深入理解有机化学的基本原理和有机合成的方法。 未来,在有机官能团转化领域的研究和应用将进一步拓展我们对功能有机物的认识和应用。
由羧酸和醇缩合得到的官能团,具有亲电性 和参与酯交换反应的性质。
有官能团的转换
有机官能团的转换指的是通过化学反应将一个有机官能团转化为另一个有机官能团。 这种转换可以通过选择合适的试剂和反应条件来实现,从而实现有机化合物的功能扩展和结构改变。
常见的有机官能团转化反应
1
醇的氧化
通过氧化剂将醇氧化成醛、酮或羧酸。
《有机官能团的转换》 PPT课件
有机官能团是有机化合物中具有一定化学性质和反应活性的结构单元。了解 有机官能团及其转换对于理解有机化学的基本原理和有机合成具有重要意义。
什么是有机官能团
有机官能团是有机分子中特定的原子或原子团,决定了分子的化学性质和反 应活性。
它们可以通过共价键与其他原子或原子团发生化学反应,从而参与有机化学 反应的进行。
2
烷烃的卤代反应
通过卤素化试剂与烷烃反应得到卤代烃。
3
烯烃的加成反应
通过加成试剂将烯烃与其他化合物反应,生成环烷化产物或加成产物。
4
醛的还原
重要官能团化合物的典型反应及相互转换的常用方法

重要官能团化合物的典型反应及相互转换的常用方法重要官能团化合物的典型反应及相互转换的常用方法官能团是指分子中具有一定功能性质的特定基团。
在化学中,官能团化合物可以通过化学反应进行自由基聚合、化学加成、脱水、缩合等反应,从而发生相互转化。
以下是重要官能团化合物的典型反应及相互转换的常用方法:1. 羰基化合物的反应及转化羰基化合物是指分子中带有羰基(C=O)的有机化合物。
羰基化合物常见的反应有酸、碱和还原反应。
酸性条件下,羰基化合物可形成酸性羟酮等化合物。
碱性条件下,则会发生羰基的亲核加成反应,生成醇、醛、羧酸等化合物。
还原反应则是将羰基还原成相应的醇。
2. 烯烃化合物的反应及转化烯烃化合物是指分子中具有双键结构的有机化合物。
烯烃化合物可进行加成反应、氧化反应和还原反应等转化。
加成反应是烯烃和亲电试剂发生反应,形成醇、醛、酮、胺等化合物。
氧化反应是将烯烃转化成醛、酮和羧酸等氧化产物。
还原反应是将烯烃还原成相应的饱和烃。
3. 烷基化合物的反应及转化烷基化合物是指分子中只有碳-碳单键的有机化合物。
烷基化合物的反应主要包括取代反应、环化反应、消除反应等。
取代反应是一种置换反应,可以将烷基化合物中的氢原子替换成其他官能团。
环化反应则是通过内部反应,将烷基化合物转化成环化化合物。
消除反应则是通过消除分子中的小分子(如水、氯气等),进行分子结构的改变。
4. 芳香烃化合物的反应及转化芳香烃化合物是指分子中含有至少一个苯环的有机化合物。
芳香烃化合物的反应主要包括芳香亲电取代反应、芳香核磁取代反应、芳香取代加成反应等。
芳香亲电取代反应是通过亲电试剂对苯环上的氢原子进行取代反应,形成新的化合物。
芳香核磁取代反应则是通过用核磁试剂取代苯环上的氢原子,形成新的化合物。
芳香取代加成反应则是将亲电试剂加到苯环中的烯丙基位或芳香环上的碳-碳双键上。
总之,重要官能团化合物的典型反应及相互转换的常用方法是化学中的重要内容。
初学者可以通过学习和掌握这些基本反应类型和相关实验技术,不断提高自己的化学实验技能和知识水平。
有机官能团与官能团反应机理

有机官能团与官能团反应机理有机官能团与官能团的反应机理是有机化学中非常重要的一部分,它涉及到了有机化合物的合成、转化和反应机制等方面。
本文将探讨有机官能团与官能团的反应机理,并从醇、酮、羧酸等常见官能团出发,介绍相应的反应机制。
I. 醇的反应机理醇是有机化合物中的一种常见官能团,其反应机理多种多样。
下面以醇的酸催化酯化反应为例,介绍醇的反应机理。
酯化反应是醇与羧酸反应生成酯的过程,其反应机理可以分为两步:醇的质子化和醇质子化后与羧酸的酰氧根发生亲核进攻反应。
首先,醇在酸性条件下质子化生成醇质子(R-OH2+),醇质子具有更好的亲核性能,使得醇质子更容易与羧酸的酰氧根结合。
随后,醇质子化后的亲核进攻部分(R-OH2+)与羧酸的酰氧根(R-COO-)发生亲核进攻反应,形成酯和质子化后的羧酸。
醇的酸催化酯化反应机理为:R-OH + R'-COOH → R'-COOR + H2OII. 酮的反应机理酮也是有机化合物中常见的官能团,其反应机理也非常重要。
下面以酮的亲核加成反应为例,介绍酮的反应机理。
亲核加成反应是酮与亲核试剂(如醇、胺等)反应生成相应加合物的过程,其反应机理可以分为两步:酮中的羰基碳负电离和亲核试剂的亲核进攻。
首先,酮中的羰基碳通过碱催化负电离,生成羰基碳负离子,羰基碳负离子具有亲电性,容易与亲核试剂发生亲核进攻反应。
随后,亲核试剂的亲核进攻部分与羰基碳负离子结合,形成加合物。
最后,通过质子转移(如酮醇互变异构反应)等步骤,加合物的结构被调整,生成最终产物。
酮的亲核加成反应机理为:R1-CO-R2 + Nu^- → R1-CO-Nu + R2III. 羧酸的反应机理羧酸是有机化合物中含有羧基功能团的一类化合物,其反应机理也非常丰富。
下面以羧酸的酸催化羰基化反应为例,介绍羧酸的反应机理。
酸催化羰基化反应是羧酸与羰基化试剂反应生成酮的过程,其反应机理可以分为两步:羧酸质子化和羧酸质子化后与羰基化试剂的亲核进攻。
第2章官能团与有机化学反应烃的衍生物高中化学课件(鲁科版2019选择性必修3)

应用练习2:某有机化合物M的结构简式如图所示,若等物质的量的M在一 定条件下分别与金属钠、氢氧化钠溶液、碳酸氢钠溶液反应,则消耗的钠、 氢氧化钠、碳酸氢钠的物质的量之比为( ) A.1∶1∶1 B.2∶4∶1 C.1∶2∶1 D.1∶2∶2
答案 B 解析 金属钠可以与M中的酚羟基、羧基发生反应;氢氧化钠溶液能使酯基 水解、溴原子发生取代反应,也能与酚羟基和羧基反应;碳酸氢钠溶液只能 与羧基发生反应,因此1 mol M消耗的钠、氢氧化钠、碳酸氢钠的物质的 量分别为2 mol、4 mol、1 mol。
苯环相互影响 —OH的邻、
对位被取代
C==O键有不饱 和性
①加成反应; ②氧化反应; ③还原反应
C—O键 、 O—H键有极性, 易断裂
①具有酸性; ②酯化反应
C—O键易断裂 水解反应
规律方法确定多官能团有机化合物性质的三步骤
应用练习1:某种药物合成中间体的结构简式如图,有关该物质的说法不 正确的是( ) A.属于芳香族化合物 B.能发生消去反应和酯化反应 C.能分别与金属Na、NaHCO3溶液反应 D.1 mol该有机化合物与足量NaOH溶液反应,消耗5 mol NaOH
把 5 个碳分为两部分,可为 CH3—O—C4H9,C2H5—O—C3H7, 由于 C4H9—有 4 种,C3H7—有 2 种,因此满足条件的同分异构体有 6 种。
如分子式为C5H10O的酮:
分子中除
外,剩余 4 个碳分为两部分,可为
, 异构体有 3 种。
,由于 C3H7—有 2 种,因此满足条件的同分
3 PART
“分碳法”书写醚、酮、酯的同分 异构体
“分碳法”书写醚、酮、酯的同分异构体
醚、酮和酯都可以看作由两部分碳骨架构成,因此可用分碳的方法书写它
药物的官能团化反应2——还原反应.

二、还原反应
分子结构中含有羰基、硝基、偶氮基等基团的的药物, 在代谢过程中可以被还原。
(一)羰基化合物的还原
由于醛类易于氧化,因此醛很少被还原为醇。
含酮基的药物在体内难以被氧化,通常被还原成仲醇。 脂肪族和芳香族不对称酮基在酶的催化下,被立体专一 性选择还原,还原产物中常产生手性中心,得到光学异 构体。
例如:降血糖药醋磺己脲代谢后生成S-(-)-代谢物。
O H3COC SO2NHC NH
H H3CC
OH SO2NH
O C NH
(二)硝基及偶氮化合物的还原
芳香族硝基及偶氮基药物在酶的作用下,分子中的硝基和
偶氮基均生成相应的芳伯胺类及芳胺类衍生物。
例如:氯霉素的还原代谢。
OH O2 N CHCHCH2OH NHCOCHCl2
OH H2N CHCHCH2OH NHCOCHCl2
百浪多பைடு நூலகம்的还原代谢。
NH2 H2 N N N SO2NH2
NH2 H2N NH2 + H2N SO2NH2
三、脱卤素反应
含卤素药物在体内一部分和谷胱甘肽结合,形成硫醚氨 酸结合物代谢排出体外,其余的经氧化脱卤素反应和还 原脱卤素反应进行代谢。 氧化脱卤素反应是许多卤代烃的常见代谢途径。 例如:抗生素氯霉素中的二氯乙酰基侧链代谢氧化后生成酰氯。
药物在体内所发生的药物在体内所发生的官能团化反应官能团化反应第第ii相生物转化相生物转化其实质是在药物分子中引入极性基团如羟基羧基其实质是在药物分子中引入极性基团如羟基羧基巯基氨基等或使药物分子暴露出这些潜在的极巯基氨基等或使药物分子暴露出这些潜在的极性基团以利于药物的排泄或与内源性物质发生结合性基团以利于药物的排泄或与内源性物质发生结合反应
(完整版)官能团的引入和转化关系
CHO
O O=C CH2 O=C CH2
O
COOH COOH
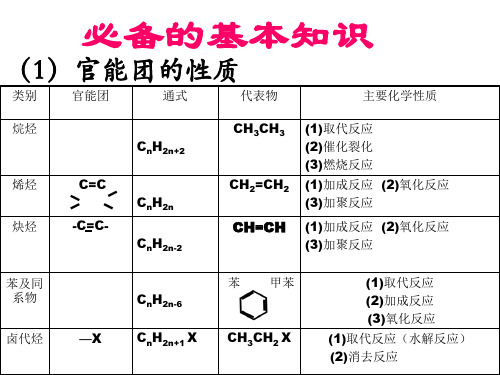
必备的基本知识
➢官能团的引入 ➢官能团的消除 ➢官能团的衍变
➢有机成环反应规律
在碳链上引入卤原子的途径
1.烷烃,苯与卤素反应:CH4 + Cl2
hv CH3Cl + HCl
C6H6 + Br2 Fe C6H5Br + HBr
3.烯/炔加成卤素/卤化氢:CH2=CH2 + Br2 CCl4 CH2BrCH2Br
CH3CH3
水解
氧化
醇类
醛类
氧化
羧酸
酯化
取代 R—OH 加氢 R—CHO
R—COOH 水解
CH3CH2Br
CH3COOC2H5
酯类 RCOOR`
CH2=CH2
CH3CH2OH
CH3CHO
CH3COOH
CH=CH CH2=CHCl
CH2Br CH2Br
[ CH2—CH ]n Cl
CH2OH
CHO
2OH
类别官能团通式代表物主要化学性质烷烃2n2ch1取代反应2催化裂化3燃烧反应烯烃2nch1加成反应2氧化反应3加聚反应2n2chch1加成反应2氧化反应3加聚反应甲苯1取代反应2加成反应3氧化反应1取代反应水解反应2消去反应类别官能团通式代表物主要化学性质ohrohoh1与钠反应2取代反应3消去反应4分子间脱水5氧化反应6酯化反应oh1有弱酸性2取代反应3显色反应4缩聚反应chorchocho1氧化反应2还原反应加成反应羧酸coohrcoohcooh1具有酸性2酯化反应coorcoor水解反应还原还原羧酸羧酸氧化氧化氧化氧化醇醇水解水解烯烃烯烃烷烃甲烷苯醇的卤代苯的硝化醇的分子间脱水酯化反应酯的水解反应等
高中化学第2章官能团与有机化学反应烃的衍生物第1节第2课时氧化反应与还原反应有机化学反应的应

第2课时氧化反应与还原反应有机化学反应的应用1.从得氧(失氢)、失氧(加氢)角度认识有机化学中的氧化反应、还原反应. 2。
理解卤代烃的制备方法和卤代烃的性质。
氧化反应与还原反应1.概念有机物分子错误!错误!有机物分子错误!错误!2.常见反应乙醇、乙醛、乙酸的转化关系:CH3CH2OH错误!CH3CHO错误!CH3COOH;化学方程式及反应类型:①2CH3CH2OH+O2错误!2CH3CHO+2H2O,氧化反应;②2CH3CHO+O2错误!2CH3COOH,氧化反应;③CH3CHO+H2错误!C2H5OH,还原反应.3.常见氧化剂和还原剂(1)氧化剂:氧气、KMnO4溶液、臭氧(O3)、银氨溶液和新制的氢氧化铜悬浊液等。
(2)还原剂:氢气、氢化铝锂(LiAlH4)和硼氢化钠(NaBH4)等。
1.判断正误(1)发生消去反应。
( )(2)HCHO―→CH3OH发生还原反应。
()(3)CH3OH错误!错误!中,①②③步反应均为氧化反应。
()(4)CH3CH2OH―→CH2===CH2发生还原反应。
()答案:(1)×(2)√(3)√(4)×2.CH3CHO+H2错误!CH3CH2OH可看做()A.氧化反应、加成反应B.氧化反应、还原反应C.还原反应、加成反应D.还原反应、取代反应解析:选C。
反应物CH3CHO中存在,而生成物中全部为饱和键,故可看做加成反应,而又是与H2加成,故又可看做还原反应.1.有机化学反应中常见的氧化反应(1)醇的氧化-—去氢式2CH3CH2OH+O2错误!2CH3CHO+2H2O反应机理:醇分子脱去羟基上氢原子和连有羟基的碳原子上的氢原子后,原羟基氧原子和连有羟基的碳原子有多余电子而再形成新的共价键。
(2)醛的氧化-—加氧式2CH3CHO+O2错误!2CH3COOH反应机理:醛的氧化是在醛基的C-H键的两个原子间插入O原子.(3)有机化合物的燃烧.(4)烯烃、炔烃、酚、醛等有机化合物使酸性KMnO4溶液退色.(5)含醛基的有机化合物与新制Cu(OH)2悬浊液、银氨溶液的反应。
有机官能团的转换

酸基在一定条件下可被一些亲核基因如OH、NH2等所 取代,因此磺酸可作为一些合成反应的中间体。磺化反 应为可逆反应利用水解反应,可将芳环上的磺酸基脱去。 这一结果,提供了利用磺酸基暂时封闭芳环某一位置的 根据。
在磺化时应注意使磺化剂的活性与芳烃活性相一致。 活化的芳烃用一般硫酸即可磺化,而钝化的芳烃则需发 烟硫酸和剧烈的反应条件。由于磺酸基是钝化基团,苯 环上最多只能进入三个磺酸基。
核试剂一般可不受溶剂层的包围而呈所调“裸露”状态, 从而表现出很强的亲核活性,有利于SN2反应的进行。 溶剂极性对SN反应的影响还同过渡态的电荷状态有关。 中性的作用物发生SNl反应时,过渡态的电荷发生分离, 即过渡态的极性增大,这时极性较高的溶剂比较低的溶
剂更能降低过渡态的能量和增加反应速度。相反,正离
如果苯环上含有一个以上的取代基时,新基进入的
位置往往受定位效应最强的取代基支配。取代基定位效 应的相对强度同反应类型和反应条件有关,相同的基团
在不同的反应或不同的反应条件下,其相对活性往往有 所不同。根据单取代苯溴代的相对反应速度一些常见邻 对位定位基的定位效应的相对活性顺序为:
根据单取代苯硝化时,问硝基衍生物的产率,一些间位 定位基的相对强度如下顺序:
当取代芳烃再度发生取代时,环上巳存在的基团将
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2) 亲核加成—与醇的加成
HC CH CH3OH
KOH 加热,加压
H2C C H OCH3
反应历程:
CH3OH + KOH
HC CH CH3O
CH3O-K+ + H2O
H3CO C CH H
CH3OH H3CO C CH2 H CH3O
HC
CH
+
CH 3OH
KOH 加 热 ,加 压 (CH 3COO)2Zn 210~250 ℃ CuCl2
H H3C C CH2 OH Br
HOBr
H3C C CH2 H
ICl
H H3C C CH2 Cl I
反应历程
空轨道 孤对 电子
第一个Br+加成符 合马式规律
3. 自由基加成—过氧化物效应
在日光和过氧化物存在下,烯烃和 HBr 加成的 取向正好和马尔科夫尼科夫规律相反,叫做烯烃与 HBr加成的过氧化物效应。
|
2.1 官能团化
2.1.2 烯烃的官能团化
N-溴代丁二酰亚胺(NBS)在光催化反 应条件下,可使多种甾烯的亚甲基发生氧化, 具有良好的区域选择性 。
hv/NBS/CaCO3 THF/H2O
H3CCOO
H3CCOO 81%
O
2.1 官能团化
2.1.2 烯烃的官能团化
用NBS进行溴化,因为反应涉及烯丙基自由基中 间体,所以得到溴代烃的混合物
Pt,Pd或Ni H2
R-CH=CH-R`
R-CH2-CH2-R`
在 H2 过量的情况下,反应不易停止在烯烃阶段. 从以下乙炔和乙烯的氢化热数据可看出: HCCH + H2 H2C=CH2 氢化热=175kJ/mol H2C=CH2 + H2 H3C-CH3 氢化热=137kJ/mol —— 炔烃比烯烃更容易加氢。 如果同一分子中同时含 有叁键和双键,首先在三键上发生加氢反应。
自由基加成
CH3CH2CH2Br
HX(强酸) CH3CHCH3 X CH3CHCH3 Y CH3CHCH2 V W X=Cl, Br, I, HSO4 HY/H+(弱酸) Y=OH, OCOCH3 VW+ 卤素或次卤酸 RCO3H KMnO4 (稀、冷) H3C HC HO CH2 OH ① O3
2.1 官能团化
2.1.1 烷烃的官能团化
烷烃对亲电试剂和亲核试剂都不活泼,可是在自由基反应中,特别是在卤化反 应里,烷烃却很活泼,因为难以控制这些反应,所以他们的合成应用受到限制。
Br2
CH3 H3C C Br CH3 CH3 H3C C Cl + CH3 CH2 H 3C C CH3 H Cl
+ -络合物
+ H+FeBr4-
HBr + FeBr3
氯苯和甲苯的氯代:
Cl + Cl2 FeCl3 Cl Cl + Cl CH3 Cl
(1) 空气催化氧化
氧化剂及反应条件不同,氧化产物不同。
O2 , Ag H2C O CH2
CH2=CH2
250℃
CuO
CH3CH=CH2 + O2
O CH3CH=CH2 + CH3C O
370℃
OH
CH2=CHCHO + H2O
CH3
CH O CH2
+ CH3COOH
烯烃成环氧化一 般用过氧酸
(2) 高锰酸钾氧化 反应产物与反应条件有关: ①在稀、冷KMnO4(中性或碱性)溶液中生成邻二醇
Br Br
a
H C H CH3 CH3 Br
-
a
H
Br H CH3 H H Br
CH3 Br CH3 CH3
内消旋体
b
b
外消旋体
•反式加成的历程
与HO-Br或HO-Cl的加成
烯烃与卤素(Br2, Cl2)在水溶液中的加成反 应。生成卤代醇,也生成相当多的二卤化物。
δ-
δ+
Br CH3CHCH2 OH
RCX2CH3
CH
RCCH3 O
RCH2CHO
(1) 亲电加成 (A) 和卤素的加成 炔烃与氯,溴加成: FeX3作催化剂
HCCH + Cl2 ClCH=CHCl + Cl2 HCCl2-CHCl2 R-CC-R` + X2 RXC=CXR` + X2 R-CX2-CX2-R` 炔烃与氯,溴加成,控制条件也可停止在一分子加 成产物上.
根据臭氧化物水解后得到的醛、酮结构,可推测原 烯烃的结构
2.1 官能团化
与卡宾反应 烯烃与卡宾的加成反应是合成环丙烷衍生物的重要方法
CH2N2
hv
CH2 + N2
CH3
CH CH2 + CH2
CH3
CH
CH2 C H2
2.1 官能团化
2.1.2 烯烃的官能团化
烯丙位氢的氧化反应(SeO2 )
SeO2
1 mol Br2 CH3 C Br Br Br CH3 C Br C Br CH3 C CH3 Br Et2O -20 oC CH3 C C CH3 2 mol Br2 25
oC
(B) 和氢卤酸的加成
R-CC-H + HX R-CX=CH2 (X=Cl、Br、I)
HX
R-CX2-CH3
不对称炔烃的加成反应符合马尔科夫尼科夫规律. H2C=CH-Cl 氯乙烯 亚铜盐或高汞盐作催化剂,可加速反应的进行. HCCH + HCl
3、
I
Br
CH2
Br
4、以丙烯为原料合成:
4、以苯为主要原料合成:
Cl Br
5、
Br C CH3
6、
Br C CH3
Br
1) 2)
OH
Br Br
CH3
COOH
CH3CO(CH2)4COOH
3) 4) 5)
OH
CH3CH2CH2Br
Cl
OH
2.1 官能团化
2.1.4 芳烃的官能团化
R
D
D2SO4
RCl RCOCl AlCl3 AlCl3 Friedel-Carefts Friedel-Carefts
CH2R ROC [H] Zn-Hg/HCl
Ar
ArN2+ClOHSO3, H2SO4 X2 FeX3 (X=Cl, Br) 气相接触 催化水解 X
HNO3, H2SO4
O 2N
HO3S NaOH
水解: (RCH2CH2O)3B + 3H2O 3 RCH2CH2OH +B(OH)3
对-烯烃是制备伯醇的一个好方法.
RCH CH2 BH3 或 B2H6 (RCH2CH2)3B
H2O2 OH
(RCH2CH2O)3B
H2O
RCH2CH2OH
总结果相当于是在 双键上反马式加一 分子H2O
氧化反应
•反应机理:
①链引发:
RO:OR 2RO· (烷氧自由基)
RO·+ HBr ROH + Br· (自由基溴)
②链增长:
CH 3CHCH 2Br HBr CH 3CH 2CH 2Br + Br
Br CH 3CH=CH 2
CH 3CHBrCH 2
HBr
CH 3CHBrCH 3 + Br
③链终止
(C) 和水的加成
HC H 2O H 2SO4 CH HgSO4 HO H2C CH
分子重排
O CH 3CH
RC CH
H 2O H 2SO4 HgSO4 H2C
HO CR
分子重排
O RCCH 3
区分烯烃水合 反应的条件!
烯醇式化合物
酮
一个分子或离子在反应过程中发生了基团的转移 和电子云密度重新分布而最后生成较稳定的分子 的反应,称为分子重排反应(或称重排反应)。
HCHO/HCl ZnCl2
ClH2CHO来自1、卤代反应 halogenate
FeCl3:路易斯酸催化剂
+ Cl2 FeCl3 Cl + HCl
+ Br2
FeBr3
Br + HBr
反应机理:
Br Br + FeBr3
Br H
+ Br Br FeBr3
Br
FeBr4-
+ Br Br FeBr3
第 2 章 官能团化和官能团 转化的基本反应
在分子中引入官能团和官能团的转换是合成的
重要方面。但我们应该指出,在一些实例中使某些
位置官能团化相对比较容易,而在另一些实例中则
不能官能团化,因而预期产物只能通过官能团转换
得到。
本章我们打算概括地汇集各种各样的反应,这
些反应都是成功的合成化学工作者所需要的。
CH3 H3C C H CH3
300 o C
300 o C
Cl2
CH3 H3C C CH3 CH3
Cl2 紫外光
CH3 H3C C CH2 Cl CH3
2.1 官能团化
2.1.2 烯烃的官能团化
烯烃与烷烃不同,进行官能团化集中表现在碳碳双键及双键的邻位——烯丙位两 个位置上。
CH3CH2CH3 催化加氢 加卡宾 H3 C CH CH2 C H2
稀、冷 KMnO4
OH C C OH
C
C
★结果是在双键位置顺式引入两个羟基。(高 锰酸钾也可用四氧化锇(OsO4)代替 )
②在酸性高锰酸钾溶液中,继续氧化,双键位置发生 断裂, 得到酮和羧酸的混合物,如:
或碱性、中性条件下加热
CH3CH2CH=CH2 KMnO4 H
