基础化学实验Ⅰ(下)
化学实验基础练习(含答案)
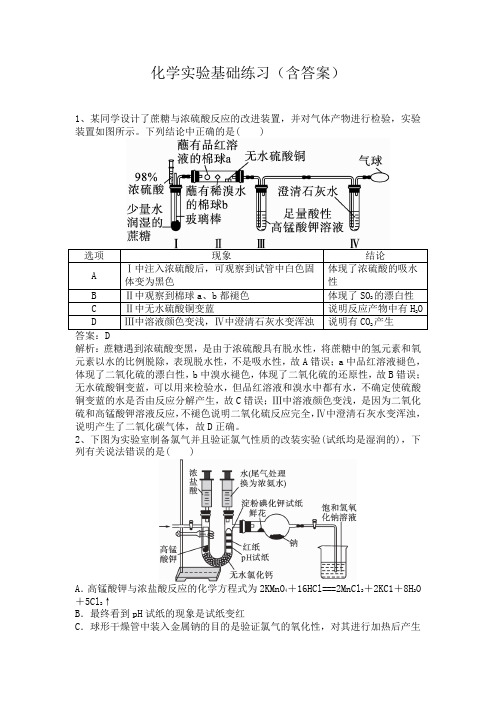
化学实验基础练习(含答案)1、某同学设计了蔗糖与浓硫酸反应的改进装置,并对气体产物进行检验,实验装置如图所示。
下列结论中正确的是( )选项现象结论A Ⅰ中注入浓硫酸后,可观察到试管中白色固体变为黑色体现了浓硫酸的吸水性B Ⅱ中观察到棉球a、b都褪色体现了SO2的漂白性C Ⅱ中无水硫酸铜变蓝说明反应产物中有H2OD Ⅲ中溶液颜色变浅,Ⅳ中澄清石灰水变浑浊说明有CO2产生答案:D解析:蔗糖遇到浓硫酸变黑,是由于浓硫酸具有脱水性,将蔗糖中的氢元素和氧元素以水的比例脱除,表现脱水性,不是吸水性,故A错误;a中品红溶液褪色,体现了二氧化硫的漂白性,b中溴水褪色,体现了二氧化硫的还原性,故B错误;无水硫酸铜变蓝,可以用来检验水,但品红溶液和溴水中都有水,不确定使硫酸铜变蓝的水是否由反应分解产生,故C错误;Ⅲ中溶液颜色变浅,是因为二氧化硫和高锰酸钾溶液反应,不褪色说明二氧化硫反应完全,Ⅳ中澄清石灰水变浑浊,说明产生了二氧化碳气体,故D正确。
2、下图为实验室制备氯气并且验证氯气性质的改装实验(试纸均是湿润的),下列有关说法错误的是( )A.高锰酸钾与浓盐酸反应的化学方程式为2KMnO4+16HCl===2MnCl2+2KC1+8H2O+5Cl2↑B.最终看到pH试纸的现象是试纸变红C.球形干燥管中装入金属钠的目的是验证氯气的氧化性,对其进行加热后产生白色的固体D.实验后,可通过注射器加入浓氨水处理残留在U形管中的氯气答案:B解析:高锰酸钾与浓盐酸混合即产生氯气,A正确;氯气溶于水形成有漂白性的次氯酸,pH试纸最终会被漂白,B错误;氯气与金属钠反应得到氯化钠白色固体,C正确;氯气可以与氨水反应而被除去,D正确。
3、下列说法中不正确的是( )A.装置②③中盛装的试剂依次是饱和食盐水和浓硫酸B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险C.从装置⑤中逸出的气体的主要成分是Cl2D.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸答案:C解析:装置②③中盛装的试剂依次是饱和食盐水(除氯气中的HCl)和浓硫酸(干燥氯气),A正确;通入干燥空气,稀释生成的Cl2O,从而降低爆炸危险,B正确;装置⑤中液氨作制冷剂,使Cl2O冷凝成液态,所以从装置⑤中逸出的气体的主要成分是空气及过量的Cl2,C错误;因为橡胶管是有机物,Cl2O是一种强氧化剂,与有机物接触会发生燃烧并爆炸,D正确。
大学基础化学实验

实验室安全事故的预防与处理
实验物品常见警告标识符号 实验时的一般注意事项
火灾、爆炸、中毒及触电事故的预防
火灾预防 爆炸预防 中毒预防与触电预防 灭火器及其使用方法 意外事故处理 返回
15
实验物品常见警告标识符号
返回
16
实验时的一般注意事项
实验前 预习实验内容、了解实验用品性能与注意事项; 检查实验装置是否正确,检查实验仪器有无破损; 检查并落实可能出现的危险和意外情况处理措施( 如灭火器材、防护眼镜、急救药品); 实验中 穿实验工作服,配带防护眼睛; 实验产生的有毒有害气体必须经过相关处理,不得 随意排放室外; 实验产生的废液、废渣必须倒入指定的收集容器; 在记录本上详细记录实验操作步骤和观察到的实验 现象,实验一旦进行就不得随意离开; 实验室内不准吸烟、喝水、进食。 实验后 关闭水、电、煤气开关,脱除实验服、洗手(脸);
带有加液的回流的搅拌装置
带有测温滴液回流的搅拌装置 38
搅拌棒常用密封方法
39
六、 脂肪提取仪
脂肪提取仪(索氏(Soxhlet)提取仪)是实验中常使用的固 -液萃取的装置。它利用了溶剂回流和虹吸的原理,使固 体物质不断被新的纯溶剂萃取, 从而达到利用少量溶剂从固体中萃 取的效果,它萃取效率较高。右图 为脂肪提取仪的装置。
返回
20
灭火器及其使用方法
21
常用灭火器种类及其适用范围
名称 泡沫灭火器 药液成份 Al(SO4)3 和NaHCO3 适用范围 用于一般失火及油类着火。因为泡沫能导电, 所以不能用于扑灭电器设备着火。火后现清 理较麻烦。 用于电器设备及汽油、丙酮等着火。四氯化 碳在高温下生成剧毒的光气,不能在狭小和 通风不良实验室使用。注意四氧化碳与金属 钠接触将发生爆炸。
初中化学基本实验教案

初中化学基本实验教案
实验名称:化学基本实验
实验目的:通过本次实验,学生将了解化学实验的基本操作方法,培养学生的实验能力和动手能力。
实验材料:试管、试管夹、酒精灯、玻璃棒、玻璃烧杯、试剂瓶等。
实验步骤:
1. 将试管夹夹住一个试管,并将试管斜倾,不要直接拿试管。
2. 使用玻璃棒小心搅拌试剂,避免接触试剂。
3. 使用酒精灯要小心防止烫伤,注意不要使试剂溅到火上。
4. 在操作过程中,注意保持实验台面整洁,避免试剂的混合或者污染。
实验内容:挥发性液体的实验操作
实验原理:挥发性液体在常温下蒸发产生气体,形成特征性气味。
实验步骤:
1. 取一小瓶挥发性液体,将其倒入试管中。
2. 将试管加热,观察挥发性液体蒸发产生的气体。
3. 闻气味,记录挥发性液体的气味。
实验注意事项:
1. 实验时要戴上实验手套,以免挥发性液体溅到手上引发伤害。
2. 使用酒精灯时要小心操作,注意安全。
3. 清洗实验器皿时要注意用水清洗干净,避免试剂残留。
实验总结:通过本次实验,学生了解了挥发性液体的挥发性能力,并掌握了实验的基本操作方法,培养了学生的动手能力和实验技巧。
希望同学们在今后的实验中能够认真操作,做好实验记录,不断提高实验能力。
初中化学下册实验教案

初中化学下册实验教案
实验目的:通过实验观察酸碱中和反应的现象,了解酸碱中和反应的基本规律,培养学生动手实验的能力。
实验材料:
1. 盐酸
2. 碳酸氢钠
3. 酚酞指示剂
4. 锥形瓶
5. 均匀玻璃搅拌棒
6. 烧杯
7. 试管
实验步骤:
1. 取一定量的碳酸氢钠溶液倒入烧杯中。
2. 用酚酞指示剂加入到碳酸氢钠溶液中,直至颜色变成粉红色。
3. 将盐酸溶液慢慢地加入到含有碳酸氢钠和酚酞指示剂的烧杯中,并用搅拌棒搅拌均匀。
4. 观察反应过程中溶液颜色的变化。
实验现象:当盐酸与碳酸氢钠溶液发生反应时,产生气泡,并且颜色由粉红变为无色。
实验结论:盐酸与碳酸氢钠发生中和反应,生成氯化钠、水和二氧化碳。
酚酞指示剂是一种酸碱指示剂,可以用来指示酸碱中和反应的进行。
注意事项:
1. 实验操作时要戴好实验室护目镜,穿好实验室工作服。
2. 实验后要及时清洗实验器材,并将废液处理好。
3. 实验操作要小心谨慎,不要将盐酸溅到皮肤上,避免受伤。
拓展实验:
1. 尝试使用其他酸和碱进行中和反应实验,观察不同酸碱反应的现象和特点。
2. 使用不同酸碱指示剂进行颜色变化实验,比较它们的反应敏感性和变化情况。
化学实验教案初中下

化学实验教案初中下
实验目的:通过本实验,让学生了解如何制备氢气,并且加深对化学反应原理的理解。
实验器材:锌粉、稀盐酸、试管、氢气收集瓶、火柴
实验步骤:
1. 取一根试管,加入适量的锌粉。
2. 在试管中加入稀盐酸,注意要小心操作,避免溅到皮肤。
3. 观察试管内的变化,观察会发现试管中产生了气泡,并且试管壁会变热。
4. 将一氢气收集瓶倒置在试管口,并用火柴点燃氢气收集瓶内的氢气。
5. 观察火焰的颜色和特点,同时可以用湿润的玻璃片将试管口关闭,观察试管内是否会出现水滴。
实验原理:在本实验中,锌与盐酸的反应生成了氢气,化学方程式为:Zn + 2HCl → ZnCl2 + H2。
氢气是一种具有燃烧性的气体,在氧气的存在下会燃烧,产生水。
安全注意事项:
1. 实验过程中要小心操作,避免溅到皮肤或衣物上。
2. 在实验室中使用火柴时要特别小心,避免火灾发生。
3. 在制备氢气时,要注意试管内产生了氢气,不要将试管口对着自己或他人。
4. 确保实验室通风良好,避免气体积累引起危险。
实验结果:通过本实验,学生可以观察到氢气的生成以及氢气的燃烧特点,加深对化学反应原理的理解。
延伸实验:可以尝试用不同量的锌粉和盐酸进行实验,观察氢气的生成量和燃烧时间的变化。
也可以尝试将氢气收集后用针管进行点燃,观察火焰的颜色和特点。
《基础化学Ⅰ》课程标准

《基础化学Ⅰ》课程标准课程代码:B0308035 课程类别:专业基础课授课系(部):药品与环境工程学院学分学时: 96学时一、课程定位与作用1.课程的定位本课程是我院化学化工类、制药类、工业分析类、食品类专业的重要专业基础课程,是各专业课程体系的重要组成部分,基于岗位分析和具体工作过程,服务于专业课程的学习和职业能力的培养,为培养合格的高端技能型人才提供必备的无机化学基本知识、基本理论、基本运算、基本实验技能,并能将其与专业技术应用相结合,分析、认识专业技术中的相关问题。
在学习过程中,重点培养学生自学能力、创造能力和分析解决问题的能力,同时注重专业基础知识在后续课程和实际工作中的应用,有助于学生形成正确的学习方法和工作思路,为全面提高学生的素质,强化职业道德,提升学生的社会能力和方法能力,培养具备一定创新能力的技术技能人才奠定基础。
2.课程的作用《基础化学Ⅰ》作为一门专业性基础课程,是各专业课程体系的重要组成部分,课程教学以服务于专业课程的学习和职业能力的培养,以培养社会主义现代化化工生产、分析检验、药品生产、食品检测等工作的高端技术技能人才为根本任务,遵循各专业人才培养方案的专业人才定位,突出课程内容和教学过程的实践性、职业性和开放性,做到由简单到复杂、由单一到综合的认知规律,实施“基础能力培养、专业能力训练、拓展能力形成”的职业能力递进教学模式。
3.与其他课程的关系这门课程是为大学一年级的学生开设的,前导课程有中学化学,但是大部分学生基础较为薄弱;后续课程有《基础化学Ⅱ》、《工业分析技术》、《生物化学》、《现代分析检测技术》、《食品理化检验技术》等,课程的开设能很好地服务于专业课程的学习,为后续学习提供知识和技能基础。
二、课程目标通过《基础化学Ⅰ》课程的学习,使学生掌握满足职业技能要求、专业课程必需的无机化学基本理论、基本知识和实验技能,能够把无机化学的基础知识、研究方法与分析检测技术、化工生产技术等应用相结合,用无机化学的知识分析、认识专业技术中的相关问题。
《基础化学实验Ⅰ》课件的设计与制作
础 实验 I( 根据 学 科 的特 点 及 联 系 , 们 将原 无 机 化 我 学 实验 、 析化 学 实 验 和有 机 化 学 实 验 合 并 为 化 学 分 基 础实 验 , 中 , 其 一部 分 内容 以原 .
将 其 与动 画 制作 的流行 软 件 Fah5有 机 结合 , 作 l s 制 具 有 一定 交 互 功能 的集 教 与学 为 一 体 的《 础 化 学 基 实 验 I》 多媒 体虚 拟 实验 软 件 . 文 主要 介绍 该 软 件 本
的设计 思 想 、 内容 和功 能特 点 .
我 们 选取 了《 础化 学 实 验 I》 学 中具 有 代表 性 且 基 教 比较 抽 象 、 实验 现 象 难 以观 察 的实 验 作 为 重 点 制 作 对象 , “ 化 还 原 反 应 ” “ 如 氧 、 电解 和 电镀 ” “ 色 反 、焰 应 ”分 子 和原 子 晶体 结 构模 型 等 , 、 同时 , 实 验 习题 在
我 系 在 20 0 0年 教 学计 划 的指 导 下 , 消 了 原 无 取 机化 学 实验 和分 析 化 学 实 验 , 而 代 之 的是 化 学 基 取
2 《 础 化 学 实验 工》 基 多媒 体 虚 拟 实 验软 件 的总体 设计 思想
软 件 的总 体设 计 方案 是 要求 建 立 软件 合理 的结
学 生也 可 以 自由地 上 机 学 习 , 习 或 复 习 相 关 实 验 预
3 《 基础 化学实验 工》 能模块 介绍 功
3 1 口令 录入 模块 .
内容及 操 作 .
学员 在 进 入 实 验 之 前 , 必 须 输 入 已经 指 定 的 都
基础有机化学实验智慧树知到课后章节答案2023年下浙江大学
基础有机化学实验智慧树知到课后章节答案2023年下浙江大学浙江大学第一章测试1.以下物质中,哪些应该在通风橱内操作? ()答案:氯化氢2.高温实验装置使用注意事项错误的是:()答案:使用高温装置的实验,要求在防火建筑内或配备有防火设施的室内进行,并要求密闭,减少热量损失3.取用化学药品时,以下哪些事项操作是正确的?()答案:其余选项都是4.用剩的活泼金属残渣的正确处理方法是:()答案:在氮气保护下,缓慢滴加乙醇,进行搅拌使所有金属反应完毕后,整体作为废液处理5.试剂或异物溅到皮肤上,处理措施正确的是:()答案:其余选项都是第二章测试1.关于蒸馏,下列描述正确的是()答案:通过蒸馏可以测定液体化合物的沸点。
2.简单蒸馏时,蒸馏物的体积一般在蒸馏瓶容积的()答案:1/3-2/33.液体的沸点高于140℃时用()冷凝管答案:空气4.简单蒸馏时,温度水银球对应蒸馏头侧管下线位置偏高,会导致测得沸点()答案:偏低5.蒸馏不能分离以下哪种混合物:()答案:乙醇(95%)与5%水的混合液第三章测试1.关于Rf值,下列说法错误的是:()答案:同一物质的Rf值是一常数2.薄层层析上行法操作程序,按正确顺序排列:()a.加盖密闭,展开剂借毛细作用慢慢上移b.当展开剂的前沿距薄板另一端约1 cm左右时,取出薄层板,用铅笔轻轻画下溶剂前沿,然后让板上的溶剂自然挥发c.把一定量的展开溶剂倒入层析缸d.将薄层板点样端朝下以一定角度小心地放置在层析缸中,层析缸中溶剂的液面应在离样品原点0.5 cm以下答案:3、4、1、23.点样量的多少分析错误的是()答案:点样量随薄层厚度和分离目的而定,在0.25 mm厚度的薄层上,作定性分离时,一般点样量为点样量可达几十毫克~几百毫克4.薄层色谱的基本操作过程的正确顺序()1 薄层板的制备 2选择吸附剂 3展开4 点样5 记录6 显色,7 展开剂的选择答案:2,1,4,7,3,6,55.薄层色谱可用于:()答案:其余选项都是第四章测试1.关于柱层析中的洗脱剂,下列说法错误的是:()答案:一般要求该溶剂的极性应大于样品极性2.装柱时若柱中形成气泡或裂缝,会造成:()答案:样品分离不均匀,造成组分重叠,影响分离效果3.现有少量下列几种物质,纯度都不是很高。
化学实验基本操作实验报告(通用10篇)
化学实验基本操作实验报告(通用10篇)化学实验基本操作实验报告(通用10篇)随着个人素质的提升,报告的用途越来越大,我们在写报告的时候要注意逻辑的合理性。
你还在对写报告感到一筹莫展吗?以下是小编收集整理的化学实验基本操作实验报告,希望对大家有所帮助。
化学实验基本操作实验报告篇1[实验目的]1、掌握常用量器的洗涤、使用及加热、溶解等操作。
2、掌握台秤、煤气灯、酒精喷灯的使用。
3、学会液体剂、固体试剂的取用。
[实验用品]仪器:仪器、烧杯、量筒、酒精灯、玻璃棒、胶头滴管、表面皿、蒸发皿、试管刷、试管夹、药匙、石棉网、托盘天平、酒精喷灯、煤气灯。
药品:硫酸铜晶体。
其他:火柴、去污粉、洗衣粉[实验步骤](一)玻璃仪器的洗涤和干燥1、洗涤方法一般先用自来水冲洗,再用试管刷刷洗。
若洗不干净,可用毛刷蘸少量去污粉或洗衣粉刷洗,若仍洗不干净可用重络酸加洗液浸泡处理(浸泡后将洗液小心倒回原瓶中供重复使用),然后依次用自来水和蒸馏水淋洗。
2、干燥方法洗净后不急用的玻璃仪器倒置在实验柜内或仪器架上晾干。
急用仪器,可放在电烘箱内烘干,放进去之前应尽量把水倒尽。
烧杯和蒸发皿可放在石棉网上用小火烘干。
操作时,试管口向下,来回移动,烤到不见水珠时,使管口向上,以便赶尽水气。
也可用电吹风把仪器吹干。
带有刻度的计量仪器不能用加热的方法进行干燥,以免影响仪器的精密度。
(二)试剂的取用1、液体试剂的取用(1)取少量液体时,可用滴管吸取。
(2)粗略量取一定体积的液体时可用量筒(或量杯)。
读取量筒液体体积数据时,量筒必须放在平稳,且使视线与量筒内液体的凹液面最低保持水平。
(3)准确量取一定体积的液体时,应使用移液管。
使用前,依次用洗液、自来水、蒸馏水洗涤至内壁不挂水珠为止,再用少量被量取的液体洗涤2-3次。
2、固体试剂的取用(1)取粉末状或小颗粒的药品,要用洁净的药匙。
往试管里粉末状药品时,为了避免药粉沾到试管口和试管壁上,可将装有试剂的药匙或纸槽平放入试管底部,然后竖直,取出药匙或纸槽。
化学实验基础初中讲解教案
化学实验基础初中讲解教案
一、实验目的:
通过本实验,学生将了解化学实验的基本原理和方法,培养学生的观察力和实验技能。
二、实验材料:
1. 烧杯
2. 试管
3. 酒精灯
4. 草酸钠
5. 盐酸
6. 碱性溶液
7. 酸性溶液
8. 红色、蓝色指示剂
三、实验步骤:
1. 将烧杯中倒入一定量的草酸钠溶液。
2. 按比例在试管中混合盐酸和碱性溶液,形成化学反应。
3. 将试管倾斜,并点燃酒精灯,加热试管中的混合溶液。
4. 观察试管中的变化,记录下产生的气体、颜色变化等现象。
5. 使用红色、蓝色指示剂进行酸性、碱性的检验,确认反应产生的物质特性。
四、实验内容:
1. 草酸钠与盐酸的反应:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
2. 碱性溶液与酸性溶液的中和反应。
五、实验原理:
1. 化学反应是指两种或多种物质发生物质变化的过程。
2. 酸碱中和反应是指酸性溶液与碱性溶液混合后,酸碱的性质被中和,生成盐和水。
六、实验总结:
通过本次实验,学生将掌握化学反应的基本原理与方法,加深对酸碱中和反应的理解,并培养实验技能与观察力。
同时,学生也应该在实验后进行实验总结与结果分析,巩固所学知识,加深对化学知识的理解与掌握。
以上为化学实验基础初中讲解教案范本,教师可以根据具体情况进行适当调整和修改。
愿本教案对您有所帮助,学习愉快!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
基础化学实验Ⅰ(下)实验一、分析天平的称量练习1. 用分析天平称量的方法有哪几种?指定质量称样法和递减称样法各有何优缺点?在什么情况下选用这两种方法?答:称量有三种方法:直接称量法,指定质量称量法,递减称量法。
指定质量称量法:此方法称量操作的速度很慢,适于称量不易吸潮,在空气中能稳定存在的粉末状或小颗粒(最小颗粒应小于0.1mg )样品,以便容易调节其质量。
在直接配制标准溶液和试样分析时经常使用指定质量称样法。
递减称量法:此称量操作比较繁琐。
主要用于称量过程中样品易吸水、易氧化或易与空气中的CO 2发生反应的试样。
2. 使用称量瓶时,如何操作才能保证试样不致损失?答:将称量瓶取出,在接收器的上方,倾斜瓶身,用称量瓶盖轻敲瓶口上部使试样慢慢落入容器中。
当顷出的试样接近所需量时,一边继续用瓶盖轻敲瓶口,一边逐渐将瓶身竖直,使粘附在瓶口上的试样全部进入称量瓶中,然后再盖好瓶盖,称量。
实验二、滴定分析基本操作练习1.HCl 溶液与NaOH 溶液定量反应完全后,生成NaCl 和水,为什么用HCl 滴定NaOH 时采用甲基橙作为指示剂,而用NaOH 滴定HCl 溶液时却使用酚酞作为指示剂?答:HCl 溶液与NaOH 溶液,相互滴定两种指示剂均可采用,但是考虑到终点颜色的观察敏锐性一般黄色到橙色,无色到红色容易观察,因此采用上述方法。
2.滴定读数的起点为什么每次最好调到0.00刻度处?答:因为滴定管在制作过程中会出现管内刻度不完全均匀的现象,每次滴定都从0.00刻度开始,能消除系统误差。
实验三、混碱分析1. 双指示剂法的测定原理是什么?答:用HCl 溶液滴定Na 2CO 3 为例。
H 2CO 3 为二元酸,离解常数分别为p K a1=6.38; p K a2=10.25,用HCl 溶液滴定Na 2CO 3 溶液时c K b1>10-9 ,c K b2=10-8.62 > 10-9,且K b1/K b2=10-3.75/10-7.62=103.87 ≈104,能分步进行:第一步反应:Na 2CO 3+HCl =NaHCO 3+NaCl ,第二步的反应产物为CO 2 ,其饱和溶液的浓度为0.04 mol·L -13.8)25.1036.6(21)p p (21pH :11a a 1=+=+=K K 第一化学计量点 9.3)40.136.6(21)p p (21pH :1a 2=+=+=c K O H CO .............................................CO H NaCl HCl NaHCO 22323+↑+=+a 第二化学计量点用HCl 溶液滴定Na 2CO 3有2个滴定突跃:第一个突跃在化学计量点pH=8.3的附近,可用酚酞作指示剂;第二个突跃在化学计量点pH=3.9的附近,可用甲基橙作指示剂。
2. 采用Na 2CO 3作基准物质标定0.l mol·L -1 HCl 溶液时,基准物质称取量如何计算?答:标定反应Na 2CO 3+2HCl =NaCl +HCl +H 2O 1-CO Na l HC HCl CO Na L 1000mL 213232⋅=M V c m 1-CO Na CO Na l HC HCl L 1000mL 23232⋅××=M m V cV HCl =20∼40mL 时,则 0.11g g 10590L 1000mL g/mol 99105mL 20L mol 10211-1CO Na 32≈=⋅××⋅×=−...m若配制250mL,分取25.00mL 用于标定HCl 溶液浓度则应称量1.1g ∼ 2.2g ;通常V HCl =20∼30mL ,若配制250mL ,分取25.00mL 用于标定HCl 溶液浓度则应称量1.1g ∼ 1.6 g3.“总碱量”的测定应选用何种指示剂?终点如何控制?为什么?·答:指示剂选用:“总碱量”的测定应选用甲基橙作指示剂。
溶液由黄色变为橙色时即为终点。
因为用和HCl 溶液滴定Na 2CO 3时,其反应包括以下两步:Na 2CO 3 + HCl NaHCO 3 +NaClNaHCO 3 + HCl NaCl + H 2CO 3H 2O+CO 2当中和成NaHCO 3时,pH 值为8.3;在全部中和后,其pH 值为3.7。
由于滴定的第一等当点(pH8.3)的突跃范围比较小,终点不敏锐。
因此采用第二等当点,以甲基橙为指示剂,溶液由黄色到橙色时即为终点。
终点控制:滴定快到终点时应慢滴快摇,要充分摇动锥形瓶,以防形成CO 2的过饱和溶液使终点提前到达。
当颜色由黄变橙,且颜色稳定,即为终点。
实验四、含氮量测定1.NH 4NO 3、NH 4C1或NH 4HCO 3中的含氮量能否用甲醛法分别测定?答:NH 4NO 3中铵态N 可以直接用甲醛法测定,但是其中NO 3里面的N 无法直接用甲醛法测定;NH 4C1中的含氮量可以直接用甲醛法测定;NH 4HCO 3中的含氮量不能直接用甲醛法测定,因为NH 4HCO 3中的HCO 3- 干扰测定。
NH 4HCO 3 + HCHO →(CH 2)6N 4H + + H 2CO 3产物 H 2CO 3易分解且酸性太弱,不能被NaOH 准确滴定。
2.为什么中和甲醛中的游离酸使用酚酞指示剂,而中和(NH 4)2 SO 4试样中的游离酸却使用甲基红指示剂?答:若试样中含有游离酸,加甲醛之前应事先用甲基红为指示剂,用碱预中和至甲基红变为黄色 。
因为(NH 4)2SO 4试样溶液的pH ≈4.63,若用酚酞作指示剂NH 4+将部分被NaOH 滴定,影响结果的准确度, 故中和试样中游离酸时应选择甲基红(4.4~6.2)做指示剂;二甲醛溶液中常含有微量酸,但不存在NH 4+会被部分滴定的情况,因此用酚酞作指示剂会和测定方法统一起来,做到标测一致,减少误差,提高分析结果的准确度。
3.(NH 4)2 SO 4试液中含有PO 43-、Fe 3+、Al 3+等离子,对测定结果有何影响?答:PO 43-产生酸效应使测的结果偏低;Fe 3+、Al 3+离子在中和残余酸时,容易产生水解现象导致测定结果偏高。
实验五、水的硬度分析1.在中和碳酸钙基准溶液中的HCl 时,能否用酚酞取代甲基红?为什么?答:不能,主要是因为酚酞在终点时呈现红色,该颜色影响终点时EBT 蓝色的观察,从而影响对滴定终点的判断,导致结果准确性降低。
2.阐述Mg 2+-EDTA 能够提高终点敏锐度的原理。
答:由于指示剂EBT 对Mg 2+变色灵敏,而对Ca 2+不敏锐,所以当测定水硬时,试液的Mg 2+浓度较低或没有Mg 2+时,需要加入Mg 2+-EDTA 提高指示剂EBT 变色的敏锐性。
提高终点敏锐度的原理: Ca 2+与EDTA 的络合常数为10.69,比Mg 2+与EDTA 的络合常数8.7大,溶液中开始时存在大量的Ca 2+,溶液中加入Mg 2+-EDTA 后,Ca 2+置换Mg 2+,形成Ca 2+-EDTA ,游离出的Mg 2+与指示剂络合形成酒红色化合物,到滴定终点时,过量的半滴EDTA 与Mg 2+结合从而释放出游离指示剂(蓝色),可以敏锐的指示滴定终点。
3. 滴定为什么要在缓冲溶液中进行?如果没有缓冲溶液存在,将会导致什么现象发生? 答:EDTA 滴定分析中采用的标准滴定溶液是Na 2H 2Y ,在滴定过程中随着滴定的进行,溶液的酸度逐渐增加,EDTA 的酸效应逐渐增强即副反应系数增大,导致逐渐减小,致使,滴定反应不完全,不能准确滴定。
为此要达到准确滴定的目的必须严格控制溶液的酸度,故需要加入缓冲溶液。
Y(H)α,,、MgY CaY K K 8lg MY<′K c实验六、混合溶液中铅铋含量的测定1 滴定Bi 3+、Pb 2+离子时溶液酸度各控制在什么范围?怎样调节?为什么?答:因PbY: lg K PbY=18.04,(pH)min=3.3;BiY: lg K BiY=27.94,(pH)min=0.7故:可通过控制酸度分别滴定测定条件:pH=1 时测定Bi 3+,指示剂 二甲酚橙(XO ),终点Bi-XO(紫红)→XO(亮黄);在滴定Bi 3+后的溶液中,调节溶液的pH=5~6 时测定Pb 2+ , 终点Pb-XO(紫红)→XO(亮黄)2. 为什么不用NaOH 、NaAc 或者NH 3·H 2O ,而用六亚甲基四胺调节pH 到5~6?答:测定金属离子Pb 2+的适宜的滴定酸度pH=5~6,按照缓冲溶液的选择原则选择:所需要控制的溶液的酸度应该在p K a ± 1范围内,NaOH 、NH 3·H 2O 不符合要求,单从p K a 分析可以NaAc 和六亚甲基四胺缓冲液体系,但是NaAc 与Pb 2+生成Pb(Ac)3-,Pb(Ac)α增大,减少,影响反应的完全程度,故用六亚甲基四胺调节pH 到5~6。
,PbYK 实验七、重铬酸钾滴定法测定铁1. SnCl 2还原Fe 3+的条件是什么?怎样控制SnCl 2不过量?答:在还原Fe 3+时HCl 溶液浓度应控制在4 mol/L ,若大于6 mol/L ,Sn 2+会先将甲基橙还原为无色,无法指示Fe 3+的还原反应。
HCl 溶液浓度低于2 mol/L ,则甲基橙褪色缓慢。
控制SnCl 2不过量的措施是采用甲基橙指示SnCl 2还原Fe 3+,原理是:Sn 2+将Fe 3+还原完后,过量的Sn 2+可将甲基橙还原为氢化甲基橙而褪色,不仅指示了还原的终点,Sn 2+还能继续使氢化甲基橙还原成N,N-二甲基对苯二胺和对氨基苯磺酸,过量的Sn 2+则可以消除。
在溶液中加入一滴甲基橙,再滴加SnCl 2溶液,当溶液由橙变红,再慢慢滴加SnCl 2至溶液变为淡粉色,再摇几下直至粉色褪去。
如刚加入SnCl 2红色立即褪去,说明SnCl 2已经过量,可补加1滴甲基橙,以除去稍过量的SnCl 2,此时溶液若呈现粉红色,表明SnCl 2已不过量。
2. 以K 2Cr 2O 7基准溶液滴定Fe 2+时,加入H 3PO 4的作用是什么?答:滴定反应为:6 Fe2++Cr2O72-+14H+ →6 Fe3++2 Cr3++7H2O;滴定突跃范围为0.93 ~ 1.34V,使用二苯胺磺酸钠为指示剂时,由于变色点电位为0.85V,终点提前到达,引入较大误差。
因而需加入H3PO4。
加入H3PO4可使滴定生成的Fe3+生成无色的Fe(HPO4)2-而降低Fe3+/ Fe2+电对的电位,使突跃范围变成0.71~1.34V,指示剂可以在此范围内变色,同时也消除了FeCl4-黄色对终点观察的干扰。
