果胶含量的测定方法二
果胶物质的测定

流动水冷却至室温
在530nm 下
沸水浴加热10min
混合,冷却
充分混合,室温 放置30min
以0号为空白测 定吸光度 果胶提取液 稀释
绘制标准工作曲 线
含半乳糖醛 酸约 10-70ug ml
2ml稀释液与50ml比色管中
测吸光度查浓度
结果计算:
ρV K
X=——— ×100 m×10
6
式中:X——果胶物质(以半乳糖醛酸计)的含量,g/100g
主讲: 主讲:亓新会
果胶物质的定义及形态
果 胶 物 质 的 测 定
果胶物质在食品中的应用 果胶酸钙滴定法
蒸馏滴定法 果胶物质的测定 重量法
咔唑比色法
果胶物质
定义:果胶物质是一种植物胶,存在于果蔬类植物组织中,是构成植物细胞的主要成 分之一。
原果胶:果蔬未成熟时,存在于细胞壁中
果胶 物质 的形 态
果胶酸酯:可溶性
区别在于甲 氧基含量或 酯化程度不 同
果胶酸
(1)原果胶(Protopectin):植物在未成熟前,果胶物质相互间,或它与半纤维素 (1)原果胶(Protopectin):植物在未成熟前,果胶物质相互间,或它与半纤维素 及钙盐之间,以机械方式或化学方式相结合,形成了不溶于水的物质。原果 胶可以成为一种不溶于水的、亲水能力很大的结合剂,这时原果胶具有增稠 作用。 在酶的作用下,草莓等成熟的果实和胡萝卜等蔬菜中的原果胶,能逐渐变为 果胶酯酸。于是,一部分果胶物质呈溶解状态而存在细胞液中。原果胶在水 或酸性溶液中加热,也同样可转变为果胶酯酸。 或酸性溶液中加热,也同样可转变为果胶酯酸。
(2)果胶酯酸(Pectinic acid):它的基本结构是 (2)果胶酯酸(Pectinic acid):它的基本结构是 多聚半乳糖醛酸,呈胶态。其中甲基酯的含 量是可变的。酯化程度100%的完全甲基化的 量是可变的。酯化程度100%的完全甲基化的 果胶酯酸,甲氧基(CH3O— 含量为16.32%。 果胶酯酸,甲氧基(CH3O—)含量为16.32%。 按甲氧基含量的不同,果胶酯酸分为两类。 甲氧基含量大于7%的,叫作高甲氧基果胶( 甲氧基含量大于7%的,叫作高甲氧基果胶(又 称果胶,Pectin);甲氧基含量小于7%的,叫 称果胶,Pectin);甲氧基含量小于7%的,叫 作低甲氧基果胶(又称低酯果胶) 作低甲氧基果胶(又称低酯果胶)。果胶酯酸与 糖和酸在适当条件下能形成凝胶。甚至,不 用加糖,只要有多价正离子存在,,低酯果 胶也可形成凝胶。果胶酯酸的游离羧基与金 属离子可形成正盐或酸式盐。
果胶(称重法)

果胶含量(称重法)(1)原理用沉淀剂使果胶物质沉淀析出,而后分别用乙醇、乙醚处理沉淀以去除可溶性糖类、脂肪、色素等干扰物,所得残渣再用酸或水提取总果胶或水溶性果胶。
果胶经皂化,酸化、钙化后生成的果胶酸钙沉淀物,干燥至恒重。
果胶沉淀剂依果胶酯化程度不同分两类,果胶酯化程度在20%-50%时,可用电解质沉淀剂,如氯化钠、氯化钙等。
果胶酯化程度大于50%,则用有机溶剂为沉淀剂,如乙醇、丙酮等,且随酯化程度的升高,醇的浓度也应加大。
(2)试剂0.1mol/l氢氧化钠溶液,1mol/l醋酸溶液,0.05mol/l氢氧化钠溶液,1mol/l氯化钙溶液,0.05mol/l盐酸溶液(3)操作方法总果胶的提取,取磨碎的新鲜样品50g,放入1000ml烧杯中,加入0.05mol/l盐酸溶液400ml,置沸水浴中加热1h,加热时应随时补充蒸发损失的水分。
冷却后,移入500ml容量瓶,定容摇匀,过滤,滤液待用。
测定,取100ml提取液于1000ml烧杯中,用0.5mol/l氢氧化钠中和后,加水至300ml,加入0.1mol/l氢氧化钠溶液100ml,充分搅拌,放置0.5h,进行皂化。
加入1mol/l醋酸溶液50 ml,静置5min后,边搅拌边缓慢加入0.1mol/l氯化钙溶液溶液25ml,然后再滴加2mol/l 氯化钙溶液25ml,充分搅拌后放置1h(陈化)。
加热煮沸5min,趁热用烘干至衡量的滤纸过滤,用热水洗涤至无氯离子为止。
滤渣连同滤纸一起放入称量瓶中,置于105℃烘箱中干燥至恒重。
(4)计算果胶酸含量=0.9233(M1-M2)V*100%/(V1G)式中:M1为果胶酸钙和滤纸质量,g;M2为滤纸质量,g;V1为测定时取用提取液的体积,ml;V为测定提取液的总体积,ml;G为样品质量,g。
0.9233为由果胶酸钙换算成果胶酸的系数。
果胶的测定

韩雅珊.1992(2002)?.食品化学实验指导[M].中国农业大学出版社果胶的测定:一、实验原理本实验采用钙离子螯合剂和果胶酶提取水果中的总果胶物质,然后用分光光度法测定总果胶物质,先用乙醇处理样品,使果胶沉淀,再用乙醇溶液洗涤沉淀,除去可溶性糖类、脂肪、色素等物质,从残渣中提得果胶物质。
采用NaOH溶液将果胶物质皂化,生成果胶酸钠,再经乙酸酸化使之生成果胶酸,再加入果胶酶使之水解。
分光光度法测定是以果胶分子的基本结构单位——半乳糖醛酸和咔唑的反应为基础的。
果胶经水解生成半乳糖醛酸,在强酸中与咔唑发生缩合反应,生成紫红色化合物,其呈色强度与半乳糖醛酸含量成正比,测定的结果可用脱水半乳糖醛酸(AUA)。
二、实验仪器与试剂仪器:玻璃器皿烧杯、试管、玻棒、胶头滴管、容量瓶、PH计、分光光度计试剂:①果胶酶提取液:1份果胶酶试剂和10份水在一起搅拌1h,然后离心除去沉淀,上清液即为果胶酶提取液;②1%EDTA溶液(乙二胺四乙酸);③醋酸溶液(1份醋酸+2份水);④浓硫酸;⑤95%乙醇;⑥精制乙醇:在1L 95%乙醇中,加入4g锌粉和4ml硫酸(1+1),在水浴中回流24h,然后蒸馏,在馏出液中加入4g锌粉和4gKOH后再蒸馏一次;⑦一水半乳糖醛酸。
三、实验步骤1、果胶物质的提取将10g新鲜橘皮和125ml95%乙醇一起捣碎,抽滤后保留沉淀,用50ml75%乙醇洗涤沉淀两次,将沉淀转移到250ml烧杯中,加入100ml 1%EDTA溶液,用1mol/LNaOH 将PH调节至11.5,保持30min后,再用醋酸溶液将果胶溶液酸化到PH5.0,然后加入10ml 果胶酶提取液,搅拌0.5h后,定容至250ml,用脱脂棉过滤,弃去沉淀和前20ml滤液,吸取部分滤液稀释10倍,作为测定果胶含量的样品。
2、半乳糖醛酸的比色测定在20Ⅹ200mm试管中准确加入12ml浓硫酸,用冰浴将试管及内容物冷却到3℃,吸入1.00ml待测溶液,每毫升溶液中含5~40µg果胶物质。
NYT2016-2011水果及其制品中果胶含量的测定分光光度法

NY/T 2016—2011 水果及其制品中果胶含量的测定 分光光度法1 范围本标准规定了用分光光度法测定水果及其制品中果胶含量的方法。
本标准适用于水果及其制品中果胶含量的测定。
本标准方法线性范围为1 mg/L~l00 mg/L,检出限为0.02 g/kg。
2 规范性引用文件下列文件对本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 6682 分析实验室用水规格和试验方法3 原理用无水乙醇沉淀试样中的果胶,果胶经水解后生成半乳糖醛酸,在硫酸中与咔唑试剂发生缩合反应,生成紫红色化合物,该化合物在525 nm处有最大吸收,其吸收值与果胶含量成正比,以半乳糖醛酸为标准物质,标准曲线法定量。
4 试剂除非另有说明,所用水应达到GB/T 6682规定的三级水要求,所用试剂均为分析纯试剂。
4.1无水乙醇(C2H6O)。
4.2 硫酸(H2SO4,优级纯)。
4.3 咔唑(C12 H9N)。
4.4 67%乙醇溶液:无水乙醇+水= 2+1。
4.5 pH0.5的硫酸溶液:用硫酸调节水的pH至0.5。
4.6 40 g/L氢氧化钠溶液:称取4.0g氢氧化钠,用水溶解并定容至100 mL。
4.7 1 g/L咔唑乙醇溶液:称取0.100 0 g咔唑,用无水乙醇溶解并定容至100 mL。
作空白实验检测,即1 mL水、0.25 mL咔唑乙醇溶液和5 mL硫酸混合后应清澈、透明、无色。
4.8 半乳糖醛酸标准储备液:准确称取无水半乳糖醛酸0.100 0 g,用少量水溶解,加入0.5 mL氢氧化钠溶液(4.6),定容至100 mL,混匀。
此溶液中半乳糖醛酸质量浓度为1 000 mg/L。
4.9半乳糖醛酸标准使用液:分别吸取0.0 mL、1.0 mL、2.0 mL、3.0 mL、4.0 mL、5.0 mL半乳糖醛酸标准储备液(4.8)于50 mL容量瓶中,定容,溶液质量浓度分别为0.0 mg/L、20.0 mg/L、40.0 mg/L、60.0 mg/L、80.0 mg/L、100.0 mg/L。
水果中果胶物质的提取和测定

水果中果胶物质的提取和测定一、实验目的1、温水基本操作,如PH计的使用、抽滤,分光光度计的使用,标准曲线的绘制2、初步了解和掌握食品中某些成分的提取技术、分离技术以及测定方法,为灵活运用食品化学的研究方法奠定基础。
二、实验原理本实验采用钙离子螯合剂和果胶酶提取水果中的总果胶物质,然后用分光光度法测定总果胶物质,先用乙醇处理样品,使果胶沉淀,再用乙醇溶液洗涤沉淀,除去可溶性糖类、脂肪、色素等物质,从残渣中提得果胶物质。
采用NaOH溶液将果胶物质皂化,生成果胶酸钠,再经乙酸酸化使之生成果胶酸,再加入果胶酶使之水解。
分光光度法测定是以果胶分子的基本结构单位——半乳糖醛酸和咔唑的反应为基础的。
果胶经水解生成半乳糖醛酸,在强酸中与咔唑发生缩合反应,生成紫红色化合物,其呈色强度与半乳糖醛酸含量成正比,测定的结果可用脱水半乳糖醛酸(AUA)。
三、实验步骤1、果胶物质的提取将10g新鲜橘皮和125ml95%乙醇一起捣碎,抽滤后保留沉淀,用50ml75%乙醇洗涤沉淀两次,将沉淀转移到250ml烧杯中,加入100ml 1%EDTA溶液,用1mol/LNaOH将PH调节至11.5,保持30min后,再用醋酸溶液将果胶溶液酸化到PH5.0,然后加入10ml果胶酶提取液,搅拌0.5h后,定容至250ml,用脱脂棉过滤,弃去沉淀和前20ml滤液,吸取部分滤液稀释10倍,作为测定果胶含量的样品。
2、半乳糖醛酸的比色测定在20Ⅹ200mm试管中准确加入12ml浓硫酸,用冰浴将试管及内容物冷却到3℃,吸入1.00ml待测溶液,每毫升溶液中含5~40µg果胶物质。
将试管中的内容物振荡均匀后,在冰浴中冷却至5℃以下,然后将试管在100℃水浴中加热10min,冷却至20℃,吸入1.00ml0.15%咔唑试剂,充分混匀,在室温下放置25min,在520nm波长下测定溶液的吸光度,从加入咔唑试剂到测定溶液吸光度的时间和温度在各次测定中应保持一致。
果胶含量的测定
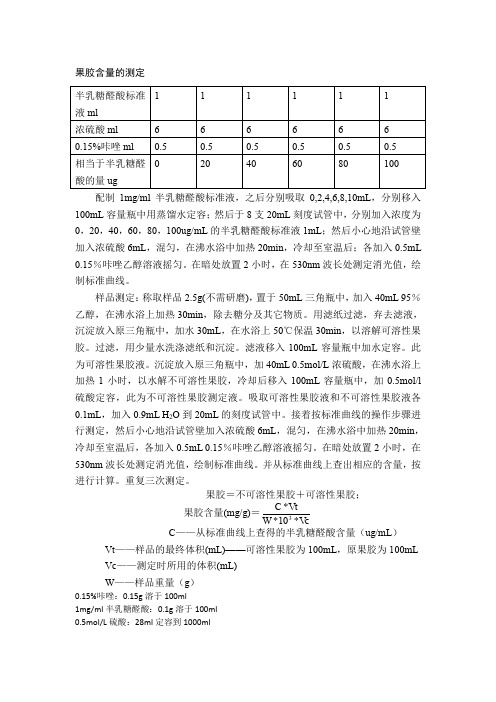
果胶含量的测定配制1mg/ml 半乳糖醛酸标准液,之后分别吸取0,2,4,6,8,10mL ,分别移入100mL 容量瓶中用蒸馏水定容;然后于8支20mL 刻度试管中,分别加入浓度为0,20,40,60,80,100ug/mL 的半乳糖醛酸标准液1mL ;然后小心地沿试管壁加入浓硫酸6mL ,混匀,在沸水浴中加热20min ,冷却至室温后;各加入0.5mL 0.15%咔唑乙醇溶液摇匀。
在暗处放置2小时,在530nm 波长处测定消光值,绘制标准曲线。
样品测定:称取样品2.5g(不需研磨),置于50mL 三角瓶中,加入40mL 95%乙醇,在沸水浴上加热30min ,除去糖分及其它物质。
用滤纸过滤,弃去滤液,沉淀放入原三角瓶中,加水30mL ,在水浴上50℃保温30min ,以溶解可溶性果胶。
过滤,用少量水洗涤滤纸和沉淀。
滤液移入100mL 容量瓶中加水定容。
此为可溶性果胶液。
沉淀放入原三角瓶中,加40mL 0.5mol/L 浓硫酸,在沸水浴上加热1小时,以水解不可溶性果胶,冷却后移入100mL 容量瓶中,加0.5mol/l 硫酸定容,此为不可溶性果胶测定液。
吸取可溶性果胶液和不可溶性果胶液各0.1mL ,加入0.9mL H 2O 到20mL 的刻度试管中。
接着按标准曲线的操作步骤进行测定,然后小心地沿试管壁加入浓硫酸6mL ,混匀,在沸水浴中加热20min ,冷却至室温后,各加入0.5mL 0.15%咔唑乙醇溶液摇匀。
在暗处放置2小时,在530nm 波长处测定消光值,绘制标准曲线。
并从标准曲线上查出相应的含量,按进行计算。
重复三次测定。
果胶=不可溶性果胶+可溶性果胶;果胶含量(mg/g)=VcW V C *10*t*3C ——从标准曲线上查得的半乳糖醛酸含量(ug/mL )Vt ——样品的最终体积(mL)——可溶性果胶为100mL ,原果胶为100mL Vc ——测定时所用的体积(mL) W ——样品重量(g )0.15%咔唑:0.15g 溶于100ml1mg/ml 半乳糖醛酸:0.1g 溶于100ml 0.5mol/L 硫酸:28ml 定容到1000ml。
果胶物质的测定解读

(2)果胶酯酸(Pectinic
acid):它的基本结构是 多聚半乳糖醛酸,呈胶态。其中甲基酯的含 量是可变的。酯化程度100%的完全甲基化的 果胶酯酸,甲氧基(CH3O—)含量为16.32%。 按甲氧基含量的不同,果胶酯酸分为两类。 甲氧基含量大于7%的,叫作高甲氧基果胶(又 称果胶,Pectin);甲氧基含量小于7%的,叫 作低甲氧基果胶(又称低酯果胶)。果胶酯酸与 糖和酸在适当条件下能形成凝胶。甚至,不 用加糖,只要有多价正离子存在,,低酯果 胶也可形成凝胶。果胶酯酸的游离羧基与金 属离子可形成正盐或酸式盐。
(3)果胶酸(Pectic
acid):它的基本结构是聚半 乳糖醛酸,呈胶态。它同果胶酯酸的差别是 其中的羧基是游离的,不以甲基酯的形式存 在,但实际限难得到无甲酯的果胶物质。通 常,把甲氧基含量为1%的,叫作果胶酸。天 然的果蔬,仅含有少量果胶酸。而在酶的作 用下,水溶性的果胶物质可以转变为果胶酸。 果胶酸的游离羧基与金属离子也形成正盐或 酸式盐。
优点:操作简便、快速、准确度高、重现性 好 仪器:分光光度计、50ml比色管
• 样品处理 • 果胶的提取
同重量法 同重量法
• 标准工作曲线的制作 • 测定
标准工作曲线的制作
取8只50ml比色管, 编号0-7 各加入12ml浓硫酸 冰水浴 各加入1.5g L咔唑 试剂1ml
浓度依次为0, 10,20,30,40, 50,60,70ug ml,各2ml
干燥样品
样品处理
测 定 方 法
新鲜样品
水溶性果胶的提取
提取果胶
总果胶的提取
测定
新 鲜 样 品
干 燥 样 品
盛有99 水浴沸腾回流 由于果胶分解酶作用, 装上回流 切片 %乙醇 15min 果胶会迅速分解,将 冷凝器 的500ml 切片浸入乙醇中,钝 锥形瓶 化酶的活性 研细 筛选 称取5—10g样 加热乙醇 苯酚-硫酸法:取检液 品于烧杯中 1ml,置于试管中,加 入5%苯酚水溶液1ml,再加入硫酸5ml, 混匀,溶液呈褐色,证明检液中含有糖分 检验滤液 残渣磨碎并 布氏漏斗 冷却 冷却 是否呈糖 滴加 70 %热 过滤 过滤 反应 乙醇 呈褐色 称取试 样3050g
果胶的提取与果胶含量的测定

果胶的提取与果胶含量的测定一、引言果胶广泛存在于水果和蔬菜中,如苹果中含量为0.7—1.5%(以湿品计),在蔬菜中以南瓜含量最多(达7%-17%)。
果胶的基本结构是以α-1,4苷键连接的聚半乳糖醛酸,其中部分羧基被甲酯化,其余的羧基与钾、钠、铵离子结合成盐。
在果蔬中,尤其是未成熟的水果和皮中,果胶多数以原果胶存在,原果胶通过金属离子桥(比如Ca2+)与多聚半乳糖醛酸中的游离羧基相结合。
原果胶不溶于水,故用酸水解,生成可溶性的果胶,再进行提取、脱色、沉淀、干燥,即为商品果胶。
从柑橘皮中提取的果胶是高酯化度的果胶(酯化度在70%以上)。
在食品工业中常利用果胶制作果酱、果冻和糖果,在汁液类食品中作增稠剂、乳化剂。
二、实验材料、试剂与仪器材料:桔皮,苹果等;试剂:0.25% HCL,95%乙醇(AR),精制乙醇,乙醚,0.05mol/L HCl,0.15%咔唑乙醇溶液,半乳糖醛酸标准液,浓硫酸(优级纯)仪器:分光光度计,50mL比色管,分析天平,水浴锅,回流冷凝器,烘箱等三、实验步骤(一)果胶的提取1、原料预处理:称取新鲜柑橘皮20g(或干样8g),用清水洗净后,放入250mL 容量瓶中,加水120mL,加热至90℃保持5-10min,使酶失活。
用水冲洗后切成3~5mm的颗粒,用50℃左右的热水漂洗,直至水为无色、果皮无异味为止(每次漂洗必须把果皮用尼龙布挤干,在进行下一次的漂洗)。
2、酸水解提取:将预处理过的果皮粒放入烧杯中,加约60mL 0.25% HCL溶液,以浸没果皮为宜,调pH至2.0~2.5,加热至90℃煮45min,趁热用100目尼龙布或四层纱布过滤。
3、脱色:在滤液中加入0.5~1.0%的活性炭,于80℃加热20min,进行脱色和除异味,趁热抽滤(如抽滤困难可加入2%~4%的硅藻土作为助滤剂)。
如果柑橘皮漂洗干净萃取液为清澈透明则不用脱色。
4、沉淀:待提取液冷却后,用稀氨水调pH至3~4。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
果胶的测定(方案一):
黄晓钰,刘邻渭等.食品化学综合实验[M].中国农业大学出版社. 2002.158~159
实验原理:果胶经水解,其产物——半乳糖醛酸可在强酸环境中与咔唑试剂产生缩合反应,生成紫红色化合物,其呈色深浅与半乳糖醛酸含量成正比,由此可进行比色定量
测定果胶。
实验试剂:1.化学纯无水乙醇或95%乙醇。
2.精制乙醇:取无水乙醇或95%乙醇1000ml,加入锌粉4g,硫酸(1:1)4ml,
至于衡温水浴中回流10h,用全玻璃仪器蒸馏,馏出液每1000ml加锌粉和氢
氧化钾各4g,并进行蒸馏。
3. 0.15%咔唑乙醇溶液:称取咔唑g,溶于精制乙醇并定容至100ml。
4.半乳糖醛酸标准溶液:先用水配置成浓度1 g/L的溶液,再配制成浓度分别为
(0、10mg/L、20 mg/L、30 mg/L、40 mg/L、50 mg/L、60 mg/L、70mg/L)的
系列半乳糖醛酸标准溶液。
5.优级纯浓硫酸。
操作方法:1样品处理:
总果胶提取:(鲜样)研磨新鲜样品50g,放入1000ml烧杯中,加入L HCl
400mL,放置沸水浴中加热1h,加热时应随时补充蒸发损失的水分。
冷却后,
移入500ml容量瓶,定容摇匀,过滤,滤液待用。
(干样)磨细的干燥样品
5g,置于250ml三角烧瓶,加入L HCL 150ml,装上冷凝器,与沸水浴中加热
回流1h,取出冷却甚至室温,用水定容至200ml,摇匀,过滤,滤液待用。
水溶性果胶提取:新鲜样品应尽量研磨碎,干燥的样品应磨细后过60目筛。
样品中存在有果胶酶时,为了顿化酶的活性,可以加入适量热的95%乙醇,
是样品溶液的乙醇最终浓度约为70%,然后于沸水浴中沸腾回流15min,使果
胶酶钝化,冷却过滤后,以95%乙醇洗涤多次,再用乙醚洗涤,以除去全部
糖类、脂类及色素,最后风干除去乙醚。
2果胶提取:水溶性果胶的提取:将样品研碎,新鲜样品标准称取30~50g,干
燥样品准确称取5~10g至于250ml烧杯,加入150ml水。
加热至沸腾,并保
持此状态1h。
加热过程随时填补蒸发损失的水分。
取出冷却,将杯中物质移
入250ml容量瓶,用水洗涤烧杯,洗液并入容量瓶,最终定容至刻度,摇匀
过滤,记录滤液体积。
3标准曲线制作:取试管8支,各加入12ml浓硫酸,置冰水浴中冷却后,分别
将各种浓度的半乳糖醛酸2ml 徐徐各加入试管中,充分混匀后,再置冰水浴
中冷却,然后置沸水浴中加热10min,迅速冷却至室温,各加入1ml %咔唑试
剂,摇匀,与室温下静置30min,用0好使观众的溶液调仪器零点,在530nm
波长下测定各管溶液的A530nm值,以A为横坐标,半乳糖醛酸浓度为纵坐标
绘制标准曲线。
4测定:取果胶提取液用水稀释至适量浓度(含半乳糖醛酸10~70mg/L)。
移
取12ml 冰水冷却的浓硫酸加入试管中,然后加入2ml 样品稀释液,充分混
合后,至于冰水冷却。
取出后在沸水浴中加热10min,冷却至室温,加入1mL %
咔唑试剂,摇匀,于室温下静置30min,用空白试剂调零,在530nm波长下
测定A530nm值,与标样对照,求出样品果胶含量。
计算:
可溶性果胶质含量(以半乳糖醛酸计)=100%1000
10g 100200mg/⨯⨯⨯⨯⨯)样品质量()半乳糖醛酸(L
说明:1糖分的存在对本法比色反应较大,使结果偏高,故样品中的糖分应预先出尽。
2硫酸浓度对显色有影响,操作时必须保持硫酸浓度一致。
果胶的测定(方案二):
一、 实验原理
本实验采用钙离子螯合剂和果胶酶提取水果中的总果胶物质,然后用分光光度法测定总果胶物质,先用乙醇处理样品,使果胶沉淀,再用乙醇溶液洗涤沉淀,除去可溶性糖类、脂肪、色素等物质,从残渣中提得果胶物质。
采用NaOH 溶液将果胶物质皂化,生成果胶酸钠,再经乙酸酸化使之生成果胶酸,再加入果胶酶使之水解。
分光光度法测定是以果胶分子的基本结构单位——半乳糖醛酸和咔唑的反应为基础的。
果胶经水解生成半乳糖醛酸,在强酸中与咔唑发生缩合反应,生成紫红色化合物,其呈色强度与半乳糖醛酸含量成正比,测定的结果可用脱水半乳糖醛酸(AUA )。
二、 实验仪器与试剂
仪器:玻璃器皿烧杯、试管、玻棒、胶头滴管、容量瓶、PH 计、分光光度计
试剂:①果胶酶提取液:1份果胶酶试剂和10份水在一起搅拌1h ,然后离心除去沉淀,上清液即为果胶酶提取液;②1%EDTA 溶液(乙二胺四乙酸);③醋酸溶液(1份醋酸+2份水);④浓硫酸;⑤95%乙醇;⑥精制乙醇:在1L 95%乙醇中,加入4g 锌粉和4ml 硫酸(1+1),在水浴中回流24h ,然后蒸馏,在馏出液中加入4g 锌粉和4gKOH 后再蒸馏一次;⑦一水半乳糖醛酸。
三、 实验步骤
1、 果胶物质的提取
将10g 新鲜橘皮和125ml95%乙醇一起捣碎,抽滤后保留沉淀,用50ml75%乙醇洗
涤沉淀两次,将沉淀转移到250ml烧杯中,加入100ml 1%EDTA溶液,用1mol/LNaOH 将PH调节至,保持30min后,再用醋酸溶液将果胶溶液酸化到,然后加入10ml果胶酶提取液,搅拌后,定容至250ml,用脱脂棉过滤,弃去沉淀和前20ml滤液,吸取部分滤液稀释10倍,作为测定果胶含量的样品。
2、半乳糖醛酸的比色测定
在20Ⅹ200mm试管中准确加入12ml浓硫酸,用冰浴将试管及内容物冷却到3℃,吸入待测溶液,每毫升溶液中含5~40μg果胶物质。
将试管中的内容物振荡均匀后,在冰浴中冷却至5℃以下,然后将试管在100℃水浴中加热10min,冷却至20℃,吸入咔唑试剂,充分混匀,在室温下放置25min,在520nm波长下测定溶液的吸光度,从加入咔唑试剂到测定溶液吸光度的时间和温度在各次测定中应保持一致。
3、标准曲线的绘制
准确称量一水半乳糖醛酸(相对分子质量为212),加入LNaOH使之溶解,然后用水定容到1L,放置过夜。
1ml上述溶液中含AUA100μg,将此标准溶液分别稀释到每ml含10、20、30、40、50、60μgAUA。
然后按前述方法测定每个溶液中咔唑试剂反应后的吸光度,以吸光度为纵坐标,脱水半乳糖醛酸的质量为横坐标绘制标准曲线。
四、实验注意事项
1、在半乳糖醛酸的测定中,从加入咔唑试剂到测定溶液吸光度的时间和温度在各次测定中
应保持一致;
2、硫酸的纯度对咔唑的呈色反应有很大影响,必须用分析纯的硫酸。
五、数据记录与处理
实验中称取沉淀,所以计算式中样品重量为1000g,波长520nm
标准曲线为:y =
将y1=,y1=分别代入得x1=μg/ml,x2=μg/ml
计算:水果中总果胶物质的质量分数(以AUA计)计算如下:
AUA含量(μg/ml)Ⅹ稀释倍数Ⅹ250(ml)/样品重量(g)/1000000Ⅹ100%
①x1=μg/ml AUA1=μg/ml 代入上式得w1 = %
②x2=μg/ml AUA2=μg/ml 代入上式得w2 = %
w =(w1+w2)/2 = %
平均偏差= (│w1-w│+│w2-w│)/2 = %
相对平均偏差= 平均偏差/w = % / % = %
六、思考题
1、加入EDTA溶液的作用是什么?
答:水溶液中的某些金属离子可能会与果胶络合对实验结果产生影响,而EDTA作为一种螯合剂,可以与碱金属、稀土金属和过渡金属等形成稳定的。
2、当样品中存在着其他种类的相对分子质量较高的碳水化合物,对实验结果会造成怎样的
影响?
答:高分子碳水化合物的存在会对咔唑的呈色反应产生较大影响,从而使实验测量结果偏高。
3、果胶在提取中发生了什么样的化学变化?
答:果胶首先在NaOH的作用下发生了皂化反应,水解成果胶酸钠和醇,又被乙酸酸化成果胶酸,最后在果胶酶作用下水解成半乳糖醛酸。
4、原果胶、果胶、果胶酸在结构和性质上有什么差异?
答:原果胶:即天然果胶是由D-半乳糖醛酸以及?-1,4糖苷键相连形成的直链高分子化合物,其中大部分门羧基已形成甲基酯,原果胶是一种无定形的胶质,有强亲水性,粘着而柔软,可被酸碱、果胶酶等溶液,水解成果胶。
果胶:是一种酸性多糖,是由?-1,4连接的多聚半乳糖醛酸,具有水溶性,适宜条件下气溶液能形成凝胶,部分发生甲基氧化。
果胶酸:由半乳糖醛酸聚糖、半乳聚糖和阿拉伯聚糖以不同比例组成的杂多糖果胶、果胶酸不含甲酯基。
5、配制标准溶液时为何要称量一水半乳糖醛酸?
答:一水半乳糖醛酸式量M=212,脱水半乳糖醛酸(AUA)式量=176
标准曲线绘制时要求:标准溶液AUA=100μg/ml=L
根据一水半乳糖醛酸与脱水半乳糖醛酸物质的量相等,即
x/212=176 得出,x=L
定容为1L时,配置标准溶液需称取一水半乳糖醛酸。
